修回日期: 2014-10-21
接受日期: 2014-11-12
在线出版日期: 2014-12-18
目的: 探讨消化系炎性纤维性息肉(infl-ammatory fibroid polyp, IFP)的临床表现、内镜特征、内镜下的鉴别诊断以及内镜下治疗方法.
方法: 收集13例消化系炎性纤维性息肉, 进行临床、内镜、超声内镜观察及内镜下治疗方法的探索.
结果: 消化系的炎性纤维性息肉主要发生在50岁以上人群(85%), 女性略占优势. 发生的部位依次为胃窦(10例)、回肠(2例)和结肠(1例). 内镜下主要表现为黏膜下隆起、息肉及新生物样隆起. 超声内镜下表现为第3层(3例)或第2层(2例)的低回声, 内部回声均匀, 与周围组织界限欠清. 内镜下4例行内镜下黏膜切除术(endoscopic mucosal resection, EMR), 6例行内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗, 2例胃和1例小肠呈新生物隆起的进行局部切除术.
结论: 胃窦是炎性纤维性息肉最常见的发病部位. 超声内镜和内镜下的表现对诊断有一定帮助. 绝大多数IFP在内镜下呈黏膜下隆起及息肉的外观. 内镜下进行ESD或EMR手术是安全、有效的. 有限的随访资料证明内镜治疗IFP后无复发.
核心提示: 炎性纤维性息肉(inflammatory fibroid polyp, IFP)是来自间叶源性良性肿瘤, 最长发生的部位是胃窦. 超声内镜(endoscopic ultrasonography)下IFP来源于第2和/或第3层、低回声、内部回声均匀的病变, 边界欠清, 第4层不受累. 根据内镜下表现, IFP行内镜下黏膜切除术(endoscopic mucosal resection)或经内镜黏膜下剥离术(endoscopic submucosal dissection)术, 手术安全基本无并发症.
引文著录: 许良璧, 项一宁. 胃肠道炎性纤维性息肉的内镜诊断与治疗. 世界华人消化杂志 2014; 22(35): 5550-5555
Revised: October 21, 2014
Accepted: November 12, 2014
Published online: December 18, 2014
AIM: To investigate the clinical manifestations, endoscopic and ultrasonographic features, and endoscopic therapy of gastric inflammatory fibroid polyps (IFPs).
METHODS: A total of 13 patients with IFPs treated at our center were collected between January 2007 January and April 2014. The clinical data for these patients were reviewed. All patients underwent digestive endoscopy, and 5 patients whose lesions were located at the antrum underwent endoscopic ultrasonography before therapy. Therapeutic methods were selected based on endoscopic morphology of the lesion.
RESULTS: IFPs had a modest female predominance (8 women and 5 men), with the majority of patients (11) being more than 50 years. Involved sites included the stomach (10), ileum (2), and colon (1). The tumors ranged in size from 6-60 mm (mean, 21.62 mm). Endoscopic features of the 13 lesions were submucosal tumors (7), polyps (3) and neoplasms (3). All lesions were located in the second (2) or third (3) sonographic layer of the antrum without involvement of the fourth layer. Endoscopic ultrasonographic features were hypoechoic/homogeneous echo pattern and unclear boundary. Four patients underwent endoscopic mucosal resection (EMR), 6 underwent endoscopic submucosal dissection (ESD) and 3 partial gastrointestinalresection. All were confirmed histologically as IFPs.
CONCLUSION: IFPs can occur throughout the gastrointestinal tract, commonly in the antrum. Understanding the characteristic digestive endoscopy and EUS features of IFP scan be helpful to IFP diagnosis. Treatmentby EMR or ESD iseffective and safe.
- Citation: Xu LB, Xiang YN. Endoscopic diagnosis and treatment of inflammatory fibroid polyps. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5550-5555
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5550
炎性纤维性息肉(inflammatory fibroid polyp, IFP)是一种罕见良性间叶组织来源肿瘤[1], 可以发生在消化系任何部位. 多数无任何临床症状, 少部分因病变较大可引发消化系梗阻、出血; 当发生于小肠的较大的IFP可引发肠套叠而使患者急诊入院. 其胃肠镜下和超声内镜下的特征, 与发生在消化系的黏膜下的肿瘤或非肿瘤性病变相似. 因此在临床及消化内镜的诊断有一定困难. 我们收集13例炎性纤维性息肉病例进行回顾研究, 探讨其胃肠镜及超声内镜(endoscopic ultrasonography, EUS)下表现、临床表现以及病理形态特征和免疫组织化学表型.
收集2007-01/2014-04贵阳医学院附属医院, 经内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)或内镜下黏膜切除术(endoscopic mucosal resection, EMR), 以及内镜检查发现较大的占位性病变, 行外科手术切除的标本, 经病理组织学及免疫组织化学诊断为炎性纤维性息肉病例13例(所用免疫组织化学试剂均购自上海基因科技有限公司). 收集患者住院期间临床资料.
1.2.1 收集临床资料: 收集自原始病历, 记录患者年龄、性别、临床症状、实验室检查及治疗方式.
1.2.2 内镜检查: 调阅13例病例的胃肠镜检查图片(胃镜10例, 结肠镜3例), 记录病变内镜下特征, 包括: 病变部位、形态大小、表面及边界情况. 其中病变发生在胃的5例患者接受EUS检查, 所用设备均为Olympus-UM-29R(20兆赫)超声探头, 记录EUS下病变来源、回声情况、边界及大小.
1.2.3 内镜下治疗: 根据内镜下病变表现, 呈"息肉"(采用山田分类法)外观的, 进行EMR术, 即"息肉"旁黏膜下注射1/万肾上腺素盐水1-2 mL至黏膜隆起后, 对"息肉"进行高频电切除; 呈黏膜下隆起的病变进行ESD术, 即按标记→黏膜下注射→环周切开→剥离步骤进行操作.
1.2.4 病理组织学观察: 记录病理组织学特点.
1.2.5 免疫组织化学检测: 免疫组织化学采用EnVision二步法, 一抗为Vimentin、CD34、CD117、DOG-1(discovered on GIST-1)、平滑肌肌动蛋白(smooth muscle actin, SMA)、S-100、Desmin及细胞角蛋白(cytokerain, CK).
收集的13例病例中男性5例, 女性8例, 男:女为1:1.6, 女性患者略占优势. 年龄从35-76岁(58.85岁±11.66岁), 50岁以上占11例(85%). 病程20 d-4年不等. 患者的临床症状与息肉发生的部位与大小相关: 其中1例因腹痛急诊入院诊断肠套叠, 肠镜显示回肠末端巨大新生物(直径60 mm); 1例因反复柏油样便1 mo余入院, 肠镜示升结肠巨大息肉(直径45 mm); 余患者症状无特异性. 均为单发的病变, 没有多发的病变.
IFP发生在胃10例(76.9%); 小肠2例(15.4%); 大肠1例(7%). 并且胃全发生在胃窦(10/10); 小肠的IFP均发生在回肠末段; 大肠1例发生于右半结肠; 而未见发生在食管的病例. IFP的直径6-60 mm(21.62 mm±19.47 mm).
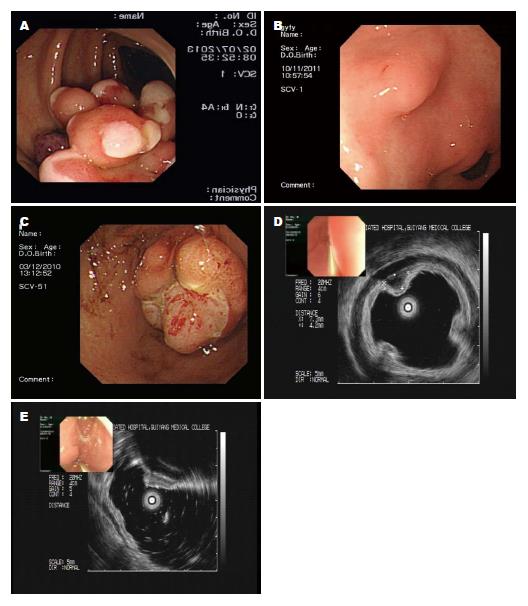
13例IFP在内镜下(图1A-C)均表现为突向管腔内的隆起. 3例呈息肉外观行EMR切除, 7例呈孤立黏膜下隆起行ESD治疗; 3例呈新生物隆起进行外科手术治疗. 5例发生在胃窦呈黏膜下隆起的病变行EUS检查(图1D, E), 均表现为低回声、内部回声均匀, 边界欠清病变, 3例来源第3层, 2例来源第2层.
内镜下治疗情况如表1. 在进行内镜治疗的9例患者中, 发生在升结肠的一例呈山田Ⅳ型长蒂息肉(图1A, 直径45 mm), 行EMR术, 术后48 h发生创面出血, 出血量约600 mL, 急诊内镜下止血成功, 无再发出血. 余8例患者无并发症. 术后1年4例进行随访, 病变完整切除, 无复发.
| 项目 | 结果 |
| 性别(男/女) | 5/8 |
| 年龄(岁) | 35-76(58.85±11.66) |
| 病变部位 | |
| 胃 | 10(胃窦) |
| 小肠 | 2(回肠末端) |
| 大肠 | 1(升结肠) |
| 病变大小(mm) | 6-60(21.62±19.47) |
| 内镜下表现 | |
| 息肉 | 3 |
| 黏膜下隆起 | 7 |
| 新生物隆起 | 3 |
| 超声内镜下表现(5例) | |
| 回声 | 低回声内部回声均匀 |
| 边界 | 边界欠清 |
| 来源 | 3例来源第3层, 2例来源第2层 |
| 治疗方法 | |
| EMR | 3 |
| ESD | 7 |
| 外科手术 | 3 |
| 免疫组织化学结果[%(n1/n)] | |
| Vimentin | 100.0(13/13) |
| CD34 | 84.6(11/13) |
| CD117 | 0.0(0/13) |
| S-100 | 0.0(0/13) |
| SMA | 12.5(1/13) |
| Desmin | 0.0(0/13) |
| CK | 0.0(0/13) |
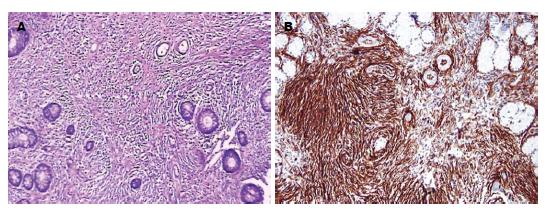
肿瘤主体位于黏膜下层(100%), 黏膜下层明显增厚. 并向上破坏黏膜肌层, 侵入黏膜层, 但未侵入肌层. IFP主要由三种成分组成(图2A): (1)过度增生的纤维母细胞样梭形细胞; (2)小血管增生. 血管周围有特征性的病理表现: 血管周围梭形细胞增生呈洋葱皮或同心圆状排列; (3)伴有大量的炎症细胞浸润: 淋巴细胞、浆细胞及嗜酸性粒细胞. 特征性嗜酸性粒细胞在IFP中恒定出现.
既往的研究报道, IFP的发生率是很罕见的, IFP在胃息肉中仅占0.1%[2]. 在本次研究中, 7年中共计13例IFP患者. 其中女性患者略占优势, 占62%. 患者分布年龄从35-76岁, 50岁以上患者占85%. IFP患者的临床症状各不相同, 取决于IFP的直径和发生部位. 大多数IFP患者是因行胃肠镜体检或其他疾病需要进行内镜随访的过程中发现的. 多数IFP因其直径小, 没有特异性症状. 发生在小肠的IFP可能会因为肠套叠而急诊入院, 发生在大肠和胃的较大的IFP可能会反复发生消化系出血.
从病变的分布部位来看, 胃是最常见的, 10例(76.9%), 且全集中在胃窦; 小肠2例(15.4%); 大肠1例(7%). 未见分布在食管的病变. Wysocki等[3]报道, IFP可以发生在在整个消化系, 其中70%发生在胃, 23%发生在小肠(多数在回肠), 结肠和直肠占4%, 其他还有发生在胆囊、十二指肠、食管及阑尾的报道. 而Liu等[4]人的研究中发现, IFP 37%发生在胃, 37%发生在大肠, 小肠发生率20%, 食管IFP占2%, 阑尾、肛管各占1%. 就发病部位差距如此之大, 可能和Liu等[4]的研究中有77%标本来源于活检有关. 在本次研究中发现绝大多数IFP(约76.9%)发生在胃, 这也和既往的多数研究一致, 而发生在胃的IFP全部在胃窦. 而Stolte等[5]的研究发现其可以发生在胃的其他部位, 77.6%病例位于胃窦, 另可发生于胃角、胃底、贲门.
在本次研究中发现, IFP在内镜下通常为黏膜下隆起(SMT)的表现(7/13), 单发, 一般直径<15 mm, 呈现为向腔内的突起, 可为广基或有蒂, 隆起表面为正常的黏膜或稍发红, 病变边界一般欠清. 在本研究中病例直径>15 mm的5个病变中, 内镜下IFP表面有炎性表现, 且呈长椭圆形, 其长径远远大于基底直径, 既往的研究[6]中也有类似报告. 部分IFP呈息肉样, 表面黏膜粗糙, 边界清晰, 可广基或有蒂.
结合EUS下的表现, 更有利于IFP诊断. 本研究发现, EUS下IFP来源于第2和/或第3层、低回声、内部回声均匀的病变, 边界欠清, 第4层不受累. 这和我们在病理上观察的结果是相一致, 显微镜下观察到IFP的病变位于黏膜下层和黏膜层, 并且所有病例的主体病变均位于黏膜下层, 部分病例破坏黏膜肌层长入黏膜层. 因此在内镜下发现位于胃窦黏膜下隆起, 表面黏膜基本正常, EUS显示病变来源于第2(和)第3层、第4层不受累, 低回声内部回声均匀的病变要考虑IFP可能.
IFP的内镜下表现多种多样, 但由于其多发生在胃窦, 且多呈黏膜下隆起, 因此主要是注意和以下发生在胃窦的SMT鉴别. 异位胰腺, 多发生在胃窦, 内镜下部分可有脐样凹陷, EUS[7]下可见来源第2和/或3、4层的低回声病变, 内部回声均匀或不均匀, 边界可清晰或不清, 多数可见内部有无回声区或管道样回声, 在笔者的经验中, 还可以有部分异位胰腺向第4层生长、使第4层回声不连续. 胃间质瘤(gastrointestinal stromal tumor, GIST), 多发生在胃底, 大小不等的黏膜下隆起, 表面光滑. EUS下多位于第4层, 也可以来源第2层, 低回声, 且回声极低, 一般内部回声均匀, 边界清晰. 平滑肌瘤相对发生于胃较少见, 其超声内镜下与GIST极为相似. 脂肪瘤在EUS下一般来源于第3层, 高回声, 内部回声均匀, 边界清. 胃神经内分泌肿瘤(gastric neuroendocrine tumor, ENT)分3型, 可单发或多发, 在内镜下以胃底、体多见, 直径多<1 cm, 对于直径>1 cm的要注意转移可能, 预后与细胞分化程度和Ki67指数有关. 在超声内镜下可呈来源于第1或2甚至第3层的低回声, 可有第4层侵润, 不同于IFP, ENT一般边界清晰[8].
但根据内镜或超声内镜的结果要诊断IFP还是比较困难的. 通常内镜下使用的活检钳较小, 对IFP活检诊断几乎是不可能的, 本研究中有7例患者进行活检, 无一例活检诊断IFP. 文献报道仅有10%发生在胃的病例在术前活检得到正确的诊断[5]. 近期研究中[7], 对22个发生在胃的黏膜下隆起, 其直径范围为8-20 mm, EUS诊断与最终内镜下切除病变的病理结果对照, EUS的诊断正确率只有44.5%. 但根据病变的内镜及EUS下的表现(病变浅, 位于第2或3层), 对可疑病变行内镜下治疗可获取最终诊断. 在本组病例中除3例(>40 mm)外观呈新生物表现的行外科手术切除. 余10例IFP, 行内镜下EMR或ESD术; 共完整切除病变10例, 除1例发生术后出血并在内镜下成功止血, 无其他并发症, 在进行随访的4例患者无一例复发. 说明内镜下治疗对IFP是安全有效的.
IFP在病理组织学中主要由3种成分组成, 纤维母细胞样的梭形细胞, 血管及嗜酸性粒细胞. 病理上主要鉴别的是间叶组织来源的肿瘤: 胃肠道间质瘤, 神经鞘瘤、丛状纤维黏液瘤、平滑肌瘤和炎性及纤维母细胞瘤. 这时免疫组织化学染色对于诊断与鉴别诊断有很大的帮助[9-12]: 文献报道100%病例表达Vimentin, 82%-100%病例表达CD34, 不同程度的灶性表达SMA, 但是不表达CD117、CD10、DOG-1、Desmin、S-100、VⅢ因子及间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK). 我们的研究结果与文献相一致. 因此在病理诊断IFP时, HE染色与免疫组织化学染色同时进行, 可准确诊断IFP, 且有助于鉴别诊断其他肿瘤.
近期研究[13]发现IFP的发生与血小板衍生生长因子受体-α(platelet-derived growth factor receptor alpha, PDGFR-α)基因激活突变有关. Schildhaus等[14]研究显示16例(70%)IFP中存在PDGFR-α基因突变. 在与IFP鉴别诊断中的一个非常重要疾病GIST, 大约有5%-15%存在PDGFR-α的基因突变[15,16]. 也有报道[17]在具有PDGFR-α基因Exonl2 V842D种系突变患者的胃、小肠及肠系膜中同时发生了胃肠道间质瘤, IFP和脂肪瘤. 因此PDGFR-α基因激活突变参与了IFP和部分胃肠道间质瘤的形成, 但两者之间的关系如何? 是否为同一肿瘤的不同发展阶段或不同亚型尚不清楚.
炎性纤维性息肉(inflammatory fibroid polyp, IFP)是消化系少见良性病变, 近年来随着分子生物学研究的深人, 部分学者发现IFP的发生与血小板衍生生长因子受体α(platelet-derived growth factor receptor alpha, PDGFR-α)基因激活突变有关, 目前第4版《WHO消化道肿瘤病理学和遗传学分类》已将IFP归为消化系良性间叶源性肿瘤.
万军, 教授, 中国人民解放军总医院南楼老年消化科
IFP发病部位可遍布整个消化系, 但以远端胃和回肠为主. 临床症状取决于病变的大小及发病部位. 内镜下有哪些表现? 如何在内镜下做出正确诊断? 如何选择治疗方案? 病理诊断的方法和基础是什么? 是临床医生关心的问题.
IFP在内镜下通常为黏膜下隆起(SMT)的表现. 超声内镜(endoscopic ultrasonography, EUS)下可见来源第2和/或3、4层的低回声病变, 内部回声均匀或不均匀, 边界可清晰或不清, 多数可见内部有无回声区或管道样回声. 先前报道表明IFP免疫组织化学表达Vimentin、PDGFR-α、CD34, 不同程度的灶性表达SMA, 但是不表达CD117、CD10、DOG-1、Desmin、S-100、VⅢ因子及ALK.
本次研究发现IFP内镜下可呈黏膜下隆起或息肉外观. EUS下IFP来源于第2或和/或第3层、低回声、内部回声均匀的病变, 边界欠清, 第四层不受累. 根据内镜下表现, IFP行经内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)或内镜下黏膜切除术(endoscopic mucosal resection, EMR)术, 手术安全基本无并发症, 术后短期随访无一例复发. 说明内镜下治疗对IFP是安全有效的.
根据内镜及EUS下表现可以对IFP做出初步诊断. 内镜治疗是安全有效的, 并可以根据术后病理及免疫组织化学结果做出最终诊断.
血小板衍生生长因子受体α: 可表达于多种细胞表面, 以成纤维细胞和平滑肌细胞为主. 该蛋白属于Ⅲ型酪氨酸蛋白激酶家族, 结构上分为细胞膜外配体结合区、跨膜区、近膜区、酪氨酸激酶功能域、激酶插入结构域和羧基末端尾区.
本文回顾性研究了13例IFP例的临床、内镜及病理学特征, 对临床医生更深入地认识胃肠黏膜下肿物的性质颇有裨益. 文章资料较为详实, 分析得当, 讨论较为深入.
编辑: 郭鹏 电编:都珍珍
| 1. | 周 晓军, 樊 祥山. 解读2010年消化系统肿瘤WHO分类(I). 临床与实验病理学杂志. 2011;27:341-346. |
| 2. | Carmack SW, Genta RM, Schuler CM, Saboorian MH. The current spectrum of gastric polyps: a 1-year national study of over 120,000 patients. Am J Gastroenterol. 2009;104:1524-1532. [PubMed] [DOI] |
| 3. | Wysocki AP, Taylor G, Windsor JA. Inflammatory fibroid polyps of the duodenum: a review of the literature. Dig Surg. 2007;24:162-168. [PubMed] [DOI] |
| 4. | Liu TC, Lin MT, Montgomery EA, Singhi AD. Inflammatory fibroid polyps of the gastrointestinal tract: spectrum of clinical, morphologic, and immunohistochemistry features. Am J Surg Pathol. 2013;37:586-592. [PubMed] [DOI] |
| 5. | Stolte M, Finkenzeller G. Inflammatory fibroid polyp of the stomach. Endoscopy. 1990;22:203-207. [PubMed] [DOI] |
| 6. | Tanaka K, Toyoda H, Imoto I, Hamada Y, Aoki M, Kosaka R, Noda T, Takei Y. Anemia caused by a gastric inflammatory fibroid polyp. Gastrointest Endosc. 2008;67:345-346. [PubMed] [DOI] |
| 7. | Karaca C, Turner BG, Cizginer S, Forcione D, Brugge W. Accuracy of EUS in the evaluation of small gastric subepithelial lesions. Gastrointest Endosc. 2010;71:722-727. [PubMed] [DOI] |
| 8. | Matsushita M, Hajiro K, Okazaki K, Takakuwa H. Gastric inflammatory fibroid polyps: endoscopic ultrasonographic analysis in comparison with the histology. Gastrointest Endosc. 1997;46:53-57. [PubMed] [DOI] |
| 9. | Kuestermann SA, Saleeb SF, Teplick SK. General case of the day. Jejunal intussusception caused by an inflammatory fibroid polyp (IFP). Radiographics. 1999;19:539-541. [PubMed] [DOI] |
| 10. | Wille P, Borchard F. Fibroid polyps of intestinal tract are inflammatory-reactive proliferations of CD34-positive perivascular cells. Histopathology. 1998;32:498-502. [PubMed] [DOI] |
| 11. | Makhlouf HR, Sobin LH. Inflammatory myofibroblastic tumors (inflammatory pseudotumors) of the gastrointestinal tract: how closely are they related to inflammatory fibroid polyps? Hum Pathol. 2002;33:307-315. [PubMed] [DOI] |
| 13. | Daum O, Hatlova J, Mandys V, Grossmann P, Mukensnabl P, Benes Z, Michal M. Comparison of morphological, immunohistochemical, and molecular genetic features of inflammatory fibroid polyps (Vanek's tumors). Virchows Arch. 2010;456:491-497. [PubMed] [DOI] |
| 14. | Schildhaus HU, Cavlar T, Binot E, Büttner R, Wardelmann E, Merkelbach-Bruse S. Inflammatory fibroid polyps harbour mutations in the platelet-derived growth factor receptor alpha (PDGFRA) gene. J Pathol. 2008;216:176-182. [PubMed] [DOI] |
| 15. | Palmirotta R, De Marchis ML, Ludovici G, Leone B, Covello R, Conti S, Costarelli L, Della-Morte D, Ferroni P, Roselli M. Mutational analysis of gastrointestinal stromal tumors (GISTs): procedural approach for diagnostic purposes. Cancer Genomics Proteomics. 2013;10:115-123. [PubMed] |
| 16. | Schaefer IM, Delfs C, Cameron S, Gunawan B, Agaimy A, Ghadimi BM, Haller F. Chromosomal aberrations in primary PDGFRA-mutated gastrointestinal stromal tumors. Hum Pathol. 2014;45:85-97. [PubMed] [DOI] |
| 17. | Carney JA, Stratakis CA. Stromal, fibrous, and fatty gastrointestinal tumors in a patient with a PDGFRA gene mutation. Am J Surg Pathol. 2008;32:1412-1420. [PubMed] [DOI] |