修回日期: 2014-10-22
接受日期: 2014-10-29
在线出版日期: 2014-12-08
目的: 探讨阻断白介素-17F(interleukin-17F, IL-17F)通路对小鼠实验性溃疡性结肠炎(ulcerative colitis, UC)的疗效观察.
方法: 24只C57BL/6J♀小鼠随机分为3组, 分别为Normal组、葡聚糖硫酸钠(dextran sulfate sodium, DSS)+anti-IL-17F组、DSS+PBS组. DSS+anti-IL-17F组、DSS+PBS组以5%DSS溶液为唯一饮用水由动物自由饮用; Normal组以蒸馏水为唯一饮用水由动物自由饮用. 分别于第4、7、10天予以DSS+anti-IL-17F组经腹腔注射IL-17F antibody(anti-IL-17F)100 µg, 予以DSS+PBS组同等剂量的PBS溶液. 观察小鼠每日的体质量变化、大便性状和隐血情况. 14 d后取小鼠结肠组织, 进行大体形态和组织病理学改变观察, 收集血清进行ELISA检测.
结果: 通过中和性使用anti-IL-17F阻断IL-17F通路发现, 与Normal组相比, DSS+anti- IL-17F组、DSS+PBS组每日疾病活动度(disease activity index, DAI)评分明显增高(P<0.01), DSS+anti-IL-17F组与DSS+PBS组相比, DSS+anti-IL-17F组DAI评分降低(P<0.05); DSS+PBS组结肠长度与DSS+anti-IL-17F组相比缩短程度更为显著[5.855 cm±0.1139 cm、7.300 cm±0.1732 cm vs Normal组(8.500 cm±0.1789 cm), P<0.01]; 在IL-17F含量测定方面, DSS+PBS组含量明显高于其他2组[207.3 pg/mL±12.74 pg/mL vs Normal组(10.06 pg/mL±2.310 pg/mL)、DSS+anti-IL-17F组(73.63 pg/mL±8.114 pg/mL), P<0.01].
结论: 阻断IL-17F通路明显缓解UC的发生发展, 为UC的临床治疗提供一种新的可能的治疗方法.
核心提示: 本文结合关于溃疡性结肠炎(ulcerative colitis, UC)发病机制的最新研究, 通过使用中和性白介素-17F(interleukin-17F, IL-17F)抗体阻断IL-17F通路, 以消除IL-17F的效应. 观察阻断IL-17F的作用对葡聚糖硫酸钠(dextran sulfate sodium)诱导小鼠实验性UC的效应, 以期为UC的临床治疗寻求一种新的免疫治疗方法.
引文著录: 张萌, 王雪明, 翟俊山, 朱超慧, 孙慧杰, 姬雅君, 李楠. 阻断IL-17F通路对小鼠实验性溃疡性结肠炎的影响. 世界华人消化杂志 2014; 22(34): 5304-5309
Revised: October 22, 2014
Accepted: October 29, 2014
Published online: December 8, 2014
AIM: To explore the effects of blocking the interleukin-17F (IL-17F) pathway in mice with experimental ulcerative colitis (UC).
METHODS: Twenty-four female C57BL/6J mice were randomly divided into three groups: a normal group, a dextran sulfate sodium (DSS) + anti-IL-17F antibody (anti-IL-17F) group, and a DSS + PBS group. The DSS + anti-IL-17F group and DSS + PBS group were given 5% DSS in drinking water, while the normal group was given distilled water only. On days 4, 7, and 10, the DSS + anti-IL-17F group underwent intraperitoneal injection of anti-IL-17F 100 µg, and the DSS + PBS group was given equal volume of PBS. During the duration of the experiment, weight loss compared to initial weight, stool consistency, and bleeding were daily observed. Colon tissues of mice were collected on day 14 to observe the morphological and histopathological changes, and serum samples were collected for ELISA.
RESULTS: The use of anti-IL-17F blocked the IL-17F signaling pathway. Compared with the normal group, disease activity index (DAI) scores significantly increased in the DSS + anti-IL-17F group and DSS + PBS group (P < 0.01), but DAI score was significantly lower in the DSS anti-IL-17F group than in the DSS + PBS group (P < 0.05). Relative to the normal group, the DSS + PBS group had more significantly shortened colon length than the DSS + anti-IL-17F group (5.855 cm ± 0.1139 cm, 7.300 cm ± 0.1732 cm vs 8.500 cm ± 0.1789 cm), P < 0.1. IL-17F content was significantly higher in the DSS + PBS group than in the other groups [207.3 pg/mL ± 12.74 pg/mL vs normal group (10.06 pg/mL ± 2.310 pg/mL), DSS + anti-IL-17F group (73.63 pg/mL ± 8.114 pg/mL), P < 0.01].
CONCLUSION: The blocking of the IL-17F pathway significantly alleviates the development and progression of ulcerative colitis, which might provide a new therapeutic strategy for ulcerative colitis.
- Citation: Zhang M, Wang XM, Zhai JS, Zhu CH, Sun HJ, Ji YJ, Li N. Effects of inhibition of interleukin-17F pathway in mice with experimental ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5304-5309
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5304.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5304
炎症性肠病(inflammatory bowel disease, IBD)是一类慢性、易反复发作的非特异性肠道炎性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). 虽然距UC的首次报道至今已经有160余年的历史[1], 但其病因及发病机制尚未完全明确. 目前认为UC是多因素相互作用的结果, 主要包括环境、遗传、感染、免疫因素等. 其中免疫功能的异常与UC的发病关系更为密切. 最近研究[2]发现一类新细胞亚群, 称为Th17细胞. 分化成熟的Th17细胞可分泌多种细胞因子, 主要包括白介素-17A(interleukin-17A, IL-17A)、IL-17F、IL-22、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、IL-6等. 而IL-17F在UC的发生发展中所起到的关键作用, 亦在国内外大量文献中得到体现[3]. 本研究通过经腹腔注射anti-IL-17F阻断IL-17F通路的方法, 对Normal组、葡聚糖硫酸钠(dextran sulfate sodium, DSS)+anti-IL-17F组、DSS+PBS组3组进行疗效观察, 以期为阻断IL-17F通路可缓解UC的发生发展提供依据.
SPF级♀C57BL/6J小鼠24只, 8-10周龄, 体质量18.0-22.0 g, 购自中国人民解放军军事医学科学院动物中心[SCXK-(军): 0012-0004]; DSS(分子量36000-50000 Da, MP, 美国); IL-17F antibody(Novus, 美国); PBS溶液; 便潜血试剂组(北京华晟源医疗科技有限公司); IL-17F ELISA检测试剂盒(博士德生物).
1.2.1 建立小鼠实验性UC模型: 24只♂C57BL/6J小鼠随机分为3组, 分别为Normal组、DSS+anti-IL-17F组、DSS+PBS组. 将DSS配制成5%的应用浓度. DSS+anti-IL-17F组、DSS+PBS组以5%DSS溶液为唯一饮用水由动物自由饮用; Normal组以蒸馏水为唯一饮用水由动物自由饮用. 每日观察动物的体质量变化、大便性状以及便血情况. 按照表1[4]进行疾病活动度(disease activity index, DAI)评分, 以评估疾病活动情况.
1.2.2 通过IL-17F antibody阻断IL-17F通路: 记录给予小鼠喂养5%DSS溶液的时间为实验开始时, 然后分别于实验第4、7、10天依次经腹腔注射予以DSS+anti-IL-17F组anti-IL-17F 100 µg, 予以DSS+PBS组同等剂量的PBS溶液[5]. 治疗期间, 继续每日观察动物的体质量变化、大便性状及便血情况, 进行DAI评分.
1.2.3 小鼠大体形态观察及标本采集: 颈椎脱臼法分别处死24只小鼠. 经眼球静脉采血, 室温下血液自然凝固20 min, 离心25 min(3000 r/min), 分离上清. 沿小鼠腹中线剖开腹腔, 分离肛门至回盲部的结肠, 测量结肠长度. 沿肠系膜附着部纵行剪开肠壁, 采用无菌生理盐水将肠内容物冲洗干净后在滤纸上将肠壁展开并固定, 在解剖镜下观察结肠大体形态.
1.2.4 HE染色: 将分离的结肠组织分成0.5-1.0 cm的组织段, 并标记组织所属结肠区域, 40 g/L多聚甲醛固定, 梯度乙醇脱水, 常规石蜡包埋、切片(4 µm)、脱蜡后行HE染色.
1.2.5 ELISA检测IL-17F含量: 将各组分离的上清采用相应的ELISA试剂盒进行检测, 按说明书进行操作, 以计算得出各组上清中IL-17F含量.
统计学处理 采用SPSS16.0软件进行分析. 计量资料以mean±SD表示, 多组间均数比较采用单因素方差分析, 进一步两两比较采用Student t检验, P<0.05为差异有统计学意义.
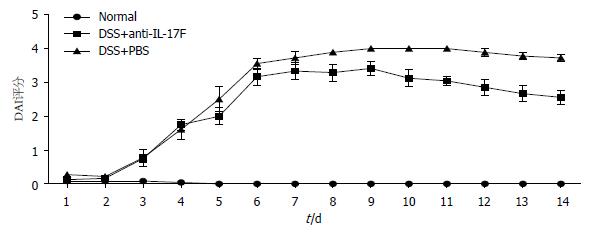
通过观察小鼠每日的体质量变化、大便性状和隐血情况计算得出小鼠DAI评分结果显示, DSS+anti-IL-17F组、DSS+PBS组与Normal组相比, DSS+anti-IL-17F组、DSS+PBS组每日DAI评分明显增高(P<0.01), DSS+anti-IL-17F组与DSS+PBS组相比, DSS+anti-IL-17F组DAI评分明显降低(P<0.05), 且于实验第9天后DSS+anti-IL-17F组DAI评分出现下降趋势(图1).
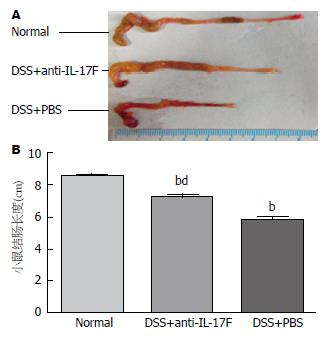
DSS+PBS组可见结肠肠壁充血、水肿明显, 严重者可见全结肠内均为血性肠内容物; DSS+anti-IL-17F组结肠肠壁明显肿胀, 且结肠内未见残留血性大便, 但是2例存在点状充血灶; DSS+PBS组及DSS+anti-IL-17F组均未见明显糜烂及溃疡病灶. 全结肠长度测量结果显示, DSS+anti-IL-17F组、DSS+PBS组与Normal组相比结肠长度均明显缩短(P<0.01), 并且DSS+PBS组与DSS+anti-IL-17F组比较, DSS+PBS组差异更显著(P<0.01)(图2).
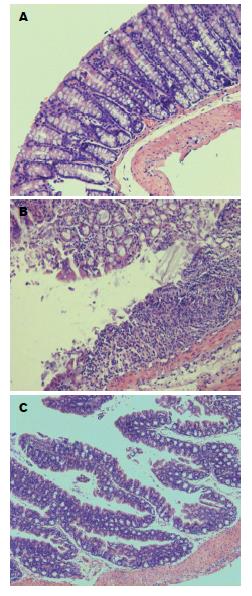
HE染色病理学结果显示Normal组黏膜光滑完整, 隐窝结构正常; DSS+PBS组可见大量炎症细胞浸润至黏膜层、黏膜下层以及肌层, 隐窝结构破坏, 黏膜上皮脱落形成糜烂; DSS+anti-IL-17F组炎症细胞浸润至肌层, 但较DSS+PBS组炎性病变轻微, 肠隐窝呈单长管状, 形态尚可, 可见少量隐窝结构异常(图3).
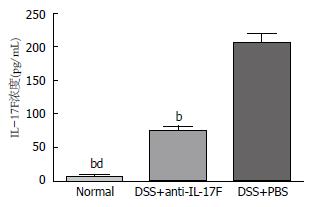
ELISA检测结果显示, DSS+anti-IL-17F组、DSS+PBS组与Normal组相比, DSS+anti-IL-17F组、DSS+PBS组中IL-17F含量明显增高(P<0.01), 其中DSS+anti-IL-17F组与DSS+PBS组相比, DSS+anti-IL-17F组IL-17F含量明显降低(P<0.01)(图4).
UC是一个复杂的病因不明的疾病, 主要表现为疾病反复缓解与复发[6]. 最近研究[7]发现Th17细胞及其分泌的细胞因子IL-17为先天性免疫系统及适应性免疫系统之间提供一个新的独特的联系路径. 在目前已知的6个IL-17细胞因子家族成员中, 其中IL-17F在UC患者肠道黏膜层的大量发现, 提示其在UC发生发展中起着举足轻重的作用. 国内外大量研究[2,8-10]显示IL-17F作为IL-17家族的一种原型细胞因子, 可诱导不同的组织和细胞产生炎性细胞因子、趋化因子和金属蛋白酶, 并向组织募集中性粒细胞, 促进组织降解基质金属蛋白酶的表达, 从而造成组织的损伤. 此外, IL-17F还可以通过稳定细胞因子的mRNA以及提高受体的表达以增强他所介导的炎症反应[11], 而这一炎症反应主要表现在增强炎症因子的迁移以及提高趋化因子基因表达水平两个方面. IL-17F还可以诱导生长调节致癌基因α/趋化因子3(growth-regulated oncogene-α/CXC chemokine ligands 1, GRO-α/CXCL1), IL-8/趋化因子8(CXC chemokine ligands 8, CXCL8)以及巨噬细胞炎性蛋白-1β/趋化因子4(macrophageinflammatoryprotein-1β/CXC chemokine ligands 4, MIP-1β/CXCL4)的释放, 可导致前致炎症因子IL-1β、IL-6产量的增加. 若运用选择性抑制剂阻断其传导通路, 可以显著降低趋化因子的释放量[12]. 由此可见, IL-17F在促进炎症反应方面发挥着重要作用.
小鼠实验性UC模型明显有助于我们目前对UC的认识, 并可通过动物模型对疾病复杂的机制进行系统的研究. DSS是一种具有内在破坏上皮细胞屏障, 促进黏膜巨噬细胞浸润, 并且可促进产生免疫调节细胞因子的一种物理制剂[6]. 本研究通过以DSS为动物唯一饮用水由动物自由饮用而建立小鼠实验性UC模型, 此结肠炎模型以严重的T细胞依赖性为特征, 主要表现为黏膜组织内免疫细胞浸润, 慢性腹泻、便血以及体质量下降等. 我们观察小鼠每日的体质量变化、大便性状和隐血情况, 根据DAI评分标准绘制得出3组小鼠的疾病活动趋势图, 由此可以看出, DSS+anti-IL-17F组与DSS+PBS组相比, DSS+anti-IL-17F组DAI评分明显降低, 且DSS+anti-IL-17F组DAI评分有下降趋势出现. 小鼠处死后经大体形态观察发现DSS+PBS组有明显UC结肠组织损伤表现, 而DSS+anti-IL-17F组小鼠则损伤较轻微. 而组织病理学检测结果亦证实DSS+anti-IL-17F组小鼠比DSS+PBS组炎症病变轻微. 且通过各组结肠长度测量后比较发现DSS+PBS组结肠长度与其他两组相比明显缩短, 具有明显统计学意义. 本研究旨在通过anti-IL-17F以阻断IL-17F通路观察对小鼠实验性UC的影响, 我们使用ELISA实验方法检测IL-17F在各组小鼠血清中的表达含量以直接反映anti-IL-17F对UC小鼠的影响. 结果显示致炎因子IL-17F在DSS+anti-IL-17F组中较DSS+PBS组含量明显降低, 与UC疾病活动呈明显正相关关系. 以上研究结果均提示经腹腔注射anti-IL-17F后UC模型疾病较前恢复, 可明显缓解UC疾病的发生发展.
Th17细胞对结肠炎的致病作用已众所周知, 其效应细胞因子IL-17F作为UC患者潜在的治疗靶点已经被提出. 虽然目前为止IL-17F在UC发生发展过程中其发病机制以及调控机制并不完全明确. 但重要的是大量研究[13-15]证实IL-17F在肠道炎症的小鼠模型中发挥显著的致病作用. 通过本项研究我们得出在肠道炎症的动物模型中中和性使用IL-17F抗体可明显改善UC疾病进展, 充分显示免疫阻断的治疗策略对UC患者存在着极大的潜能. 而本研究得出的IL-17F在UC患者的免疫病理作用方面的研究结果, 期望可以为治疗UC带来新的希望.
近年来溃疡性结肠炎(ulcerative colitis, UC)的发病率逐年上升, 但临床治疗方法进展缓慢, 亟待开发新的免疫治疗方法应对临床需求. 随着对UC免疫学发病机制研究的不断深入, 新的免疫学治疗靶点逐步显现. 白介素-17F(interleukin-17F, IL-17F)作为一种新发现的致炎因子, 与自身免疫及黏膜免疫关系密切, 在UC的发病过程中占有主要地位.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
UC作为炎症性肠病的一种, 发病率逐年上升, 但临床治疗发展缓慢. 治疗UC的免疫抑制剂-英夫利昔单抗是在对于UC发病机制的认识不断深入的前提下开发出来的肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)的单克隆抗体, 对于一些难治性UC取得了一定的疗效, 但仍有一部分患者对于英夫利昔单抗及传统的UC疗效欠佳. 因此亟待开发新的治疗方法应用于临床.
国外最新研究结果表明, IL-17F基因敲除可以缓解葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导小鼠实验性UC的肠道炎症; 且通过联合阻断IL-17A以及IL-17F通路已经证实对治疗UC有一定的疗效. 因此IL-17F应该成为治疗UC的主要靶标之一.
基因敲除方法虽然可缓解UC的发生发展, 但技术要求强, 价格昂贵, 不适于向临床转化, 但是抗体却临床应用广泛. 国外研究已经证实IL-17F作为引起结肠炎症的主要介质之一, 对UC的发病至关重要, 但是关于中和性抗体阻断IL-17F的研究却报道甚少. 本文章主要目的就是探索一种UC的新的治疗途径.
我们通过使用中和性抗体阻断IL-17F通路在UC发病发展中的致炎效应, 从而可缓解UC的病情, 为临床应用探索一种新的治疗方法. 如果此种治疗能够取得疗效, 我们期望可以通过制备IL-17F的单克隆抗体, 从而开发一种UC治疗的新药物.
葡聚糖硫酸钠(DSS): 是葡聚糖的聚阴离子衍生物, 由葡聚糖和氯磺酸的酯化反应形成, 有提高核酸杂交率、显示免疫相关的活动、纯化材料等重要用途. 为制备小鼠实验性UC经典模型的物理制剂;
疾病活动指数(DAI): 结合患者(患病动物)的体质量下降百分率、大便黏稠度和大便出血三种情况进行综合评分, 将3项结果的总分除以3即得到DAI值. 即DAI = (体质量指数+大便形状+出血情况)/3.
本研究通过研究阻断IL-17F通路对小鼠实验性UC的影响, 结果发现可明显缓解UC的发生发展, 该研究成果期望可以为治疗UC带来新的思路.
编辑: 郭鹏 电编:闫晋利
| 1. | Danese S, Fiocchi C. Ulcerative colitis. N Engl J Med. 2011;365:1713-1725. [PubMed] [DOI] |
| 2. | Bettelli E, Korn T, Oukka M, Kuchroo VK. Induction and effector functions of T(H)17 cells. Nature. 2008;453:1051-1057. [PubMed] [DOI] |
| 3. | Wedebye Schmidt EG, Larsen HL, Kristensen NN, Poulsen SS, Lynge Pedersen AM, Claesson MH, Pedersen AE. TH17 cell induction and effects of IL-17A and IL-17F blockade in experimental colitis. Inflamm Bowel Dis. 2013;19:1567-1576. [PubMed] [DOI] |
| 4. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 5. | Fan Y, Weifeng W, Yuluan Y, Qing K, Yu P, Yanlan H. Treatment with a neutralizing anti-murine interleukin-17 antibody after the onset of coxsackievirus b3-induced viral myocarditis reduces myocardium inflammation. Virol J. 2011;8:17. [PubMed] [DOI] |
| 6. | Chu CC, Hou YC, Pai MH, Chao CJ, Yeh SL. Pretreatment with alanyl-glutamine suppresses T-helper-cell-associated cytokine expression and reduces inflammatory responses in mice with acute DSS-induced colitis. J Nutr Biochem. 2012;23:1092-1099. [PubMed] [DOI] |
| 7. | Hundorfean G, Neurath MF, Mudter J. Functional relevance of T helper 17 (Th17) cells and the IL-17 cytokine family in inflammatory bowel disease. Inflamm Bowel Dis. 2012;18:180-186. [PubMed] [DOI] |
| 8. | Fitzpatrick LR. Inhibition of IL-17 as a pharmacological approach for IBD. Int Rev Immunol. 2013;32:544-555. [PubMed] [DOI] |
| 9. | Kimang'a A, Revathi G, Kariuki S, Sayed S, Devani S, Vivienne M, Kuester D, Mönkemüller K, Malfertheiner P, Wex T. IL-17A and IL-17F gene expression is strongly induced in the mucosa of H. pylori-infected subjects from Kenya and Germany. Scand J Immunol. 2010;72:522-528. [PubMed] [DOI] |
| 10. | Maddur MS, Miossec P, Kaveri SV, Bayry J. Th17 cells: biology, pathogenesis of autoimmune and inflammatory diseases, and therapeutic strategies. Am J Pathol. 2012;181:8-18. [PubMed] [DOI] |
| 11. | Hot A, Miossec P. Effects of interleukin (IL)-17A and IL-17F in human rheumatoid arthritis synoviocytes. Ann Rheum Dis. 2011;70:727-732. [PubMed] [DOI] |
| 12. | Cheung PF, Wong CK, Lam CW. Molecular mechanisms of cytokine and chemokine release from eosinophils activated by IL-17A, IL-17F, and IL-23: implication for Th17 lymphocytes-mediated allergic inflammation. J Immunol. 2008;180:5625-5635. [PubMed] [DOI] |
| 13. | McLean LP, Cross RK, Shea-Donohue T. Combined blockade of IL-17A and IL-17F may prevent the development of experimental colitis. Immunotherapy. 2013;5:923-925. [PubMed] [DOI] |
| 14. | Leppkes M, Becker C, Ivanov II, Hirth S, Wirtz S, Neufert C, Pouly S, Murphy AJ, Valenzuela DM, Yancopoulos GD. RORgamma-expressing Th17 cells induce murine chronic intestinal inflammation via redundant effects of IL-17A and IL-17F. Gastroenterology. 2009;136:257-267. [PubMed] [DOI] |