修回日期: 2014-08-14
接受日期: 2014-10-15
在线出版日期: 2014-12-08
目的: 研究植物甾醇酯(phytosterol ester, PSE)对高脂饮食诱导的非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)大鼠的预防作用.
方法: 通过高脂饮食诱导建立NAFLD大鼠模型, 饲喂高脂饮食的同时灌胃给予不同剂量PSE[低剂量组: 0.05 g/100 g体质量(body weight, BW); 中剂量组: 0.10 g/100 g BW; 高剂量组: 0.15 g/100 g BW], 观察其对大鼠血脂、肝脂的影响.
结果: 与模型组(high-fat diet group, HF)相比, 低剂量PSE组(low dosage of PSE treatment group, PSEL)血清低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)降低13.6%, 剂量增加未表现出更明显的降低效果; 各PSE干预组肝脏甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、游离脂肪酸(free fatty acids, FFA)含量均显著低于HF组, 其中PSEL的FFA接近正常对照组(normal controlled group, NC)水平. 此外, 中剂量PSE干预组(medium dosage of PSE treatment group, PSEM)、高剂量PSE干预组(high dosage of PSE treatment group, PSEH)血糖水平显著低于HF组, 与正常对照组接近. HE病理染色结果显示, PSE能明显减轻肝脏脂肪变性程度.
结论: PSE能在一定程度上纠正高脂饮食诱导的血脂、血糖代谢异常, 减少肝脂质积累, 显著改善肝脏脂肪变性程度, 对高脂饮食诱导的NAFLD有良好的预防作用.
核心提示: 在高脂饮食诱导的非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)动物体内, 植物甾醇酯(phytosterol ester, PSE)通过降低动物体内胆固醇含量、调节糖脂代谢发挥良好的预防NAFLD的作用, PSE将有可能是治疗NAFLD的天然植物化学物质.
引文著录: 张情, 伍佩英, 曲丹, 张瑶, 熊瑛, 宋立华. 植物甾醇酯对高脂饮食诱导的非酒精性脂肪肝的预防作用. 世界华人消化杂志 2014; 22(34): 5242-5248
Revised: August 14, 2014
Accepted: October 15, 2014
Published online: December 8, 2014
AIM: To explore the preventive effects of phytosterol ester (PSE) on high fat diet-induced non-alcoholic fatty liver disease (NAFLD).
METHODS: An NAFLD rat model was established by giving a high fat diet, and different dosages of PSE [PSEL: 0.05 g/100 g body weight (BW); PSEM: 0.10 g/100 g BW; PSEH: 0.15 g/100 g BW] fortified milk were given to rats by intragastric administration. Serum lipid profile and liver lipids were detected, and histological changes were observed after HE staining.
RESULTS: Compared with the high fat diet group (HF group), serum low-density lipoprotein cholesterol (LDL-C) in animals in the PSEL group was lowered by 13.6%, while no further effect was observed with higher concentrations of PSE; liver triglyceride (TG), total cholesterol (TC), and free fatty acids (FFAs) were reduced significantly in all the PSE treatment groups, among which the level of FFA was close to the normal level. Glucose (GLU) levels in the PSEM and PSEH groups were lower than that in the HF group, which were close to the normal level. HE staining results showed that the degree of hepatic steatosis was obviously ameliorated in all the PSE treatment groups.
CONCLUSION: PSE could effectively reduce serum LDL-C and hepatic fat accumulation induced by a high fat diet, and attenuate hepatic steatosis, thus exhibiting preventive effects on NAFLD.
- Citation: Zhang Q, Wu PY, Qu D, Zhang Y, Xiong Y, Song LH. Preventive effects of phytosterol ester on high fat diet-induced non-alcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5242-5248
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5242.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5242
近年来, 由于饮食结构和生活方式改变, 肥胖及其相关代谢综合征呈全球化流行趋势, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发病率在欧美发达国家和我国富裕地区迅速上升, 成为慢性肝病的重要病因. 其中在北美地区, 其患病率高达20%-33%[1]; 在亚洲, 患病率约为12%-24%[2]; 在中国, NAFLD患病率明显上升, 在过去15年中增长了大约1倍, 上海市成人NAFLD患病率为15.35%, 占脂肪肝患者的88.78%[3]. NAFLD将是21世纪世界范围的一个重要的公共健康问题[4,5]. 虽然脂肪肝被认为是良性病变, 但他并不是静止的病变, 是许多慢性肝脏疾病的早期阶段, 可在短期内发展为严重的肝损害, 不经治疗的脂肪肝会逐渐由单纯性脂肪肝发展为脂肪性肝炎和脂肪性肝纤维化, 其肝纤维化的发生率高达25%, 且约1.5%-8.0%的患者可发展为肝硬化[6,7], 并可能引起肝细胞癌变, 对人类生命健康造成极大威胁[8]. 因此, 对NAFLD的防治研究亦日益成为医学关注和研究的焦点[9,10].
目前, 关于NAFLD的治疗主要是通过运动疗法或者服用降脂药. 运动疗法因其对运动强度及频率的要求使其适用范围受到限制, 而大部分降脂药对肝内脂肪消除作用有限, 许多降脂药还具有不良反应, 导致肝细胞损伤, 在治疗NAFLD方面尚存在争议[11]. 已有研究表明羟甲基戊二酰辅酶A(hydroxy methylglutaryl coenzyme A, HMG-CoA)还原酶抑制剂(他汀类药物, 降胆固醇药物)及胆固醇吸收抑制剂(依泽替米贝)能显著改善NAFLD, 提示降胆固醇药物对NAFLD具有一定的治疗效果[12-15]. 植物甾醇(phytosterol, PS)是广泛分布于植物界的甾体化合物. 大量研究[16,17]表明, 每日摄入植物甾醇2-3 g, 能降低总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)约10%. 然而其对NAFLD的治疗效果如何尚未见报道. 此外, 还有研究[18]表明连续8 wk摄入植物甾醇, 剂量分别为3、6及9 g/d, 均未见不良反应, 显示出其良好的安全性. 因此, 本实验利用SD大鼠建立NAFLD模型, 探索植物甾醇对NAFLD的预防作用, 为深入研究植物甾醇的生物活性和开发植物甾醇强化食品奠定理论基础.
植物甾醇酯(phytosterol ester, PSE)(总植物甾醇酯和植物甾醇含量≥97%, 植物甾醇酯含量≥91%, 游离植物甾醇含量≤6%, 总植物甾醇含量≥59%. 甾醇组成: 胆甾醇≤2%, 菜籽甾醇≤6%, 菜油甾醇20.0%-29.0%, 豆甾醇12.0%-23.0%, β-谷甾醇42.0%-55.0%, D5-燕麦甾醇≤4%, D7-燕麦甾醇≤2%, D7-豆甾烯醇≤2%, 其他≤5%), 由巴斯夫(中国)有限公司(BASF)提供. 将PSE产品置于65℃水浴锅中充分液化, 与纯牛奶经高压均质配制成0.05、0.10、0.15 g/mL的植物甾醇强化牛奶用于大鼠灌胃. 基础饲料由上海交通大学药学院实验动物中心提供. 基础饲料营养成分: 水分≤10%、粗蛋白≥20%、粗脂肪≥4%、粗纤维≤5%、灰分≤8%、钙1.0%-1.8%、磷0.6%-1.2%、赖氨酸1.32%、蛋氨酸+胱氨酸0.78%. 繁殖鼠料55.8%、猪油18.4%、胆固醇1.0%、胆盐0.2%、蔗糖10.0%、酪蛋白10.0%、预混料1.9%、麦芽糊精2.7%. 由上海斯莱克实验动物有限公司提供. APV-2000高压均质机(波兰APV); 超声粉碎机(瑞士KINEMATICA公司); 日立7600-20全自动生化分析仪(日本株式会社); INFINITE M200PRO多功能酶标仪(瑞士TECAN公司); 肝脂质[甘油三酯(triglyceride, TG); TC; 游离脂肪酸(free fatty acids, FFA)]检测试剂盒(南京建成生物工程研究所).
1.2.1 实验动物及分组: 1月龄健康♂SD大鼠55只, 清洁级, 体质量100 g±10 g, 由上海斯莱克实验动物有限公司提供. SD大鼠给予基础饲料适应性喂养7 d后, 随机分为5组: 正常对照组(NC, n = 7), 高脂模型组(HF, n = 12), 低剂量PSE组(PSEL, n = 12), 中剂量PSE组(PSEM, n = 12)及高剂量PSE组(PSEH, n = 12). 其中, 正常对照组饲喂基础饲料, 其余各组均饲喂高脂饲料, 正常组及高脂模型组均以纯牛奶灌胃, 低、中、高剂量PSE干预组分别按照0.05 g/100 g体质量(body weight, BW)、0.10 g/100 g BW、0.15 g/100 g BW灌胃给予PSE强化牛奶, 1次/d, 灌胃体积为1 mL/100 g.
1.2.2 指标测定: 实验于开始前与实验第7周, 禁食12 h后眼眶采血; 实验第12周, 禁食12 h, 麻醉后腹主动脉取血, 剥离肝脏. 分离血清, 利用全自动生化分析仪检测血脂四项[TC、TG、LDL-C、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)]、血糖(glucose, GLU); 根据南京建成试剂盒说明书测定肝脂质(FFA、TC、TG); 同时取新鲜肝组织固定, 石蜡包埋, 利用HE染色法制作病理切片.
统计学处理 实验结果以mean±SD表示, 统计分析软件为SPSS19.0(IBM, 美国), 采用One-way ANOVA进行组间比较, P<0.05为差异有统计学意义.
表1所示为实验不同时间点大鼠的血脂及血糖水平. 从表中数据可以看出, 实验起始(t0)时, 各项指标组间差异无统计学意义(P>0.05); 实验至第7周(t1)时, HF组血清TC、HDL-C、LDL-C水平显著高于NC组(P<0.01). 与HF组相比, PSEL、PSEH组LDL-C水平明显下降(P<0.01); 实验至第12周(tend)时, HF组大鼠血清LDL-C较NC组显著升高(P<0.01), TC、GLU略高于NC组, 但差异无统计学意义. 与HF组相比, PSE各干预组LDL-C及GLU水平均有不同程度降低, 其中PSEL组LDL-C较HF组降低了13.6%, 显著低于HF组(P<0.05), 增加PSE剂量未见LDL-C的进一步降低. 此外, 值得注意的是, 本实验中中剂量PSEM(0.10 g/100 g BW)及高剂量PSEH(0.15 g/100 g BW)可显著抑制高脂饮食诱导的GLU升高, 两组的血糖值分别为9.2 mmol/L和8.5 mmol/L, 显著低于HF组(P<0.05), 与正常对照组相近.
| 时间 | 指标 | NC | HF | PSEL | PSEM | PSEH |
| t0 | TC | 2.63±0.21 | 2.74±0.35 | 2.62±0.31 | 2.77±0.21 | 2.67±0.34 |
| TG | 2.03±1.01 | 1.84±0.64 | 1.79±0.59 | 1.40±0.40 | 1.37±0.44 | |
| HDL-C | 1.77±0.10 | 1.84±0.24 | 1.82±0.22 | 1.98±0.19 | 1.95±0.23 | |
| LDL-C | 0.89±0.13 | 0.97±0.23 | 0.91±0.20 | 1.03±0.21 | 1.01±0.25 | |
| GLU | 4.50±0.50 | 4.70±0.60 | 4.60±0.70 | 4.90±0.90 | 5.00±0.90 | |
| t1 | TC | 1.82±0.17 | 2.41±0.44b | 2.35±0.25b | 2.52±0.27b | 2.55±0.37b |
| TG | 1.92±0.80 | 1.22±0.47a | 1.52±0.51 | 1.56±0.49 | 1.79±0.49c | |
| HDL-C | 1.55±0.15 | 1.82±0.22b | 1.80±0.14b | 1.92±0.16b | 1.88±0.19b | |
| LDL-C | 0.48±0.09 | 1.12±0.24b | 0.92±0.08bd | 1.00±0.13b | 0.91±0.16bd | |
| GLU | 4.10±0.50 | 3.80±0.40 | 4.20±0.70 | 4.40±0.90 | 5.20±0.90bd | |
| tend | TC | 1.45±0.17 | 1.65±0.29 | 1.61±0.14 | 1.79±0.25b | 1.76±0.30a |
| TG | 1.18±0.79 | 0.73±0.30a | 0.90±0.28 | 1.05±0.30 | 0.90±0.39 | |
| HDL-C | 1.34±0.14 | 1.44±0.19 | 1.35±0.18 | 1.58±0.21a | 1.23±0.28c | |
| LDL-C | 0.45±0.11 | 0.81±0.12b | 0.70±0.11cb | 0.74±0.09b | 0.75±0.15b | |
| GLU | 9.30±0.80 | 10.4±1.30 | 10.1±1.70 | 9.20±0.80c | 8.50±1.60d |
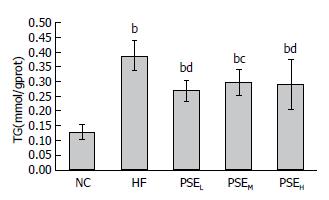
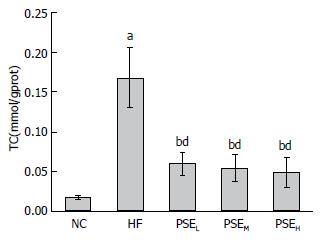
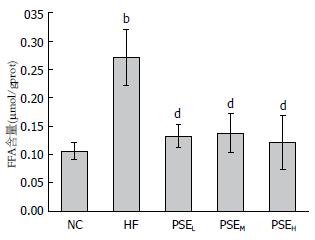
肝脏脂质含量检测结果如图1-3所示. 从图中可以看出, 12 wk的高脂饮食诱导使HF组大鼠肝脂含量极显著高于NC组(P<0.01), HF组大鼠肝脏TC、TG、FFA分别是NC组的8.33倍、2.00倍、1.55倍. 与HF组相比, PSEL组(0.05 g/100 g BW)大鼠肝脏TG、TC、FFA水平均显著降低(P<0.05), 尤其是FFA水平, 与NC组接近. 继续增高PSE剂量没有表现出更明显的降脂效果.
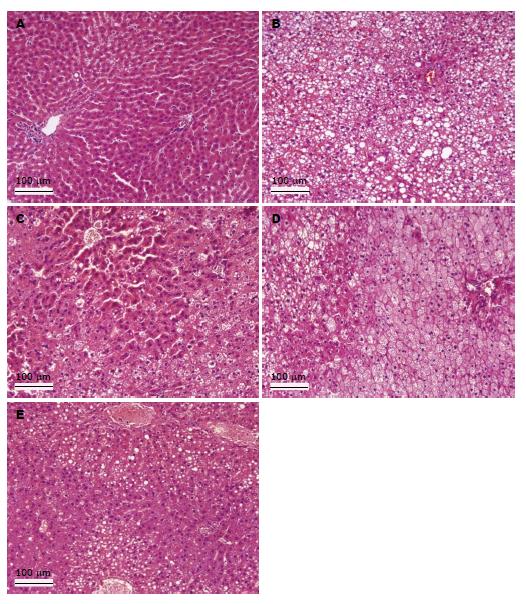
图4为各组大鼠肝组织HE染色病理观察结果. 从图4看出, 正常肝细胞形态(NC组)可观察到清晰的肝小叶结构, 肝窦排列规律, 肝细胞间界限明显. HF组大鼠肝脏呈现出明显的肝脂肪变性, 表现为肝小叶结构遭到破坏, 肝窦消失, 肝细胞变大, 细胞之间界限模糊, 细胞膜有破损, 细胞质中充满脂滴将细胞核挤压到一边, 并有多处脂肪滴连成一片形成脂肪空泡. 与HF组相比, 各PSE干预组的肝细胞中没有大的脂肪空泡出现, 脂滴直径大幅减小, 脂滴数量明显减少, 脂肪滴覆盖面积明显减少, 肝细胞间界限渐趋明显, 并且已能清晰辨别出肝小叶结构. 上述结果表明高脂饮食导致脂肪在肝脏中积累, 造成肝脂肪变性, 而不同剂量PSE干预组的肝脂肪变性程度均有不同程度改善.
本实验利用高脂饮食诱导NAFLD, 通过对血脂、血糖、肝脂质的检测, 观察不同剂量PSE对NAFLD的预防作用. 实验至第7周, HF组大鼠血清TC、LDL-C显著升高, 表明高脂饮食导致脂质代谢紊乱; 实验至第12周, HF组大鼠血清LDL-C水平较是NC组的1.8倍, 大鼠肝脏TC、TG、FFA含量分别是NC组的8.33倍、2.00倍、1.55倍, HE染色病理结果也显示HF组大鼠肝组织呈现明显肝脂肪变性, 表明成功构建了NAFLD动物模型. 此外, 观察本实验动物血脂的变化情况, 并与其他NAFLD动物模型血脂谱相比较, 本实验NAFLD模型组(HF组)大鼠血清HDL-C较NC组升高, 而TG水平低于NC组, 这与Zhang等[19]与Li等[20]报道的变化趋势有所不同, 说明不同的高脂饲料配方对NAFLD血脂谱的影响不同[21,22].
根据NAFLD的"二次打击学说", 长期摄入高脂饮食引起动物体内糖、脂代谢紊乱, 造成胰岛素抵抗(insulin resistance, IR)是NAFLD的重要发病机制. 长期处于胰岛素抵抗状态也会导致肝脏脂肪合成增加, 进而激活促炎症细胞因子, 促进NAFLD的进一步发展[23,24].
在有关NAFLD脂代谢研究中, 对于FFA和TG的研究较多, 而很少关注TC代谢异常与NAFLD之间的关系[15]. 实际上, 很多新的研究发现非肥胖NAFLD患者TC摄入量明显高于肥胖患者[25], 尽管总热能摄入在正常范围内, 但过多摄入TC本身对于肝脏脂肪变性是很强的诱因[26]. 已有研究表明过量摄入TC造成肝TC积累, 会导致LXRα-SREBP-1c通路的激活, 这与NAFLD的发展密切相关. 另有研究[12-15]表明, HMG-CoA还原酶抑制剂(他汀类药物, 降胆固醇药物)及胆固醇吸收抑制剂(依泽替米贝)能显著改善NAFLD患者血清谷丙转氨酶水平, 提示降TC药物或活性物质对NAFLD患者肝功能具有一定的改善效果. 因此, 调节TC代谢是NAFLD很有希望的治疗靶点, 抑制TC吸收或减少膳食TC摄入为NAFLD的治疗提供了可靠有效的措施.
大量研究[16,17,27-29]表明, 由于PSE与胆固醇结构相似, PSE可竞争性抑制小肠对胆固醇的吸收, 从而降低血清TC及LDL-C水平. 本实验结果表明低剂量PSE(0.05 g/100 g BW)(相当于成人3 g/d的摄入量), 能显著降低NAFLD大鼠血清LDL-C水平, 且不同剂量PSE均可显著降低肝脂质(TG、TC、FFA)水平, 显著减轻高脂饮食诱导的肝脂肪变性, HE染色病理结果也证实了这一结果. 因此, PSE对NAFLD的预防作用可能与其较好的降胆固醇活性有很大关系.
此外, 肝脏中过量的FFA酯化形成TG, 在肝脏中累积会引起脂肪变性; FFA本身具有很强的细胞毒性, 他能够诱导内质网应激, 使溶酶体通透性增加, 并导致线粒体功能障碍, 改变细胞致死因子的基因表达, 使肝细胞坏死, 引发肝脏病变. 此外, FFA还会激活促炎症因子, 加剧NAFLD向非酒精性脂肪肝炎发展[30,31]. 本实验研究结果提示PSE还可通过降低肝脏FFA含量, 延缓NAFLD的发生发展.
另外, 本实验中未见中(0.1 g/100 g BW)、高剂量(0.15 g/100 g BW)PSE(分别相当于人摄入6 g/d和9 g/d)对肝脏TC及LDL-C的进一步降低, 也有部分研究[16,17,29,32,33]表明, PSE有效降低TC剂量在2 g/d左右, PSE约3 g左右, 增加剂量不会明显降低TC和LDL-C水平, 这与本实验结果具有一致性.
值得注意的是, 本实验结果表明中、高剂量PSE可显著降低血糖, 提示PSE可纠正高脂饮食引起的糖代谢紊乱. Gupta等[34]研究也发现10、15和20 mg/kg β-谷甾醇可降低链脲霉素(streptozocin, STZ)诱导的糖尿病大鼠的血糖及糖化血红蛋白水平. 高脂饮食导致血糖升高, 动物长期处于高血糖状态引起糖代谢紊乱而使糖耐量降低, 形成胰岛素抵抗. 胰岛素是体内调节物质代谢最重要的激素之一, 当其发生抵抗, 会出现多元代谢紊乱, 其中脂代谢紊乱对NAFLD的发生最为关键. 因此, 本实验结果表明PSE能够降低血糖、改善胰岛素抵抗状态, 减轻NAFLD的脂肪变性程度.
总之, PSE能显著降低血清LDL-C及肝脏脂质含量, 减轻由高脂饮食引起的肝脂肪变性, 抑制肝损伤, 对NAFLD具有一定的预防作用, 其分子机制尚有待进一步研究.
本项目获得"巴斯夫(亚洲)营养与健康研究基金"的赞助和支持. 实验所用植物甾醇酯由巴斯夫(中国)有限公司提供.
近年来, 由于饮食结构和生活方式改变, 非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)发病率迅速上升. 脂肪肝若不及时纠正, 肝纤维化的发生率高达25%, 约1.5%-8.0%的患者可发展为肝硬化, 并可能引起肝细胞癌变. 因此, 对脂肪肝的预防和治疗研究亦日益成为医学关注和研究的重点问题之一.
郭永红, 副主任医师, 西安交通大学医学院第二附属医院感染科
流行病学调查结果表明, 高TC血症、高TG血症、低HDL-C血症、糖尿病、超重和肥胖以及中心性肥胖是脂肪肝患病的危险因素, 临床上NAFLD患者多伴有高TG血症. 因此, 针对FFA和TG代谢异常与NAFLD的研究较多, 而很少关注胆固醇代谢异常与NAFLD之间的关系.
植物甾醇(phytosterol, PS)及植物甾醇酯(phytosterol ester, PSE)具有很多重要的生理功能. 大量研究证实其可通过竞争性抑制胆固醇的吸收降低TC和低密度脂蛋白(LDL), 该活性在人群和动物实验中已得到广泛验证. 也有研究表明PS/PSE具有降糖活性.
本文章利用PSE对TC及LDL-C的调节活性, 通过观察其对高脂饮食诱导的NAFLD大鼠血脂及肝脂质的影响, 从调节胆固醇代谢的角度研究其对NAFLD发生及发展的影响, 进一步扩展研究了PSE的生物学活性.
结合人们日常饮食习惯, 将PSE强化牛奶用于实验动物, 从膳食干预的角度为NAFLD的防治提供了线索, 也为PSE的开发利用提供理论基础.
植物甾醇(PS): 一种天然植物化学活性物质, 与胆固醇结构相似, 通过竞争性抑制胆固醇的吸收, 发挥调节胆固醇代谢的作用.
本文对从调节胆固醇代谢的角度, 观察了天然植物化学物质PSE对NAFLD的预防作用, 对NAFLD的预防和治疗具有一定的临床指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Weston SR, Leyden W, Murphy R, Bass NM, Bell BP, Manos MM, Terrault NA. Racial and ethnic distribution of nonalcoholic fatty liver in persons with newly diagnosed chronic liver disease. Hepatology. 2005;41:372-379. [PubMed] [DOI] |
| 2. | Fan JG, Saibara T, Chitturi S, Kim BI, Sung JJ, Chutaputti A. What are the risk factors and settings for non-alcoholic fatty liver disease in Asia-Pacific? J Gastroenterol Hepatol. 2007;22:794-800. [PubMed] [DOI] |
| 4. | 上海交通大学医学院附属新华医院, 美国克利夫兰医学中心消化病院, 加拿大肝脏基金会. 上海国际消化系统疾病会议. 上海. 2012;. |
| 5. | Ratziu V, Bellentani S, Cortez-Pinto H, Day C, Marchesini G. A position statement on NAFLD/NASH based on the EASL 2009 special conference. J Hepatol. 2010;53:372-384. [PubMed] [DOI] |
| 6. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 7. | Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [PubMed] [DOI] |
| 8. | Fan JG, Li F, Cai XB, Peng YD, Ao QH, Gao Y. Effects of nonalcoholic fatty liver disease on the development of metabolic disorders. J Gastroenterol Hepatol. 2007;22:1086-1091. [PubMed] [DOI] |
| 10. | Hsu CS, Kao JH. Non-alcoholic fatty liver disease: an emerging liver disease in Taiwan. J Formos Med Assoc. 2012;111:527-535. [PubMed] [DOI] |
| 12. | Hyogo H, Tazuma S, Arihiro K, Iwamoto K, Nabeshima Y, Inoue M, Ishitobi T, Nonaka M, Chayama K. Efficacy of atorvastatin for the treatment of nonalcoholic steatohepatitis with dyslipidemia. Metabolism. 2008;57:1711-1718. [PubMed] [DOI] |
| 13. | Kashi MR, Torres DM, Harrison SA. Current and emerging therapies in nonalcoholic fatty liver disease. Semin Liver Dis. 2008;28:396-406. [PubMed] [DOI] |
| 14. | Nelson A, Torres DM, Morgan AE, Fincke C, Harrison SA. A pilot study using simvastatin in the treatment of nonalcoholic steatohepatitis: A randomized placebo-controlled trial. J Clin Gastroenterol. 2009;43:990-994. [PubMed] [DOI] |
| 15. | Enjoji M, Yasutake K, Kohjima M, Nakamuta M. Nutrition and nonalcoholic Fatty liver disease: the significance of cholesterol. Int J Hepatol. 2012;2012:925807. [PubMed] [DOI] |
| 16. | Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc. 2003;78:965-978. [PubMed] [DOI] |
| 17. | Demonty I, Ras RT, van der Knaap HC, Duchateau GS, Meijer L, Zock PL, Geleijnse JM, Trautwein EA. Continuous dose-response relationship of the LDL-cholesterol-lowering effect of phytosterol intake. J Nutr. 2009;139:271-284. [PubMed] [DOI] |
| 18. | Davidson MH, Maki KC, Umporowicz DM, Ingram KA, Dicklin MR, Schaefer E, Lane RW, McNamara JR, Ribaya-Mercado JD, Perrone G. Safety and tolerability of esterified phytosterols administered in reduced-fat spread and salad dressing to healthy adult men and women. J Am Coll Nutr. 2001;20:307-319. [PubMed] |
| 19. | Zhang S, Zheng L, Dong D, Xu L, Yin L, Qi Y, Han X, Lin Y, Liu K, Peng J. Effects of flavonoids from Rosa laevigata Michx fruit against high-fat diet-induced non-alcoholic fatty liver disease in rats. Food Chem. 2013;141:2108-2116. [PubMed] [DOI] |
| 20. | Li S, Liao X, Meng F, Wang Y, Sun Z, Guo F, Li X, Meng M, Li Y, Sun C. Therapeutic role of ursolic acid on ameliorating hepatic steatosis and improving metabolic disorders in high-fat diet-induced non-alcoholic fatty liver disease rats. PLoS One. 2014;9:e86724. [PubMed] [DOI] |
| 21. | Cintra DE, Costa AV, Peluzio Mdo C, Matta SL, Silva MT, Costa NM. Lipid profile of rats fed high-fat diets based on flaxseed, peanut, trout, or chicken skin. Nutrition. 2006;22:197-205. [PubMed] [DOI] |
| 22. | Zelber-Sagi S, Ratziu V, Oren R. Nutrition and physical activity in NAFLD: an overview of the epidemiological evidence. World J Gastroenterol. 2011;17:3377-3389. [PubMed] [DOI] |
| 23. | Adams LA, Angulo P, Lindor KD. Nonalcoholic fatty liver disease. CMAJ. 2005;172:899-905. [PubMed] [DOI] |
| 24. | Boden G. Obesity, insulin resistance and free fatty acids. Curr Opin Endocrinol Diabetes Obes. 2011;18:139-143. [PubMed] [DOI] |
| 25. | Nakamuta M, Kohjima M, Higuchi N, Kato M, Kotoh K, Yoshimoto T, Yada M, Yada R, Takemoto R, Fukuizumi K. The significance of differences in fatty acid metabolism between obese and non-obese patients with non-alcoholic fatty liver disease. Int J Mol Med. 2008;22:663-667. [PubMed] [DOI] |
| 26. | Wouters K, van Gorp PJ, Bieghs V, Gijbels MJ, Duimel H, Lütjohann D, Kerksiek A, van Kruchten R, Maeda N, Staels B. Dietary cholesterol, rather than liver steatosis, leads to hepatic inflammation in hyperlipidemic mouse models of nonalcoholic steatohepatitis. Hepatology. 2008;48:474-486. [PubMed] [DOI] |
| 27. | Plat J, Mensink RP. Effects of plant stanol esters on LDL receptor protein expression and on LDL receptor and HMG-CoA reductase mRNA expression in mononuclear blood cells of healthy men and women. FASEB J. 2002;16:258-260. [PubMed] [DOI] |
| 28. | Derdemezis CS, Filippatos TD, Mikhailidis DP, Elisaf MS. Review article: effects of plant sterols and stanols beyond low-density lipoprotein cholesterol lowering. J Cardiovasc Pharmacol Ther. 2010;15:120-134. [PubMed] [DOI] |
| 29. | Berger A, Jones PJ, Abumweis SS. Plant sterols: factors affecting their efficacy and safety as functional food ingredients. Lipids Health Dis. 2004;3:5. [PubMed] [DOI] |
| 30. | Zhang J, Zhao Y, Xu C, Hong Y, Lu H, Wu J, Chen Y. Association between serum free fatty acid levels and nonalcoholic fatty liver disease: a cross-sectional study. Sci Rep. 2014;4:5832. [PubMed] [DOI] |
| 31. | Ibrahim SH, Kohli R, Gores GJ. Mechanisms of lipotoxicity in NAFLD and clinical implications. J Pediatr Gastroenterol Nutr. 2011;53:131-140. [PubMed] [DOI] |
| 32. | National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002;106:3143-3421. [PubMed] |
| 33. | Hallikainen MA, Sarkkinen ES, Uusitupa MI. Plant stanol esters affect serum cholesterol concentrations of hypercholesterolemic men and women in a dose-dependent manner. J Nutr. 2000;130:767-776. [PubMed] |
| 34. | Gupta R, Sharma AK, Dobhal MP, Sharma MC, Gupta RS. Antidiabetic and antioxidant potential of β-sitosterol in streptozotocin-induced experimental hyperglycemia. J Diabetes. 2011;3:29-37. [PubMed] [DOI] |