修回日期: 2014-10-08
接受日期: 2014-10-15
在线出版日期: 2014-11-28
目的: 白介素-22(interleukin-22, IL-22)分泌性CD4+ T细胞(IL-22-producing CD4+ T cells, Th22 cells)是最近几年才被发现和确认的新的CD4+细胞, Th22细胞已确定在人类某些癌症显著增多. 然而, Th22细胞在肝癌恶性腹水(malignant ascites, MA)中如何调节抗肿瘤免疫反应等问题仍有待探讨. 所以我们对比研究了Th22细胞在MA、同源外周血和健康对照组外周血中的表达比例. 由于淋巴细胞的浸润密切地受到趋化因子/趋化因子受体(chemokine receptor, CCR)相互作用的调节, 因此我们设法阐明趋化效应在MA对Th22细胞主动募集过程中的影响.
方法: 收集了26例肝癌MA患者, 15例健康对照. 流式细胞术检测Th22、CCR4、CCR6和CCR10的表达. 酶联免疫吸附试验(ELISA)测定样本趋化因子(CC基序)配体20[chemokine (c-c motif) ligand 20, CCL20]、CCL22、CCL27和细胞因子IL-22的浓度.
结果: MA中Th22细胞和IL-22的比例较同源外周血和健康对照组外周血显著升高. 趋化因子CCL20、CCL22和CCL27在MA中的浓度远高于同源配对血清者. Th22细胞表达高水平的CCR6、CCR4和CCR10, 其对应的配体CCL20、CCL22和CCL27在MA中也显著升高. 此外, MA中Th22细胞和Th17细胞以及IL-22呈正相关.
结论: MA中Th22细胞的比例显著高于同源配对血清者, 趋化因子CCL20、CCL22和CCL27在MA中的浓度远高于同源配对血清者. 由此分析, CCL20/CCR6、CCL22/CCR4和/或CCL27/CCR10趋化轴参与了Th22细胞募集浸润到腹膜腔的过程. 这些研究表明,Th22细胞可能参与MA的发病机制, 而Th22细胞可能是干预治疗合适的细胞靶点.
核心提示: 我们的研究表明恶性腹水中白介素-22(interleukin-22, IL-22)分泌性CD4+ T(IL-22-producing CD4+ T, Th22)细胞的比例以及趋化因子(CC基序)配体20[chemokine(c-c motif) ligand 20, CCL20]、CCL22和CCL27的浓度均显著高于同源配对血清者. CCL20/趋化因子受体6(chemokine receptor 6, CCR6)、CCL22/CCR4和/或CCL27/CCR10趋化轴参与了Th22细胞募集浸润到腹膜腔的过程. Th22细胞可能在抗肿瘤免疫和恶性腹水的发病机制中扮演重要角色, 提示Th22细胞可能是干预治疗合适的细胞靶点.
引文著录: 杨显文, 姜海行, 卢威顺, 陈梅, 卢东红, 黄小丽, 王家旭, 覃山羽. Th22细胞在肝癌恶性腹水中的发病机制. 世界华人消化杂志 2014; 22(33): 5069-5078
Revised: October 8, 2014
Accepted: October 15, 2014
Published online: November 28, 2014
AIM: To examine the frequency of Th22 cells in malignant ascites (MA) from patients with hepatic carcinoma and elucidate the effects of chemokine-chemokine receptor interactions on recruitment of Th22 cells into MA.
METHODS: Twenty-six hepatic carcinoma patients with MA and 15 healthy controls were included. The expression of interleukin-22 (IL-22), chemokine receptor (CCR) 4, CCR6 and CCR10 were examined in patients with MA and healthy controls by flow cytometry. The levels of IL-22, as well as chemokines CCL20, CCL22 and CCL27 in MA and sera were examined by enzyme-linked immunosorbent assay.
RESULTS: The proportions of Th22 cells and IL-22 positive cells were significantly elevated in MA patients compared with those in peripheral blood from both patients with MA and healthy controls. The levels of chemokines CCL20, CCL22 and CCL27 were significantly higher in MA than in serum. Th22 cells expressed high levels of CCR6, CCR4 and CCR10, which are ligands for CCL20, CCL22 and CCL27, respectively. The proportion of Th22 cells had a positive correlation with the proportion of Th17 cells as well as IL-22 level in MA patients.
CONCLUSION: The recruitment of Th22 cells into MA might be induced via a chemokine-dependent mechanism. The overrepresentation of Th22 cells into MA could be induced by CCL20-CCR6, CCL22-CCR4 and/or CCL27-CCR10 axes. These findings suggest that Th22 cells may be implicated in the pathogenesis of MA, and Th22 cells may be a reasonable cellular target for therapeutic intervention.
- Citation: Yang XW, Jiang HX, Lu WS, Chen M, Lu DH, Huang XL, Wang JX, Qin SY. Role of Th22 cells in pathogenesis of malignant ascites in patients with hepatic carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(33): 5069-5078
- URL: https://www.wjgnet.com/1009-3079/full/v22/i33/5069.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i33.5069
恶性腹腔积液(malignant ascites, MA)为多种恶性肿瘤, 如肝癌、卵巢癌、胃癌等发展至晚期时, 因肿瘤细胞侵袭和转移到腹腔而发生的临床症状. 发生MA的患者预后较差, 平均生存期约为20 wk[1]. 恶性胸腹水中聚集大量淋巴细胞, 尤其是辅助性CD4+ T淋巴(helper T cell, Th)细胞[2-4]. 以CD4+为代表T细胞亚群能够抑制T细胞对外源和自体抗原的反应, 在维持对自身成分免疫耐受的同时也可以阻止机体对自体同源肿瘤的免疫[1]. 这些细胞通过分泌多种可溶性炎症和免疫因子, 参与肿瘤的生长、转移、扩散等过程.
辅助性T细胞是机体获得性免疫系统的重要组成部分. 其中Th22细胞是最近几年才被发现和确认的新的CD4+细胞, 每种细胞在特定转录调控下产生特定的效应细胞因子. Th22细胞表达趋化因子受体6(chemokine receptor 6, CCR6)、CCR4和CCR10, 其关键转录因子是芳香烃受体(aryl hydrocarbon receptor, AHR), 主要分泌白介素-22(interleukin-22, IL-22)、IL-6、IL-1β等细胞因子, 但不分泌IL-17、干扰素-γ(interferon-γ, IFN-γ)[5]. 在浆细胞样树突细胞刺激的下, IL-6和肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)可以促进人CD4+初始T细胞向Th22型细胞的分化[6]. TGF-β可以促进Th17细胞的分化, 但却抑制Th22细胞的分化[7]. 此外, IL-10和INF-γ通过抑制转录因子AHR的活性和表达影响Th22的分化. 最近研究[8,9]报道, Th22细胞可能导致人类恶性肿瘤的免疫反应. 然而, IL-22确切功能尚不清楚.
研究发现, 目前有关MA中IL-22作用的研究报道十分有限. 尽管现有的多项研究已表明, IL-22参与了多种肿瘤的发生发展过程, 包括肝癌[8]、结直肠癌[10]、肺癌[11]等, 然而, 仅有少量研究报道了Th22细胞/IL-22在肿瘤发生发展过程的表达情况. 在对胃癌的研究发现, 胃癌患者外周血CD4+IL-22+ T细胞、CD4+IL-17+ T细胞, Th22细胞以及Th17细胞数量显著高于健康人群, Th22细胞与Th17细胞、CD4+IL-17+ T细胞存在正相关关系, Th22与Th17细胞数量在Ⅲ-Ⅳ期胃癌患者的比Ⅰ-Ⅱ期患者高, 且高Th22细胞数量提示患者预后不良[12].
然而, 迄今为止国内外尚无任何关于MA中的Th22细胞免疫学特征的研究报告, 本研究探讨MA中Th22细胞分化和募集浸润腹腔的可能机制, 并研究MA中的Th22细胞与肿瘤免疫微环境中的其他免疫细胞之间的相互作用及其对MA发生、发展和转归的影响机制.
本研究由广西医科大学第一附属医院伦理委员会批准, 所有受试患者均签署了知情同意书. 共有26例最近确诊为肝癌MA患者(年龄范围为46-47岁)和15例健康对照(年龄范围为40-45岁)纳入研究. 通过检测腹腔积液中恶性细胞和/或腹腔镜取腹膜活检样本以确定MA的诊断. 遵循严格的纳入标准, 所有纳入的患者均未曾接受抗肿瘤治疗, 未使用糖皮质激素或其他非甾体类抗炎药物治疗. MA患者和健康对照者的主要临床信息汇总在(表1). RPMI 1640培养基及胎牛血清购自美国Hyclone公司; 乙酸肉豆蔻佛波酯(phorbol myristate acetate, PMA)、离子霉素购自Sigma-Aldrich公司; 红细胞裂解液、高尔基体阻断剂、莫能霉素、破膜剂购自美国BD公司; 流式细胞检测抗体: 抗CD4、抗CCR4、抗CCR6、抗CCR10、抗IL-22、抗IL-17、抗IFN-γ及同型对照IgG单克隆抗体购自BD公司或eBioscience公司; IL-22、IL-17、CCL20、CCL22及CCL27酶联免疫吸附试验(ELISA)法检测试剂盒购自美国eBioscience或Neobioscience公司.
| 指标 | 恶性腹水患者 | 健康对照 |
| n | 26 | 15 |
| 性别(男/女) | 12/14 | 8/7 |
| 年龄(岁) | 50.7±8.6 | 50.9±5.5 |
| 蛋白质(g/mL) | 4.1±0.4 | - |
| 乳酸脱氢酶(U/L) | 747.3±125.6 | - |
| C反应蛋白(mg/L) | 62.6±15.4 | 8.1±1.2 |
| 天冬氨酸转氨酶(U/L) | 78.7±11.3 | 20.6±6.1 |
| 丙氨酸转氨酶(U/L) | 68.9±9.4 | 18.5±7.4 |
| 甲胎蛋白(µg/L) | 81.7±10.6 | - |
| 癌胚抗原(µg/L) | 43.5±2.4 | - |
1.2.1 标本收集与处理: 在患者入院24 h内, 通过标准腹腔穿刺术采集300-500 mL恶性腹水标本放置于肝素化管中, 并同时抽取10 mL外周血. 恶性腹水标本立即冰浴, 随后以1000 g离心10 min. 离心后取腹水上清和血清冰冻保存于-80 ℃, 留待后续的细胞因子和趋化因子浓度检测. 以PBS重悬恶性腹水细胞沉淀, 以Ficoll-Hypaque梯度离心分离单个核细胞, 并且在1 h内检测T细胞亚群.
1.2.2 流式细胞检测: 来源于MA和外周血样本的细胞经过藻红蛋白(PE)或FITC等多种荧光素标记的抗人特异性抗体作细胞膜表面和细胞内染色之后, 在流式细胞仪上进行T细胞标志物检测. T细胞亚群在加有PMA(50 ng/mL)、离子霉素(1 µmol/L)以及高尔基体阻断剂的含10%胎牛血清的RPMI 1640培养基内进行37 ℃、5%CO2刺激孵育5 h. 孵育后, 用抗CD4、抗CCR4、抗CCR6和抗CCR10单克隆抗体进行细胞膜表面染色标记并在暗室室温孵育30 min. 破膜剂破膜后进行抗IL-22、抗IL-17和抗IFN-γ单克隆抗体细胞内染色标记并在4 ℃孵育30 min. 用同型对照确定正确的荧光补偿和确认抗体特异性. 流式细胞仪型号BD FACSCalibur, 数据以FCS ExpressV3软件分析.
1.2.3 酶联免疫吸附试验检测细胞因子IL-22和IL-17: 操作过程严格按照试剂盒说明, 采用CurveExpert软件绘制标准曲线, 计算血清IL-22和IL-17的浓度.
1.2.4 趋化因子CCL20、CCL22和CCL27浓度检测: 采用ELISA检测试剂盒, 按照相关试剂盒推荐检测步骤, 对腹腔积液和同源配对血清中的趋化因子CCL20、CCL22和CCL27的浓度进行检测.
统计学处理 采用SPSS16.0软件(Chicago, IL, USA)进行处理数据, 数据以mean±SE表示(除特殊注明的情况以外). 采用Kruskal-Wallis单因素秩和检验进行组间比较, 采用Wilcoxon秩和检验进行恶性腹水和配对外周血的比较, 采用Spearman秩相关系数检验变量间相关关系. P<0.05为差异具有统计学意义.
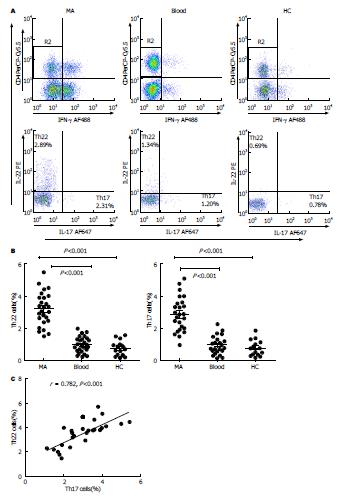
使用流式细胞仪检测MA和外周血中的单个核细胞, 以抗CD4单克隆抗体设计分析CD4+ T细胞. 流式散点图显示来源于恶性腹水及外周血中的Th22和Th17细胞(图1A). 如图1B所示, MA中Th22细胞比例(3.28%±0.45%)与其匹配外周血(1.09%±0.21%, n = 26; Wilcoxon signed-rank test, P<0.001)以及健康对照组(0.71%±0.18%, n = 15; Wilcoxon signed-rank test, P<0.001)相比明显升高. 同时MA中的Th17细胞比例(2.45%±0.23% )亦较外周血(1.10%±0.19%, n = 26, P<0.001)和健康对照组(0.77%±0.11%; n = 15; P<0.001)明显增高. 此外, MA中Th22细胞数量与Th17细胞数量呈正相关(P<0.001)(图1C).
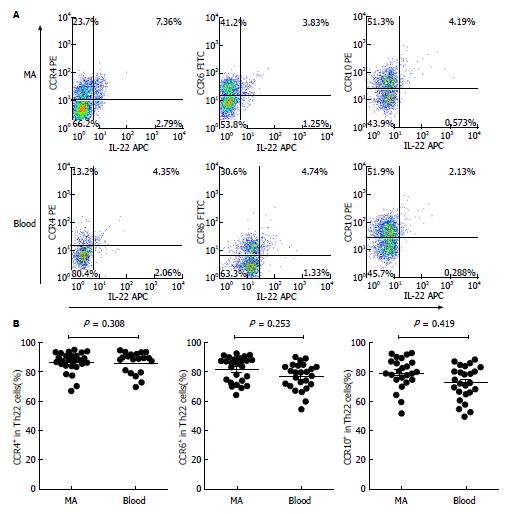
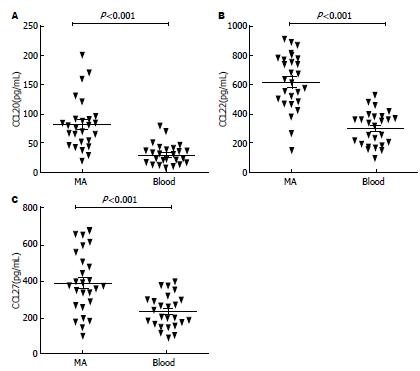
除在腹膜腔局部分化的机制以外, 外周血中Th22细胞迁移浸润至腹膜腔可能为MA中Th22细胞比例增多的原因. 研究表明, 淋巴细胞的迁移受到趋化因子/趋化因子受体(CCL/CCR)轴作用的严密调控[13], 由此, 本实验探索CCL/CCR趋化轴调节Th22细胞. 流式散点图显示MA及外周血中Th22细胞上CCR4、CCR6和CCR10的表达水平(图2A). 根据我们的表型分析结果显示, MA和外周血(blood)Th22细胞高表达CCR6、CCR4和CCR10(84.8%±3.3%, 80.2%±2.5%和76.3%±3.1% vs 80.2%±3.1%, 75.8%±2.4%和75.6%±3.3%, P>0.05)(图2B). CCR6、CCR4和CCR10的配体分别为CCL20、CCL22和CCL27. 此次的结果进一步显示MA中CCL20、CCL22和CCL27浓度(80.2 pg/mL±15.6 pg/mL, 650.7 pg/mL±74.1 pg/mL和386.2 pg/mL±63.7 pg/mL)同样明显高于相应外周血清(26.5 pg/mL±5.4 pg/mL, 375.4 pg/mL±31.7 pg/mL和226.8 pg/mL±44.3 pg/mL, P<0.001)(图3). 基于上述结果, 我们推测外周的Th22细胞可能受到这些趋化因子诱导而浸润至腹膜腔. 综合这些数据分析, Th22细胞可能经由CCL20/CCR6、CCL22/CCR4或/和CCL27/CCR10趋化轴的动员而募集浸润至腹膜腔.
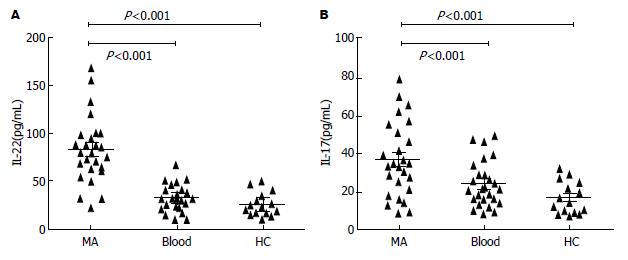
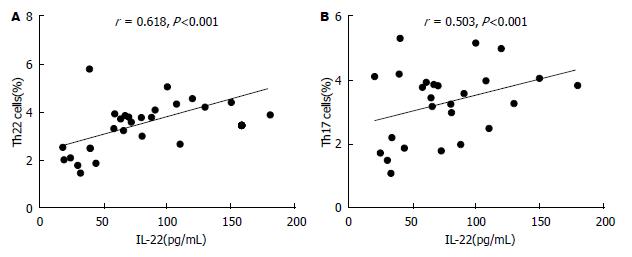
ELISA检测样本中IL-22和IL-17的浓度水平. MA中IL-22浓度(81.58 pg/mL±5.14 pg/mL)明显高于相应外周血清(29.39 pg/mL±4.80 pg/mL)以及健康对照组(21.36 pg/mL±3.54 pg/mL)(图4). 同样, MA中IL-17浓度(36.8 pg/mL±3.9 pg/mL)明显高于相应外周血清(20.70 pg/mL±3.55 pg/mL)以及健康对照组(16.81 pg/mL±3.45 pg/mL)(图4). 此次结果还显示, MA中IL-22的浓度分别与Th22细胞数量和Th17细胞数量呈正相关(图5).
虽然迄今为止关于Th22细胞的研究为数不多, 但可以明确的是IL-22确实参与了肿瘤的发生, IL-22具有激活细胞生长、增殖和分裂周期的相关信号通路的功能[14-17]. 据我们所知, 这是首次对Th22细胞的分布、表型和募集的可能机制、及其在MA中发挥的肿瘤免疫调节作用进行的研究. 最近Zhang等[18]的报道证实, 在非小细胞肺癌患者肿瘤原发灶、恶性胸腔积液及血清中IL-22浓度升高, 而且IL-22的高表达与肺癌的发生和进展密切相关. 卵巢癌恶性腹水的研究发现, 在肿瘤晚期阶段, 体内的CD4+CD25+ Treg细胞主要积聚于肿瘤部位和腹水中, 很少停留于肿瘤引流淋巴结[19]. 同时, 与外周血相比, 腹水中IL-6、IL-8、IL-10、IL-15、TNF-α和VEGF水平明显升高. 我们的研究显示, MA中Th22和Th17细胞数量均显著高于相应外周血和健康对照组. 并且, MA中Th22细胞数量分别和Th17细胞数量以及IL-22的浓度呈正相关. 这些研究提示MA中Th22和Th17细胞可能有类似的分化机制. 研究证明, IL-6不仅可以促进IL-22的表达[20], 而且是促使初始CD4+T细胞分化为Th17细胞所不可缺少的细胞因子. 另外, IL-23的治疗可以诱导IL-22的分泌, 而IL-23是人类Th17细胞分化所必须的细胞因子[21]. 这也许可以解析我们实验中Th22和Th17细胞数量呈正相关的原因, 而Th22和Th17细胞之间潜在的关系有待进一步研究. 我们的结果还显示, MA中Th22细胞的比例及其主要效应因子IL-22的浓度均明显高于相应的外周血和健康对照组. 研究发现, 除了Th22细胞外, Th17和Th1细胞也可以分泌IL-22. 在所有产生IL-22的T细胞中, Th22细胞占37%-63%, Th17占10%-18%, Th1约占35%[7]. 这些也许可以阐述我们的研究结果IL-22的浓度分别和Th22细胞的数量以及Th17细胞的数量呈正相关的内在因素.
此外, 我们亦检测到部分IL-17阳性Th22细胞以及IFN-γ阳性Th22细胞, 尤以MA中为多. 迄今为止, 有关人腹腔中Th22/Th17和Th22/Th1细胞的表型及功能研究尚不充分, 对此我们正在进行深入探索.
Th17细胞是由初始Th细胞在IL-6和TGF-β[22,23]的共同刺激下发生分化而来的, 具有分泌IL-17A和IL-17F功能的CD4+ T细胞. 研究[24-27]表明, Th17细胞存在于人类某些恶性肿瘤中, 但是关于其在MA中是如何调节抗肿瘤免疫反应等问题仍有待探讨. 曾有报道[28]指出, 恶性肿瘤微环境中的Th17通过促进树突状细胞、细胞毒性T淋巴细胞和NK细胞的浸润和定植而发挥间接的抗肿瘤作用. Martin-Orozco等[29]通过IL-17缺陷小鼠肺部黑素瘤模型直接证实, Th17细胞在抗肿瘤免疫中扮演了保护性的角色, 并且在肺部黑素瘤模型中促进了肿瘤特异性细胞毒性T细胞的免疫应答. Ye等[30]研究发现, 胸腔积液中促炎性细胞因子可促进Th17的分化, 趋化因子CCL20和CCL22可能在诱导Th17细胞浸润至恶性胸腔积液中起重要作用. 本研究的数据显示MA中Th17细胞的比例和IL-17的浓度明显高于外周血和健康对照, 这暗示着Th17及其分泌IL-17在调节肿瘤疾病进展中可能具有促进肿瘤免疫作用.
研究[31]证明, IL-22通过抑制STAT3磷酸化, 进而降低ERK1/2和AKT磷酸化水平, 并且IL-22呈剂量依赖性的抑制肾癌细胞生长, 也可抑制移植肿瘤生长, IL-22的这种抑制效应少部分是通过调节STAT1信号通路和G2-M细胞周期停滞实现, 而不是通过诱导凋亡和其他炎症细胞因子产生而发挥作用[32]. 在恶性胸腔积液的研究表明[33], 胸水中的Th22细胞数量和IL-22水平显著高于相应外周血清者; 研究发现IL-22不仅能促使A549细胞黏附到胸腔间皮细胞, 而且还可以明显促进肺癌细胞系A549增殖和迁移. 我们的研究显示, MA中Th22、Th17、IL-22和IL-17水平均显著高于相应外周血和健康对照组. 致使MA中Th22细胞数量增多的另一原因可能在于外周血中Th22细胞受到MA的动员而募集浸润腹腔. 近来的体外趋化实验证实[33], 恶性胸腔积液对Th22细胞具有趋化活性, 抗CCL20、CCL22和CCL27单克隆中和抗体在单独或联合应用时均能够削弱恶性胸腔积液对Th22细胞的趋化效应. 我们的研究数据显示: MA和外周血中Th22细胞表面均高表达CCR6、CCR4和CCR10, 而和CCR6、CCR4和CCR10分别对应的配体CCL20、CCL22和CCL27浓度在MA中也显著高于相应外周血清者. 这些研究结果提示Th22细胞和IL-22在MA中发挥了生物学效应, CCL20/CCR6、CCL22/CCR4和/或CCL27/CCR10趋化轴参与了Th22细胞募集浸润到腹膜腔的过程. 我们已经着手Th22细胞的体外的趋化实验等的研究, 而Th22细胞分化和募集浸润腹腔的确切机制有待进一步研究.
总之, 我们的研究显示MA中Th22细胞的比例显著高于同源配对血清者以及健康对照组, 趋化因子CCL20、CCL22和CCL27在MA中的浓度远高于同源配对血清者. 尽管尚不能排除MA中局部抗原刺激引起Th22细胞的过度表达的可能性, 然而我们的结果提示, MA中促炎性细胞因子可促进Th22细胞的分化, 趋化因子CCL20、CCL22和CCL27可能诱导Th22细胞浸润至MA中. 这些研究表明, CCL20/CCR6、CCL22/CCR4和/或CCL27/CCR10趋化轴参与了Th22细胞募集浸润到腹膜腔的过程. Th22细胞可能在抗肿瘤免疫和恶性腹水的发病机制中扮演重要的角色, 提示Th22细胞可能是干预治疗合适的细胞靶点.
恶性腹腔积液为多种恶性肿瘤细胞侵袭和转移到腹腔而发生的临床症状. Th22细胞是最近几年才被发现和确认的新的CD4+细胞, Th22细胞已确定在人类某些癌症显著增多. 由于淋巴细胞的浸润密切地受到趋化因子/趋化因子受体相互作用的调节, 提示Th22细胞可能是干预治疗合适的细胞靶点.
于则利, 教授, 首都医科大学附属北京同仁医院外科
恶性腹腔积液中聚集大量淋巴细胞, 尤其是以CD4+的辅助性T(helper T cell, Th)细胞为主. Th细胞是贯通固有免疫和获得性免疫的桥梁, 在机体免疫反应的启动和维持中扮演核心角色. 目前国内外有关Th22、Th17等新型细胞亚群在恶性腹腔积液中的的表型和免疫学活性研究甚少.
既往研究报道, Th22细胞与人类癌症的发病过程有关, IL-22确实参与了肿瘤的发生, IL-22具有激活细胞生长、增殖和分裂周期的相关信号通路的功能. Th22细胞在胸腔细胞因子和趋化因子的共同作用下募集浸润胸膜腔, 其在人类恶性胸腔积液环境中对肿瘤细胞发挥了重要的免疫调节作用.
CD4+为代表的T细胞亚群不仅能够抑制T细胞对外源和自体抗原的反应, 而且也可以阻止机体对自体同源肿瘤的免疫. 迄今为止国内外尚无任何关于恶性腹水中Th22细胞免疫学特征的研究报告, 本研究探讨恶性腹水中Th22细胞分化和募集浸润腹腔的可能机制, 并研究Th22细胞对恶性腹水的发生、发展和转归的影响机制.
本研究瞄准国际前沿领域, 对TH22细胞亚群在恶性腹水中的生物学特征以及如何参与腹膜疾病发生发展的机制展开了研究. 除了加深人们对TH22细胞亚群免疫学特性的认识、从崭新的角度出发来阐明腹膜疾病的发病学机制之外, 还为临床更好地控制肿瘤性和感染性疾病提供了新的干预途径和理论依据.
本文引用较新颖的实验手段对晚期肝癌患者的腹水中Th22表达及作用机制进行了探讨, 有一定特色, 具备一定的科学性, 可在一定程度上反映国内胃肠病学基础研究的水平
编辑: 郭鹏 电编:都珍珍
| 1. | Smith EM, Jayson GC. The current and future management of malignant ascites. Clin Oncol (R Coll Radiol). 2003;15:59-72. [PubMed] [DOI] |
| 2. | Hao C, Shi Y, Yu J, Wei X, Li S, Tong Z. The therapeutic function of the chemokine RANTES on the H22 hepatoma ascites model. Mol Cell Biochem. 2012;367:93-102. [PubMed] [DOI] |
| 3. | Dalbeth N, Lee YC. Lymphocytes in pleural disease. Curr Opin Pulm Med. 2005;11:334-339. [PubMed] [DOI] |
| 4. | Yang HB, Shi HZ. T lymphocytes in pleural effusion. Chin Med J (Engl). 2008;121:579-580. [PubMed] |
| 5. | Eyerich K, Pennino D, Scarponi C, Foerster S, Nasorri F, Behrendt H, Ring J, Traidl-Hoffmann C, Albanesi C, Cavani A. IL-17 in atopic eczema: linking allergen-specific adaptive and microbial-triggered innate immune response. J Allergy Clin Immunol. 2009;123:59-66.e4. [PubMed] [DOI] |
| 6. | Eyerich S, Eyerich K, Pennino D, Carbone T, Nasorri F, Pallotta S, Cianfarani F, Odorisio T, Traidl-Hoffmann C, Behrendt H. Th22 cells represent a distinct human T cell subset involved in epidermal immunity and remodeling. J Clin Invest. 2009;119:3573-3585. [PubMed] [DOI] |
| 7. | Duhen T, Geiger R, Jarrossay D, Lanzavecchia A, Sallusto F. Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells. Nat Immunol. 2009;10:857-863. [PubMed] [DOI] |
| 8. | Jiang R, Tan Z, Deng L, Chen Y, Xia Y, Gao Y, Wang X, Sun B. Interleukin-22 promotes human hepatocellular carcinoma by activation of STAT3. Hepatology. 2011;54:900-909. [PubMed] [DOI] |
| 9. | Miyagaki T, Sugaya M, Suga H, Kamata M, Ohmatsu H, Fujita H, Asano Y, Tada Y, Kadono T, Sato S. IL-22, but not IL-17, dominant environment in cutaneous T-cell lymphoma. Clin Cancer Res. 2011;17:7529-7538. [PubMed] [DOI] |
| 10. | Petanidis S, Anestakis D, Argyraki M, Hadzopoulou-Cladaras M, Salifoglou A. Differential expression of IL-17, 22 and 23 in the progression of colorectal cancer in patients with K-ras mutation: Ras signal inhibition and crosstalk with GM-CSF and IFN-γ. PLoS One. 2013;8:e73616. [PubMed] [DOI] |
| 11. | Kobold S, Völk S, Clauditz T, Küpper NJ, Minner S, Tufman A, Düwell P, Lindner M, Koch I, Heidegger S. Interleukin-22 is frequently expressed in small- and large-cell lung cancer and promotes growth in chemotherapy-resistant cancer cells. J Thorac Oncol. 2013;8:1032-1042. [PubMed] [DOI] |
| 12. | Zhuang Y, Peng LS, Zhao YL, Shi Y, Mao XH, Guo G, Chen W, Liu XF, Zhang JY, Liu T. Increased intratumoral IL-22-producing CD4(+) T cells and Th22 cells correlate with gastric cancer progression and predict poor patient survival. Cancer Immunol Immunother. 2012;61:1965-1975. [PubMed] [DOI] |
| 13. | Moser B, Ebert L. Lymphocyte traffic control by chemokines: follicular B helper T cells. Immunol Lett. 2003;85:105-112. [PubMed] |
| 14. | Bernardi RJ, Trump DL, Yu WD, McGuire TF, Hershberger PA, Johnson CS. Combination of 1alpha,25-dihydroxyvitamin D(3) with dexamethasone enhances cell cycle arrest and apoptosis: role of nuclear receptor cross-talk and Erk/Akt signaling. Clin Cancer Res. 2001;7:4164-4173. [PubMed] |
| 15. | Fang JY, Richardson BC. The MAPK signalling pathways and colorectal cancer. Lancet Oncol. 2005;6:322-327. [PubMed] |
| 16. | Romerio F, Zella D. MEK and ERK inhibitors enhance the anti-proliferative effect of interferon-alpha2b. FASEB J. 2002;16:1680-1682. [PubMed] |
| 17. | Wu JJ, Zhang XD, Gillespie S, Hersey P. Selection for TRAIL resistance results in melanoma cells with high proliferative potential. FEBS Lett. 2005;579:1940-1944. [PubMed] |
| 18. | Zhang W, Chen Y, Wei H, Zheng C, Sun R, Zhang J, Tian Z. Antiapoptotic activity of autocrine interleukin-22 and therapeutic effects of interleukin-22-small interfering RNA on human lung cancer xenografts. Clin Cancer Res. 2008;14:6432-6439. [PubMed] [DOI] |
| 19. | Curiel TJ, Coukos G, Zou L, Alvarez X, Cheng P, Mottram P, Evdemon-Hogan M, Conejo-Garcia JR, Zhang L, Burow M. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med. 2004;10:942-949. [PubMed] [DOI] |
| 20. | Zheng Y, Danilenko DM, Valdez P, Kasman I, Eastham-Anderson J, Wu J, Ouyang W. Interleukin-22, a T(H)17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature. 2007;445:648-651. [PubMed] |
| 21. | Volpe E, Servant N, Zollinger R, Bogiatzi SI, Hupé P, Barillot E, Soumelis V. A critical function for transforming growth factor-beta, interleukin 23 and proinflammatory cytokines in driving and modulating human T(H)-17 responses. Nat Immunol. 2008;9:650-657. [PubMed] [DOI] |
| 22. | Bettelli E, Carrier Y, Gao W, Korn T, Strom TB, Oukka M, Weiner HL, Kuchroo VK. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 2006;441:235-238. [PubMed] |
| 23. | Veldhoen M, Hocking RJ, Atkins CJ, Locksley RM, Stockinger B. TGFbeta in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells. Immunity. 2006;24:179-189. [PubMed] |
| 24. | Kryczek I, Banerjee M, Cheng P, Vatan L, Szeliga W, Wei S, Huang E, Finlayson E, Simeone D, Welling TH. Phenotype, distribution, generation, and functional and clinical relevance of Th17 cells in the human tumor environments. Blood. 2009;114:1141-1149. [PubMed] [DOI] |
| 25. | Kryczek I, Wei S, Zou L, Altuwaijri S, Szeliga W, Kolls J, Chang A, Zou W. Cutting edge: Th17 and regulatory T cell dynamics and the regulation by IL-2 in the tumor microenvironment. J Immunol. 2007;178:6730-6733. [PubMed] [DOI] |
| 26. | Miyahara Y, Odunsi K, Chen W, Peng G, Matsuzaki J, Wang RF. Generation and regulation of human CD4+ IL-17-producing T cells in ovarian cancer. Proc Natl Acad Sci U S A. 2008;105:15505-15510. [PubMed] |
| 27. | Sfanos KS, Bruno TC, Maris CH, Xu L, Thoburn CJ, DeMarzo AM, Meeker AK, Isaacs WB, Drake CG. Phenotypic analysis of prostate-infiltrating lymphocytes reveals TH17 and Treg skewing. Clin Cancer Res. 2008;14:3254-3261. [PubMed] [DOI] |
| 28. | Zou W, Restifo NP. T(H)17 cells in tumour immunity and immunotherapy. Nat Rev Immunol. 2010;10:248-256. [PubMed] [DOI] |
| 29. | Martin-Orozco N, Muranski P, Chung Y, Yang XO, Yamazaki T, Lu S, Hwu P, Restifo NP, Overwijk WW, Dong C. T helper 17 cells promote cytotoxic T cell activation in tumor immunity. Immunity. 2009;31:787-798. [PubMed] [DOI] |
| 30. | Ye ZJ, Zhou Q, Gu YY, Qin SM, Ma WL, Xin JB, Tao XN, Shi HZ. Generation and differentiation of IL-17-producing CD4+ T cells in malignant pleural effusion. J Immunol. 2010;185:6348-6354. [PubMed] [DOI] |
| 31. | Weber GF, Gaertner FC, Erl W, Janssen KP, Blechert B, Holzmann B, Weighardt H, Essler M. IL-22-mediated tumor growth reduction correlates with inhibition of ERK1/2 and AKT phosphorylation and induction of cell cycle arrest in the G2-M phase. J Immunol. 2006;177:8266-8272. [PubMed] |
| 32. | Zhang F, Shang D, Zhang Y, Tian Y. Interleukin-22 suppresses the growth of A498 renal cell carcinoma cells via regulation of STAT1 pathway. PLoS One. 2011;6:e20382. [PubMed] [DOI] |
| 33. | Ye ZJ, Zhou Q, Yin W, Yuan ML, Yang WB, Xiang F, Zhang JC, Xin JB, Xiong XZ, Shi HZ. Interleukin 22-producing CD4+ T cells in malignant pleural effusion. Cancer Lett. 2012;326:23-32. [PubMed] [DOI] |