修回日期: 2014-08-19
接受日期: 2014-08-26
在线出版日期: 2014-10-08
目的: 探讨重症急性胰腺炎(serve acute pancreatitis, SAP)大鼠小肠平滑肌细胞凋亡情况及相关机制.
方法: 健康纯系♂SD大鼠30只, 随机分为假手术组(15只)与胰腺炎组(15只), 胰腺炎组大鼠麻醉后开腹, 胰管逆行注射3%牛磺胆酸钠溶液1 mL/kg, 缝合腹腔, 假手术组大鼠胰管逆行注射生理盐水1 mL/kg, 余同胰腺炎组. 造模48 h后检测胰腺组织病理学改变及小肠推进率; TUNEL法、荧光定量RT-PCR、流式细胞术与免疫组织化学法分别检测小肠平滑肌细胞凋亡、线粒体腺苷酸转移载体(adenine nucleotide translocater, ANT)mRNA含量、线粒体膜电位(mitochondrion membrane potential)变化及细胞色素C(cytochrome C, Cyt-C)表达情况.
结果: (1)假手术组大鼠胰腺大体结构及光镜结构均无异常, 与假手术组相比, SAP组大鼠胰腺炎症明显, 胰腺病理评分显著增高(6.85±1.21 vs 1.13±0.91, P<0.001); SAP组大鼠小肠推进率下降明显(55.91%±2.93% vs 68.9%±5.69%, P<0.05); (2)与假手术组相比, SAP组大鼠小肠平滑肌细胞凋亡显著增加(0.056±0.184 vs 0.029±0.038, P<0.05); ANT mRNA的相对含量是1.98; Cyt-C蛋白表达显著增加(0.024±0.001 vs 0.057±0.168, P<0.001); 线粒体膜电位显著降低(5.07±0.92 vs 2.40±0.50,P<0.05).
结论: 线粒体信号转导途径可能介导了SAP大鼠小肠平滑肌细胞凋亡, 后者在SAP大鼠肠道动力下降中扮演一定角色.
核心提示: 线粒体信号转导途径介导了重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠小肠平滑肌的细胞凋亡, 后者在SAP所致小肠动力障碍中扮演一定角色.
引文著录: 赵宏贤, 杨晓红, 李昌平, 陈霞. 重症急性胰腺炎对大鼠小肠平滑肌细胞凋亡的影响. 世界华人消化杂志 2014; 22(28): 4231-4236
Revised: August 19, 2014
Accepted: August 26, 2014
Published online: October 8, 2014
AIM: To investigate whether small intestinal smooth muscle cell apoptosis occurs in rats with severe acute pancreatitis (SAP) and the underlying mechanism.
METHODS: Male SD rats were randomly divided into a sham operation group (SO) and an SAP group. SAP was induced by injecting 3.8% sodium taurocholate solution into the subcapsular region of the pancreas of SD rats. Rats in the SO group were injected with 1 mL/kg normal saline. Forty-eight hours later, pancreatic pathological changes and the transit rate of the small bowel were determined. Cell apoptosis, expression of adenine nucleotide translocator (ANT) mRNA, mitochondrial membrane potential, and cytochrome C (Cyt-C) protein expression in the small intestinal smooth muscle were determined by TUNEL method, RT-PCR, flow cytometry and immunohistochemistry, respectively.
RESULTS: Compared with rats in the SO group, rats in the SAP group developed typical SAP symptoms, with a higher pancreatic pathology score (6.85 ± 1.21 vs 1.13 ± 0.91, P < 0.001). Compared with rats in the SO group, the transit rate of the small intestine was significantly lower (55.91% ± 2.93% vs 68.9% ± 5.69%, P < 0.05), the apoptosis of smooth muscle cells in the small intestine increased significantly (0.056 ± 0.184 vs 0.029 ± 0.038, P < 0.05), the expression of ANT mRNA and Cyt-C protein (0.024 ± 0.001 vs 0.057 ± 0.168, P < 0.001) in the smooth muscle of the small intestine increased significantly, and the mitochondrial membrane potential decreased significantly (5.07 ± 0.92 vs 2.40 ± 0.50, P < 0.05) in the SAP group.
CONCLUSION: The mitochondrial signal transduction pathway contributes to smooth muscle cell apoptosis in the small intestine, which may play a role in small intestinal motility dysfunction in SAP rats.
- Citation: Zhao HX, Yang XH, Li CP, Chen X. Small intestinal smooth muscle cell apoptosis in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(28): 4231-4236
- URL: https://www.wjgnet.com/1009-3079/full/v22/i28/4231.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i28.4231
肠动力障碍是重症急性胰腺炎(severe acute pancreatitis, SAP)常见的临床表现之一, 危害较大. 认识肠道运动障碍机制, 改善肠道运动功能有助于SAP治疗和预后. 研究[1-14]表明SAP所致肠道动力下降可能与胃肠激素分泌紊乱、肠神经系统功能失调、炎性介质增多等有关. 小肠肌层平滑肌细胞是肠道运动的核心成分与执行者. 其数量减少必然会减弱肠道运动能力, 细胞坏死与凋亡增加及增殖减少均可导致平滑肌细胞数量减少. 大量研究表明SAP可引起多种器官组织细胞凋亡增加, 本课题前期研究[15]发现SAP大鼠小肠黏膜细胞凋亡增多, 至于肌层平滑肌细胞凋亡是否介导SAP大鼠小肠动力下降未见相关文献报道. 本实验建立SAP大鼠模型, 在观察到小肠动力下降的基础上, 检测SAP大鼠小肠平滑肌细胞凋亡情况及其机制, 以探讨SAP肠道动力障碍的内在分子机制.
健康纯系♂SD大鼠30只, 体质量200 g(泸州医学院动物科提供). TUNEL试剂盒(瑞典Roche Diagnostics公司); JC-1线粒体膜电位检测试剂盒(美国Biovision公司); 牛磺胆酸钠、Ⅰ型胶原酶、胎牛血清白蛋白、胰蛋白酶抑制剂、细胞色素C(cytochrome C, Cyt-C)单抗(美国Sigma公司); TRIzol(美国MRC公司); VertAidTM First Strand cDNA Synthesis Kit(立陶宛MBI公司); EPICS-XL型流式细胞仪(美国Beckman公司); FTC2000实时荧光定量基因扩增仪(加拿大FUNGLYN公司).
1.2.1 实验动物分组及模型制作: SD大鼠适应性喂养1 wk后, 随机分为2组: (1)假手术组(15只): 麻醉后开腹, 胰管逆行注射生理盐水1 mL/kg, 缝合腹腔; (2)胰腺炎组(15只): 胰管逆行注射3%牛磺胆酸钠溶液1 mL/kg. 所有动物手术后均经皮下注射生理盐水5 mL以补充血容量. 自由饮水、进食.
1.2.2 小肠推进率测定: 造模后48 h, 大鼠空腹状态下, 亚甲蓝-甲基纤维素混合物l mL/kg灌胃, 30 min后颈椎脱臼处死大鼠, 立即剖腹暴露肠管, 在幽门下端和回盲部用丝线结扎, 并于此两处剪断肠管, 剪开肠系膜, 分离出小肠, 剔除脂肪, 测定小肠推进率: 将小肠铺平保持无张力状态, 分别量取小肠全长及亚甲蓝前端至幽门的距离. 按公式计算小肠推进率. 小肠推进率 = 亚甲蓝前端至幽门距离/小肠全长×100%.
1.2.3 胰腺病理学观察: 大鼠开腹后, 迅速观察胰腺大体病变情况, 然后取胰腺组织制作石蜡切片, HE染色检查胰腺显微病理改变.
1.2.4 TUNEL法检测小肠平滑肌细胞凋亡: 取回肠组织制作石蜡切片, 按TUNEL试剂盒说明的步骤进行染色. 切片放入3%H2O2水溶液中, 室温10 min; PBS洗涤样片, 将TdT及Biotin-dUTP混合液加至样片50 µL/片, 37 ℃湿盒中孵育标记60 min; 以封闭液按照1:50配置HRP为工作液, 50 µL加于样片, 37 ℃盒中孵育标记60 min, DAB显色, 脱水, 透明, 封片, 镜下观察. TUNEL法阳性结果判断: 细胞核棕黄(褐)色. 每组取15个标本, 每个标本1张切片, 每张切片400倍下随机选取5个视野进行数码显微镜照相, image-proplus6.0软件计算每张照片阳性细胞平均光密度(average optical density, IA)值, 并取5张照片的平均值作为一个标本的IA值.
1.2.5 荧光定量RT-PCR法检测小肠平滑肌细胞ANT mRNA: (1)取材: 取回肠肌层平滑肌组织, 迅速至-196 ℃液氮冻存; (2)引物设计合成及染料: 从Genbank中调出ANT的cDNA序列, 根据引物设计原则, 上游引物序列: 5'-TAGGCAATAGCATAAGAGCGGC-3', 下游引物序列: 5'-GTCCAGTGGGTAGACGAAGC-3'; (3)组织总RNA的提取: 按照RNA抽提试剂盒的操作步骤, 取冻存大鼠小肠肌层平滑肌组织50 mg提取总RNA, 并制备cDNA; (4)荧光定量RT-PCR检测小肠平滑肌细胞ANT mRNA, 经过最后循环后, 用PCR扩增仪自带软件进行荧光定量分析, 并计算出△Ct值, 荧光定量RT-PCR结果使用比较阈值法进行定量分析, 其计算方法是: 目的基因相对量 = 2-△△Ct, Ct值是热循环仪中荧光达到荧光阈值的循环数, △△Ct = △Ct实验组(Ct目的基因-Ct管家基因)-△Ct对照组(Ct目的基因-Ct管家基因).
1.2.6 流式细胞术检测小肠平滑肌细胞线粒体膜电位: 取回肠肌层平滑肌, 机械与胶原酶消化混合法获单细胞悬液, 调整细胞悬液密度为1×106/mL. 线粒体膜电位检测是以5,5,6,6-四氯-1,1,3,3-四乙基苯并咪唑基羰花青碘(5,5,6,6-Tetrachloro-1,1,3,3-tetraethyl benzimidazolyl carbocyanine iodide, JC-1)为荧光探针, 检测细胞线粒体膜电位变化. 当线粒体膜电位水平较高时, JC-1在线粒体的基质中聚集, 形成聚合物, 产生红色荧光, 可被PI(FL-2)通道纪录; 在线粒体膜电位水平较低时. JC-1不能在线粒体的基质中聚集, 产生绿色荧光, 可被FITC(FL-1)通道纪录.
1.2.7 免疫组织化学检测小肠平滑肌Cyt-C: 取回肠组织制作石蜡切片, 免疫组织化学步骤参考说明书. Cyt-C阳性结果判断: 胞质棕黄(褐)色. 每组取15个标本, 每个标本1张切片, 每张切片400倍下随机选取5个视野进行数码显微镜照相, image-proplus6.0软件计算每张照片阳性细胞IA, 并取5张照片的平均值作为一个标本的IA值.
统计学处理 结果以mean±SD表示, SPSS14.0统计软件对数据进行分析, 数据统计采用t检验, P<0.05为差异具有统计学意义.
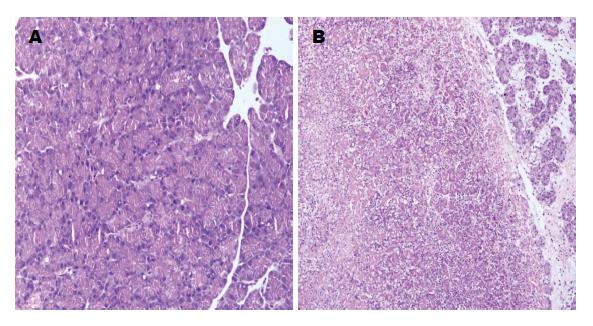
假手术组大鼠胰腺大体及光镜结构均无异常. 与假手术组相比, 胰腺炎组大鼠腹腔有大量淡红色腹水, 肠腔扩张, 肠腔积气明显, 胰腺大片出血坏死, 可见白色皂化斑, 网膜可见出血及坏死灶, 胰腺与胃、网膜、脾脏明显黏连; 光镜下可见胰腺高度水肿, 腺泡呈孤岛状, 大量胰腺腺泡坏死, 腺泡结构模糊不清, 胞浆内可见空泡形成, 局部可见融合坏死灶, 于坏死区周围可见大量中性粒细胞及单核细胞浸润. 胰腺间质内部分血管壁坏死、出血, 大量红细胞渗出, 间质内可见大量中性粒细胞及淋巴细胞浸润(图1).
利用Rongione评分法[16]对胰腺组织病理进行双盲评分. 胰腺炎组比假手术组胰腺病理评分显著增高(6.85±1.21 vs 1.13±0.91, P<0.001).
胰腺炎组大鼠小肠推进率明显低于假手术组(55.91%±2.93% vs 68.9%±5.69%, P<0.05).
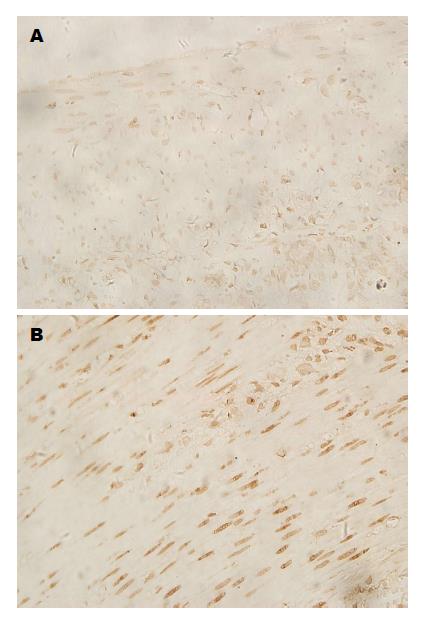
胰腺炎组小肠肌层凋亡阳性平滑肌细胞IA值较假手术组显著增高(0.056±0.184 vs 0.029±0.038, P<0.05)(图2).
mRNA 与假手术组相比, 胰腺炎组小肠肌层平滑肌ANT mRNA的相对含量是1.98.
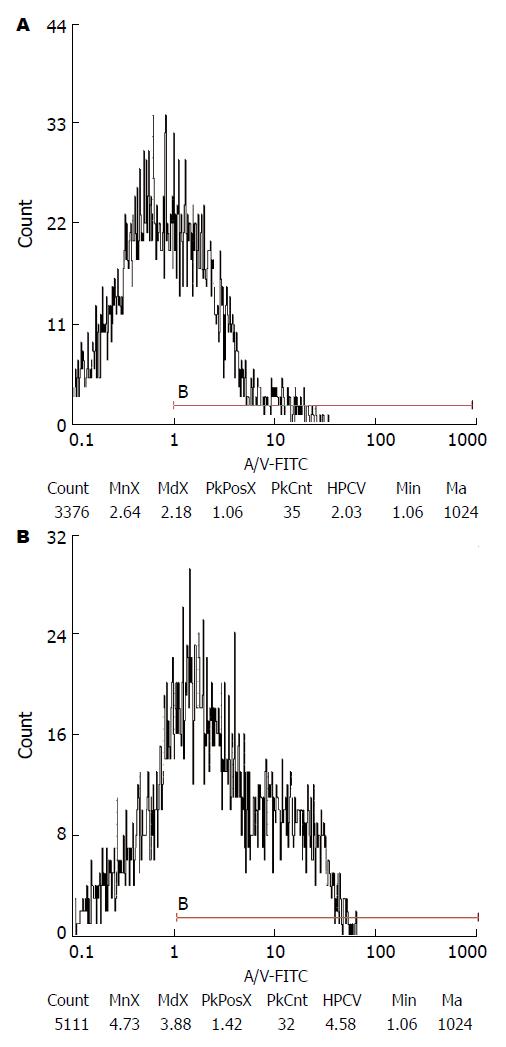
胰腺炎组小肠肌层平滑肌细胞绿色荧光强度明显高于假手术组(5.07±0.92 vs 2.40±0.50, P<0.05)(图3).
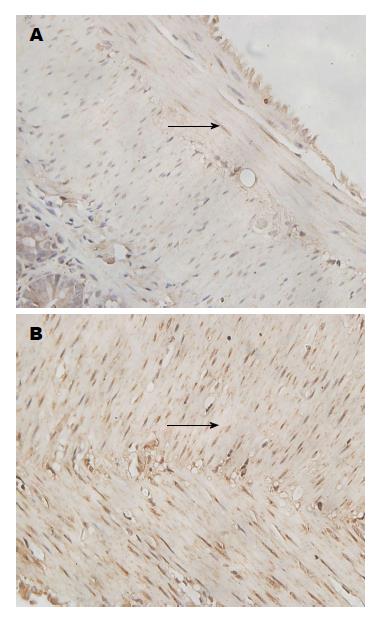
假手术组小肠肌层平滑肌Cyt-C蛋白IA值明显低于胰腺炎组(0.024±0.001 vs 0.057±0.168, P<0.001)(图4).
本实验在SAP造模成功的基础上发现SAP大鼠小肠推进率显著下降, 肠腔扩张, 肠道充气明显, 表明SAP大鼠存在肠道动力下降现象. SAP引起肠动力下降的机制尚未完全阐明. 在SAP肠动力下降发病机制的研究中, 关于肠道肌层平滑肌自身的研究比较少. 近年来研究发现SAP可导致不同组织器官细胞的凋亡, SAP可导致大鼠肠黏膜上皮细胞的凋亡增加, 其在肠黏膜屏障功能障碍的发生发展中的作用已被证实[16]. 陆正明等[17]研究发现SAP大鼠心肌细胞凋亡明显增多. SAP大鼠肾小管细胞凋亡增加在SAP急性肾功能衰竭中发挥了重要作用[18]. 此外, SAP还可导致Ⅱ型肺泡细胞、淋巴细胞、胰腺腺泡等细胞凋亡增加[19-22]. 本研究发现SAP大鼠小肠肌层平滑肌细胞凋亡较假手术组明显增多. 推测SAP时, 大鼠体内凋亡因素(缺血、缺氧等)增加, 凋亡因素间接或直接作用于小肠肌层平滑肌, 诱导平滑肌细胞凋亡增加, 引起有功能的小肠平滑肌细胞数量减少, 影响大鼠肠道动力, 从而在SAP肠动力障碍中发挥一定的作用.
细胞凋亡有三种主要途径, 即死亡受体信号转导途径、线粒体信号转导途径与内质网应激信号转导途径[23-25], 其中线粒体信号转导途径被认为是经典的细胞凋亡途径, 在多种疾病的发病机制中发挥中重要的作用. 在该凋亡途径中, 线粒体通透性转变孔(mitochondrial permeability transition pore, MPTP)开放增强是凋亡的关键, 腺苷酸转移载体(adenine nucleotide translocator, ANT)是构成MPTP的主要成分, 在调控MPTP开放中扮演重要角色, ANT与细胞凋亡密切相关[26,27]. 正常的线粒体膜电位(mitochondrial membrane potential)是细胞生存所必需的, 线粒体膜电位下降的细胞不可避免走向凋亡[28]. Cyt-C释放是线粒体凋亡途径的标志事件[29]. 在观察到SAP大鼠小肠平滑肌细胞凋亡增加的基础上, 本研究同时发现SAP大鼠小肠平滑肌ANT含量增加, 线粒体膜电位下降, Cyt-C有所增加, 推测SAP时大鼠小肠平滑肌细胞受到凋亡因素刺激, 引起ANT含量增加, 增加的ANT含量导致 MPTP呈高水平开放, 从而引起小肠肌层平滑肌线粒体内膜两侧电子梯度发生变化, 引起线粒体膜电位下降, 进而导致凋亡诱导因子(apoptosis inducing factor, AIF)释放; 另一方面, MPTP的开放使小肠肌层平滑肌线粒体内基质膨胀, 外膜破裂, 使得本来结合于线粒体内膜外侧的Cyt-C释放到胞质中. 在AIF等因子的诱导下, 释放到胞质中的Cyt-C激活Caspase9, Caspase9通过级联放大效应, 激活下游的效应酶Caspase3, Caspase3最终作用于底物, 引起小肠平滑肌细胞凋亡[30,31].
总之, 本研究提示线粒体信号转导途径介导了SAP大鼠小肠平滑肌细胞凋亡, 后者在SAP所致肠动力下降中扮演一定角色.
重症急性胰腺炎(severe acute pancreatitis, SAP)病情重、并发症多、病死率高. 肠动力障碍是SAP常见的临床表现之一. 认识肠道运动障碍机制, 改善肠道运动功能有助于SAP治疗和预后.
周翔宇, 副主任医师, 泸州医学院附属医院血管甲状腺外科
平滑肌细胞是肠道运动的核心与执行者, 肠道平滑肌结构、功能与数量在SAP所致肠动力障碍中的变化值得关注与研究.
诸多研究表明SAP可引起多种器官组织细胞凋亡, 如Chen等对SAP大鼠小肠黏膜上皮细胞进行了研究, 与假手术组相比, SAP组大鼠小肠黏膜上皮细胞凋亡增加, 细胞增殖减少.
目前, 国内对肠道平滑肌细胞凋亡在SAP所致肠道动力障碍中扮演的角色鲜有报道, 本实验在建立SAP大鼠模型, 并观察到小肠动力下降的基础上, 检测SAP大鼠小肠平滑肌细胞凋亡情况及其机制, 以探讨SAP肠道动力障碍的内在分子机制.
从平滑肌细胞凋亡的角度探讨SAP大鼠肠道动力障碍的机制, 为研究与揭示SAP大鼠肠道动力障碍的机制, 寻找其治疗的新靶点提供了新思路与新途径.
线粒体通透性转变孔(MPTP): 位于线粒体内外膜间由蛋白质所构成的复合体, 由己糖激酶、苯二氮卓受体、电位依赖性阴离子通道、腺苷酸转移载体、环孢菌素A结合蛋白D等构成.
本研究具有一定的创新性, 研究目的较明确, 方法得当, 数据较为可信. 希望作者将此研究继续进行下去, 深入探讨SAP引起的小肠平滑肌细胞凋亡的相关分子机制.
编辑: 郭鹏 电编: 闫晋利
| 1. | Zietlow A, Nakajima H, Taniguchi H, Ludwig K, Takahashi T. Association between plasma ghrelin and motilin levels during MMC cycle in conscious dogs. Regul Pept. 2010;164:78-82. [PubMed] [DOI] |
| 2. | Nakajima H, Mochiki E, Zietlow A, Ludwig K, Takahashi T. Mechanism of interdigestive migrating motor complex in conscious dogs. J Gastroenterol. 2010;45:506-514. [PubMed] [DOI] |
| 3. | Petrov MS, Windsor JA. Nutritional management of acute pancreatitis: the concept of 'gut rousing'. Curr Opin Clin Nutr Metab Care. 2013;16:557-563. [PubMed] [DOI] |
| 5. | Herbert MK, Holzer P. Standardized concept for the treatment of gastrointestinal dysmotility in critically ill patients--current status and future options. Clin Nutr. 2008;27:25-41. [PubMed] [DOI] |
| 6. | Miyano Y, Sakata I, Kuroda K, Aizawa S, Tanaka T, Jogahara T, Kurotani R, Sakai T. The role of the vagus nerve in the migrating motor complex and ghrelin- and motilin-induced gastric contraction in suncus. PLoS One. 2013;8:e64777. [PubMed] [DOI] |
| 7. | Zhongkai L, Jianxin Y, Weichang C. Vasoactive intestinal peptide promotes gut barrier function against severe acute pancreatitis. Mol Biol Rep. 2012;39:3557-3563. [PubMed] [DOI] |
| 8. | Lin Z, Liu Y, Zheng Q, Hu Q. Increased proportion of nitric oxide synthase immunoreactive neurons in rat ileal myenteric ganglia after severe acute pancreatitis. BMC Gastroenterol. 2011;11:127. [PubMed] [DOI] |
| 9. | Ke L, Ni HB, Sun JK, Tong ZH, Li WQ, Li N, Li JS. Risk factors and outcome of intra-abdominal hypertension in patients with severe acute pancreatitis. World J Surg. 2012;36:171-178. [PubMed] [DOI] |
| 10. | Wang J, Xu P, Hou YQ, Xu K, Li QH, Huang L. Pancreatitis-associated ascitic fluid induces proinflammatory cytokine expression in THP-1 cells by inhibiting anti-inflammatory signaling. Pancreas. 2013;42:855-860. [PubMed] [DOI] |
| 11. | Seerden TC, De Man JG, Holzer P, Van den Bossche RM, Herman AG, Pelckmans PA, De Winter BY. Experimental pancreatitis disturbs gastrointestinal and colonic motility in mice: effect of the prokinetic agent tegaserod. Neurogastroenterol Motil. 2007;19:856-864. [PubMed] |
| 12. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 13. | Wang L, Basa NR, Shaikh A, Luckey A, Heber D, St-Pierre DH, Taché Y. LPS inhibits fasted plasma ghrelin levels in rats: role of IL-1 and PGs and functional implications. Am J Physiol Gastrointest Liver Physiol. 2006;291:G611-G620. [PubMed] |
| 14. | Farrugia G. Interstitial cells of Cajal in health and disease. Neurogastroenterol Motil. 2008;20 Suppl 1:54-63. [PubMed] [DOI] |
| 15. | Chen X, Zhao HX, Fu XS, Li CP, Zhong XL. Glucagonlike peptide 2 protects intestinal barrier in severe acute pancreatitis through regulating intestinal epithelial cell proliferation and apoptosis. Pancreas. 2012;41:1080-1085. [PubMed] [DOI] |
| 16. | Rongione AJ, Kusske AM, Kwan K, Ashley SW, Reber HA, McFadden DW. Interleukin 10 reduces the severity of acute pancreatitis in rats. Gastroenterology. 1997;112:960-967. [PubMed] |
| 17. | 陆 正明, 方 驰华, 朱 明德, 史 学深. DDFA方案对重症急性胰腺炎大鼠心肌细胞凋亡及Bax, Bcl-2表达的影响. 世界华人消化杂志. 2006;14:3268-3272. [DOI] |
| 19. | Liu G, Zhang J, Chen H, Wang C, Qiu Y, Liu Y, Wan J, Guo H. Effects and mechanisms of alveolar type II epithelial cell apoptosis in severe pancreatitis-induced acute lung injury. Exp Ther Med. 2014;7:565-572. [PubMed] |
| 20. | Pinhu L, Qin Y, Xiong B, You Y, Li J, Sooranna SR. Overexpression of Fas and FasL is associated with infectious complications and severity of experimental severe acute pancreatitis by promoting apoptosis of lymphocytes. Inflammation. 2014;37:1202-1212. [PubMed] [DOI] |
| 21. | Meng HB, Gong J, Zhou B, Hua J, Yao L, Song ZS. Therapeutic effect of human umbilical cord-derived mesenchymal stem cells in rat severe acute pancreatitis. Int J Clin Exp Pathol. 2013;6:2703-2712. [PubMed] |
| 22. | Xu P, Lou XL, Chen C, Yang ZW. Effects of peroxisome proliferator-activated receptor-γ activation on apoptosis in rats with acute pancreatitis. Dig Dis Sci. 2013;58:3516-3523. [PubMed] [DOI] |
| 23. | Chen X, Fu XS, Li CP, Zhao HX. ER stress and ER stress-induced apoptosis are activated in gastric SMCs in diabetic rats. World J Gastroenterol. 2014;20:8260-8267. [PubMed] |
| 24. | Zhang XQ, Xu CF, Yu CH, Chen WX, Li YM. Role of endoplasmic reticulum stress in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 2014;20:1768-1776. [PubMed] [DOI] |
| 25. | Li G, Chen JB, Wang C, Xu Z, Nie H, Qin XY, Chen XM, Gong Q. Curcumin protects against acetaminophen-induced apoptosis in hepatic injury. World J Gastroenterol. 2013;19:7440-7446. [PubMed] [DOI] |
| 26. | Crompton M, Virji S, Ward JM. Cyclophilin-D binds strongly to complexes of the voltage-dependent anion channel and the adenine nucleotide translocase to form the permeability transition pore. Eur J Biochem. 1998;258:729-735. [PubMed] |
| 27. | Halestrap AP, McStay GP, Clarke SJ. The permeability transition pore complex: another view. Biochimie. 2002;84:153-166. [PubMed] |
| 28. | Shoshan-Barmatz V, Gincel D. The voltage-dependent anion channel: characterization, modulation, and role in mitochondrial function in cell life and death. Cell Biochem Biophys. 2003;39:279-292. [PubMed] |
| 29. | Würstle ML, Laussmann MA, Rehm M. The central role of initiator caspase-9 in apoptosis signal transduction and the regulation of its activation and activity on the apoptosome. Exp Cell Res. 2012;318:1213-1220. [PubMed] [DOI] |
| 30. | Bratton SB, Salvesen GS. Regulation of the Apaf-1-caspase-9 apoptosome. J Cell Sci. 2010;123:3209-3214. [PubMed] [DOI] |
| 31. | Reubold TF, Eschenburg S. A molecular view on signal transduction by the apoptosome. Cell Signal. 2012;24:1420-1425. [PubMed] [DOI] |