修回日期: 2014-08-19
接受日期: 2014-08-26
在线出版日期: 2014-10-08
目的: 观察急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)大鼠肝髓样细胞触发受体-1(triggering receptor expressed on myeloid cells-1, TREM-1)基因表达, 探讨其与肝损伤的关系.
方法: 选择健康♂SD大鼠48只, 随机分为对照组(C组, n = 24)和模型组(A组, n = 24), 以5%的牛磺胆酸钠液逆行性胰胆管注射建立成ANP大鼠模型, 各组分别于造模后3、6、12、24 h分批处死, 检测血清淀粉酶(amylase, AMY)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)以及可溶性TREM-1和白介素-1β(interleukin-1β, IL-1β)水平; 光镜下观察胰腺、肝脏组织病理学变化并评分; 实时荧光定量逆转录聚合酶链反应(real-time quantitative polymerase chain reaction, qRT-PCR)检测肝内TREM-1基因表达水平.
结果: A组大鼠AMY、可溶性TREM-1、IL-1β于造模后3 h开始升高, 各时点均处于高水平状态, 均较同时间点C组大鼠升高(P<0.05), 且A组大鼠可溶性TREM-1与胰腺病理评分呈正相关(r = 0.481, P<0.05); A组大鼠血ALT、AST浓度在造模后6、12、24 h均较同时点C组升高(P<0.05); A组大鼠胰腺及肝脏病理损伤和评分均高于同时点C组(P<0.01); A组大鼠肝脏组织TREM-1 mRNA表达较C组增加(3 h: 1.96±0.63 vs 0.94±0.23; 6 h: 4.46±1.42 vs 0.95±0.24; 12 h: 2.59±1.14 vs 1.10±0.33; 24 h: 2.56±1.08 vs 0.85±0.27; 均P<0.05).
结论: A组大鼠肝脏组织中TREM-1 mRNA表达以及血清可溶性TREM-1浓度均增加, TREM-1可能在ANP并肝损中发挥重要作用.
核心提示: 炎症细胞因子在重症急性胰腺炎(severe acute pancreatitis, SAP)并肝损伤中起重要作用. 大量实验证实髓样细胞触发受体-1(triggering receptor expressed on myeloid cells-1, TREM-1)在急性胰腺炎(acute pancreatitis)中发挥重要促炎作用, 本实验发现在急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)并肝损伤大鼠肝脏中TREM-1 mRNA表达较对照组上调, 因此, 考虑TREM-1可能在ANP并肝损伤中发挥重要作用, 为临床上SAP并肝损伤治疗提供新思路.
引文著录: 李维维, 唐国都, 梁志海, 詹媛, 方春芸. TREM-1在大鼠急性坏死性胰腺炎并肝损伤中的作用. 世界华人消化杂志 2014; 22(28): 4223-4230
Revised: August 19, 2014
Accepted: August 26, 2014
Published online: October 8, 2014
AIM: To investigate the expression of triggering receptor expressed on myeloid cells-1 (TREM-1) in liver injury with acute necrotizing pancreatitis (ANP) and to explore the correlation between TREM-1 expression and liver injury in rats with ANP.
METHODS: Forty-eight male Sprague-Dawley rats were randomly divided into two groups: a control group and an ANP group. ANP was induced by retrograde injection of 5% sodium taurocholate into the biliary pancreatic duct. Rats were sacrificed at 3, 6, 12 and 24 h after treatment. Serum amylase (AMY), alanine aminotransferase (ALT), aspartate aminotransferase (AST), sTREM-1 and interleukin-1β (IL-1β) were measured. The pathologic changes of the pancreatic and hepatic tissues were observed and graded under a microscope. The expression of TREM-1 mRNA in the liver was detected by real-time quantitative (qRT) PCR.
RESULTS: The levels of serum amylase, sTREM-1 and IL-1β began to increase at 3 h after sodium taurocholate injection, and were then maintained at high levels at all subsequent time points, significantly higher than those in the control group (P < 0.05). The level of sTREM-1 in the ANP group was correlated with Schmidt score (r = 0.481, P < 0.05). Serum ALT and AST concentrations at 6, 12 and 24 h, the pathologic scores of pancreatic and liver tissues, and the expression of TREM-1 mRNA (3 h: 1.96 ± 0.63 vs 0.94 ± 0.23; 6 h: 4.46 ± 1.42 vs 0.95 ± 0.24; 12 h: 2.59 ± 1.14 vs 1.10 ± 0.33; 24 h: 2.56 ± 1.08 vs 0.85 ± 0.27) in the liver were significantly higher in the ANP group than in the control group (P < 0.05 for all).
CONCLUSION: The expression of TREM-1 mRNA in liver tissue and the level of serum sTREM-1 increase significantly in rats with ANP, suggesting that TREM-1 may play an important role in ANP with liver injury.
- Citation: Li WW, Tang GD, Liang ZH, Zhan Y, Fang CY. Role of triggering receptor expressed on myeloid cells-1 in liver injury in rats with acute necrotizing pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(28): 4223-4230
- URL: https://www.wjgnet.com/1009-3079/full/v22/i28/4223.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i28.4223
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床上起病凶险、病死率高的急腹症之一, 多系统器官功能衰竭(multiple systemic organ failure, MSOF)是急性胰腺炎(acute pancreatitis, AP)的主要死亡原因, 病死率达40%以上[1]. 肝脏是胰腺血液回流的第一站, 胰腺血流中大量细胞因子和炎症介质进入肝脏, 引起肝脏损伤. 近年来有学者统计SAP并发肝损伤的发生率达89%[2], 肝损伤时其调节微循环及清除炎性物质及毒素的能力下降, 加重了炎症反应对全身其他脏器的损伤, 从而影响了AP的临床治疗效果和病情预后[3], 因此SAP时加强肝损伤的防治对AP的预后很重要. 髓样细胞触发受体-1(triggering receptor expressed on myeloid cells-1, TREM-1)可诱导炎症因子形成瀑布效应, 产生级联放大, 加重组织器官损伤[4,5]. 本实验用最经典的逆行性胰管内注射法[6]建立ANP并肝损伤模型, 通过观察胰腺和肝脏病理改变, 检测血清淀粉酶(amylase, AMY)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)水平, 以及TREM-1 mRNA在肝脏中的表达, 探讨TREM-1在ANP并肝损伤中的作用.
健康♂SD大鼠48只, 体质量为250-300 g, 购自广西医科大学动物实验中心; 牛磺胆酸钠购自日本TCI公司; TRIzol购自Omega公司; TREM-1引物由北京六合华大基因科技股份有限公司合成; GAPDH引物由上海生工生物工程有限公司合成; 白介素-1β(interleukin-1 beta, IL-1β)ELISA试剂盒购自杭州联科生物技术有限公司; TREM-1酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)试剂盒购自武汉华美生物工程有限公司.
1.2.1 分组及造模: 48只大鼠随机分为C和A两组, 每组24只. A组为急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)组, 用牛磺胆酸钠配成5%溶液, 以1 mL/kg体质量的量逆行胰胆管内注射诱导ANP. C组为正常对照组, 开腹仅翻动胰腺后关闭腹腔. 各组分别于造模后3、6、12、24 h各时点开腹, 心脏取血, 取部分胰腺、肝脏组织40 g/L甲醛固定, 部分肝脏组织-80 ℃保存.
1.2.2 AMY、ALT、AST检测: 用全自动生化分析仪测定.
1.2.3 血清sTREM-1、IL-1β检测: 采用ELISA测定.
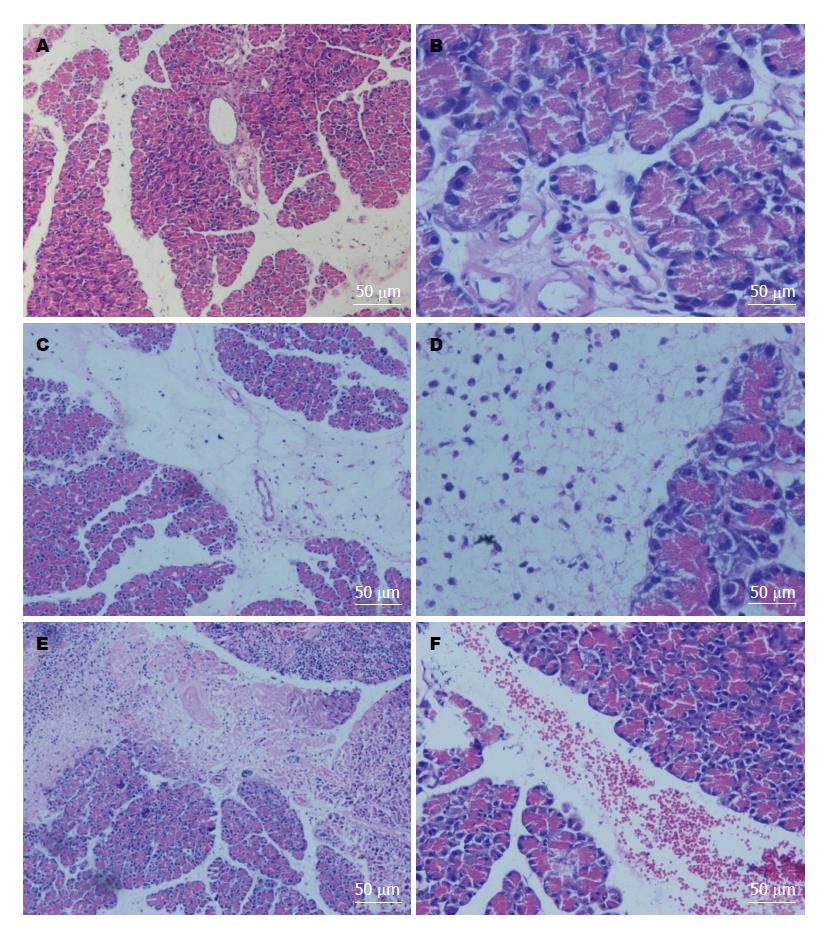
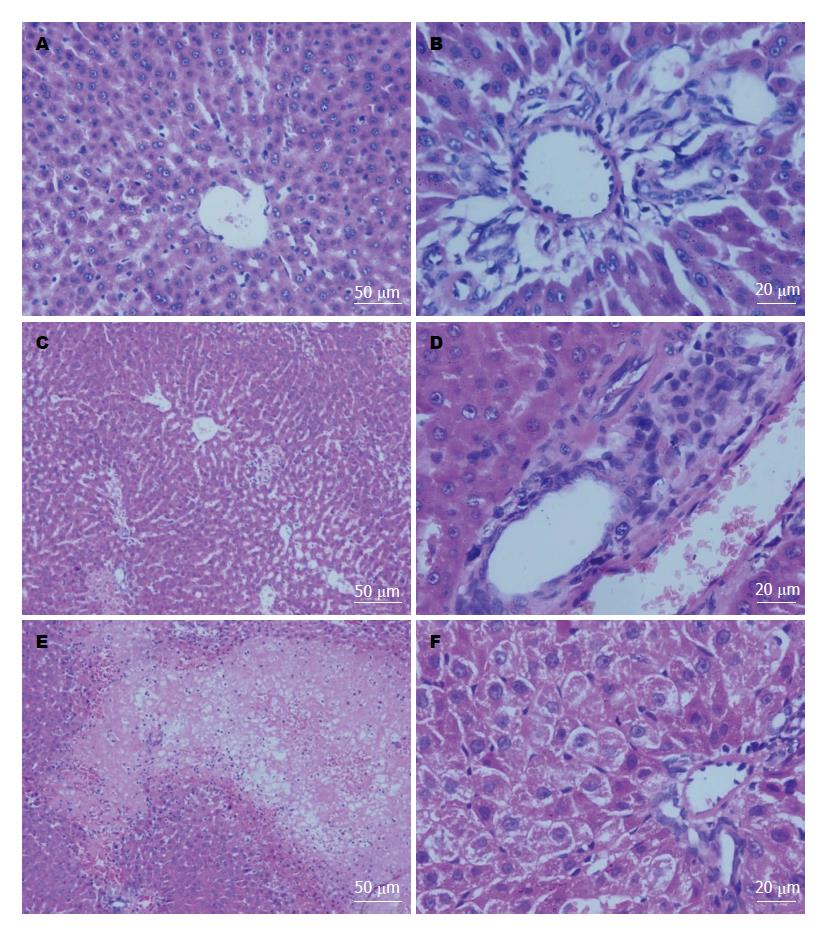
1.2.4 胰腺及肝脏切片、HE染色: 胰腺及肝脏组织经过固定、脱水、石蜡包埋、切片及HE染色后, 利用盲法同一病理医师在光镜下观察胰腺及肝脏病变并评分, 胰腺和肝脏病理评分分别参考Schmidt等[7]和Camargo等[8]评分标准.
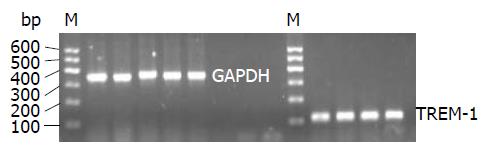
1.2.5 肝内TREM-1 mRNA水平检测: 采用qRT-PCR技术测定. 利用TRIzol试剂提取细胞的总RNA, 根据逆转录试剂盒具体说明进行逆转录成cDNA, 再以TREM-1引物进行PCR扩增, GAPDH作为内参. TREM-1上游引物: 5'-CTCCGAACGACCCTGTTCTG-3', 下游引物: 5'-GGAACCTCAGTCGGCTTTGT-3', 扩增片段长度为112 bp; GAPDH上游引物: 5'-CATGGTCTACATGTTCCAGT-3', 下游引物: 5'-GGCTAAGCAGTTGGTGGTGC-3', 扩增片段长度为349 bp. PCR条件为: 95 ℃ 10 min, 95 ℃ 15 s, 62 ℃ 45 s, 进行40个循环(62 ℃收集荧光). 利用2-△△Ct计算TREM-1 mRNA表达水平.
统计学处理 应用SPSS16.0统计软件, 所有数据均用mean±SD的形式表示, 采用两样本t检验的统计学方法进行组间比较,P<0.05为差异有统计学意义.
2.1.1 血清AMY水平: A组大鼠于造模后3 h AMY浓度升高, 且各时点均处于高水平状态, 均较同时间点C组大鼠升高(均P<0.05)(表1).
| 时间(h) | 分组 | 血清AMY(U/L) | 血清ALT(U/L) | 血清AST(U/L) | 血清TREM-1(pg/mL) | 血清IL-1β(pg/mL) |
| 3 | A组 | 7162±1360a | 101±28 | 491±96 | 61.5±23.2a | 88.6±32.2a |
| C组 | 2115±489 | 100±34 | 414±102 | 13.9±4.0 | 13.9±4.0 | |
| 6 | A组 | 6957±1093a | 169±29a | 694±106a | 67.7±19.0a | 127.0±36.6a |
| C组 | 2040±247 | 101±19 | 494±137 | 13.3±3.4 | 16.4±3.1 | |
| 12 | A组 | 6762±1669a | 186±89a | 580±152a | 83.0±20.1a | 107.0±32.1a |
| C组 | 1894±367 | 69±23 | 354±150 | 13.1±2.6 | 43.0±7.1 | |
| 24 | A组 | 7360±960a | 192±28a | 557±119a | 104.0±27.8a | 126.3±22.1a |
| C组 | 1794±631 | 66±31 | 306±140 | 13.6±4.1 | 42.2±6.2 |
2.1.2 ALT、AST水平: A组大鼠ALT、AST浓度在造模后6、12、24 h各时点均较同时点C组升高(均P<0.05)(表1).
2.1.3 血清TREM-1、IL-1β水平: A组大鼠TREM-1、IL-1β浓度于造模后各时点均较C组同时点升高(均P<0.05)(表1).
2.2.1 胰腺大体及病理改变: C组大鼠胰腺外观正常, 镜下见胰腺小叶结构完整, A组大鼠胰腺出现明显水肿, 大量出血以及胶冻样坏死, 镜下见胰腺小叶间隙及腺泡间隙均增宽, 胰腺小叶结构被破坏, 大量的炎性细胞浸润以及片状出血和坏死, 病理评分均较同时点C组升高(均P<0.01)(表2, 图1).
2.2.2 肝脏大体及病理改变: C组大鼠肝脏大体无明显改变, 镜下见肝小叶结构完整. A组大鼠肝脏外观无明显异常, 镜下见肝细胞浊肿和点状坏死, 汇管区少量炎细胞浸润, 以及肝窦扩张, 病理评分均较同时点C组升高(均P<0.01)(表2, 图2).
人类TREM基因定位于染色体6p21, 包括TREM-1和TREM-2受体, 他们属于免疫球蛋白超家族. TREM-1是一种相对分子质量约为30 kDa跨膜糖蛋白, 其与信号转导分子DAP12结合后通过活化Jak-信号传导与转录激活因子(signal transducer and activator of transcription, STAT3)、Akt、细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)、核转录因子κB(nuclear transcription factor-κB, NF-κB)[9,10]这些信号通路发挥其促炎作用. TREM-1广泛表达于皮肤、淋巴结、肺组织中, 在血中性粒细胞、单核/巨噬细胞、肺泡巨噬细胞高表达[11], 在胃上皮细胞[12]、肝脏内皮细胞[13]以及肠道巨噬细胞[14,15]亦可见有少量表达. 按照其所处位置不同, TREM-1可分为细胞表面TREM-1和可溶性TREM-1(soluble triggering receptor expressed on myeloid cells-1, sTREM-1)两种形式. 最早研究TREM-1主要发现其在感染性疾病中的作用. TREM-1能触发及扩大细菌感染后细胞因子的级联反应并进一步影响脓毒性休克的病理过程, 因此被认为可能在炎性反应的触发及放大过程中具有重要作用[16]. Bouchon等[17]研究表明, 在细菌脂质体等的刺激下, TREM-1可被激活而触发IL-8、单核细胞趋化蛋白-1和肿瘤坏死因子等炎症介质、细胞因子的分泌, 并可诱导中性粒细胞脱颗粒; 在细胞内部, TREM-1可诱发钙离子移动, 并使细胞表面信号相关激酶1、2和磷脂酶C酪氨酸磷酸化, 最终可引起炎症反应的增强、放大, 导致"过度"的炎症反应. 近几年来进一步研究发现, TREM-1不仅在感染性疾病中起作用, 而且在非感染性炎症性疾病如急性胰腺炎[18,19]、痛风[4,20]、类风湿性关节炎[4,21-25]、炎症性肠病[26,27]等疾病中亦发挥重要作用. 故认为TREM-1在体内的炎症反应中扮演一个至关重要的角色.
Wang等[28]实验发现, AP患者白细胞TREM-1 mRNA表达较健康者增加, 且与AP的严重性呈正相关; Dang等[15]通过实验发现SAP大鼠血sTREM-1含量和胰腺TREM-1 mRNA表达水平均较对照组升高; 本实验采用经典方法诱导ANP模型, 模型组胰腺病理评分和血清淀粉酶均升高, 说明造模成功, 通过ELISA检测血中sTREM-1, A组大鼠sTREM-1含量与对照组比较于3 h即开始升高, 持续处于高水平, 且与ANP的严重性呈正相关, 同时观察到ANP大鼠血IL-1β也升高, 考虑sTREM-1和IL-1β可能相关, 认为TREM-1和IL-1β均与AP的发生、发展可能有关.
Chen等[13]发现在小鼠急性内毒素血症中肝巨噬细胞和内皮细胞TREM-1表达明显增加. 张丽霞等[29]和王小娟等[30]通过实验研究认为: TREM-1可能通过与肠源性内毒素相互作用在非酒精性脂肪性肝炎中发挥重要作用. Liao等[31]研究发现TREM-1在乙型病毒性肝炎相关性肝癌肝星状细胞中有表达, 促进肝癌细胞的迁移能力, 影响肝癌预后. 在临床上肝脏是SAP最常累及的胰外器官之一[32,33]. 而对于TREM-1在SAP并发肝损伤中作用机制研究却很少. 目前研究认为SAP并发肝损伤的主要机制有细胞因子、胰酶、氧化应激、微循环障碍、细胞凋亡和胰腺炎相关性腹水等, 其中炎症细胞因子可能起重要作用. 肝脏中的枯否(Kupffer)细胞占整个机体单核巨噬细胞群的80%-90%, 是产生炎性细胞因子的主要效应细胞[34]. SAP发生后, 大量的炎性介质和细胞因子经门静脉首先进入肝脏, 损伤肝实质, 同时大量的炎性细胞被激活, 分泌大量的炎症因子, 参与触发"瀑布式"级联反应, 使炎症从局部蔓延至全身, 加剧了SAP的发展. Kamei等[35]通过ELISA检测SAP大鼠胰腺、肝脏和肾脏组织中TREM-1的表达, 发现SAP组大鼠胰腺、肝脏和肾脏中TREM-1的表达均较对照组增加. 本实验发现, 与C组比较, A组大鼠肝脏结构于3 h即出现病理改变, 血肝功能ALT、AST水平于6 h开始升高, 肝脏组织TREM-1 mRNA表达于3 h即开始升高, 且各时点均处于高水平状态, 与Kamei等[35]研究结果相符, 提示ANP大鼠早期出现肝脏结构和功能的急性损伤, 而TREM-1与ANP大鼠并发肝损可能有关.
总之, TREM-1可能与ANP并发肝损伤有关. 因此, 根据TREM-1的结构与信号转导机制设计干预剂可能为ANP并肝损治疗提供新方法.
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床上起病凶险, 病死率高的急腹症之一, 其死亡原因主要为并发多器官功能障碍. SAP并发肝损伤主要机制有细胞因子、胰酶、氧化应激、微循环障碍、细胞凋亡和胰腺炎相关性腹水等, 其中炎症细胞因子可能起重要作用.
江建新, 副主任医师, 贵阳医学院附属医院肝胆外科
首先需要大量的干预实验证实髓样细胞触发受体-1(triggering receptor expressed on myeloid cells -1, TREM-1)在SAP并发肝损伤中发挥重要作用, 同时需要更多的临床证据来进一步验证, 然后更深入研究在SAP中TREM-1通过哪些分子机制引发肝损伤, 最后根据TREM-1的结构与信号转导机制设计干预剂可能为急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)并肝损治疗提供新方法.
Kamei等研究是通过ELISA同时检测SAP大鼠胰腺、肝脏和肾脏组织中TREM-1的表达, 发现SAP组大鼠胰腺、肝脏和肾脏中TREM-1的表达均较对照组增加, 初步认为TREM-1可能在SAP并发多器官功能障碍中发挥重要作用. 对本实验研究起着引导作用.
本文研究TREM-1在ANP并发肝损伤中作用, 实验结果说明TREM-1可能在ANP并发肝损伤中发挥重要作用, 为以后相关的进一步的研究打基础, 将来可根据TREM-1的结构与信号转导机制设计干预剂可能为ANP并肝损治疗提供新方法.
髓样细胞触发受体-1: 主要表达于中性粒细胞和单核/巨噬细胞表面的跨膜糖蛋白, 主要发挥促炎作用.
本文具有一定的学术价值和临床意义.
编辑: 郭鹏 电编: 闫晋利
| 1. | Raraty MG, Connor S, Criddle DN, Sutton R, Neoptolemos JP. Acute pancreatitis and organ failure: pathophysiology, natural history, and management strategies. Curr Gastroenterol Rep. 2004;6:99-103. [PubMed] |
| 3. | Zhang XP, Wang L, Zhang J. Study progress on mechanism of severe acute pancreatitis complicated with hepatic injury. J Zhejiang Univ Sci B. 2007;8:228-236. [PubMed] [DOI] |
| 4. | Murakami Y, Kohsaka H. [Triggering receptor expressed on myeloid cells-1 as an inflammation amplifier]. Nihon Rinsho Meneki Gakkai Kaishi. 2009;32:242-248. [PubMed] [DOI] |
| 5. | Gibot S, Kolopp-Sarda MN, Béné MC, Cravoisy A, Levy B, Faure GC, Bollaert PE. Plasma level of a triggering receptor expressed on myeloid cells-1: its diagnostic accuracy in patients with suspected sepsis. Ann Intern Med. 2004;141:9-15. [PubMed] |
| 6. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] |
| 7. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] |
| 8. | Camargo CA, Madden JF, Gao W, Selvan RS, Clavien PA. Interleukin-6 protects liver against warm ischemia/reperfusion injury and promotes hepatocyte proliferation in the rodent. Hepatology. 1997;26:1513-1520. [PubMed] [DOI] |
| 9. | Fortin CF, Lesur O, Fulop T. Effects of TREM-1 activation in human neutrophils: activation of signaling pathways, recruitment into lipid rafts and association with TLR4. Int Immunol. 2007;19:41-50. [PubMed] [DOI] |
| 10. | Bosco MC, Pierobon D, Blengio F, Raggi F, Vanni C, Gattorno M, Eva A, Novelli F, Cappello P, Giovarelli M. Hypoxia modulates the gene expression profile of immunoregulatory receptors in human mature dendritic cells: identification of TREM-1 as a novel hypoxic marker in vitro and in vivo. Blood. 2011;117:2625-2639. [PubMed] [DOI] |
| 11. | Radaev S, Kattah M, Rostro B, Colonna M, Sun PD. Crystal structure of the human myeloid cell activating receptor TREM-1. Structure. 2003;11:1527-1535. [PubMed] |
| 12. | Schmausser B, Endrich S, Beier D, Moran AP, Burek CJ, Rosenwald A, Rieckmann P, Müller-Hermelink HK, Eck M. Triggering receptor expressed on myeloid cells-1 (TREM-1) expression on gastric epithelium: implication for a role of TREM-1 in Helicobacter pylori infection. Clin Exp Immunol. 2008;152:88-94. [PubMed] [DOI] |
| 13. | Chen LC, Laskin JD, Gordon MK, Laskin DL. Regulation of TREM expression in hepatic macrophages and endothelial cells during acute endotoxemia. Exp Mol Pathol. 2008;84:145-155. [PubMed] [DOI] |
| 14. | Schenk M, Bouchon A, Seibold F, Mueller C. TREM-1--expressing intestinal macrophages crucially amplify chronic inflammation in experimental colitis and inflammatory bowel diseases. J Clin Invest. 2007;117:3097-3106. [PubMed] |
| 15. | Dang S, Shen Y, Yin K, Zhang J. TREM-1 Promotes Pancreatitis-Associated Intestinal Barrier Dysfunction. Gastroenterol Res Pract. 2012;2012:720865. [PubMed] [DOI] |
| 16. | Nathan C, Ding A. TREM-1: a new regulator of innate immunity in sepsis syndrome. Nat Med. 2001;7:530-532. [PubMed] [DOI] |
| 17. | Bouchon A, Dietrich J, Colonna M. Cutting edge: inflammatory responses can be triggered by TREM-1, a novel receptor expressed on neutrophils and monocytes. J Immunol. 2000;164:4991-4995. [PubMed] |
| 18. | Ferat-Osorio E, Wong-Baeza I, Esquivel-Callejas N, Figueroa-Figueroa S, Duarte-Rojo A, Guzmán-Valdivia-Gómez G, Rodea-Rosas H, Torres-González R, Sánchez-Fernández P, Arriaga-Pizano L. Triggering receptor expressed on myeloid cells-1 expression on monocytes is associated with inflammation but not with infection in acute pancreatitis. Crit Care. 2009;13:R69. [PubMed] [DOI] |
| 19. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Sawa H, Takahiro N, Kamei K, Ku Y, Kuroda Y, Ohyanagi H. Increased levels of soluble triggering receptor expressed on myeloid cells-1 in patients with acute pancreatitis. Crit Care Med. 2008;36:2048-2053. [PubMed] [DOI] |
| 20. | Murakami Y, Akahoshi T, Hayashi I, Endo H, Kawai S, Inoue M, Kondo H, Kitasato H. Induction of triggering receptor expressed on myeloid cells 1 in murine resident peritoneal macrophages by monosodium urate monohydrate crystals. Arthritis Rheum. 2006;54:455-462. [PubMed] [DOI] |
| 21. | Collins CE, La DT, Yang HT, Massin F, Gibot S, Faure G, Stohl W. Elevated synovial expression of triggering receptor expressed on myeloid cells 1 in patients with septic arthritis or rheumatoid arthritis. Ann Rheum Dis. 2009;68:1768-1774. [PubMed] [DOI] |
| 22. | Kim TH, Choi SJ, Lee YH, Song GG, Ji JD. Soluble triggering receptor expressed on myeloid cells-1 as a new therapeutic molecule in rheumatoid arthritis. Med Hypotheses. 2012;78:270-272. [PubMed] [DOI] |
| 23. | Iwai H, Kohsaka H. [Blockade of Triggering receptor expressed on myeloid cells-1 as a new therapy of arthritis]. Nihon Rinsho Meneki Gakkai Kaishi. 2012;35:81-86. [PubMed] [DOI] |
| 24. | Kuai J, Gregory B, Hill A, Pittman DD, Feldman JL, Brown T, Carito B, O'Toole M, Ramsey R, Adolfsson O. TREM-1 expression is increased in the synovium of rheumatoid arthritis patients and induces the expression of pro-inflammatory cytokines. Rheumatology (Oxford). 2009;48:1352-1358. [PubMed] [DOI] |
| 25. | Murakami Y, Akahoshi T, Aoki N, Toyomoto M, Miyasaka N, Kohsaka H. Intervention of an inflammation amplifier, triggering receptor expressed on myeloid cells 1, for treatment of autoimmune arthritis. Arthritis Rheum. 2009;60:1615-1623. [PubMed] [DOI] |
| 26. | Saurer L, Rihs S, Birrer M, Saxer-Seculic N, Radsak M, Mueller C. Elevated levels of serum-soluble triggering receptor expressed on myeloid cells-1 in patients with IBD do not correlate with intestinal TREM-1 mRNA expression and endoscopic disease activity. J Crohns Colitis. 2012;6:913-923. [PubMed] [DOI] |
| 27. | Park JJ, Cheon JH, Kim BY, Kim DH, Kim ES, Kim TI, Lee KR, Kim WH. Correlation of serum-soluble triggering receptor expressed on myeloid cells-1 with clinical disease activity in inflammatory bowel disease. Dig Dis Sci. 2009;54:1525-1531. [PubMed] [DOI] |
| 28. | Wang DY, Qin RY, Liu ZR, Gupta MK, Chang Q. Expression of TREM-1 mRNA in acute pancreatitis. World J Gastroenterol. 2004;10:2744-2746. [PubMed] |
| 31. | Liao R, Sun TW, Yi Y, Wu H, Li YW, Wang JX, Zhou J, Shi YH, Cheng YF, Qiu SJ. Expression of TREM-1 in hepatic stellate cells and prognostic value in hepatitis B-related hepatocellular carcinoma. Cancer Sci. 2012;103:984-992. [PubMed] [DOI] |
| 32. | Zhang XP, Zhang L, Wang Y, Cheng QH, Wang JM, Cai W, Shen HP, Cai J. Study of the protective effects of dexamethasone on multiple organ injury in rats with severe acute pancreatitis. JOP. 2007;8:400-412. [PubMed] |
| 33. | Zhao YF, Zhai WL, Zhang SJ, Chen XP. Protection effect of triptolide to liver injury in rats with severe acute pancreatitis. Hepatobiliary Pancreat Dis Int. 2005;4:604-608. [PubMed] |
| 35. | Kamei K, Yasuda T, Ueda T, Qiang F, Takeyama Y, Shiozaki H. Role of triggering receptor expressed on myeloid cells-1 in experimental severe acute pancreatitis. J Hepatobiliary Pancreat Sci. 2010;17:305-312. [PubMed] [DOI] |