修回日期: 2014-08-21
接受日期: 2014-08-26
在线出版日期: 2014-10-08
目的: 构建人microRNA-155(miR-155)真核过表达载体, 并探讨其对HepG2.2.15细胞中乙型肝炎e抗原(hepatitis B e antigen, HBeAg)的抑制作用, 为研究其基因调控机制对乙型肝炎病毒(hepatitis B virus, HBV)复制及免疫状态影响提供实验基础.
方法: 以人肝癌细胞系HepG2.2.15细胞基因组为模板, 通过PCR扩增人miR-155前体序列, 酶切后连接到pmR-mCherry质粒, 构建pmiR-155真核过表达载体, 然后进行酶切和测序鉴定. 利用脂质体将pmiR-155转染HepG2.2.15细胞, 同时设空质粒(pmR-mCherry质粒)转染组和空白对照组. 转染24 h后荧光显微镜下观察细胞内Cherry表达, RT-PCR检测各组细胞内miR-155表达量以及ELISA法检测HBeAg分泌量的改变.
结果: 经测序证实, 成功构建人pmiR-155真核过表达载体. 转染细胞后进行应荧光观察, 载体中Cherry有较好的表达活性. RT-PCR表明, 与对照组细胞相比, pmiR-155组细胞内所表达的miR-155明显提高. ELISA结果示pmiR-155组细胞所分泌的HBeAg量显著低于空载组和空白组.
结论: 成功构建了人miR-155真核过表达载体; 转染HepG2.2.15细胞后表达稳定; 蛋白水平检测表明其可以抑制HepG2.2.15细胞中HBeAg的表达.
核心提示: 真核过表达载体pmiR-155转染HepG2.2.15细胞后, 过表达的miR-155可抑制HBeAg的分泌, 可能对乙型肝炎病毒(hepatitis B virus)复制具有一定抑制作用.
引文著录: 蔡启茵, 任广立, 张卫云, 马恒灏. 人miR-155真核过表达载体的构建及其对HepG2.2.15细胞中HBeAg的抑制效应. 世界华人消化杂志 2014; 22(28): 4217-4222
Revised: August 21, 2014
Accepted: August 26, 2014
Published online: October 8, 2014
AIM: To construct an eukaryotic vector carrying human microRNA-155 (miR-155) and to analyze the inhibitory effect of miR-155 on HBeAg in HepG2.2.15 cells.
METHODS: The pre-miR-155 was amplified from total DNA of human hepatoma cell line HepG2.2.15 by PCR. The target gene fragment was digested with EcoRⅠ and BamHⅠ, and cloned into the pmR-mCherry plasmid. Restriction digestion and DNA sequencing were performed to evaluate the recombinant vector. miR-155 was transfected into HepG2.2.15 cells by liposome-mediated method. The cells transfected with empty plasmid and untransfected cells were used as controls. The expression of cherry was detected by fluorescence microscopy after 24 h. The intracellular expression of miR-155 was detected by RT-PCR. ELISA was carried out to analyze the levels of HBeAg.
RESULTS: The pmiR-155 eukaryotic expression vector was successfully constructed. Fluorescence microscopy showed that the cherry protein was expressed in the HepG2.2.15 cells. miR-155 level in HepG2.2.15 cells transfected with the recombinant plasmid was significantly higher than those in controls. Compared with cells transfected with empty plasmid and untransfected cells, specific miR-155 could significantly decrease HBeAg gene expression in HepG2.2.15 cells.
CONCLUSION: A recombinant plasmid expressing miR-155 has been successfully constructed, and miR-155 is expressed stably in HepG2.2.15 cells. miR-155 can inhibit the expression of HBeAg in HepG2.2.15 cells.
- Citation: Cai QY, Ren GL, Zhang WY, Ma HH. Construction of a eukaryotic vector expressing human miR-155 and inhibitory effect of miR-155 on HBeAg in HepG2.2.15 cells. Shijie Huaren Xiaohua Zazhi 2014; 22(28): 4217-4222
- URL: https://www.wjgnet.com/1009-3079/full/v22/i28/4217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i28.4217
微小RNA(microRNA, miRNA)是长约为21-23个核苷酸的小分子非编码RNA, 通过与靶细胞mRNA特异性碱基部分或完全配对, 引起靶细胞mRNA降解或调控蛋白合成. miRNAs参与细胞分化、增殖、凋亡等多种生物学进展[1-3]. miR-155位于人类21号染色体上B细胞非编码集合基因簇的第3个外显子, 表达于T细胞、B细胞、单核细胞及巨噬细胞等多种细胞, 在炎症[4]、免疫系统发育和应答[5,6]、抗病毒感染[7,8]中发挥重要的调控作用. 近年来, 报道[9-11]证实miRNAs可影响肝再生、肝免疫反应、肝纤维化及肝细胞癌形成过程. Su等[12]研究发现异位表达miR-155可以上调干扰素诱导抗病毒基因的表达, 抑制相关信号通路使乙型肝炎病毒X蛋白(hepatitis X protein, HBX)表达减少, 从而干扰乙型肝炎病毒(hepatitis B virus, HBV)的复制. 本研究通过构建miR-155真核过表达载体并在HepG2.2.15细胞内进行转染, 观察miR-155的表达情况及对乙型肝炎e抗原(hepatitis B e antigen, HBeAg)的影响, 为下一步研究miR-155过表达对HBV免疫状态的影响奠定实验基础.
Takara TaqTM、QuickCutTMEcoRⅠ、QuickCutTMBamHⅠ、T4 DNA连接酶及DNA切胶回收试剂盒均购自TaKaRa公司; 质粒小提抽提试剂盒、基因组DNA小量抽提试剂盒及PCR纯化试剂盒均购自碧云天生物技术研究所; 去内毒素质粒小提中量试剂盒购自Omega公司; TRIzol总RNA提取试剂盒、脂质体LipofectamineTM 2000、Opti-MEM®ⅠReduced Serum Medium及M-MLV 1st strand Kit均购自Invitrogen公司; 高糖DMEM培养液购自Hyclone公司; 胎牛血清(fatal bovine serum, FBS)购自Sciencell; G418购自MPBIO公司; HBV表面抗原诊断试剂盒购自深圳华康生物医学有限公司; 其他试剂均为国内分析纯. 实验中选用的pmR-mCherry质粒由美国Dr. Keith Peden教授惠赠. 大肠杆菌菌株DH5α及肝癌细胞株HepG2.2.15由中国人民解放军广州军区广州总医院医学实验科保存.
1.2.1 引物的设计和合成: 根据miRBase及GenBank数据库查找到成熟miR-155序列、pre-miR-155序列及两侧约100 nt的侧翼序列和GAPDH的序列. 利用primer 5.0及Oligo7设计上下游引物. Pre-miR-155上下游引物引入EcoRⅠ、BamHⅠ酶切位点, 每对引物序列约19-21个碱基, 由上海英骏公司合成(表1).
| 引物名称 | 序列(5'→3') | 产物大小(bp) |
| pre-miR-155 PCR | Forward: TCGAGAATTCAGGTGGCACAAACCAGGAA | 304 |
| Reverse: TCGAGGATCCGTTGAACATCCCAGTGACCAG | ||
| pre-miR-155 RT-PCR | Forward: ATTGCCAATTTCTCTACCAC | 333 |
| Reverse: AGTAACAGGCATCATACACT | ||
| GAPDH RT-PCR | Forward: GCTCTCTGCTCCTCCTGT | 504 |
| Reverse: ATGAGTCCTTCCACGATAC |
1.2.2 质粒的扩增及纯化: 氯化钙法制备感受态细胞DH5α. PmR-mCherry质粒转化宿主菌, 筛选阳性菌落, 小量制备质粒DNA, 琼脂糖凝胶电泳分析选出含相应质粒的阳性细菌克隆.
1.2.3 目的基因的扩增及纯化: 用PCR方法以HepG2.2.15细胞基因组DNA为模板扩增pre-miR-155序列. PCR的反应程序如下: 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸30 s, 共循环30次, 最后72 ℃延伸3 min, 产物经电泳鉴定, 用PCR纯化试剂盒纯化, 送上海英骏公司测序.
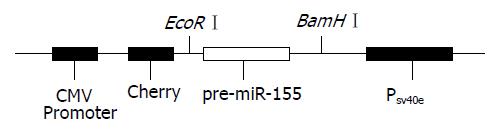
1.2.4 真核过表达载体的构建及鉴定: 用快速限制性内切酶EcoRⅠ和BamHⅠ双酶切pmR-mCherry质粒及PCR产物, 琼脂糖电泳回收片段, 用T4 DNA连接酶将两片段连接, 产物转化感受态细胞DH5α, 经含卡那霉素的LB培养基筛选, 挑取阳性克隆进行质粒的小量制备, 将重组质粒pmiR-155行双酶切鉴定及测序分析(图1). 用去内毒素质粒小量中提试剂盒提取重组质粒及空载体用于细胞转染.
1.2.5 细胞培养及转染: HepG2.2.15细胞培养于含200 mg/L的G418、100 g/L FBS的高糖DMEM培养液中, 同时含有100000 IU/L 青链霉素(转染时不加双抗)和10 g/L的L-谷氨酰胺[13]. 在37 ℃、50 mL/L CO2培养箱中培养. 细胞传代培养3次后消化接种到6孔板内, 细胞密度为4.8×105/孔, 培养24 h后待细胞汇合度达底面积的80%左右准备转染. 分别设重组组(pmiR-155质粒)、空载组(pmR-mCherry质粒)和空白组, 除空白组外每孔分取质粒2 µg和脂质体LipofectamineTM 2000 6 µL用Opti-MEM®ⅠReduced Serum Medium稀释至200 µL, 两者混匀后室温放置5 min, 使之形成复合物后加入各孔, 转染5 h后每孔补加2 mL含10%FBS的高糖DMEM培养液[14]. 转染24 h后荧光显微镜下观察红色荧光蛋白表达情况.
1.2.6 两步法RT-PCR验证: 转染24 h后, 胰酶消化收集重组组、空载组和空白组的HepG2.2.15细胞, 提取总RNA进行逆转录, 以各自的cDNA为模板, 用RT-PCR引物进行扩增. Pre-miR-155序列的PCR反应程序如下: 94 ℃变性30 s, 53 ℃退火30 s, 72 ℃延伸30 s, 共循环30次, 最后72 ℃延伸3 min, 产物经电泳鉴定. GAPDH序列的PCR反应程序除退火温度改为56 ℃外, 其他同pre-miR-155片段的扩增.
1.2.7 ELISA检测细胞上清培养液中HBeAg分泌量: 转染后24 h后收集各组细胞上清培养液, 1000 r/min离心5 min, 吸取上清, 作为检测样品. 按试剂说明书操作. 结果用A值表示.
统计学处理 应用统计软件SPSS17.0进行数据分析. 所有数据以mean±SD表示, 两组间比较作t检验. P<0.05为差异具有统计学意义.
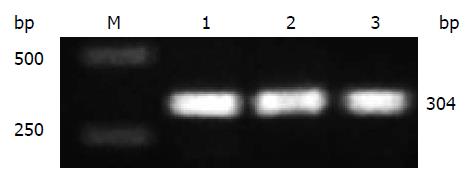
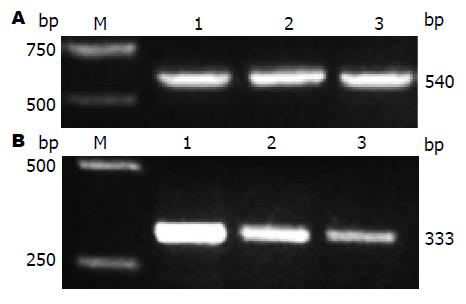
以HepG2.2.15细胞基因组DNA为模板进行PCR扩增, PCR产物进行2%琼脂糖凝胶电泳, 对照DNA相对分子质量标准, 扩增出约304 bp的单一条带, 与预计片段大小相同(图2). PCR产物经纯化后送测序, 测序结果与pre-miR-155序列一致.
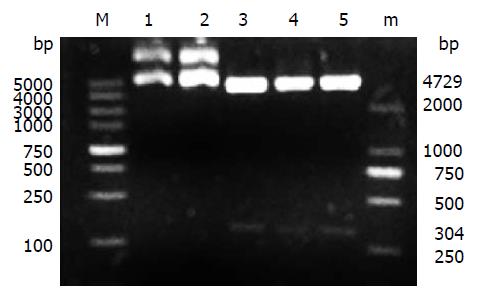
pmiR-155重组质粒经EcoRⅠ和BamHⅠ双酶切后, 产物进行1%琼脂糖凝胶电泳, 并选取空质粒双酶切作为对照. 电泳结果显示空质粒和重组质粒均观察到约4729 bp的DNA条带, 重组质粒产生的小片段则约为304 bp(图3). 同时对其进行碱基测序, 测序结果显示峰图良好, 将所测序列与目的载体序列在DNAMAN进行比对, 结果显示两端序列完全匹配, 则pmiR-155真核过表达载体构建成功.
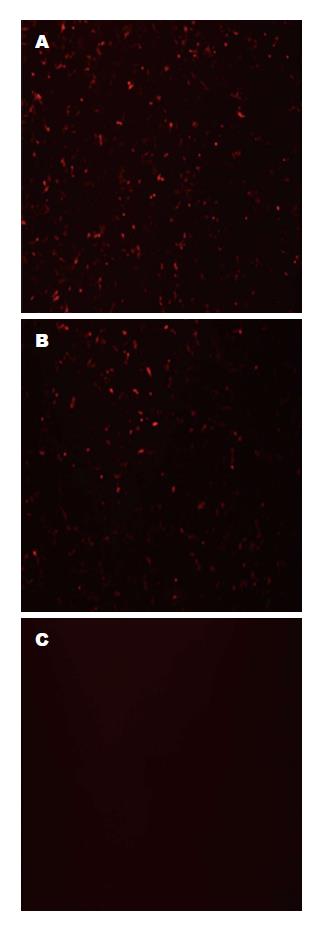
转染24 h后, 经蓝色荧光激发可见转染pmiR-155组和转染pmR-mCherry组均有部分细胞激发出红色荧光(图4A, B), 表明红色荧光蛋白具有较好的表达活性, 转染效率达到50%以上, 即转染成功; 而空白组未见荧光(图4C).
经RT-PCR检测结果表明, 以空白组细胞内表达的miR-155量为基准, 转染pmR-mCherry细胞组内的miR-155表达无明显变化, 转染pmiR-155细胞组内的miR-155表达显著增多(图5B).
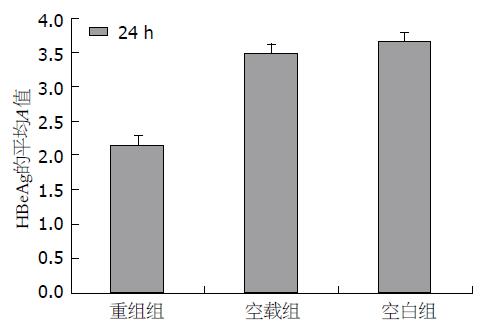
经ELISA检测结果表明, 以空白组细胞所分泌的HBeAg量为基准, 转染pmR-mCherry细胞组内所分泌的HBeAg量(3.50±0.35)与空白组(3.67±0.13)相比, 未见明显变化. 转染pmiR-155细胞组所分泌的HBeAg(2.17±0.13)与余两组相比, 存在显著性差异, 具有统计学意义(P<0.05)(图6).
miRNAs是机体内高度保守的小单链非编码RNA, 在肿瘤[15]、心血管性疾病[16]、免疫性疾病[17-19]等方面发挥重要作用. 目前, miR-155被认为是新的炎症介质, 影响先天免疫和适应性免疫的调节及系统的稳定[20,21]. miR-155通过核因子κB(nuclear factor-kappa B, NF-κB)和JNK-c-Juh/AP1信号通路刺激Toll样受体(Toll-like receptor, TLR)应答, 影响单核巨噬细胞炎症反应和粒细胞的生成[22-24], 是多种炎症介质的共同中央靶点. 同时, miR-155是T、B细胞应答和树突状细胞(dendritic cells, DC)抗原提呈反应中的不可缺少的参与者[25,26]. Rodriguez等[27]发现敲除miR-155的转基因小鼠中, DC的抗原提呈能力和共刺激能力下降, T细胞倾向分化成Th2细胞, 除此之外, DC的一些炎症因子基因和趋向因子基因亦受到影响. Rodriguez证实miR-155在参与免疫反应及维持免疫平衡中发挥重要作用. Lu等[28]认为miR-155可能作用于IL-2信号途径抑制分子SOCS1的表达, 从而达到调节T调节细胞的分化能力. 最近, Dudda等[29]发现miR-155在CD8+ T细胞比初始T细胞中表达增加, 可以调节CD8+ T细胞的免疫应答来抗病毒感染及影响肿瘤恶化. miR-155在免疫应答中的作用机制的深入研究和阐述具有重要的理论意义和临床应用价值.
本实验的重组组中, miR-155前体序列连接到真核过表达载体pmR-mCherry并经转染至HepG2.2.15细胞后, miR-155呈过表达状态, 而细胞内所分泌的HBeAg则显著减少. HBeAg不仅反映病毒复制水平, 且作为重要的免疫调节蛋白参与感染过程的免疫应答[30]. 如前所述, miR-155被发现在调控自身免疫系统抗病毒感染方面具有十分重要的作用. 因此, 重组组中所分泌的HBeAg的明显减少很有可能是由miR-155的过表达所导致的miR-155可能通过调控某种免疫应答, 提高细胞抗病毒感染作用, 从而影响HBeAg的分泌. 但这种影响是否通过基因水平起作用, 目前尚未得知.
此外, 人miR-155真核过表达载体的成功构建, 为更好地在体外水平上进一步研究miR-155对HBV复制及免疫状态影响提供了实验基础. 今后将在此次研究基础上, 针对miR-155对HBV DNA表达量是否具有抑制作用进行深入研究.
乙型肝炎病毒(hepatitis B virus, HBV)感染是危及全球人类健康问题, 可续发为肝硬化、肝纤维化, 甚至肝细胞癌. 抗病毒药物主要是干扰素和核苷类似物, 但无法彻底体内病毒复制. MicroRNA-155 (miR-155)是新的炎症因子, 参与炎症反应、免疫系统的发育和应答, 甚至发挥抗病毒感染作用.但目前尚无miR-155在HBV免疫状态的作用及影响的相关研究.
刘正稳, 教授, 西安交通大学医学院第一附属医院
本研究中miR-155在HepG2.2.15细胞的表达及其对HBV复制的影响鲜有研究报道. 我们利用PCR法扩增miR-155前体序列, 连接到真核过表达载体pmR-mCherry的多克隆位点, 成功构建pmiR-155真核过表达载体, 以脂质体法转染肝细胞株HepG2.2.15细胞, 检测各组细胞内miR-155的表达量及乙型肝炎e抗原(hepatitis B e-antigen, HBeAg)表达量的变化, 观察miR-155对HBV复制的影响.
miR-155是炎症因子, 参与免疫系统的发育与应答, 具有抗病毒感染作用. 最新研究报道异位表达的miR-155通过抑制信号通路来减少HBX的表达量. 然而miR-155在HBV复制及免疫状态的影响机制尚未清楚.
本研究报道的miR-155, 其在HBV中的作用鲜有报道, 我们首次通过构建miR-155真核过表达载体, 转染到HepG2.2.15细胞内, 证明其在HepG2.2.15细胞内表达上调后, 可降低HBeAg的分泌, 表明在HepG2.2.15细胞中, 由于miR-155的高表达, 抑制HBeAg的分泌, 进而抑制HBV的复制及验证其抗病毒感染作用.
miR-155过表达可能是对HBV复制产生抑制作用, 这可能为研究miR-155对HBV复制及免疫状态的影响提供实验理论基础.
本研究为进一步研究其对HBV复制的影响及其可能的机制提供了基础.
编辑: 郭鹏 电编: 闫晋利
| 1. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 2. | Nilsen TW. Mechanisms of microRNA-mediated gene regulation in animal cells. Trends Genet. 2007;23:243-249. [PubMed] [DOI] |
| 3. | Pager CT, Wehner KA, Fuchs G, Sarnow P. MicroRNA-mediated gene silencing. Prog Mol Biol Transl Sci. 2009;90:187-210. [PubMed] [DOI] |
| 4. | Faraoni I, Antonetti FR, Cardone J, Bonmassar E. miR-155 gene: a typical multifunctional microRNA. Biochim Biophys Acta. 2009;1792:497-505. [PubMed] [DOI] |
| 5. | O'Connell RM, Kahn D, Gibson WS, Round JL, Scholz RL, Chaudhuri AA, Kahn ME, Rao DS, Baltimore D. MicroRNA-155 promotes autoimmune inflammation by enhancing inflammatory T cell development. Immunity. 2010;33:607-619. [PubMed] [DOI] |
| 7. | Vargova K, Curik N, Burda P, Basova P, Kulvait V, Pospisil V, Savvulidi F, Kokavec J, Necas E, Berkova A. MYB transcriptionally regulates the miR-155 host gene in chronic lymphocytic leukemia. Blood. 2011;117:3816-3825. [PubMed] [DOI] |
| 8. | Teng G, Papavasiliou FN. Shhh! Silencing by microRNA-155. Philos Trans R Soc Lond B Biol Sci. 2009;364:631-637. [PubMed] [DOI] |
| 11. | Zhang J, Jin H, Liu H, Lv S, Wang B, Wang R, Liu H, Ding M, Yang Y, Li L. MiRNA-99a directly regulates AGO2 through translational repression in hepatocellular carcinoma. Oncogenesis. 2014;3:e97. [PubMed] [DOI] |
| 12. | Su C, Hou Z, Zhang C, Tian Z, Zhang J. Ectopic expression of microRNA-155 enhances innate antiviral immunity against HBV infection in human hepatoma cells. Virol J. 2011;8:354. [PubMed] [DOI] |
| 13. | Sells MA, Chen ML, Acs G. Production of hepatitis B virus particles in Hep G2 cells transfected with cloned hepatitis B virus DNA. Proc Natl Acad Sci USA. 1987;84:1005-1009. [PubMed] |
| 14. | Ren GL, Bai XF, Zhang Y, Chen HM, Huang CX, Wang PZ, Li GY, Zhang Y, Lian JQ. Stable inhibition of hepatitis B virus expression and replication by expressed siRNA. Biochem Biophys Res Commun. 2005;335:1051-1059. [PubMed] [DOI] |
| 15. | Ruan K, Fang X, Ouyang G. MicroRNAs: novel regulators in the hallmarks of human cancer. Cancer Lett. 2009;285:116-126. [PubMed] [DOI] |
| 16. | Hu YL, Fong S, Largman C, Shen WF. HOXA9 regulates miR-155 in hematopoietic cells. Nucleic Acids Res. 2010;38:5472-5478. [PubMed] [DOI] |
| 17. | Singh RP, Massachi I, Manickavel S, Singh S, Rao NP, Hasan S, Mc Curdy DK, Sharma S, Wong D, Hahn BH. The role of miRNA in inflammation and autoimmunity. Autoimmun Rev. 2013;12:1160-1165. [PubMed] [DOI] |
| 18. | Grigoryev YA, Kurian SM, Hart T, Nakorchevsky AA, Chen C, Campbell D, Head SR, Yates JR, Salomon DR. MicroRNA regulation of molecular networks mapped by global microRNA, mRNA, and protein expression in activated T lymphocytes. J Immunol. 2011;187:2233-2243. [PubMed] [DOI] |
| 19. | Sonkoly E, Ståhle M, Pivarcsi A. MicroRNAs and immunity: novel players in the regulation of normal immune function and inflammation. Semin Cancer Biol. 2008;18:131-140. [PubMed] [DOI] |
| 21. | Vigorito E, Kohlhaas S, Lu D, Leyland R. miR-155: an ancient regulator of the immune system. Immunol Rev. 2013;253:146-157. [PubMed] [DOI] |
| 22. | Schulte LN, Westermann AJ, Vogel J. Differential activation and functional specialization of miR-146 and miR-155 in innate immune sensing. Nucleic Acids Res. 2013;41:542-553. [PubMed] [DOI] |
| 23. | Tili E, Michaille JJ, Cimino A, Costinean S, Dumitru CD, Adair B, Fabbri M, Alder H, Liu CG, Calin GA. Modulation of miR-155 and miR-125b levels following lipopolysaccharide/TNF-alpha stimulation and their possible roles in regulating the response to endotoxin shock. J Immunol. 2007;179:5082-5089. [PubMed] |
| 24. | McCoy CE, Sheedy FJ, Qualls JE, Doyle SL, Quinn SR, Murray PJ, O'Neill LA. IL-10 inhibits miR-155 induction by toll-like receptors. J Biol Chem. 2010;285:20492-20498. [PubMed] [DOI] |
| 25. | Kohlhaas S, Garden OA, Scudamore C, Turner M, Okkenhaug K, Vigorito E. Cutting edge: the Foxp3 target miR-155 contributes to the development of regulatory T cells. J Immunol. 2009;182:2578-2582. [PubMed] [DOI] |
| 26. | Banerjee A, Schambach F, DeJong CS, Hammond SM, Reiner SL. Micro-RNA-155 inhibits IFN-gamma signaling in CD4+ T cells. Eur J Immunol. 2010;40:225-231. [PubMed] [DOI] |
| 27. | Rodriguez A, Vigorito E, Clare S, Warren MV, Couttet P, Soond DR, van Dongen S, Grocock RJ, Das PP, Miska EA. Requirement of bic/microRNA-155 for normal immune function. Science. 2007;316:608-611. [PubMed] [DOI] |
| 28. | Lu LF, Thai TH, Calado DP, Chaudhry A, Kubo M, Tanaka K, Loeb GB, Lee H, Yoshimura A, Rajewsky K. Foxp3-dependent microRNA155 confers competitive fitness to regulatory T cells by targeting SOCS1 protein. Immunity. 2009;30:80-91. [PubMed] [DOI] |
| 29. | Dudda JC, Salaun B, Ji Y, Palmer DC, Monnot GC, Merck E, Boudousquie C, Utzschneider DT, Escobar TM, Perret R. MicroRNA-155 is required for effector CD8+ T cell responses to virus infection and cancer. Immunity. 2013;38:742-753. [PubMed] [DOI] |
| 30. | Wu S, Kanda T, Imazeki F, Arai M, Yonemitsu Y, Nakamoto S, Fujiwara K, Fukai K, Nomura F, Yokosuka O. Hepatitis B virus e antigen downregulates cytokine production in human hepatoma cell lines. Viral Immunol. 2010;23:467-476. [PubMed] [DOI] |