修回日期: 2014-07-22
接受日期: 2014-08-17
在线出版日期: 2014-09-28
目的: 利用雨蛙素(caerulein, CAE)及脂多糖(lipopolysaccharides, LPS)复制典型的轻重型急性胰腺炎(acute pancreatitis, AP)模型.
方法: C57小鼠50只, 随机分为5组: 正常对照组(CON组)、CAE 7次组(CAE 7组)、CAE 7次加LPS组(CAE 7+LPS组)、CAE 13次组(CAE 13组)及CAE 13次加LPS组(CAE 13+LPS组), 检测血淀粉酶、脂肪酶水平, 组织病理学及透射电镜观察.
结果: 各实验组酶学水平及病理评分明显高于对照组(淀粉酶含量最低的CAE 7组: 27020 U/dL±3443 U/dL vs CON组: 2696 U/dL±400 U/dL, P<0.01; 脂肪酶含量最低的CAE 7组: 1379 U/L±283 U/L vs CON组: 33 U/L±13 U/L, P<0.01; 病理评分最低的CAE 7组: 5.8±0.9 vs CON组: 0.1±0.3, P<0.01); 与CAE 7组相比, CAE 13+LPS组酶学水平及病理评分升高更明显(CAE 13+LPS组淀粉酶: 46969 U/dL±11852 U/dL vs CAE 7组淀粉酶: 27020 U/dL±3443 U/dL, P<0.01; CAE 13+LPS组脂肪酶: 1962 U/dL±496 U/dL vs CAE 7组脂肪酶: 1379 U/dL±283 U/dL, P<0.05; CAE 13+LPS组病理评分: 11.1±1.1 vs CAE 7组病理评分: 5.8±0.9, P<0.05); CAE 13+LPS组较CAE 13组病理评分改变更明显(CAE 13+LPS组: 11.1±1.1 vs CAE 13组: 10.1±0.99, P<0.05); 电镜示CAE 7组细胞线粒体和粗面内质网扩张水肿, CAE 13+LPS组细胞坏死、间质结构破坏.
结论: 单纯CAE腹腔注射7次可制典型急性水肿型胰腺炎模型, CAE 13次加末次LPS腹腔注射可制典型急性坏死型胰腺炎模型, 是研究不同程度AP较理想的模型.
核心提示: 7次腹腔注射雨蛙素可以成功诱导轻型急性胰腺炎(acute pancreatitis, AP); 13次腹腔注射雨蛙素加末次脂多糖(lipopolysaccharides)注射更容易诱导典型的重型AP的病理改变. 此方法对于研究AP的发病机制和转归提供了良好的动物模型.
引文著录: 郑英强, 黄娟, 曾凡才, 周翔宇. 雨蛙素及脂多糖在小鼠急性胰腺炎建模中的应用. 世界华人消化杂志 2014; 22(27): 4068-4074
Revised: July 22, 2014
Accepted: August 17, 2014
Published online: September 28, 2014
AIM: To establish typical mouse models of mild or severe acute pancreatitis induced with caerulein (CAE) and/or lipopolysaccharides (LPS).
METHODS: Fifty healthy adult male C57 mice were randomly divided into five groups (with 10 mice in each group): a control group (CON group), the caerulein 7 group (CAE 7 group), a caerulein 7 plus LPS group (CAE 7 + LPS group), a caerulein 13 group (CAE 13 group), and a caerulein 13 plus LPS group (CAE 13 + LPS group). All the animals were killed three hours after the last intraperitoneal injection. The pancreas was carefully removed for microscopic examination and further observed under a transmission electron microscope (TEM). Serum amylase and lipase concentrations were assayed.
RESULTS: Enzyme levels and pathological score in all the experimental groups were significantly higher than those in the CON group (amylase lowest CAE 7 group: 27020 U/dL ± 3443 U/dL vs CON group: 2696 U/dL ± 400 U/dL, P < 0.01; lipase content lowest CAE 7 group: 1379 U/L ± 283 U/L vs CON group: 33 U/L ± 13 U/L, P < 0.01; pathological score lowest CAE 7 group: 5.8 ± 0.9 vs CON group: 0.1 ± 0.3, P < 0.01). Compared with the CAE 7 group, the enzyme levels and pathological score in the CAE 13 + LPS group increased more significantly (CAE 13 + LPS group amylase: 46969 U/dL ± 11852 U/dL vs CAE 7 group amylase: 27020 U/dL ± 3443 U/dL, P < 0.01; CAE13 + LPS group lipase: 1962 U/dL ± 496 U/dL vs CAE 7 group lipase: 1379 U/dL ± 283 U/dL, P < 0.05; CAE13 + LPS group pathological score : 11.1 ± 1.1 vs CAE 7 group pathological score : 5.8 ± 0.9, P < 0.05). The grade of pathological changes in the CAE 13 + LPS group was significantly higher than that in the CAE 13 group (CAE 13 + LPS group: 11.1 ± 1.1 vs CAE 13 group: 10.1 ± 0.99, P < 0.05). The ultrastructure of acinar cells was damaged in the CAE 7 group, and the rough endoplasmic reticulum and mitochondria were markedly swollen. However, in the CAE 13 + LPS group, the acinar cells were seriously damaged.
CONCLUSION: Caerulein alone by intraperitoneal injection 7 times can be used to prepare a typical model of acute edematous pancreatitis, and caerulein by intraperitoneal injection 13 times plus LPS at the last time can be used to produce typical acute necrotizing pancreatitis.
- Citation: Zheng YQ, Huang J, Zeng FC, Zhou XY. Application of caerulein and lipopolysaccharides in creating mouse models of mild or severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(27): 4068-4074
- URL: https://www.wjgnet.com/1009-3079/full/v22/i27/4068.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i27.4068
急性胰腺炎(acute pancreatitis, AP)临床常见, 而研究人体AP存在诸多困难[1], 建立动物模型, 深入研究AP的发病机制, 轻型向重型的转归机制具有重要的意义. 过去研究, 不同的种属和不同的动物模型被采用来模拟AP, 有的是针对病因学研究[2-4], 有的是模拟临床[5,6], 就发病机制的研究而言, 雨蛙素(caerulein, CAE)或CAE联合脂多糖(lipopolysaccharides, LPS)(LPS是一种内毒素)在CAE诱导的轻型胰腺炎的基础上, 联合腹腔内注射大剂量LPS, 产生内毒素血症, 促使AP向重症急性胰腺炎(severe AP, SAP)进展诱导小鼠AP模型由于具有建模方便、无创伤性等特点被广泛采用[7]. 但是剂量、诱导时间等各个文献还不统一, 本文就我们诱导AP的经验作一交流.
50只♂C57小鼠(购自重庆腾鑫生物技术有限公司), 10周龄, 体质量22-24 g, 随机分为5组: CAE 7次组(CAE 7组)、CAE 7次+LPS组(CAE 7+LPS组)、CAE 13次组(CAE 13组)、CAE 13次+LPS组(CAE 13+LPS组)及正常对照组(CON组).
1.2.1 模型建立和标本收集: 将所有动物于实验前适应性喂养1 wk, 术前禁食12 h, 自由饮水. CAE 7组与CAE 13组小鼠腹腔注射CAE(50 μg/kg), 分别连续7次与13次, 每次间隔1 h; CAE 7+LPS组与CAE 13+LPS组在最后一次注射CAE时, 加注一次LPS(15 mg/kg); 对照组腹腔注射相同体积的生理盐水. 所有分组于最后一次注射后3 h用3%戊巴比妥钠(0.1 mL/100 g)行腹腔内注射麻醉, 麻醉满意后将小鼠平卧固定于手术台, 术野备皮, 75%乙醇消毒, 铺无菌单, 取上腹部正中切口进腹, 整个手术过程严格无菌操作. 开腹后, 首先肉眼观察各器官病理改变, 然后充分游离出下腔静脉, 用1 mL注射器从下腔静脉抽取血液0.5-1.0 mL, 以3000 r/min离心10 min分离血浆, 用试剂盒(购自南京建成生物制品研究所)测定血清淀粉酶和脂肪酶含量.
1.2.2 组织学检测及病理评分: 取胰腺组织(约1 mm3), 沁入2.5%戊二醛固定, 留作透射电镜观察; 再完整切除小鼠胰腺, 常规固定, 石蜡包埋, 连续切片, 苏木素-伊红(HE)染色, 由3位专业的病理医师双盲阅片, 每张切片随机选取10个视野, 对每个视野参照Schmidt's组织学病理分级法[8]进行评分(表1), 各项积分总和为最终得分, 10个视野的平均分计为每张切片的最后病理评分.
| 病理改变 | 分值 | |||
| 0 | 1 | 2 | 3 | |
| 间质水肿 | 无 | 小叶间 | 小叶内 | 腺泡孤岛状 |
| 炎细胞浸润 | 无 | <20个 | 20-50个 | >50个 |
| 实质坏死 | 无 | <5% | 5%-20% | >20% |
| 实质出血 | 无 | 1-2处 | 3-5处 | >20% |
统计学处理 各组数据采用mean±SD表示, 用SPSS17.0软件处理数据, 采用t检验进行两样本均数比较. P<0.05代表差异有统计学意义.
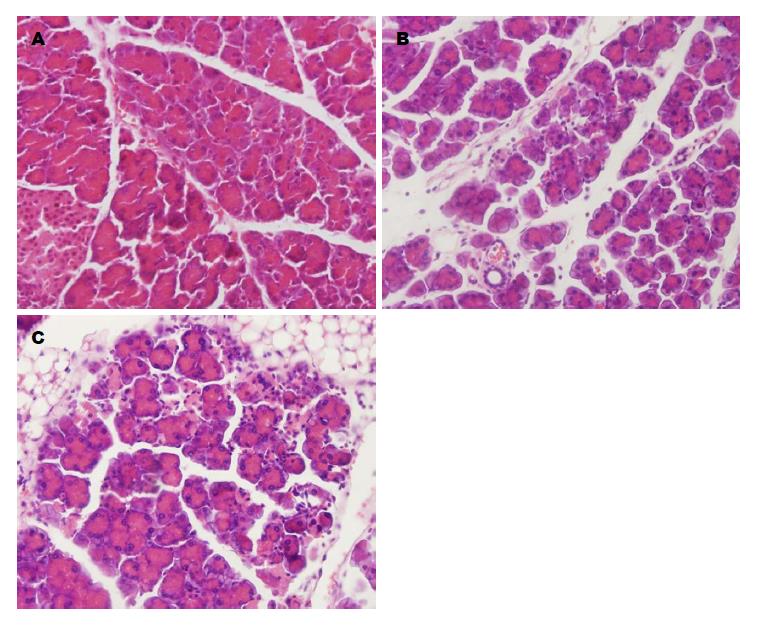
2.1.1 各组肉眼观: CAE 7组胰腺组织呈现轻重不一的水肿, 包膜紧张, 胰腺轮廓模糊, 伴有散在的充血, 多数有大量浅红色腹水形成, 胰外器官未见异常. CAE 7组+LPS组及CAE 13组与CAE 7组相似. CAE 13+LPS组腹腔有少量血性积液, 胰腺轮廓消失, 呈暗灰色, 体积增大, 胰腺可见广泛分布的暗红色点灶状坏死, 胰腺、胰周及肠系膜根部均有白色皂化斑形成, 胃肠道部分充血、扩张; 肾包膜紧张, 包膜下偶可见出血点; 肝色变暗, 略显肿胀. CON组胰腺组织形态学未见明显改变.
2.1.2 各组病理切片观察: CAE 7组胰腺呈现典型水肿性胰腺炎改变, 小叶间隙增宽、水肿、充血、有中性粒细胞和单核细胞浸润, 腺泡细胞肿胀, 但小叶结构完好, 未见明显出血坏死, 部分细胞内可见脂质空泡形成. CAE 13+LPS组胰腺组织结构破坏明显, 小叶排列紊乱, 小叶间有明显的炎症反应、水肿, 小叶边缘区大量腺泡细胞坏死, 局部有融合性坏死灶, 邻近坏死灶的腺泡细胞小且脱颗粒明显, 胞内空泡形成, 间质内动脉痉挛, 静脉扩张淤血, 有炎细胞附着管壁, 局部血管壁出血、坏死, 脂肪组织坏死. CAE 7+LPS组及CAE 13组介于CAE 7组与CAE 13+LPS组之间. CON组病理切片未见明显异常(图1).
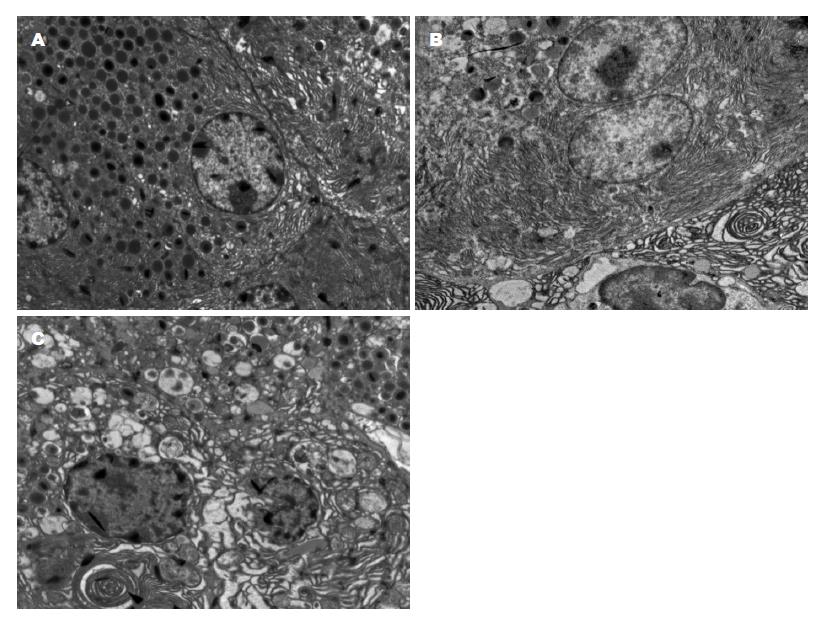
CAE 7组细胞胞核核质水肿, 粗面内质网扩张, 酶原颗粒明显减少, 胞质内可见少量自噬性空泡形成. CAE 13+LPS组细胞轮廓不清, 结构破坏; 细胞核内染色质边集, 胞质内大量自噬性空泡形成, 粗面内质网扩张明显, 部分破坏断裂形成絮状结构、酶原颗粒明显减少. CON组胰腺超微结构正常, 可见胞核、粗面内质网、线粒体和大量的酶原颗粒(图2).
与CON组比较, 各实验组的酶含量均明显升高, 差异有统计学意义(P<0.01); 实验组中酶含量最高的CAE 13+LPS组与含量相对最低的CAE 7组比较, CAE 13+LPS组的升高趋势更明显(P<0.05). 各组胰腺损伤的病理学评分也有类似的变化趋势(表2).
AP为胰酶消化自身胰腺及周围组织所引起的化学性炎症[9], 临床症状轻重不一. 当前, 对于AP的发病机制仍未完全清楚[10,11], 缺乏对轻型向重型相互转归的认识, 以及采取有效地干预手段阻止AP向重型的发生发展. 这就需要建立动物模型来模拟人类AP来进行研究.
尽管很多的动物种属都可以用来诱导AP模型, 包括兔子[12]、猫、狗、猪等, 最广泛使用的动物仍是啮齿类动物[13,14], 尤其是小鼠, 因为他更容易标准化和易于获得; 更重要的是, 更方便对小鼠遗传性状操作来诱导基因敲除和转基因动物, 进行更深入的机制探讨[15]. 本课题组正是采用小鼠作为建立模型的对象.
过去150年, 许多学者设计了不同的动物模型来研究AP的发病机制[16]. 这些模型有力地推动了对该疾病的细胞生物[17]、遗传性状[18,19]和分子机制认识, 以及对新的治疗手段的尝试. 就探讨发病机制和病因学的角度而言, CAE诱导的AP模型仍然被最广泛使用[20]. CAE是胆囊收缩素的肽类似物, 能强烈刺激胰腺的外分泌, 使胰蛋白水解酶大量释放, 引起胰腺腺泡的自身消化诱导AP模型[21,22]. 自从1977年Lampel[23]首先报道成功利用CAE诱导AP动物模型以来, 由于具有快速诱导、非侵入性、高重复性、高实用性的特点以及典型的AP组织学改变, CAE诱导的AP模型已经成为最广泛采用的AP模型之一.
早期的用药途径是通过静脉给药, 需要插入大鼠尾静脉和颈静脉导管, 后来的学者改进为经腹腔注射, 还有学者认为腹腔内给药往往能获得更为严重和持久的损害[24,25]. 用药剂量的研究发现, CAE在0-50 μg/kg的剂量范围内炎症的严重程度是剂量依赖性的, 但超过50 μg/kg后, 腺泡的最大损害程度不再随剂量的增加而有显著的加重, 因此50 μg/kg是较为合适的剂量浓度[6].
目前, 在用小鼠诱导AP模型时, 较为公认方法是用CAE (50 μg/kg)腹腔注射7次, 每次间隔1 h, 但这往往仅能诱导轻型胰腺炎[14,25,26], 这在我们的实验中也得到了证实. 如果要复制重型AP, 需要加大注射次数或者加注LPS[27,28], 但是文献报道不一致: 有的文献报道13次注射CAE可以诱导胰腺发生坏死性的炎症改变[27]; 有的学者则认为, 7次CAE注射后, 需要加注一次大剂量的LPS (10 mg/kg)触发所谓的"二重伤害", 即胰腺的炎症加细菌感染, 从而加重炎症反应从局部向全身发展[29].
为了建立比较可靠的重型AP模型, 本实验组就不同的建模方法进行验证. 通过浓度梯度, CAE的浓度采用经典的50 μg/kg, 而LPS浓度选择15 mg/kg. 结果发现, CAE 7组的淀粉酶及脂肪酶较对照组显著增高, 组织学结果显示胰腺组织广泛的水肿, 炎细胞浸润, 无明显出血坏死, 符合轻型胰腺炎的病理特征. CAE 7+LPS组病理改变与CAE 7组相似. CAE 13+LPS组的淀粉酶及脂肪酶升高幅度在CAE 7组的基础上又有所增加, 出现明显的坏死、出血、炎症浸润, 胰外器官不同程度的损害, 符合重型AP的病理特征. CAE 13组胰腺坏死程度介于CAE 7+LPS组与CAE 13+LPS组之间, 总体来说坏死程度不典型.
总之, 7次腹腔注射CAE可以成功诱导轻型AP, 13次腹腔注射CAE加末次LPS注射更容易诱导典型的重型AP. 单独使用CAE和CAE联合LPS诱导不同的AP模型, 与人类AP的病程及组织学改变相似[30], 对于研究AP的发病机制和转归提供了良好的动物模型.
研究人体急性胰腺炎(acute pancreatitis, AP)存在诸多困难, 目前制备AP模型的方法各异, 找到一种发病机制与人类相似而又方便可靠的模型建立方法, 无疑对AP的研究具有重要的推动作用.
江建新, 副主任医师, 贵阳医学院附属医院肝胆外科
胰腺炎模型的建立包括侵入性和非侵入性方法: 侵入性方法操作复杂, 对实验动物损伤大, 部分实验结果不可靠; 非侵入性方法操作简单, 但有时胰腺的病理改变往往过重或过轻, 并不能满足实验需要, 在雨蛙素基础上改良胰腺炎模型的建立成为一个获得理想动物模型的良好突破口.
常用的诱导小鼠AP模型的方法是用雨蛙素(50 μg/kg)腹腔注射7次, 每次间隔1 h, 但这往往仅能造成轻型胰腺炎的模型, 如果要复制急性坏死型胰腺炎模型, 还需加注一次大剂量的脂多糖(lipopolysaccharides, LPS)(10 mg/kg), 我们通过实验发现, 此方法还存在需改进之处.
通过比较几种常用的雨蛙素诱导AP模型的方法, 在传统雨蛙素注射次数及脂多糖剂量基础上加以改进, 总结出一套较为简便可靠的, 可分别制备不同程度AP的方法.
通过对传统雨蛙素诱导AP基础上的改良, 获得了更为理想的不同程度的AP模型, 此模型的发病及转归与人类疾病相似, 借此可以更好的对AP的发生发展机制及相关干预治疗进行研究.
文章在先前研究文献的基础上, 进一步探索雨蛙素和LPS联用致不同类型胰腺炎模型, 具有一定的实用性; 文章书写流畅, 具有一定的可读性.
编辑: 郭鹏 电编: 都珍珍
| 1. | Jung KH, Song SU, Yi T, Jeon MS, Hong SW, Zheng HM, Lee HS, Choi MJ, Lee DH, Hong SS. Human bone marrow-derived clonal mesenchymal stem cells inhibit inflammation and reduce acute pancreatitis in rats. Gastroenterology. 2011;140:998-1008. [PubMed] [DOI] |
| 2. | Wan MH, Huang W, Latawiec D, Jiang K, Booth DM, Elliott V, Mukherjee R, Xia Q. Review of experimental animal models of biliary acute pancreatitis and recent advances in basic research. HPB (Oxford). 2012;14:73-81. [PubMed] [DOI] |
| 3. | Bedrosian AS, Nguyen AH, Hackman M, Connolly MK, Malhotra A, Ibrahim J, Cieza-Rubio NE, Henning JR, Barilla R, Rehman A. Dendritic cells promote pancreatic viability in mice with acute pancreatitis. Gastroenterology. 2011;141:1915-26.e1-14. [PubMed] [DOI] |
| 4. | Kempuraj D, Twait EC, Williard DE, Yuan Z, Meyerholz DK, Samuel I. The novel cytokine interleukin-33 activates acinar cell proinflammatory pathways and induces acute pancreatic inflammation in mice. PLoS One. 2013;8:e56866. [PubMed] [DOI] |
| 5. | Zhao JB, Liao DH, Nissen TD. Animal models of pancreatitis: can it be translated to human pain study? World J Gastroenterol. 2013;19:7222-7230. [PubMed] [DOI] |
| 6. | Niederau C, Ferrell LD, Grendell JH. Caerulein-induced acute necrotizing pancreatitis in mice: protective effects of proglumide, benzotript, and secretin. Gastroenterology. 1985;88:1192-1204. [PubMed] |
| 7. | Ding SP, Li JC, Jin C. A mouse model of severe acute pancreatitis induced with caerulein and lipopolysaccharide. World J Gastroenterol. 2003;9:584-589. [PubMed] |
| 8. | Shimizu T, Shiratori K, Sawada T, Kobayashi M, Hayashi N, Saotome H, Keith JC. Recombinant human interleukin-11 decreases severity of acute necrotizing pancreatitis in mice. Pancreas. 2000;21:134-140. [PubMed] [DOI] |
| 9. | Saluja A, Saito I, Saluja M, Houlihan MJ, Powers RE, Meldolesi J, Steer M. In vivo rat pancreatic acinar cell function during supramaximal stimulation with caerulein. Am J Physiol. 1985;249:G702-G710. [PubMed] |
| 10. | Al Mofleh IA. Severe acute pancreatitis: pathogenetic aspects and prognostic factors. World J Gastroenterol. 2008;14:675-684. [PubMed] [DOI] |
| 11. | Wang GJ, Gao CF, Wei D, Wang C, Ding SQ. Acute pancreatitis: etiology and common pathogenesis. World J Gastroenterol. 2009;15:1427-1430. [PubMed] [DOI] |
| 12. | Hirano T, Saluja A, Ramarao P, Lerch MM, Saluja M, Steer ML. Apical secretion of lysosomal enzymes in rabbit pancreas occurs via a secretagogue regulated pathway and is increased after pancreatic duct obstruction. J Clin Invest. 1991;87:865-869. [PubMed] [DOI] |
| 13. | Lerch MM, Gorelick FS. Models of acute and chronic pancreatitis. Gastroenterology. 2013;144:1180-1193. [PubMed] [DOI] |
| 14. | Mareninova OA, Hermann K, French SW, O'Konski MS, Pandol SJ, Webster P, Erickson AH, Katunuma N, Gorelick FS, Gukovsky I. Impaired autophagic flux mediates acinar cell vacuole formation and trypsinogen activation in rodent models of acute pancreatitis. J Clin Invest. 2009;119:3340-3355. [PubMed] [DOI] |
| 15. | Lerch MM, Saluja AK, Dawra R, Ramaraò P, Saluja M, Steer ML. Acute necrotizing pancreatitis in the opossum: earliest morphological changes involve acinar cells. Gastroenterology. 1992;103:205-213. [PubMed] |
| 16. | Benard C. Lecon de Physilogie Experimentale. Paris: Bailliere, 1856. . |
| 17. | van Minnen LP, Blom M, Timmerman HM, Visser MR, Gooszen HG, Akkermans LM. The use of animal models to study bacterial translocation during acute pancreatitis. J Gastrointest Surg. 2007;11:682-689. [PubMed] [DOI] |
| 18. | Oz HS, Lu Y, Vera-Portocarrero LP, Ge P, Silos-Santiago A, Westlund KN. Gene expression profiling and endothelin in acute experimental pancreatitis. World J Gastroenterol. 2012;18:4257-4269. [PubMed] [DOI] |
| 19. | Bluth M, Lin YY, Zhang H, Viterbo D, Zenilman M. Use of gene expression profiles in cells of peripheral blood to identify new molecular markers of acute pancreatitis. Arch Surg. 2008;143:227-233; discussion 233-234. [PubMed] [DOI] |
| 20. | Nathan JD, Romac J, Peng RY, Peyton M, Macdonald RJ, Liddle RA. Transgenic expression of pancreatic secretory trypsin inhibitor-I ameliorates secretagogue-induced pancreatitis in mice. Gastroenterology. 2005;128:717-727. [PubMed] [DOI] |
| 21. | Bhatia M, Brady M, Shokuhi S, Christmas S, Neoptolemos JP, Slavin J. Inflammatory mediators in acute pancreatitis. J Pathol. 2000;190:117-125. [PubMed] [DOI] |
| 22. | Bhatia M, Wong FL, Cao Y, Lau HY, Huang J, Puneet P, Chevali L. Pathophysiology of acute pancreatitis. Pancreatology. 2005;5:132-144. [PubMed] [DOI] |
| 23. | Lampel M, Kern HF. Acute interstitial pancreatitis in the rat induced by excessive doses of a pancreatic secretagogue. Virchows Arch A Pathol Anat Histol. 1977;373:97-117. [PubMed] [DOI] |
| 25. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [PubMed] [DOI] |
| 26. | Mareninova OA, Sung KF, Hong P, Lugea A, Pandol SJ, Gukovsky I, Gukovskaya AS. Cell death in pancreatitis: caspases protect from necrotizing pancreatitis. J Biol Chem. 2006;281:3370-3381. [PubMed] [DOI] |
| 27. | Su KH, Cuthbertson C, Christophi C. Review of experimental animal models of acute pancreatitis. HPB (Oxford). 2006;8:264-286. [PubMed] [DOI] |
| 28. | Tan ZH, Yu LH, Wei HL, Liu GT. [Protective action of ulinastatin against lipopolysaccharides-induced acute lung injury in mice and the relation of it to iNOS and c-Jun expressions]. Yaoxue Xuebao. 2006;41:636-640. [PubMed] |
| 29. | Jaworek J, Jachimczak B, Tomaszewska R, Konturek PC, Pawlik WW, Sendur R, Hahn EG, Stachura J, Konturek SJ. Protective action of lipopolysaccharidesin rat caerulein-induced pancreatitis: role of nitric oxide. Digestion. 2000;62:1-13. [PubMed] [DOI] |
| 30. | Helin H, Mero M, Markkula H, Helin M. Pancreatic acinar ultrastructure in human acute pancreatitis. Virchows Arch A Pathol Anat Histol. 1980;387:259-270. [PubMed] |