修回日期: 2014-06-23
接受日期: 2014-08-18
在线出版日期: 2014-09-18
目的: 分析1型糖尿病肾病(diabetic nephropathy, DN)与胰岛素抵抗的关系.
方法: 采用1:1随机对照病例临床研究方法, 研究对象无其他病理因素. 其中, 糖尿病肾病患者40例, 同龄正常对照组40例. 分别采集各个研究对象的血浆, Western blot检测胰岛素受体底物(insulin receptor substrate, IRS)-2、p-IRS-2和AKT、p-AKT的蛋白表达水平, 并采用统计学方法分析尿蛋白含量与胰岛素信号通路相关蛋白以及胰岛素抵抗指数(homeostasis model assessment-insulin resistance, HOMA-IR)和胰岛素敏感指数(homeostasis model assessment-insulin sensitive index, HOMA-ISI)的相关性.
结果: 正常对照组血浆中p-IRS-2/IRS-2的水平比糖尿病肾病组高, 差异有统计学意义(P<0.05). 正常对照组血浆中p-AKT/AKT的水平也比糖尿病肾病组高, 差异有统计学意义(P<0.05). 通过相关性分析可知, 患者尿蛋白含量、肾血流量(renal blood flow, RBF)、肾小球滤过率(glomerular filtration rate, GFR)与HOMA-IR呈正相关(P<0.05), 而与HOMA-ISI呈负相关(P<0.05), 与胰岛功能(homeostasis model assessment-pancreatic beta-cell function, HOMA-β%)也呈负相关(P<0.05).
结论: 胰岛素信号通路中p-IRS-2/IRS-2和p-AKT/AKT的比值在糖尿病肾病患者中明显下降, 且患者尿蛋白含量、RBF、GFR与HOMA-IR、HOMA-ISI和HOMA-β%有相关性. 说明HOMA-IR的增加和胰岛素敏感性的降低以及胰岛素信号通路受阻很可能是1型糖尿病肾病发病的重要原因, 为1型糖尿病肾病的治疗提供了新的思路.
核心提示: 1型糖尿病肾病(diabetic nephropathy, DN)患者尿蛋白含量、肾血流量、肾小球滤过率与胰岛素抵抗指数(homeostasis model assessment-insulin resistance, HOMA-IR)呈正相关, 而与胰岛素敏感指数(homeostasis model assessment-insulin sensitive index, HOMA-ISI)呈负相关, 与胰岛功能(homeostasis model assessment-pancreatic beta-cell function, HOMA-β%)也呈负相关, 胰岛素信号通路中p-IRS-2/IRS-2和p-AKT/AKT的比值在糖尿病肾病患者中明显下降, 且患者尿蛋白含量、肾血流量、肾小球滤过率与HOMA-IR, HOMA-ISI和HOMA-β%有相关性.
引文著录: 虞建新, 吴奇, 杨欢. 1型糖尿病肾病与胰岛素抵抗的相关性. 世界华人消化杂志 2014; 22(26): 3925-3931
Revised: June 23, 2014
Accepted: August 18, 2014
Published online: September 18, 2014
AIM: To perform a quantitative test for urinary protein and different renal function indexes and explore the expression and phosphorylation of relevant proteins in the insulin signal pathway.
METHODS: Controls and cases at a ratio of 1:1 were included in this prospective randomized controlled clinical study. There were 40 patients with diabetic nephropathy (DN) and 40 normal cases with comparable age. Plasma samples were collected from the subjects to detect the protein expression of insulin receptor substrate (IRS)-2, p-IRS-2, AKT, and p-AKT by Western blot. The correlations of the quantity of urinary protein, RBF and GFR with homeostasis model assessment-insulin resistance (HOMA-IR), homeostasis model assessment-insulin sensitive index (HOMA-ISI) and homeostasis model assessment-pancreatic beta-cell function (HOMA-β%) were analyzed.
RESULTS: The ratios of p-IRS-2/IRS-2 and p-AKT/AKT decreased significantly in the DN group compared with the normal group (P < 0.05). There was a positive correlation between the quantity of urinary protein and HOMA-IR (P < 0.05) and a negative correlation between the quantity of urinary protein and HOMA-ISI (P < 0.05).
CONCLUSION: The ratios of p-IRS-2/IRS-2 and p-AKT/AKT decrease in DN patients. There exist correlations between the quantity of urinary protein and HOMA-IR and HOMA-ISI. These results indicate that the decrease of HOMA-ISI, the increase of HOMA-IR and the blockage of the insulin signal pathway may be key factors that cause DN.
- Citation: Yu JX, Wu Q, Yang H. Correlation between type 1 diabetic nephropathy and insulin resistance. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 3925-3931
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/3925.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.3925
糖尿病已成为人类生命的"三大杀手"之一[1], 极易引发并发症, 糖尿病肾病(diabetic nephropathy, DN)是糖尿病全身微血管病性合并症之一, 也是慢性并发症中较为严重的一种[2]. 1型糖尿病患者发生糖尿病肾病多在起病10-15年左右[3], 而2型糖尿病患者发生糖尿病肾病的时间则短, 这主要与年龄大、同时合并较多其他基础疾病有关[4]. 目前的研究表明糖尿病肾病的发生与胰岛素抵抗有密切的关系[5], 1型糖尿病患者体内胰岛素绝对不足[6], 容易发生酮症酸中毒, 必须用胰岛素治疗才能获得满意疗效[7], 但也由于长期的注射胰岛素, 很可能会诱导体内产生胰岛素抗体从而导致胰岛素抵抗的发生[8]. 研究认为1型糖尿病患者因长期的注射胰岛素, 其敏感性下降而产生胰岛素抵抗[9], 长此以往是造成1型糖尿病肾病发生的重要原因之一[10]. 糖尿病肾病的患者极易发展为肾丝球硬化症、膀胱无力、膀胱炎等[11], 严重危害糖尿病患者的健康和生活质量[12].
胰岛素受体底物(insulin receptor substrate, IRS)是能够被胰岛素受体酪氨酸激酶作用的底物. 目前已知有IRS-1、IRS-2、IRS-3、IRS-4[13]. 磷酸化的IRS-2能够结合并激活下游的效应物, 从而调控胰岛素信号通路的转导[14]. IRS-2位于胰岛素通路的上游, 被酪氨酸激酶磷酸化后, 可激活下游的AKT, 使AKT也发生磷酸化, 从而传导胰岛素信号[15]. 由于IRS-2和AKT是两个在胰岛素信号通路传导过程中的重要蛋白[16], 而且在胰岛素抵抗的发病过程中也扮演了重要的角色[17]. 本研究主要探究胰岛素信号通路中与胰岛素抵抗相关的蛋白及其磷酸化的变化, 建立模型分析1型糖尿病肾病患者尿蛋白含量、肾血流量(renal blood flow, RBF)、肾小球滤过率(glomerular filtration rate, GFR)与胰岛素抵抗指数(homeostasis model assessment-insulin resistance, HOMA-IR)、胰岛素敏感指数(homeostasis model assessment-insulin sensitive index, HOMA-ISI)、胰岛功能(homeostasis model assessment-pancreatic beta-cell function, HOMA-β%)之间的相关性, 从而分析1型糖尿病肾病与胰岛素抵抗的关系.
研究对象分为2组: (1)随机选取2013 -05-01/2013-10-01在九江学院附属医院进行体检的健康人40名为正常对照组, 平均年龄53.25岁±5.47岁; (2)随机选取2013-01-01/2013-10-01九江学院附属医院收治的1型糖尿病肾病患者40例作为DN组, 平均年龄55.12岁±4.96岁. 纳入标准: (1)根据医学论理学原则, 研究前应对研究对象进行告知和讲解, 确保所有研究对象充分了解相关信息, 并签署知情同意书[18]; (2)研究对象无其他病理因素; (3)采用1:1随机对照病例研究方法. 1型糖尿病患者的诊断标准: (1)胰岛素自身抗体(insulin autoantibody, IAA), 胰岛细胞抗体(islet cell antibody, ICA), 谷氨酸脱羧酶抗体(glutamic acid decarboxylase antibody, GAD-Ab)呈阳性; (2)发病一般比较急骤, 口渴、多饮、多尿、多食以及乏力消瘦, 体质量急剧下降等症状十分明显; (3)无一例外地必须使用胰岛素治疗才有效[19]. 1型糖尿病肾病诊断标准: (1)由于微量白蛋白尿是诊断糖尿病肾病的标志, 故糖尿病起病5年后进行尿微量白蛋白筛查, 且半年内复查3次, 有2次检查呈阳性, 均可诊断为1型糖尿病肾病. A: UAE(运动后尿白蛋白排出率)持续升高20-200 μg/min. B: 尿白蛋白30-300 mg/24 h. C: 尿肌酐为30-300 μg/mg; (2)肾脏血流动力学异常: 主要表现为肾小球高灌注、滤过分数增加、肾血流量和肾小球滤过率增加[20].
1.2.1 标本采集与保存: 实验对象在实验前12 h禁食, 于清晨空腹抽取静脉血4 mL,一部分装在有肝素抗凝的离心管中, 混匀, 5000 r/min离心10 min[21], 收集上层即为血浆, 用于做Western blot的各项检测; 另一部分, 装在无肝素抗凝的离心管中, 离体的血液凝固之后, 经血凝块聚缩释放出的上层液体则为血清, 用于测甘油三酯(triglyceride, TG)、总胆固醇含量(total cholesterol, TC)、低密度脂蛋白(low density lipoprotein, LDL)、高密度脂蛋白(high density lipoprotein, HDL)、空腹血糖(fasting blood glucose, FBG)以及空腹胰岛素(fasting insulin, FINS).
1.2.2 实验室检测: (1)TG、TC、LDL、HDL的测定: 本部分实验采用九江学院附属医院进口的日立7600全自动生化分析仪进行, 将样品送入分析仪中, 记录各项指标; (2)FBG和FINS的测定: 采用葡萄糖氧化酶法测定FBG. 其基本原理是: 葡萄糖可以在葡萄糖氧化酶的作用下产生葡萄糖酸和过氧化氢, 过氧化氢在过氧化物酶的作用下使邻联甲苯胺生成蓝色物质, 此有色物质在625 nm波长下与葡萄糖浓度成正比. 通过测定蓝色物质的吸光度可计算样品中葡萄糖的含量. 采用BACKMAN全自动化学发光免疫分析仪, 通过酶联免疫化学发光法测定FINS[22]. 按步骤操作, 记录原始数据; (3)HOMA评价胰岛β细胞功能以及胰岛素抵抗情况: HOMA-IR = FINS×FBG/22.5; HOMA-ISI = In[22.5/(FBG×FINS)]; HOMA-β% = 20×FINS/(FBG-3.5); (4)IRS-2, p-IRS-2和AKT, p-AKT蛋白表达水平的检测: 由于是对血浆中的蛋白进行检测, 所以采用PBS将血浆样品稀释, 为确保每个蛋白样品的上样量一致, 需要测定每个蛋白样品的蛋白浓度, 采用碧云天生产的BCA工作液对样品中的蛋白进行定量. 在样品中加入适量碧云天生产的5×SDS-PAGE蛋白上样缓冲液. 沸水浴中3 min后上样, 电泳(80 V电压30 min, 100 V电压60 min), 电转膜仪转膜(200 mA 90 min), 用5%脱脂牛奶封闭, 随后于摇床上孵育一抗1 h, 4 ℃冰箱过夜, 第2天继续孵育一抗1 h, 洗膜3次, 5 min/次, 孵育二抗2 h, 洗膜3次, 10 min/次. 用自动显影仪显影, 并分析条带灰度[23]; (5)相关性分析: 采用SPSS软件对尿蛋白含量、RBF、GFR与HOMA-IR、HOMA-ISI、HOMA-β%之间的相关性进行分析.
统计学处理 采用SPSS13.0对尿蛋白含量、RBF、GFR与HOMA-IR、HOMA-ISI、HOMA-β%之间的相关性进行分析, 由于统计资料不服从正态分布, 统计结果采用(中位数±四分位间距)表示. P<0.05为差异有统计学意义.
通过对临床一般资料的分析, 可知两组研究对象在平均年龄, 男女比例方面均无差异(P>0.05). 但在尿蛋白定量、血尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, Scr)、肌酐清除率(creatinine clearance rate, Ccr)、RBF、GFR等方面均有显著差异(P<0.01)(表1).
| 分组 | 正常对照组 | DN组 | P值 |
| 男女比例 | 1.25:1 | 1.53:1 | >0.05 |
| 平均年龄(岁) | 53.25±5.47 | 55.12±4.96 | >0.05 |
| 尿蛋白定量(g/24 h) | 0.12±0.24 | 1.36±0.42 | <0.01 |
| BUN(mmol/L) | 5.10±2.03 | 7.73±2.15 | <0.01 |
| Scr(μmol/L) | 102.32±20.51 | 159.15±27.32 | <0.01 |
| Ccr(mL/min) | 90.23±15.32 | 55.33±18.36 | <0.01 |
| RBF(mL/min.1.73 m2) | 650.34±20.68 | 989.78±17.89 | <0.01 |
| GFR(mL/min) | 120.56±13.65 | 180.75±19.11 | <0.01 |
通过生化自动分析仪的分析, 可发现与对照组相比, TG、TC、LDL在糖尿病肾病组明显升高(P<0.05); HDL在糖尿病肾病组明显降低(P<0.05)(表2).
| 分组 | TG | TC | LDL | HDL |
| 正常对照组 | 5.09±0.43 | 2.13±0.52 | 3.02±0.42 | 3.34±0.25 |
| DN组 | 6.93±0.72 | 3.93±0.35 | 3.79±0.52 | 1.25±0.32 |
| P值 | <0.01 | <0.05 | <0.05 | <0.05 |
通过葡萄糖氧化酶法测定FBG以及酶联免疫化学发光法测定FINS[24]可知, 与正常对照组相比, 糖尿病肾病组的空腹血糖和空腹胰岛素均明显升高(P<0.01)(表3).
| 分组 | FBG | FINS |
| 正常对照组 | 4.25±0.69 | 8.23±1.95 |
| DN组 | 7.53±0.89 | 15.66±1.34 |
| P值 | <0.01 | <0.01 |
通过HOMA稳态模型计算公式, 可知与正常对照组相比, 糖尿病肾病组的HOMA-IR增高(P<0.01), HOMA-ISI降低(P<0.01), HOMA-β%明显降低(P<0.05)(表4).
| 分组 | HOMA-IR | HOMA-ISI | HOMA-β% |
| 正常对照组 | 1.65±0.62 | -0.25±0.37 | 225.37±80.01 |
| DN组 | 4.25±0.89 | -1.47±0.12 | 135.67±95.42 |
| P值 | <0.01 | <0.01 | <0.05 |
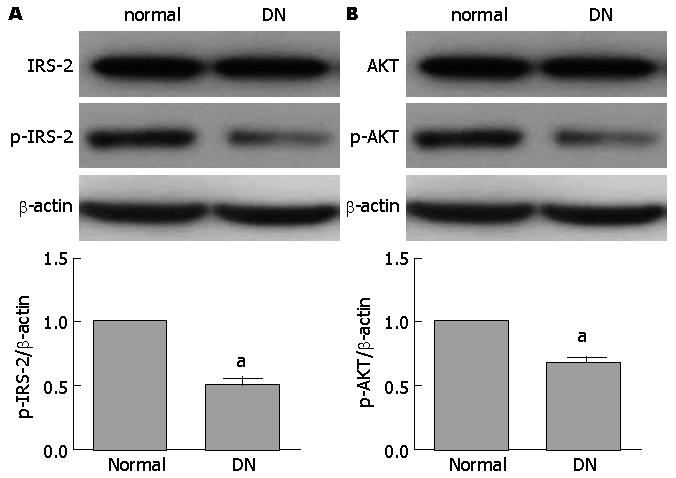
Western blot结果显示, 与正常对照组相比, 糖尿病肾病组的IRS-2和AKT总蛋白无明显变化, 但p-IRS-2和p-AKT蛋白表达明显降低(P<0.05, 图1).
由SPSS统计软件分析可知, 糖尿病肾病患者的尿蛋白量、RBF、GFR均与HOMA-IR正相关(P<0.05), 与HOMA-ISI呈负相关(P<0.05), 与胰HOMA-β%呈负相关(P<0.05)(表5, 表6, 表7).
| 分组 | 相关系数 | P值 |
| HOMA-IR | 0.385 | <0.05 |
| HOMA-ISI | -0.496 | <0.05 |
| HOMA-β% | -0.274 | <0.05 |
| 分组 | 相关系数 | P值 |
| HOMA-IR | 0.265 | <0.05 |
| HOMA-ISI | -0.322 | <0.05 |
| HOMA-β% | -0.298 | <0.05 |
| 分组 | 相关系数 | P值 |
| HOMA-IR | 0.326 | <0.05 |
| HOMA-ISI | -0.156 | <0.05 |
| HOMA-β% | -0.223 | <0.05 |
糖尿病肾病在我国的发病率亦呈上升趋势, 目前已成为终末期肾脏病的第2位原因[25]. 由于其存在复杂的代谢紊乱, 一旦发展到终末期肾脏病, 往往比其他肾脏疾病的治疗更加棘手, 因此及时防治对于延缓糖尿病肾病的意义重大[26]. 研究表明1型糖尿病肾病的发生与胰岛素抵抗有密切的关系, 主要是由于长期注射胰岛素, 导致糖尿病患者对胰岛素的敏感性下降而产生胰岛素抵抗, 长此以往, 发展成为糖尿病肾病[27]. IRS-2上的酪氨酸残基可被酪氨酸激酶磷酸化, 从而结合并可激活下游的AKT, 使AKT也发生磷酸化, 从而传导胰岛素信号, 产生相应的效应[28]. 本研究主要探究胰岛素信号通路中与胰岛素抵抗相关的蛋白及其磷酸化的变化, 建立模型分析糖尿病肾病患者尿蛋白含量与p-AKT、p-IRS-2以及HOMA-IR、HOMA-ISI之间的相关性[29], 从而分析糖尿病肾病与胰岛素抵抗的关系.
实验结果显示, 正常对照组和糖尿病肾病组研究对象在平均年龄, 男女比例方面均无差异(P>0.05). 但在尿蛋白定量、BUN、Scr、Ccr方面均有显著差异(P<0.01). 与对照组相比, TG、TC、LDL在糖尿病肾病组明显升高(P<0.05); HDL在糖尿病肾病组明显降低(P<0.05). 与正常对照组相比, 糖尿病肾病组的HOMA-IR增高(P<0.01), HOMA-ISI降低(P<0.01), HOMA-β%明显降低(P<0.05). Western blot结果显示, 与正常对照组相比, 糖尿病肾病组的IRS-2和AKT总蛋白无明显变化, 但p-IRS-2和p-AKT蛋白表达明显降低(P<0.05). 说明其阻碍了胰岛素通路信号通路的传导. 通过相关性分析可知, DN患者的尿蛋白量、RBF、GFR与HOMA-IR呈正相关(P<0.05), 与HOMA-ISI呈负相关(P<0.05), 与胰岛β细胞功能(HOMA-β%)呈负相关(P<0.05).
以上研究结果表明, 胰岛素信号通路中p-IRS-2/IRS-2和p-AKT/AKT的比值在糖尿病肾病患者中明显下降, 且患者尿蛋白、肾血流量、肾小球滤过率含量与HOMA-IR和HOMA-ISI有相关性. 说明HOMA-IR的增加和胰岛素敏感性的降低以及胰岛素信号通路受阻很可能是糖尿病肾病发病的重要原因[30]. 下一步, 我们将进一步研究在糖尿病肾病中, 胰岛素抵抗发生的机制[31].
感谢李春平、罗爱国在本试验中给予的大力帮助.
糖尿病肾病(diabetic nephropathy, DN)在我国的发病率亦呈上升趋势. 长期注射胰岛素, 导致糖尿病患者对胰岛素的敏感性下降而产生胰岛素抵抗, 长此以往, 发展成为糖尿病肾病. 胰岛素受体底物-2(insulin receptor substrate, IRS-2)上的酪氨酸残基可被酪氨酸激酶磷酸化, 从而结合并可激活下游的AKT, 使AKT也发生磷酸化, 从而传导胰岛素信号, 产生相应的效应.
徐庆, 教授, 桂林医学院药理教研室
胰岛素抵抗指数(homeostasis model assessment-insulin resistance, HOMA-IR)的增加和胰岛素敏感指数(homeostasis model assessment-insulin sensitive index, HOMA-ISI)的降低以及胰岛素信号通路受阻很可能是糖尿病肾病发病的重要原因. 我们将进一步研究在糖尿病肾病中, 胰岛素抵抗发生的机制.
Duvnjak报道1型糖尿病、胰岛素抵抗与代谢综合征密切相关. 而长期胰岛素抵抗会发展为糖尿病肾病.
DN患者的尿蛋白量、RBF、GFR与HOMA-IR呈正相关, 与HOMA-ISI呈负相关, 与胰岛β细胞功能(HOMA-β%)呈负相关.
研究工作对糖尿病肾病的发病机理及相关因素提供了临床数据, 对糖尿病肾病的防治提供了诊疗检查指标.
HOMA-IR的增加和HOMA-ISI的降低以及胰岛素信号通路受阻很可能是1型糖尿病肾病发病的重要原因, 为1型糖尿病肾病的治疗提供了新的思路.
编辑: 田滢 电编:闫晋利
| 1. | LeBleu VS, Taduri G, O'Connell J, Teng Y, Cooke VG, Woda C, Sugimoto H, Kalluri R. Origin and function of myofibroblasts in kidney fibrosis. Nat Med. 2013;19:1047-1053. [PubMed] [DOI] |
| 2. | Thibodeau JF, Nasrallah R, Carter A, He Y, Touyz R, Hébert RL, Kennedy CR. PTGER1 deletion attenuates renal injury in diabetic mouse models. Am J Pathol. 2013;183:1789-1802. [PubMed] [DOI] |
| 3. | Tesch GH, Lim AK. Recent insights into diabetic renal injury from the db/db mouse model of type 2 diabetic nephropathy. Am J Physiol Renal Physiol. 2011;300:F301-F310. [PubMed] [DOI] |
| 4. | Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, Di Angelantonio E, Ingelsson E, Lawlor DA, Selvin E, Stampfer M. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010;375:2215-2222. [PubMed] [DOI] |
| 5. | Ghani AA, Al Waheeb S, Al Sahow A, Hussain N. Renal biopsy in patients with type 2 diabetes mellitus: indications and nature of the lesions. Ann Saudi Med. 2009;29:450-453. [PubMed] [DOI] |
| 6. | Zelmanovitz T, Gerchman F, Balthazar AP, Thomazelli FC, Matos JD, Canani LH. Diabetic nephropathy. Diabetol Metab Syndr. 2009;1:10. [PubMed] [DOI] |
| 7. | Lim AK, Tesch GH. Inflammation in diabetic nephropathy. Mediators Inflamm. 2012;2012:146154. [PubMed] [DOI] |
| 8. | Palm F, Cederberg J, Hansell P, Liss P, Carlsson PO. Reactive oxygen species cause diabetes-induced decrease in renal oxygen tension. Diabetologia. 2003;46:1153-1160. [PubMed] |
| 9. | 张 波, 刘 志红, 曾 彩虹. 糖尿病肾病合并非糖尿病肾脏病变的临床病理分析. 中华老年多器官疾病杂志. 2002;1:180-183. |
| 11. | 臧 丽, 母 义明, 吕 朝晖, 汪 保安, 窦 京涛, 陆 菊明, 潘 长玉. 人白血病相关蛋白16基因对3T3-L1脂肪细胞葡萄糖摄取及过氧化物酶体增殖物激活受体γ活性的影响. 中国糖尿病杂志. 2011;19:293-297. |
| 12. | Cartland SP, Erlich JH, Kavurma MM. TRAIL deficiency contributes to diabetic nephropathy in fat-fed ApoE-/- mice. PLoS One. 2014;9:e92952. [PubMed] [DOI] |
| 13. | Piwkowska A, Rogacka D, Angielski S, Jankowski M. Insulin stimulates glucose transport via protein kinase G type I alpha-dependent pathway in podocytes. Biochem Biophys Res Commun. 2014;446:328-334. [PubMed] [DOI] |
| 14. | Mallipattu SK, Gallagher EJ, LeRoith D, Liu R, Mehrotra A, Horne SJ, Chuang PY, Yang VW, He JC. Diabetic nephropathy in a nonobese mouse model of type 2 diabetes mellitus. Am J Physiol Renal Physiol. 2014;306:F1008-F1017. [PubMed] [DOI] |
| 15. | Nannapaneni S, Ramar K, Surani S. Effect of obstructive sleep apnea on type 2 diabetes mellitus: A comprehensive literature review. World J Diabetes. 2013;4:238-244. [PubMed] |
| 16. | Cherney DZ, Perkins BA, Soleymanlou N, Maione M, Lai V, Lee A, Fagan NM, Woerle HJ, Johansen OE, Broedl UC. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus. Circulation. 2014;129:587-597. [PubMed] [DOI] |
| 17. | Wali FA. Actions of polypeptides at the neuromuscular junction. Agents Actions. 1985;16:558-566. [PubMed] [DOI] |
| 18. | Tiwari S, Ndisang JF. The heme oxygenase system and type-1 diabetes. Curr Pharm Des. 2014;20:1328-1337. [PubMed] |
| 19. | Bahadoran Z, Mirmiran P, Azizi F. Dietary polyphenols as potential nutraceuticals in management of diabetes: a review. J Diabetes Metab Disord. 2013;12:43. [PubMed] [DOI] |
| 20. | Friedman AN, Chambers M, Kamendulis LM, Temmerman J. Short-term changes after a weight reduction intervention in advanced diabetic nephropathy. Clin J Am Soc Nephrol. 2013;8:1892-1898. [PubMed] [DOI] |
| 21. | Solini A, Menini S, Rossi C, Ricci C, Santini E, Blasetti Fantauzzi C, Iacobini C, Pugliese G. The purinergic 2X7 receptor participates in renal inflammation and injury induced by high-fat diet: possible role of NLRP3 inflammasome activation. J Pathol. 2013;231:342-353. [PubMed] [DOI] |
| 22. | Yang HY, Wu LY, Yeh WJ, Chen JR. Beneficial effects of β-conglycinin on renal function and nephrin expression in early streptozotocin-induced diabetic nephropathy rats. Br J Nutr. 2014;111:78-85. [PubMed] [DOI] |
| 23. | Kautzky-Willer A, Stich K, Hintersteiner J, Kautzky A, Kamyar MR, Saukel J, Johnson J, Lemmens-Gruber R. Sex-specific-differences in cardiometabolic risk in type 1 diabetes: a cross-sectional study. Cardiovasc Diabetol. 2013;12:78. [PubMed] [DOI] |
| 24. | Liu RT, Chung MS, Wang PW, Chen CD, Lee JJ, Lee WC, Chancellor MB, Yang KD, Chuang YC. The prevalence and predictors of androgen deficiency in Taiwanese men with type 2 diabetes. Urology. 2013;82:124-129. [PubMed] [DOI] |
| 25. | Kim JE, Lee MH, Nam DH, Song HK, Kang YS, Lee JE, Kim HW, Cha JJ, Hyun YY, Han SY. Celastrol, an NF-κB inhibitor, improves insulin resistance and attenuates renal injury in db/db mice. PLoS One. 2013;8:e62068. [PubMed] [DOI] |
| 26. | Tomino Y. Lessons From the KK-Ay Mouse, a Spontaneous Animal Model for the Treatment of Human Type 2 Diabetic Nephropathy. Nephrourol Mon. 2012;4:524-529. [PubMed] [DOI] |
| 27. | Duvnjak L, Kokić V, Bulum T, Kokić S, Krnić M, Hozo IS. The metabolic syndrome is associated with high-normal urinary albumin excretion and retinopathy in normoalbuminuric type 1 diabetic patients. Coll Antropol. 2012;36:1373-1378. [PubMed] |
| 28. | de Souza CG, Sattler JA, de Assis AM, Rech A, Perry ML, Souza DO. Metabolic effects of sulforaphane oral treatment in streptozotocin-diabetic rats. J Med Food. 2012;15:795-801. [PubMed] [DOI] |
| 29. | Gandhi S, Srinivasan B, Akarte AS. Aliskiren improves insulin resistance and ameliorates diabetic renal vascular complications in STZ-induced diabetic rats. J Renin Angiotensin Aldosterone Syst. 2013;14:3-13. [PubMed] [DOI] |
| 30. | Smyth DD, Polimeni PI. Drag-reducing polymers: a novel class of diuretic and natriuretic compounds. Cardiovasc Drugs Ther. 1990;4:297-300. [PubMed] |
| 31. | Kuang QT, Zhao JJ, Ye CL, Wang JR, Ye KH, Zhang XQ, Wang Y, Ye WC. [Nephro-protective effects of total triterpenoids from Psidium guajava leaves on type 2 diabetic rats]. Zhongyaocai. 2012;35:94-97. [PubMed] |