修回日期: 2014-07-21
接受日期: 2014-07-31
在线出版日期: 2014-09-18
目的: 本文旨在探讨新辅助放化疗与手术之间的时间间隔是否影响ⅢA、ⅢB期直肠癌患者的病理完全缓解率(pathologic complete response, pCR)、无病生存率(disease-free survival, DFS)、复发率及总体生存率(overall survival, OS).
方法: 我们回顾性地分析了2009-03/2011-03就诊于新疆医科大学附属肿瘤医院经病理诊断为直肠癌并顺利完成了新辅助放化疗和之后的全直肠系膜切除术(total mesorectal excision, TME)的93例ⅢA、ⅢB期直肠癌患者. 根据时间间隔的不同将这些患者分为两组: ≤7 wk(A组)(n = 49), >7 wk (B组)(n = 44). 研究的主要终点为病理完全缓解率、无病生存率、复发率及总体生存率, 次要终点为手术方式、术后并发症、手术时间及住院时间.
结果: 全部患者病理完全缓解率为10.75%(pCR: A组 vs B组, 8.2% vs 13.6%, P = 0.027), 3年无病生存率为39.8%(DFS: A组 vs B组, 28.6% vs 52.3%, P = 0.013), 复发率(A组 vs B组, 20.4% vs 4.5%, P = 0.023). 两组患者的总体生存率、手术方式、术后并发症、手术时间及住院时间无显著差异.
结论: 对于ⅢA、ⅢB期直肠癌, 新辅助放化疗与手术之间一个>7 wk的时间间隔可明显提高患者的病理完全缓解率和无病生存率, 降低局部复发率且不影响手术方式、术后并发症、手术时间、住院时间及肿瘤结局.
核心提示: 本研究以新辅助放化疗与手术之间的时间间隔7 wk为界限将患者分为两组, 结果显示: >7 wk组的病理完全缓解率、无病生存率明显高于≤7 wk组, 且两组的术后并发症及肿瘤结局无显著差异.
引文著录: 田含含, 王海峰, 张瑾熔, 阿衣古丽·哈热, 伊斯刊达尔·阿布力米提. 术前放化疗与手术时间间隔对ⅢA、ⅢB期直肠癌的影响. 世界华人消化杂志 2014; 22(26): 3918-3924
Revised: July 21, 2014
Accepted: July 31, 2014
Published online: September 18, 2014
AIM: To assess whether the time interval between neoadjuvant chemoradiotherapy and surgery affects the pathologic complete response (pCR) rate, disease-free survival (DFS), disease recurrence and overall survival (OS) in patients with stage ⅢA and ⅢB rectal cancer.
METHODS: We retrospectively studied 93 patients diagnosed with stage ⅢA and ⅢB rectal cancer by pathological examination who underwent neoadjuvant therapy followed by total mesorectal excision (TME) between March 2009 and March 2011 at our hospital. They were divided into two groups according to the interval between neoadjuvant therapy and surgery: A (≤7 wk, n = 49) and B (>7 wk, n = 44). The primary endpoints were reported as pCR rate, DFS, disease recurrence and OS. Secondary endpoints were type of surgery, postoperative complications, operative time and length of hospital stay.
RESULTS: The overall pCR rate was 10.75% (pCR: group A vs group B, 8.2% vs 13.6%; P = 0.027), and the overall 3-year DFS was 39.8% (DFS: group A vs group B, 28.6% vs 52.3%; P = 0.013). Disease recurrence was 20.4% in group A vs 4.5% in group B (P = 0.023). There were no significant differences in OS, type of surgery, postoperative complications, operative time or length of hospital stay between the two groups.
CONCLUSION: A neoadjuvant-surgery interval > 7 wk increases the rates of pCR and DFS and decreases disease recurrence in patients with stage ⅢA and ⅢB rectal cancer, with no effect on type of surgery, postoperative complications, operative time, length of hospital stay or oncologic outcome.
- Citation: Tian HH, Wang HF, Zhang JR, Ayiguli·Hare, Yisikandaer·Abulimiti. Impact of interval between preoperative chemotherapy and surgery on therapeutic effects in patients with stage ⅢA and ⅢB rectal cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(26): 3918-3924
- URL: https://www.wjgnet.com/1009-3079/full/v22/i26/3918.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i26.3918
直肠癌是我国目前较常见的恶性肿瘤之一, 且发病率呈逐年上升趋势, 直肠癌早期无明显症状, 确诊时大多为中晚期, 其中约3/4为中低位直肠癌[1]. 外科手术切除是根治直肠癌的唯一治疗手段, 中晚期直肠癌单纯手术治疗切除率较低且术后复发率较高, 据相关文献报道复发率约30%左右[2]. 术前辅助放化疗可使肿瘤缩小, 达到肿瘤降期、减少局部复发及提高手术切除率等目的. 目前对于可切除的局部中晚期直肠癌, 新辅助放化疗(neoadjuvant chemoradiotherapy, nCRT)联合全直肠系膜切除术(total mesorectal excision, TME)是标准的治疗方案[3], 他可以提高手术切除率、减少局部复发及改善无病生存率. 但对于新辅助放化疗与手术之间的时间间隔仍有待探讨, 传统的方法是6-8 wk[4]. 也有研究表明[5,6], 较长的时间间隔有助于提高病理完全缓解率和无病生存率. 新疆医科大学附属肿瘤医院新辅助放化疗与手术间隔一般在6 wk, 基于上述文献研究结果并结合新疆医科大学附属肿瘤医院实际, 本研究对时间间隔稍作延长并取传统时间间隔的中间状态7 wk作为界限. 本研究重点探讨: >7 wk的时间间隔是否影响患者的病理完全缓解率(pathologic complete response, pCR)、无病生存率(disease-free survival, DFS)、复发率及肿瘤结局.
我们回顾性地分析了2009-03/2011-03就诊于新疆医科大学附属肿瘤医院并顺利完成了新辅助放化疗和手术的93例ⅢA、ⅢB期直肠癌患者, 男60例, 女33例, 平均年龄55.4岁±5.1岁; 肿瘤下缘距肛缘平均距离4.0 cm±1.4 cm; 以上病例均经电子计算机X射线断层扫描技术(computerized tomography, CT)、磁共振成像(magnetic resonance imaging, MRI)、肠镜及病理活检检查明确诊断为直肠癌. 术前放化疗及手术治疗均经患者及家属同意并签署相关治疗同意书. 将这些患者根据新辅助放化疗和手术之间的时间间隔分为两组: ≤7 wk进行手术(A组), >7 wk进行手术(B组). 两组患者的基线状况一致, 差异无统计学意义(P>0.05)(表1).
| 特征 | A组时间间隔≤7 wk | B组时间间隔>7 wk | P值 |
| n | 49 | 44 | |
| 平均年龄(岁) | 56.2±6.3 | 54.6±4.4 | 0.506 |
| 性别[n(%)] | 0.867 | ||
| 男 | 32(65) | 28(64) | |
| 女 | 17(35) | 16(36) | |
| 下缘距肛缘平均距离(cm) | 4.1±1.2 | 4.0±1.7 | 0.566 |
| 平均体质量指数(kg/m2) | 24.0±1.4 | 23.5±2.1 | 0.283 |
| 术后化疗[n(%)] | 44(90) | 39(89) | 0.857 |
| 中位随访时间(mo) | 36.64 | 36.59 | 0.932 |
| 病理类型[n(%)] | 0.413 | ||
| 高分化腺癌 | 9(18.4) | 8(18.2) | |
| 中分化腺癌 | 28(57.1) | 30(68.2) | |
| 低分化腺癌 | 3(6.1) | 3(6.8) | |
| 黏液腺癌 | 9(18.4) | 3(6.8) | |
| CT分级[n(%)] | 0.430 | ||
| 2 | 3(6) | 3(7) | |
| 3 | 10(20) | 14(32) | |
| 4 | 36(74) | 27(61) | |
| CN分级[n(%)] | 0.957 | ||
| 1 | 27(55) | 24(54.5) | |
| 2 | 22(45) | 20(45.5) | |
| 临床分期1[n(%)] | 0.868 | ||
| ⅢA期 | 27(55.1) | 25(56.8) | |
| ⅢB期 | 22(44.9) | 19(43.2) |
1.2.1 nCRT: (1)放疗: 所有患者均采用三维适形调强放疗技术, 应用23EX或600CD直线加速器5-7野进行术前放疗, 2 Gy/次、5次/wk, 总剂量50 Gy/25 f; 肉眼肿瘤靶区(gross tumor volume, GTV)包括直肠肿瘤和周围筋膜内组织及转移的淋巴结, 临床靶区(clinical target volume, CTV)包括直肠肿瘤、直肠系膜区、肠周淋巴结、骶前区、髂内淋巴结、盆壁区, 计划靶区(planning target volume, PTV)为CTV外扩0.5-1.0 cm. 靶区上界在L5-S1椎体间, 下界至闭孔下缘或肛门边缘. 95%等剂量曲线包括PTV, 危及器官(organs at risk, OARs)剂量限定为双侧股骨头V50<5%、膀胱V30<50%、小肠V50<5%; (2)同步化疗: 根据《当代肿瘤内科治疗方案评价(第二版)》[7], 卡培他滨联合奥沙利铂作为局部晚期直肠癌患者的一线治疗, 总有效率可达到55%, 1年生存率为72%, 较少有Ⅲ、Ⅳ度毒性, 安全性好. 也有文献报道, 术前卡培他滨联合奥沙利铂同步放化疗后达pCR者预后好, 降期明显者预后好[8]. 所有患者均采用XELOX方案(卡培他滨1000 mg/m2bid d1-14、d22-35+奥沙利铂 130 mg/m2 d1、d22)化疗. 放化疗期间定期复查血常规、肝肾电, 60%的患者出现不同程度的不良反应, 包括胃肠道反应、骨髓抑制、肝功能异常等, 其中90%为轻度不良反应, 给予对症处理后缓解而不影响放化疗, 10%为Ⅲ度及Ⅳ度不良反应, 此时暂停放化疗, 对症处理好转后继续行放化疗. 无一例因不良反应而终止治疗.
1.2.2 TME: 新辅助放化疗结束后93例患者均在全麻下行全直肠系膜切除术, 手术方式包括低位或超低位经腹前切除术(low anterior resection, LAR)和腹会阴联合切除术(abdominoperineal resection, APR). 其中LAR术43例, A组21例, B组22例; APR术50例, A组28例, B组22例.
1.2.3 疗效评价: pCR评价标准: 由2名有经验的病理科医师根据美国癌症委员会病理肿瘤分期指南对切除的肿瘤标本进行评估[9], pCR被定义为肿瘤完全消退, 仅见纤维组织, 反之为非pCR. 术后所有患者均每3 mo进行一次随访, 通过直肠指诊、CT扫描、电子肠镜及癌胚抗原(carcinoembryonic antigen, CEA)等方法来判断肿瘤的复发及转移. 根据美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)《直肠癌临床实践指南(中国版)》(2009, 第一版)[10], 患者术后常规给予4-6 wk辅助化疗.
1.2.4 研究终点: 主要终点为pCR率, DFS, 复发率及总体生存率(overall survival, OS), 次要终点为手术方式、术后并发症、手术时间及住院时间.
统计学处理 采用SPSS17.0软件行Kaplan-Meier法进行生存分析、Logistic回归行多因素分析、余组间比较行χ2检验. P<0.05为差异有统计学意义.
A组患者LAR术21例(43%)、APR术28例(57%), B组患者LAR术22例(50%)、APR术22例(50%)(P = 0.490); A组患者19例(39%)行术中输血, B组患者18例(41%)行术中输血(P = 0.834); A组共11例(22%)患者发生术后并发症, 其中吻合口瘘3例、切口感染4例、泌尿系感染2例、肺部感染2例, B组共11例(25%)患者发生术后并发症, 其中吻合口瘘2例、切口感染5例、泌尿系感染3例、肺部感染1例(P = 0.773); 两组患者的手术时间和术后住院时间均未见显著统计学差异(表2). 两组均无围手术期死亡的发生.
| 项目 | A组时间间隔≤7 wk | B组时间间隔>7 wk | P值 |
| n | 49 | 44 | |
| 手术方式[n(%)] | 0.490 | ||
| LAR | 21(43) | 22(50) | |
| APR | 28(57) | 22(50) | |
| 术后并发症[n(%)] | 11(22) | 11(25) | 0.773 |
| 术中输血[n(%)] | 19(39) | 18(41) | 0.834 |
| 平均住院时间(d) | 11.9±3.2 | 11.9±3.1 | 0.950 |
| 平均手术时间(min) | 220.0±14.6 | 222.7±15.8 | 0.608 |
共10例(10.75%)患者达到pCR, 其中A组4例(8.2%)、B组6例(13.6%). 年龄、性别、时间间隔、病理类型、临床分期等5个参数进入单因素和多因素分析, 结果显示时间间隔是pCR的唯一独立预测因素(表3).
| 影响因素 | B | S.E. | Wals | Sig. | Exp(B) | EXP(B)的95%CI | |
| 下限 | 上限 | ||||||
| 性别 | 0.578 | 0.619 | 0.870 | 0.351 | 1.782 | 0.529 | 5.996 |
| 年龄 | 0.011 | 0.024 | 0.201 | 0.654 | 1.011 | 0.964 | 1.060 |
| 病理类型 | 0.000 | 0.000 | 1.930 | 0.587 | 0.000 | 0.000 | 0.000 |
| 高分化腺癌 | -1.427 | 1.230 | 1.347 | 0.246 | 0.240 | 0.022 | 2.673 |
| 中分化腺癌 | -0.664 | 1.154 | 0.331 | 0.565 | 0.515 | 0.054 | 4.944 |
| 低分化腺癌 | -0.708 | 1.639 | 0.187 | 0.665 | 0.492 | 0.020 | 12.219 |
| 黏液腺癌 | -0.743 | 1.562 | 0.112 | 0.702 | 0.387 | 0.046 | 7.384 |
| 临床分期 | -0.798 | 0.590 | 1.826 | 0.177 | 0.450 | 0.142 | 1.433 |
| 时间间隔 | -1.343 | 0.607 | 4.902 | 0.027 | 0.261 | 0.080 | 0.857 |
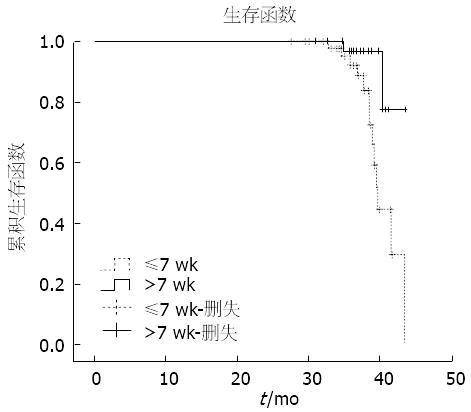
中位随访时间(A组 vs B组, 36.64 mo vs 36.59 mo, P = 0.932). 共41例(44.1%)发生复发或转移, A组26例(53%)、B组15例(34%)(P = 0.066); 15例(16.1%)死亡, A组9例(18.4%)、B组6例(13.6%)(P = 0.536)(表4). 我们将影响两组无病生存率和总生存率的潜在影响因素: 年龄、性别、手术方式、临床分期、时间间隔、术后辅助化疗等6个参数纳入单因素及多因素分析, 结果显示时间间隔是DFS的唯一独立预测因素, 新辅助放化疗7 wk后进行手术会明显改善患者的无病生存率, 两组差异具有显著统计学意义(P = 0.013)(图1), 两组患者的总生存率未见明显统计学差异(P = 0.082).
| 结果 | A组时间间隔≤7 wk | B组时间间隔>7 wk | P值 |
| n | 49 | 44 | |
| 局部复发 | 10(20.4) | 2(4.5) | 0.023 |
| 转移 | 15(30.6) | 12(27.3) | 0.723 |
| 局部复发+转移 | 1(2) | 1(2.3) | 1.000 |
| 总发生率 | 26(53) | 15(34) | 0.066 |
| 死亡 | 9(18.4) | 6(13.6) | 0.536 |
新辅助放化疗是局部中晚期直肠癌初期治疗的标准疗法, 与术后辅助治疗相比, 他能显著提高病理完全缓解率, 减少局部复发率, 改善无病生存率, 可以减少长期和短期不良反应[11-16]. 传统上, 我们通常在完成nCRT后6-8 wk进行手术, 但时间间隔常受一些因素的影响, 如患者的耐受情况及患者的选择等. 尽管我们通过不断的改变放化疗方案来改善肿瘤反应, 但对肿瘤的结局仍无影响[17-21]. de Campos-Lobato等[22]的相关研究表明延长新辅助放化疗与手术之间的时间间隔是获得pCR的独立预测因素. Kalady等[23]的研究也证明了上述结论. Tulchinsky等[5]小样本、短期随访研究也表明: >7 wk的时间间隔可以获得高pCR率并且改善DFS. Moore等[24]相关研究认为较长的时间间隔会增加术区黏连、组织脆性、组织纤维化、临近组织肿胀使手术增难等, 从而导致吻合口瘘频繁发生和盆腔脓肿等并发症的增加, 而de Campos-Lobato等[22]的研究则证明了两组在吻合口瘘、盆腔脓肿、其他并发症及再入院率上无显著统计学差异[4,22,25-30].
目前对于新辅助放化疗与手术之间的时间间隔无统一标准, 尚存争议. 延长新辅助放化疗与手术之间的时间间隔可以提高肿瘤反应, 这是由于射线和化疗药物所诱导的肿瘤坏死是一个时间依赖的过程[31-33], 因此, 选择一个最佳的时间再评估肿瘤临床和影像学去优化肿瘤降期及缩小从而选择最佳手术时间是十分重要的[27,32]. 我们的研究显示, >7 wk的时间间隔对于患者是安全的, 他可以提高患者的pCR率、改善DFS、降低局部复发率而不影响术后并发症及肿瘤结局, 这和Tulchinsky等[5]与de Campos-Lobato等[22]的研究结论一致. 由于本研究是回顾性研究且样本量较小, 没有预期的设计和匹配, 可能存在潜在的偏倚和限制, 上述结论有待前瞻性研究进一步证实.
总之, 本研究证明了新辅助放化疗与手术之间一个>7 wk的时间间隔对于术中和术后并发症及肿瘤结局无消极影响, 且能改善局部控制. 虽然, 通过一项前瞻性、大样本、多中心的随机临床试验来更好的定义nCRT与手术之间最佳的时间间隔是必要的, 但我们推荐的时间间隔是>7 wk.
直肠癌是我国较常见的恶性肿瘤之一, 确诊时大多为中晚期. 目前新辅助放化疗联合全直肠系膜切除术对于可切除的局部中晚期直肠癌是标准的治疗方案.
肖秀英, 副主任医师, 上海交通大学医学院附属仁济医院
本研究表明新辅助放化疗与手术之间一个>7 wk的时间间隔可提高患者的病理完全缓解率、改善无病生存率、降低局部复发率而不影响术后并发症及肿瘤结局. 这对于临床有一定的指导意义, 但上述结论有待大样本、前瞻性研究进一步证实.
近年来, 国外关于直肠癌新辅助放化疗与手术时间间隔的研究报道, 但数目较少, 相关研究表明: 延长时间间隔可以获得高病理完全缓解率和改善无病生存率.
本研究是针对ⅢA、ⅢB期直肠癌的研究, 在病理完全缓解率、无病生存率、复发率、总体生存率、手术方式、术后并发症、手术时间及住院时间等方面做了较全面的分析比较, 是在国内较早的相关研究, 对于局部中晚期直肠癌有一定的临床指导意义.
本研究对于直肠癌新辅助放化疗后的手术时间选择有一定的参考价值, 可在一定程度上为大样本的前瞻性研究提供依据.
本文简明而有特色, 科学结论较明确, 实验证据充足. 文章的科学性、创新性和可读性能较好地反映我国结直肠癌临床和基础研究的先进水平.
编辑: 郭鹏 电编:闫晋利
| 2. | Tveit KM, Wiig JN, Olsen DR, Storaas A, Poulsen JP, Giercksky KE. Combined modality treatment including intraoperative radiotherapy in locally advanced and recurrent rectal cancer. Radiother Oncol. 1997;44:277-282. [PubMed] [DOI] |
| 3. | 杨 咏强, 冯 林春, 贾 宝庆, 曲 宝林, 马 林, 刘 洪一, 王 运来, 葛 瑞刚, 陈 静, 蓝 玉玲. 局部中晚期直肠癌术前同期加量调强放疗前瞻性临床研究的初步结果. 中华放射医学与防护杂志. 2013;33:512-515. |
| 4. | Francois Y, Nemoz CJ, Baulieux J, Vignal J, Grandjean JP, Partensky C, Souquet JC, Adeleine P, Gerard JP. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial. J Clin Oncol. 1999;17:2396. [PubMed] |
| 5. | Tulchinsky H, Shmueli E, Figer A, Klausner JM, Rabau M. An interval > 7 weeks between neoadjuvant therapy and surgery improves pathologic complete response and disease-free survival in patients with locally advanced rectal cancer. Ann Surg Oncol. 2008;15:2661-2667. [PubMed] [DOI] |
| 6. | Wolthuis AM, Penninckx F, Haustermans K, De Hertogh G, Fieuws S, Van Cutsem E, D'Hoore A. Impact of interval between neoadjuvant chemoradiotherapy and TME for locally advanced rectal cancer on pathologic response and oncologic outcome. Ann Surg Oncol. 2012;19:2833-2841. [PubMed] [DOI] |
| 8. | 金 晶, 任 骅, 李 晔雄, 王 淑莲, 王 维虎, 宋 永文, 刘 跃平, 房 辉, 刘 新帆, 余 子豪. Ⅱ/Ⅲ期直肠癌术前同步放化疗加根治术的毒性和疗效分析. 第七届泛珠江区域放射肿瘤学学术大会. 2012;. |
| 9. | Greene FL, Page DL, Fleming ID, Fritz A, Balch CM, Haller DG, Morrow M, eds . American Joint Committee on Cancer: AJCC Cancer Staging Manual. 6th ed, New York, NY, USA: Springer 2002; 157-164. |
| 10. | 孙 燕, 万 德森, 李 进, 蔡 三军, 徐 瑞华. NCCN直肠癌临床实践指南(中国版). 第1版. 2010;REC-3. |
| 11. | Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, Martus P, Tschmelitsch J, Hager E, Hess CF. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351:1731-1740. [PubMed] [DOI] |
| 12. | Maas M, Nelemans PJ, Valentini V, Das P, Rödel C, Kuo LJ, Calvo FA, García-Aguilar J, Glynne-Jones R, Haustermans K. Long-term outcome in patients with a pathological complete response after chemoradiation for rectal cancer: a pooled analysis of individual patient data. Lancet Oncol. 2010;11:835-844. [PubMed] [DOI] |
| 13. | Martin ST, Heneghan HM, Winter DC. Systematic review and meta-analysis of outcomes following pathological complete response to neoadjuvant chemoradiotherapy for rectal cancer. Br J Surg. 2012;99:918-928. [PubMed] [DOI] |
| 14. | Dahlberg M, Glimelius B, Påhlman L. Improved survival and reduction in local failure rates after preoperative radiotherapy: evidence for the generalizability of the results of Swedish Rectal Cancer Trial. Ann Surg. 1999;229:493-497. [PubMed] |
| 15. | Zorcolo L, Rosman AS, Restivo A, Pisano M, Nigri GR, Fancellu A, Melis M. Complete pathologic response after combined modality treatment for rectal cancer and long-term survival: a meta-analysis. Ann Surg Oncol. 2012;19:2822-2832. [PubMed] [DOI] |
| 16. | Mohiuddin M, Winter K, Mitchell E, Hanna N, Yuen A, Nichols C, Shane R, Hayostek C, Willett C. Randomized phase II study of neoadjuvant combined-modality chemoradiation for distal rectal cancer: Radiation Therapy Oncology Group Trial 0012. J Clin Oncol. 2006;24:650-655. [PubMed] [DOI] |
| 17. | Bosset JF, Nguyen F, Bosset M, Servagi-Vernat S, Schipman B. Recent advances in the treatment of localized rectal cancer. Curr Oncol Rep. 2008;10:220-224. [PubMed] |
| 18. | Chau I, Brown G, Cunningham D, Tait D, Wotherspoon A, Norman AR, Tebbutt N, Hill M, Ross PJ, Massey A. Neoadjuvant capecitabine and oxaliplatin followed by synchronous chemoradiation and total mesorectal excision in magnetic resonance imaging-defined poor-risk rectal cancer. J Clin Oncol. 2006;24:668-674. [PubMed] [DOI] |
| 19. | Lawson JD, Kauh J, Koshy M, Staley C, Landry J. Early clinical results from chemoradiation with 5-fluorouracil and oxaliplatin for locally advanced rectal cancer. Clin Colorectal Cancer. 2008;7:325-330. [PubMed] [DOI] |
| 20. | Carlomagno C, Farella A, Bucci L, D'Armiento FP, Pesce G, Pepe S, Cannella L, Pacelli R, De Stefano A, Solla R. Neo-adjuvant treatment of rectal cancer with capecitabine and oxaliplatin in combination with radiotherapy: a phase II study. Ann Oncol. 2009;20:906-912. [PubMed] [DOI] |
| 21. | Rosenthal DI, Catalano PJ, Haller DG, Landry JC, Sigurdson ER, Spitz FR, Benson AB. Phase I study of preoperative radiation therapy with concurrent infusional 5-fluorouracil and oxaliplatin followed by surgery and postoperative 5-fluorouracil plus leucovorin for T3/T4 rectal adenocarcinoma: ECOG E1297. Int J Radiat Oncol Biol Phys. 2008;72:108-113. [PubMed] [DOI] |
| 22. | de Campos-Lobato LF, Geisler DP, da Luz Moreira A, Stocchi L, Dietz D, Kalady MF. Neoadjuvant therapy for rectal cancer: the impact of longer interval between chemoradiation and surgery. J Gastrointest Surg. 2011;15:444-450. [PubMed] [DOI] |
| 23. | Kalady MF, de Campos-Lobato LF, Stocchi L, Geisler DP, Dietz D, Lavery IC, Fazio VW. Predictive factors of pathologic complete response after neoadjuvant chemoradiation for rectal cancer. Ann Surg. 2009;250:582-589. [PubMed] [DOI] |
| 24. | Moore HG, Gittleman AE, Minsky BD, Wong D, Paty PB, Weiser M, Temple L, Saltz L, Shia J, Guillem JG. Rate of pathologic complete response with increased interval between preoperative combined modality therapy and rectal cancer resection. Dis Colon Rectum. 2004;47:279-286. [PubMed] [DOI] |
| 25. | Stein DE, Mahmoud NN, Anné PR, Rose DG, Isenberg GA, Goldstein SD, Mitchell E, Fry RD. Longer time interval between completion of neoadjuvant chemoradiation and surgical resection does not improve downstaging of rectal carcinoma. Dis Colon Rectum. 2003;46:448-453. [PubMed] |
| 26. | Kerr SF, Norton S, Glynne-Jones R. Delaying surgery after neoadjuvant chemoradiotherapy for rectal cancer may reduce postoperative morbidity without compromising prognosis. Br J Surg. 2008;95:1534-1540. [PubMed] [DOI] |
| 27. | Tran CL, Udani S, Holt A, Arnell T, Kumar R, Stamos MJ. Evaluation of safety of increased time interval between chemoradiation and resection for rectal cancer. Am J Surg. 2006;192:873-877. [PubMed] [DOI] |
| 28. | Veenhof AA, Kropman RH, Engel AF, Craanen ME, Meijer S, Meijer OW, van der Peet DL, Cuesta MA. Preoperative radiation therapy for locally advanced rectal cancer: a comparison between two different time intervals to surgery. Int J Colorectal Dis. 2007;22:507-513. [PubMed] |
| 29. | Lim SB, Choi HS, Jeong SY, Kim DY, Jung KH, Hong YS, Chang HJ, Park JG. Optimal surgery time after preoperative chemoradiotherapy for locally advanced rectal cancers. Ann Surg. 2008;248:243-251. [PubMed] [DOI] |
| 30. | Garcia-Aguilar J, Smith DD, Avila K, Bergsland EK, Chu P, Krieg RM. Optimal timing of surgery after chemoradiation for advanced rectal cancer: preliminary results of a multicenter, nonrandomized phase II prospective trial. Ann Surg. 2011;254:97-102. [PubMed] [DOI] |
| 31. | Berger C, de Muret A, Garaud P, Chapet S, Bourlier P, Reynaud-Bougnoux A, Dorval E, de Calan L, Huten N, le Folch O. Preoperative radiotherapy (RT) for rectal cancer: predictive factors of tumor downstaging and residual tumor cell density (RTCD): prognostic implications. Int J Radiat Oncol Biol Phys. 1997;37:619-627. [PubMed] |
| 32. | Dhadda AS, Zaitoun AM, Bessell EM. Regression of rectal cancer with radiotherapy with or without concurrent capecitabine--optimising the timing of surgical resection. Clin Oncol (R Coll Radiol). 2009;21:23-31. [PubMed] [DOI] |
| 33. | Horn A, Morild I, Dahl O. Tumour shrinkage and down staging after preoperative radiation of rectal adenocarcinomas. Radiother Oncol. 1990;18:19-28. [PubMed] |