修回日期: 2014-07-03
接受日期: 2014-07-15
在线出版日期: 2014-09-08
目的: 探讨三维重建技术联合超声乳化吸引(cavitron ultrasonic surgical aspirator, CUSA)刀施行肝切除术的临床疗效.
方法: 收集2009-01/2012-12在广州医科大学附属第二医院肝胆外科接受手术治疗的53例临床资料, 所有病例均经病理学确诊为原发性肝细胞肝癌. A组27例, 为术前进行肝脏肿瘤的三维重建, 术中应用CUSA刀施行肝切除术; B组26例, 为常规开腹肝切除术, 比较两组的治疗效果.
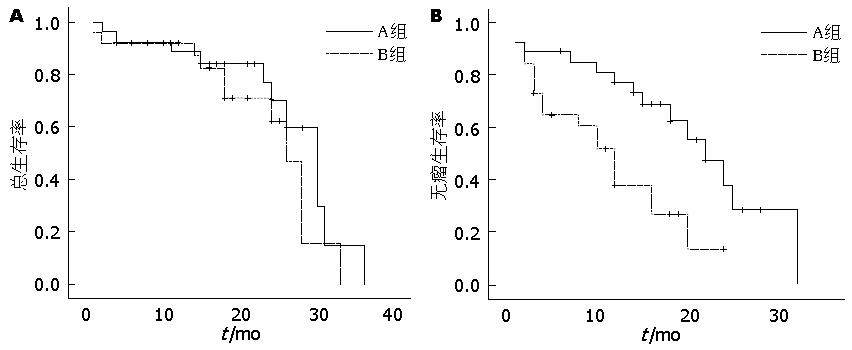
结果: 在入肝血流(第一肝门)阻断时间(7.4 min±5.6 min vs 18.3 min±7.6 min, P<0.05)、术中失血量(出血量>1 L者, 18.5% vs 46.1%, P<0.05)和术中输血方面(术中有输血者, 22.2% vs 50.0%, P<0.05), A组显著低于于B组. 此外, 两组总生存率比较无统计学意义(χ2 = 1.165, P>0.05); 而A组无瘤生存率为48.1%, B组为30.8%, 经Log-rank检验, A组的无瘤生存率显著高于B组(χ2 = 7.122, P<0.05).
结论: 三维重建技术联合CUSA刀行肝切除术具有相当高地临床疗效, 值得临床应用和推广.
核心提示: 三维重建技术联合超声乳化吸引(cavitron ultrasonic surgical aspirator)刀施行肝切除术能够缩短入肝血流阻断时间, 减少术中失血量和术中输血, 提高患者的无瘤生存率. 为临床开展肝切除手术提供参考和依据, 值得临床应用和推广.
引文著录: 曹良启, 邵子力, 张大伟, 宋笑冬, 梁惠宏, 薛平. 三维重建技术联合CUSA刀施行肝切除术的临床疗效. 世界华人消化杂志 2014; 22(25): 3843-3848
Revised: July 3, 2014
Accepted: July 15, 2014
Published online: September 8, 2014
AIM: To assess the clinical efficacy of three-dimensional reconstructive technique combined with cavitron ultrasonic surgical aspirator (CUSA) to perform hepatectomy.
METHODS: Fifty-three patients with pathologically confirmed hepatocellular carcinoma (HCC) who underwent hepatectomy from January 2009 to December 2012 at our hospital were divided into two groups: A and B. In group A (n = 27), hepatectomy was performed using preoperative three-dimensional reconstructive technique and CUSA during operation, while group B (n = 26) received traditional hepatectomy. Their clinical efficiency and safety were compared between the two groups.
RESULTS: The tolerance limit of hepatic inflow occlusion (the first porta hepatis) (7.4 min ± 5.6 min vs 18.3 min ± 7.6 min, P < 0.05), operative blood loss (>1 L, 18.5% vs 46.1% , P < 0.05) and blood transfusion (22.2% vs 50.0%, P < 0.05) in group A were significantly less than those in group B (P < 0.05). Moreover, cumulative survival rate showed no significant difference between the two groups (χ2 = 1.165, P > 0.05). Tumor-free survival rate in group A (48.1%) was significantly higher than that in group B (30.8%) (χ2 = 7.122, P < 0.05).
CONCLUSION: Hepatectomy performed using three-dimensional reconstructive technique plus CUSA is safe and effective.
- Citation: Cao LQ, Shao ZL, Zhang DW, Song XD, Liang HH, Xue P. Clinical efficacy of three-dimensional reconstructive technique combined with cavitron ultrasonic surgical aspirator to perform hepatectomy. Shijie Huaren Xiaohua Zazhi 2014; 22(25): 3843-3848
- URL: https://www.wjgnet.com/1009-3079/full/v22/i25/3843.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i25.3843
肝细胞癌(hepatocellular carcinoma, HCC)是我国常见的恶性肿瘤之一. 具有恶性程度高、病情发展快、治疗效果差、发病率高等特点. 在我国, HCC年死亡率占肿瘤死亡率的第2位, 就世界范围内而言, 其发病率呈上升趋势[1]. 肝切除仍然是HCC根治治疗的主要手段. 三维重建技术是根据肝脏的薄层计算机断层扫描(computed tomography, CT)(层厚1 mm)扫描资料, 自动分割正常肝脏和病变区域进行处理, 可以计算出肿瘤的体积, 剩余肝的体积, 手术切缘, 可以发现病灶与血管、胆管的关系, 给手术者一个三维立体模拟图像[2]. 随着医疗器械在外科手术中发展, 超声乳化吸引(cavitron ultrasonic surgical aspirator, CUSA)刀应用于肝切除术中得以广泛应用[3]. 配合计算机辅助三维重建系统可以进行肝肿瘤的准确定位, 确定手术切除范围, 大大降低了手术的难度[4,5]. 本研究回顾性分析了2009-01/2012-12在广州医科大学附属第二医院肝胆外科接受三维重建联合CUSA刀和常规开腹HCC手术患者的临床资料, 旨在分析两种手段的近远期临床疗效.
收集2009-01/2012-12在广州医科大学附属第二医院肝胆外科接受手术治疗的53例临床资料, 所有病例均经病理学确诊为原发性肝细胞HCC. A组27例, 为术前进行肝脏肿瘤的三维重建, 术中应用CUSA刀施行肝切除术, 男18例, 女7例, 年龄33-87岁, 平均年龄54.2岁±14.6岁; B组26例, 为常规开腹肝切除术, 术中使用普通电刀, 其中男17例, 女9例, 年龄37-82岁, 平均年龄53.8岁±12.1岁(P>0.05). 回顾性分析两组各临床资料(表1).
| 临床参数 | A组 | B组 | χ2值 | P值 |
| n | 27 | 26 | ||
| 性别(男/女) | 18/9 | 17/9 | 0.010 | 0.922 |
| HBsAg(有/无) | 23/4 | 21/5 | 0.183 | 0.669 |
| 肝硬化(有/无) | 25/2 | 23/3 | 0.265 | 0.607 |
| 术前肝功能Child-Pugh(A/B) | 23/4 | 24/2 | 0.669 | 0.413 |
| AFP(≤400/>400 μg/L) | 8/19 | 9/17 | 0.151 | 0.697 |
| 肿瘤大小(≤5 cm/>5 cm) | 6/21 | 7/19 | 0.158 | 0.691 |
| 肝内转移(有/无) | 3/24 | 3/23 | 0.002 | 0.961 |
| 血管侵犯(有/无) | 2/25 | 3/23 | 0.265 | 0.607 |
| 包膜完整(是/否) | 9/18 | 10/16 | 0.151 | 0.697 |
| 邻近脏器侵犯(有/无) | 2/25 | 4/22 | 0.840 | 0.360 |
| 组织学分级1(Ⅰ+Ⅱ/Ⅲ+Ⅳ) | 4/23 | 7/19 | 1.181 | 0.277 |
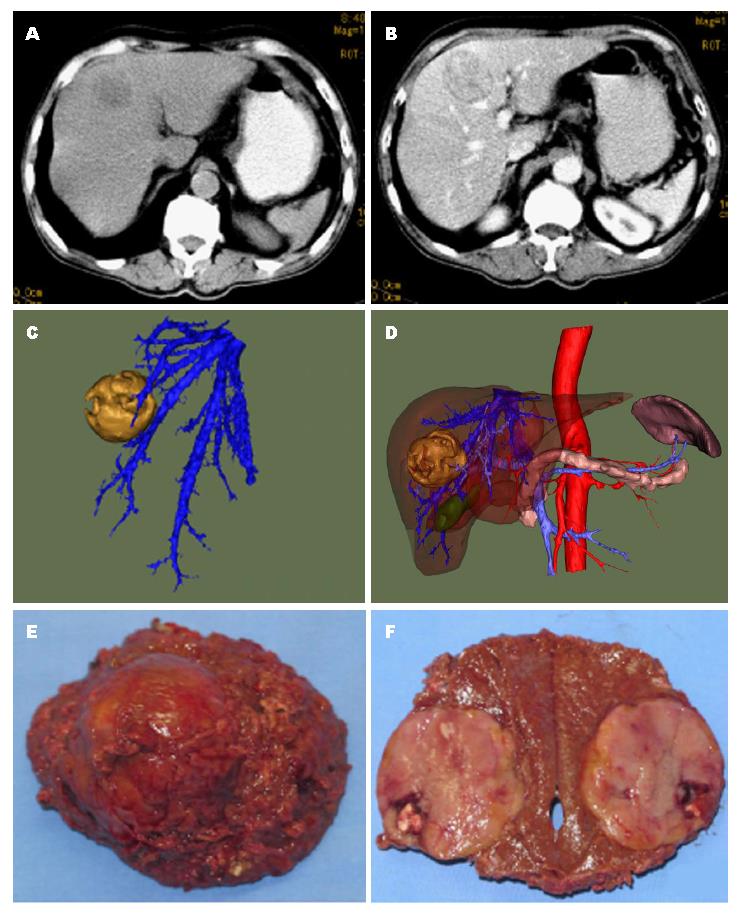
1.2.1 手术: A组患者术前进行上腹部薄层扫描, 扫描层厚1-2 mm, 造影剂(优维显, 300 mgI/mL), 高压注射, 总剂量为70-90 mL, 注射后30、70和120 s进行动脉期、门脉期及实质期三期扫描. 采用深圳旭东数字影像技术有限公司开发的影像诊断软件(通用版Ver100)进行三维重建, 了解肝脏肿瘤的大小、毗邻、剩余肝组织的体积以及与血管、胆管的关系等(图1). B组患者未进行三维重建, 近根据普通CT图片决定手术方案. A、B两组患者均采用气管插管复合全身麻醉, 平卧位, 常规肋缘下切口. A组同时采用CUSA刀(美国Valleylab公司), B组采用普通电刀, 充分暴露肿瘤后, 予以切除, 切线距肿瘤2 cm以上. 入肝血流阻断(第一肝门阻断)时间一次不超过20 min, 若超过20 min, 中间开放血流10 min.
1.2.2 术后观察和随访: 手术后常规处理, 观察患者一般情况和近期并发症. 并对全部病例的生存情况和是否有肿瘤复发进行密切随诊, 出院后前半年每个月复查肝功能、甲胎蛋白(alpha-fetoprotein, AFP)、B超等, 每2 mo复查CT或核磁共振成像(nuclear magnetic resonance imaging, MRI) 1次, 后半年每2 mo复查肝功能、AFP、B超等, 每3 mo复查CT或MRI一次, 以后每半年复查一次. 统计患者0-36 mo的总生存率和无瘤生存率.
统计学处理 采用SPSS17.0软件进行统计分析. 通过Kaplan-Meier模型的Log-rank检验比较生存率之间的差异. 样本理论频数采用χ2进行统计学分析, 计量资料结果用mean±SD表示, 两样本均数间的比较采用t检验, P<0.05为差异具有统计学意义.
A组左半肝切除者6例, 左外叶切除者5例, 右前叶切除者5例, 右后叶切除者4例, 右半肝切除者6例, 局部切除者1例. B组左半肝切除者4例, 左外叶切除者4例, 右前叶切除者6例, 右后叶切除者5例, 右半肝切除者4例, 局部切除者3例(χ2 = 2.095, P = 0.836>0.05), 表明A、B两组具有可比性.
有关两组术中、术后情况如表2所示: 两组在切除肝叶、肝段方面无显著差异, 表明两组具有可比性; 手术时间A组小于B组, 但无统计学差异; 在入肝血流(第一肝门)阻断时间、术中失血量和术中输血方面, A组显著低于B组(P<0.05). 收集两组术后第5天肝脏生化指标: 丙氨酸氨基转移酶(alanine aminotransferase, ALT)(参考区间: 10-40 U/L)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)(参考区间: 10-40 U/L)和白蛋白(albumin, ALB)(参考区间: 40-55 g/L)分别是: ALT(70.3 U/L±29.6 U/L vs 82.3 U/L±39.1 U/L, P>0.05); AST(49.7 U/L±16.4 U/L vs 54.3 U/L±18.6 U/L, P>0.05); ALB(32.0 g/L±3.0 g/L vs 31.7 g/L±3.2 g/L, P>0.05). 近期并发症A组肺部感染2例, 膈下感染2例, 尿路感染1例, 切口液化1例, 发生率为14.8%; B组肺部感染3例, 断面积液并感染3例, 切口液化2例, 胸腔积液合并肺部和膈下感染1例, 死亡1例, 系重症感染合并肝衰竭, 其余患者均予以对症处理后控制出院, 发生率38.4%, A组并发症少于B组, 但无统计学意义(χ2 = 1.657, P>0.05), 两组在住院时间方面差异不大.
| 观察指标 | A组 | B组 | χ2/t值 | P 值 |
| n | 27 | 26 | ||
| 切除范围(>2肝段/≤2肝段) | 21/6 | 19/7 | 0.158 | 0.691 |
| 入肝血流阻断时间(min) | 7.4±5.6 | 18.3±7.6 | -5.709 | 0.000 |
| 手术时间(min) | 178.1±35.6 | 197.9±40.3 | -1.900 | 0.063 |
| 术中失血量(>1 L/≤1 L) | 5/22 | 12/14 | 4.643 | 0.031 |
| 术中输血(有/无) | 6/21 | 13/13 | 4.444 | 0.035 |
| 术后近期并发症发生率(%) | 14.8(6/21) | 38.4(10/16) | 1.657 | 0.198 |
| 住院天数(d) | 17.0±5.3 | 19.3±7.2 | -1.332 | 0.189 |
三维重建技术可以在术前清楚地观察到肝脏肿瘤和血管、胆管的关系, 评估剩余肝的体积, 他不仅为临床医生提供一种形象化立体概念, 而且对变异的血管观察、肿瘤的侵犯范围、选择正确的手术方式具有非常大的帮助. 肝切除术是HCC的根治方法之一, 直接影响患者的预后[6], 术后复发和转移与手术操作、切除范围、淋巴清扫、癌栓和规范化处理等存在一定的关系[7]. 随着微创器械和影像医学相互结合, 手术的安全性大大提高[8]. CUSA刀具有选择性分离肝组织的功能, 有效地保护血管、胆管和神经组织, 同时具有超声切割止血, 冲洗和吸引的功能[9]. 我们通过三维重建联合CUSA刀实施肝切除发现: 通过术前影像学检查和病灶组织的三维重建可以清楚显示肿瘤大血管的分布, 协助选择合适的入路, 配合CUSA刀切割、止血, 避免了大出血和胆漏的发生和周围组织的损伤, 提高肝切除术的安全性和疗效.
A、B两组术前在性别、表面抗原、肝硬化、肝功能、AFP、肿瘤大小、血管侵犯、包膜完整、侵犯周围脏器和组织学分级等临床病理参数均无统计学差异, 表明两组具有可比性. 结果发现: A、B两组相比, 在入肝血流阻断时间、术中失血量和术中输血3个方面, A组显著优于B组(P<0.05). 这表明术前三维重建给予手术操作者对于肝内病灶可视的立体空间结构, 避免了在手术操作中损伤了大的血管, 比如: 肝动脉、肝静脉、门静脉以及一些变异的血管. 因为这些血管均可以通过术前的三维重建中清楚的显示出来. 正如张友磊等[10]所证实的, 肝内血管三维重建有助于肝切除的手术规划, 判断肿瘤的可切除性、选择手术入路, 精准性切除等, 降低了手术风险. CUSA刀配合病灶的三维重建能够粉碎肝细胞组织而将肝内的血管和胆管保留下来, 能够很好地减少出血, 减少术中失血量和术中输血, 缩短了入肝血流阻断时间. 在近期并发症方面, A组发生率为14.8%; B组发生率为38.4 %, A组小于B组, 但无统计学意义(χ2 = 1.657, P>0.05). 主要的原因可能受样本量的限制, 在今后的研究中收集大宗病例可能会更有说服力. 陈焕伟等[11]等报道, CUSA刀的应用改进了肝脏外科技术, 能够实施精准的肝切除术, 减少了术中出血, 增加了手术的彻底性和安全性, 降低了手术的风险.
我们将两组患者共随访0-36 mo, 在总生存率方面, 两组无差异(χ2 = 1.165, P>0.05); 但在无瘤生存率方面, A组的无瘤生存率显著高于B组(χ2 = 7.122, P<0.05). 这表明: 通过三维重建配合CUSA刀能够降低肝切除后的肿瘤复发. 无瘤生存与术中肿瘤有无侵犯大血管和病理类型有关, 开腹手术中的挤压或压迫可能会使肿瘤细胞被动入血或种植, 造成复发[12,13]. 而通过三维重建配合CUSA刀, 整个手术过程合理稳妥地处理血管, 提高了术者肝切除的成功率[14,15], CUSA刀兼有超声消融和止血功能, 可能与其无瘤生存率较高有关. 这一结论尚缺少前瞻性的随机对照研究, 也为我们今后指明了方向.
总之, 三维重建技术联合CUSA刀施行肝切除术能够缩短入肝血流阻断时间, 减少术中失血量和术中输血, 提高患者的无瘤生存率. 这些临床研究结果为临床开展肝切除手术提供了参考和依据.
肝细胞癌是我国常见的恶性肿瘤之一. 具有恶性程度高, 病情发展快, 治疗效果差, 发病率高和死亡率高等特点. 肝切除是肝癌治疗的根治手段之一. 应用三维重建可进行肿瘤的准确定位, 超声乳化吸引(cavitron ultrasonic surgical aspirator, CUSA)刀的使用能优化肝切效果.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
肝切除是治疗肝癌主要手段之一, 肝癌血供丰富, 肿瘤切除时常伴有大量出血, 因此, 控制失血成为临床上亟待解决的问题. 各临床工作者以优化肝切除, 减少术中出血为目标成为该研究领域中的热点和重点.
方驰华教授将3D技术应用在复杂性肝切除术中, 认为这种技术安全性高, 值得临床推广. 同时, 匡铭教授应用三维手术模拟系统对肝癌患者实施精准肝切除, 疗效肯定.
三维重建技术联合CUSA刀施行肝切除术能够缩短入肝血流阻断时间, 减少术中失血量和术中输血, 提高患者的无瘤生存率.
利用三维重建技术联合CUSA刀施行肝切除术既缩短了入肝血流阻断时间, 减少术中失血量和术中输血, 又提高患者的无瘤生存率. 为临床开展肝切除手术提供参考和依据, 具有广阔的应用前景.
CUSA刀: 是一种超声外科吸引器, 他是通过振动细胞内的水分子, 使富含水分的细胞空化, 空化的细胞与震动的刀头发生共振导致最终破裂. 他不能切割富含胶原蛋白和纤维蛋白的组织结构(如血管、胆管、输尿管等), 而且对周围组织的损伤不良反应小, 在各种外科器械中是最安全的一种.
本文采用三维重建技术联合CUSA刀行肝脏肿瘤切除, 并与传统肝切除进行了比较, 结果表明, 前者能使患者在减少术中出血与延长无瘤生存率方面获益, 有一定参考价值.
编辑: 郭鹏 电编:都珍珍
| 1. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 3. | Bodzin AS, Leiby BE, Ramirez CG, Frank AM, Doria C. Liver resection using cavitron ultrasonic surgical aspirator (CUSA) versus harmonic scalpel: a retrospective cohort study. Int J Surg. 2014;12:500-503. [PubMed] [DOI] |
| 4. | Lamata P, Lamata F, Sojar V, Makowski P, Massoptier L, Casciaro S, Ali W, Stüdeli T, Declerck J, Elle OJ. Use of the Resection Map system as guidance during hepatectomy. Surg Endosc. 2010;24:2327-2337. [PubMed] [DOI] |
| 5. | Lamadé W, Glombitza G, Fischer L, Chiu P, Cárdenas CE, Thorn M, Meinzer HP, Grenacher L, Bauer H, Lehnert T. The impact of 3-dimensional reconstructions on operation planning in liver surgery. Arch Surg. 2000;135:1256-1261. [PubMed] [DOI] |
| 6. | Park YK, Kim BW, Wang HJ, Kim MW. Hepatic resection for hepatocellular carcinoma meeting Milan criteria in Child-Turcotte-Pugh class a patients with cirrhosis. Transplant Proc. 2009;41:1691-1697. [PubMed] [DOI] |
| 9. | Honda G, Kurata M, Okuda Y, Kobayashi S, Tadano S, Yamaguchi T, Matsumoto H, Nakano D, Takahashi K. Totally laparoscopic hepatectomy exposing the major vessels. J Hepatobiliary Pancreat Sci. 2013;20:435-440. [PubMed] [DOI] |
| 10. | 张友磊, 王义, 郝强, Heinz-Otto Peitgen, Andrea Shenk, 陆建平, 吴孟超. 肝内血管三维重建及风险分析对肝切除手术规划的意义. 肝胆外科杂志. 2011;19:27-29. |
| 12. | Wang C, Lu Y, Chen Y, Feng Y, An L, Wang X, Su S, Bai W, Zhou L, Yang Y. Prognostic factors and recurrence of hepatitis B-related hepatocellular carcinoma after argon-helium cryoablation: a prospective study. Clin Exp Metastasis. 2009;26:839-848. [PubMed] [DOI] |
| 14. | 匡 铭, 汤 地, 王 晔, 陈 伟, 姜 春林, 任 庆旗, 彭 宝岗, 梁 力建. 三维手术模拟系统在肝癌患者精准肝切除中的应用. 中国普外基础与临床杂志. 2011;18:682-687. |