修回日期: 2014-06-22
接受日期: 2014-07-05
在线出版日期: 2014-09-08
目的: 研究胰岛再生源蛋白(regenerating islet-derived protein, Reg)Ⅰ、Ⅲ在大鼠重症急性胰腺炎(severe acute pancreatitis, SAP)小肠中表达, 评价RegⅠ、Ⅲ水平与肠黏膜屏障损伤的关系, 并初步探其作用机制.
方法: 72只SD大鼠随机分为对照组(N)、重症急性胰腺组(S)、10 mg/kg吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate, PDTC)预处理组(P)各为12 h及24 h两组. S组腹腔注射20%L-精氨酸2.5 g/kg大鼠体质量2次, 中间间隔1 h; N组于腹腔注射等体积0.9%氯化钠; P组: 于造模前1 h腹腔注射PDTC 10 mg/kg预处理. HE染色观察胰腺、小肠的病理变化, ELISA方法检测血清中白介素22(interleukin 22, IL-22)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)及肠型脂肪酸结合蛋白(intestinal fatty acid binding protein, I-FABP)水平, RT-PCR测定小肠组织中RegⅠ、Ⅲ mRNA表达含量, Western blot检测小肠组织中核转录因子κB(nuclear-factor κB, NF-κB) p65及RegⅠ、Ⅲ蛋白水平.
结果: (1)SAP组在胰腺评分(S12 h 8.92±1.130, S24 h 11.31±1.609)、肠道评分(S12 h 3.79±0.689, S24 h 4.33±0.354)、IL-22(S12 h 712.46 ng/mL±81.549 ng/mL, S24 h 751.02 ng/mL±104.054 ng/mL)、TNF-α(S12 h 138.08 ng/mL±20.369 ng/mL, S24 h 159.43 ng/mL±24.46 ng/mL)、I-FABP(S12 h 338.04 IU/mL±61.876 IU/mL, S24 h 395.26 IU/mL±58.547 IU/mL)、RegⅠ蛋白(S12 h 0.45±0.047, S24 h 0.56±0.033)、Reg Ⅲ蛋白(S12 h 0.70±0.084, S24 h 0.92±0.163)、NF-κB p65蛋白(S12 h 0.51±0.065, S24 h 0.60±0.066)水平较对照组均有明显升高(P<0.05); (2)应用PDTC预处理后各指标较SAP组均有表达降低(P<0.05), 但仍高于对照组(P<0.05); (3)RegⅠ、Ⅲ蛋白表达与肠黏膜病理评评分、IL-22、I-FABP、TNF-α及NF-κBp65表达呈正相关.
结论: SAP时大鼠小肠组织RegⅠ、Ⅲ表达上调, 与肠黏膜损伤及NF-κB通路活性相关.
核心提示: 重症急性胰腺炎(severe acute pan-creatitis)大鼠小肠胰岛再生源蛋白(regenera-ting islet-derived protein, Reg)Ⅰ、Ⅲ蛋白表达增高, RegⅠ、Ⅲ为肠黏膜屏障中调节因子之一, 且其表达可能与白介素22(interleukin 22)、肿瘤坏死因子α(tumor necrosis factor-α)等炎症因子有关, 其表达可部分通过核转录因子κB(nuclear-factor κB)通路调节.
引文著录: 马树灿, 姚金锋, 郭昱, 崔东来, 杨欢, 韩金丽. Reg蛋白与重症急性胰腺炎肠黏膜损伤的关系及其作用机制. 世界华人消化杂志 2014; 22(25): 3744-3752
Revised: June 22, 2014
Accepted: July 5, 2014
Published online: September 8, 2014
AIM: To detect the expression of regenerating islet-derived proteins (Reg)Ⅰand Ⅲ in the intestinal mucosa of rats with severe acute pancreatitis (SAP), and to evaluate the relationship between the levels of RegⅠand Ⅲ and intestinal mucosal barrier damage.
METHODS: Seventy-two adult SD rats were randomly divided into three groups: a normal control (N) group, an SAP (S) group, and a pyrrolidine dithiocarbamate (PDTC, 10 mg/kg) pretreatment (P) group. Each group was further divided into two subgroups for testing at different time points (12 and 24 h), with 12 rats in each subgroup. The rats in the S group were given 20% L-arginine (L-Arg, 2.5 g/kg) by intraperitoneal injection twice at one-hour interval to induce SAP. The N group was given equal volume of normal saline. The P group was given PDTC 10 mg/kg by intraperitoneal injection 1 h before the first injection of L-Arg. All rats were killed 12 h or 24 h after L-Arg injection to collect blood, pancreatic and intestinal tissue samples. The pathological changes in pancreatic and intestinal tissues were observed and graded under an optical microscope. ELISA was used to detect the levels of serum interleukin 22 (IL-22), tumor necrosis factor-α (TNF-α) and intestinal fatty acid binding protein (I-FABP). The expression of RegⅠand Ⅲ mRNAs in intestinal tissue was evaluated by RT-PCR. The levels of RegⅠ, Ⅲ and nuclear-factor κB (NF-κB) proteins in intestinal tissue were detected by Western blot.
RESULTS: In the SAP group, the scores of pancreatic changes (12 h: 8.92 ± 1.130; 24 h: 11.31 ± 1.609) and intestinal mucosal changes (12 h: 3.79 ± 0.689, 24 h: 4.33 ± 0.354), and the levels of IL-22 (12 h: 712.46 ng/mL ± 81.549 ng/mL, 24 h: 751.02 ng/mL ± 104.054 ng/mL), TNF-α (12 h: 138.08 ng/mL ± 20.369 ng/mL, 24 h: 159.43 ng/mL ± 24.46 ng/mL), I-FABP (12 h: 338.04 IU/mL ± 61.876 IU/mL, 24 h: 395.26 IU/mL ± 58.547 IU/mL), intestinal NF-κB p65 (12 h: 0.51 ± 0.065, 24 h: 0.60 ± 0.066), RegⅠprotein (12 h: 0.45 ± 0.047, 24 h: 0.56 ± 0.033), and Reg Ⅲ protein (12 h: 0.70 ± 0.084, 24 h: 0.92 ± 0.163) were significantly higher (P < 0.05) than those in the control group. Compared with the S group, pretreatment with different doses of PDTC significantly decreased the above parameters (P < 0.05), although the levels of these parameters were still significantly higher than those in the N group (P < 0.05). There were positive correlations among RegⅠand Ⅲ protein expression, intestinal mucosal pathological score, IL-22, I-FABP, TNF-α, and NF-κB p65 expression.
CONCLUSION: RegⅠand Ⅲ protein expression is upregulated in SAP, which is possibly associated with intestinal mucosa damage and NF-κB signaling pathway activation.
- Citation: Ma SC, Yao JF, Guo Y, Cui DL, Yang H, Han JL. Relationship between Reg proteins and intestinal mucosa barrier damage in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(25): 3744-3752
- URL: https://www.wjgnet.com/1009-3079/full/v22/i25/3744.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i25.3744
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床常见的急腹症, 其发病急、病情进展快, 并发症多. 近几年研究显示SAP时肠黏膜屏障功能受损, 容易发生肠屏障功能障碍(intestine barrier functional disturbance, IBFD), 使肠黏膜通透性增加, 是导致肠道细菌及内毒素发生移位, 加速败血症的进程, 诱发和加重全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、多器官功能障碍综合症(multiple organ dysfunction syndrome, MODS), 甚至会引起死亡, 因此在治疗原发病的同时对肠黏膜屏障的保护至关重要. 近年来胰岛再生源蛋白(regenerating islet-derived protein, Reg)在SAP发生发展过程中的作用日益引起广泛关注, 但其在肠黏膜屏障损伤中的作用研究甚少. 本实验旨在通过测定RegⅠ、Ⅲ蛋白及mRNA在SAP大鼠小肠中的表达, 评价RegⅠ、Ⅲ水平与肠黏膜屏障损伤的关系; 并通过分析应用特异性核转录因子κB(nuclear-factor κB, NF-κB)抑制剂吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate, PDTC)预处理后的小肠RegⅠ、Ⅲ的变化, 初步探讨Reg家族与NF-κB通路的关系.
健康成年SD大鼠72只, 清洁级, 雌雄各半, 质量250-280 g, 河北医科大学动物中心提供. 大鼠白介素22(interleukin 22, IL-22)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)及肠型脂肪酸结合蛋白(intestinal fatty acid binding protein, I-FABP), ELISA试剂盒均购自上海拜沃生物科技有限公司, RegⅠ多克隆抗体购自美国abcam公司, RegⅢ多克隆抗体购自北京博奥森公司, 兔抗大鼠NF-κB p65抗体购自武汉博士德生物科技有限公司.
1.2.1 分组: 将SD大鼠随机分为6个组: 对照组(N组)、重症急性胰腺组(S组)、PDTC预处理组(P组), 每个组又分为12 h及24 h两个亚组. 实验前禁食12 h, 不禁饮水.
1.2.2 造模: 本研究同尚宏清等[1]的实验采用20%L-精氨酸腹腔注射, 间隔1 h制造大鼠SAP模型. S组腹腔注射20%L-精氨酸2.5 g/kg 2次(总共5 g/kg大鼠质量), 间隔1 h, 诱导重症急性胰腺炎模型; N组于腹腔注射等体积0.9%氯化钠; P组: 于造模前1 h腹腔注射PDTC 10 mg/kg预处理. 各组造模成功后12 h及24 h处死实验大鼠, 开腹后观察胰腺、肠道及周围组织情况并取血、胰腺及小肠组织.
1.2.3 指标检测: (1)胰腺和小肠组织的病理学检查: 胰腺、小肠组织置于4%中性多聚甲醛固定24 h后, 常规脱水、石蜡包埋、切片、HE染色, 进行光镜观察. 用单盲法对胰腺、小肠组织进行病理评分, 胰腺采用Shmidt评分[2](表1), 小肠组织采用Chiu[3]肠黏膜损伤评分方法(表2); (2)血清TNF-α、IL-22、I-FABP的检测: 均采用双抗体夹心ABC-ELISA方法检测, 步骤严格按照试剂盒要求操作; (3)采用Western blot方法测定小肠组织RegⅠ、Ⅲ及NF-κB p65蛋白的表达; (4)采用荧光PCR(Real Time PCR, RT-PCR)的方法检测小肠组织中的RegⅠ、Ⅲ mRNA的表达量. 参阅相关文献和计算机软件分析设计引物, 引物由北京康为世纪生物科技有限公司合成. PCR引物序列设计如下: RegⅠ上游引物序列: 5'-GACACTGGGTATCCTAACAA-3', 下游引物序列: 5'-AGGCTTTGAACTTGCAGACA-3', 预计扩增长度为127 bp. RegⅢ上游引物序列: 5'-TATACCTTGGTCACGACACT-3', 下游引物序列: 5'-ATGTCTTGGTTGTTCAC-3', 预计扩增长度为152 bp. GAPDH上游引物序列: 5'-TGGAGTCTACTGGCGTCTT-3', 下游引物序列: 5'-TGTCATATTTCTCGTGGTTCA-3'. 预计扩增长度138 bp.
| 症状 | 分值 | 镜下表现 |
| 水肿 | 0 | 无 |
| 1 | 小叶间区域性水肿 | |
| 2 | 小叶间弥漫性水肿 | |
| 3 | 腺泡肿胀, 小叶间隔增大 | |
| 4 | 小叶明显分隔 | |
| 腺泡坏死 | 0 | 无 |
| 1 | 1-4个坏死细胞/HPF | |
| 2 | 5-10个坏死细胞/HPF | |
| 3 | 11-16个坏死细胞/HPF | |
| 4 | ≥17个坏死细胞/HPF大片融合坏死 | |
| 出血 | 0 | 无 |
| 1 | 1-2个出血灶 | |
| 2 | 3-4个出血灶 | |
| 3 | 5-6个出血灶 | |
| 4 | >7个出血灶 | |
| 炎细胞浸润 | 0 | 0-1个炎症细胞/HPF |
| 1 | 2-10个炎症细胞/HPF | |
| 2 | 11-20个炎症细胞/HPF | |
| 3 | 21-30个炎症细胞/HPF | |
| 4 | >30个炎症细胞/HPF |
| 分值 | 病理表现 |
| 0 | 肠黏膜绒毛正常 |
| 1 | 绒毛顶端上皮下出现囊状间隙, 并伴有毛细血管充血 |
| 2 | 上皮下间隙扩大, 中度固有层水肿, 中央乳糜管扩张 |
| 3 | 固有层明显水肿, 肠黏膜上皮层细胞变性、坏死、少数绒毛顶端脱落 |
| 4 | 上皮细胞层变性、坏死、脱落、部分绒毛脱落, 固有层裸露, 毛细血管扩张、充血 |
| 5 | 绒毛脱落、固有层崩解, 出血或溃疡形成 |
统计学处理 实验数据以mean±SD表示, 并采用SPSS17.0统计软件处理, 包括t检验、方差分析、秩和检验与相关分析等. P<0.05为差异有统计学意义.
N组大鼠饮食及活动正常, 解剖示: 胰腺大小、色泽正常, 无坏死灶、充血及皂化斑, 周围组织无黏连, 腹腔无腹水, 肠管无胀气及坏死; S组大鼠活动明显减少, 心率增快, 不喜进食, 可少量进水, 部分胰腺可见充血水肿、暗红色出血灶, 局部可见血凝块, 周围可见皂化斑, 腹腔可见血性或清亮腹水, 肠管部分积气, 24 h较12 h更为明显; P组大鼠活动及进食减少, 解剖较S组胰腺充血、水肿明显减轻, 少许坏死灶及皂化斑, 部分可见少量清亮腹水、肠管胀气, 24 h较12 h肉眼观察无明显差别.
胰腺组织HE染色S组示结构紊乱, 间质水肿明显, 可见腺泡细胞坏死及出血, 炎性细胞浸润, 并随着时间进展而渐进性加重. 肠道HE染色S组上皮细胞层坏死、脱落, 部分绒毛形态不规则、部分脱落, 固有层崩解, 毛细血管扩张、充血, 炎症细胞的浸润, 24 h较12 h更严重. 结果显示S组较N组明显升高(P<0.01), 且24 h比12 h更加严重(P<0.05)(表3), 提示L-精氨酸可成功诱导重症急性胰腺炎大鼠肠黏膜屏障损伤模型.
2.3.1 IL-22: 12 h组或24 h组, S组表达均明显高于N组(P<0.01), 给予PDTC干预后, P组与S组比较明显降低(P<0.01), 但仍高于N组(P<0.05), S组24 h IL-22较12 h明显升高(P<0.05)(表4).
| 分组 | TNF-α(ng/mL) | IL-22(ng/mL) | I-FABP(IU/mL) | |||
| 12 h | 24 h | 12 h | 24 h | 12 h | 24 h | |
| N组 | 80.35±11.88 | 83.69±11.602 | 379.62±52.471 | 431.03±32.157 | 134.90±59.936 | 144.23±46.93 |
| S组 | 138.08±20.369b | 159.43±24.46di | 712.46±81.549b | 751.02±104.054di | 338.04±61.876b | 395.26±58.547di |
| P组 | 90.98±25.134f | 98.94±20.67h | 505.55±57.14f | 501.77±62.315cf | 197.23±50.705bf | 233.89±61.438dh |
2.3.2 TNF-α: 与N组比较, 在12 h或者24 h, S组TNF-α表达明显升高(P<0.01); 与S组比较, P组表达降低(P<0.01); S组24 h较12 h有明显升高(P<0.05)(表4).
2.3.3 I-FABP: 在12 h及24 h, S组I-FABP表达明显高于N组(P<0.01), P组较N组表达升高(P<0.01); 应用PDTC干预后, 与S组比较, P组I-FABP表达降低(P<0.01); S组24 h较12 h有明显升高(P<0.05)(表4).
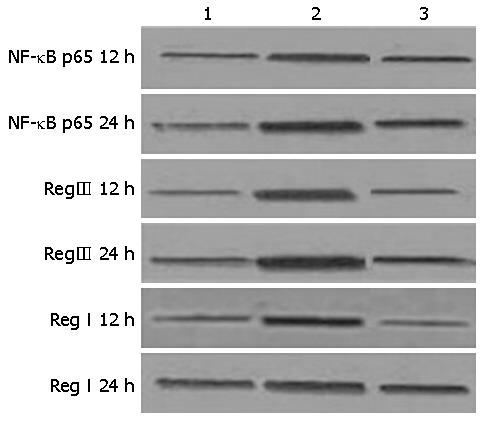
2.4.1 NF-κBp65蛋白: 无论12 h及24 h, 与N组比较, S及P组NF-κB p65表达升高(P<0.01); 给予PDTC干预后, P组与S组比较表达降低(P<0.05); S组24 h较12 h NF-κB p65表达有明显升高(P<0.05)(表5, 图1).
2.4.2 RegⅠ、Ⅲ蛋白: S组、P组RegⅠ、Ⅲ蛋白表达在12 h及24 h组均高于N组(P<0.05), 与S组比较, P组表达降低(P<0.01); RegⅠ、Ⅲ蛋白S组24 h较12 h有明显升高(P<0.05)(表5, 图1).
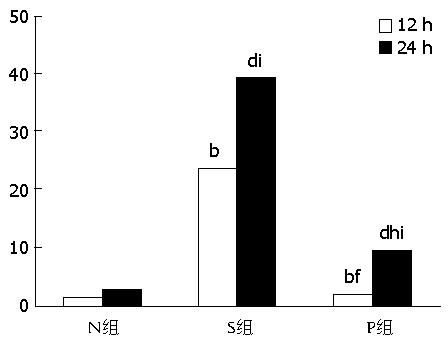
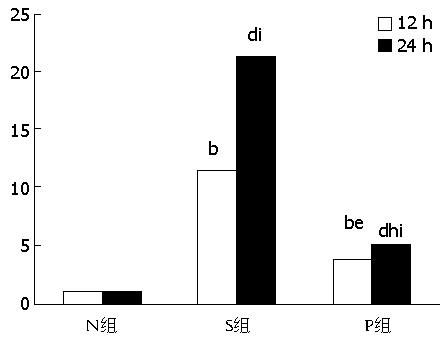
2.4.3 RegⅠ、Ⅲ mRNA的表达: 与N组比较, S组、P组RegⅠ、Ⅲ mRNA表达升高(P<0.01), P组与S组比较表达降低(P<0.05), S24 h组较12 h明显升高(P<0.05)(图2, 图3)
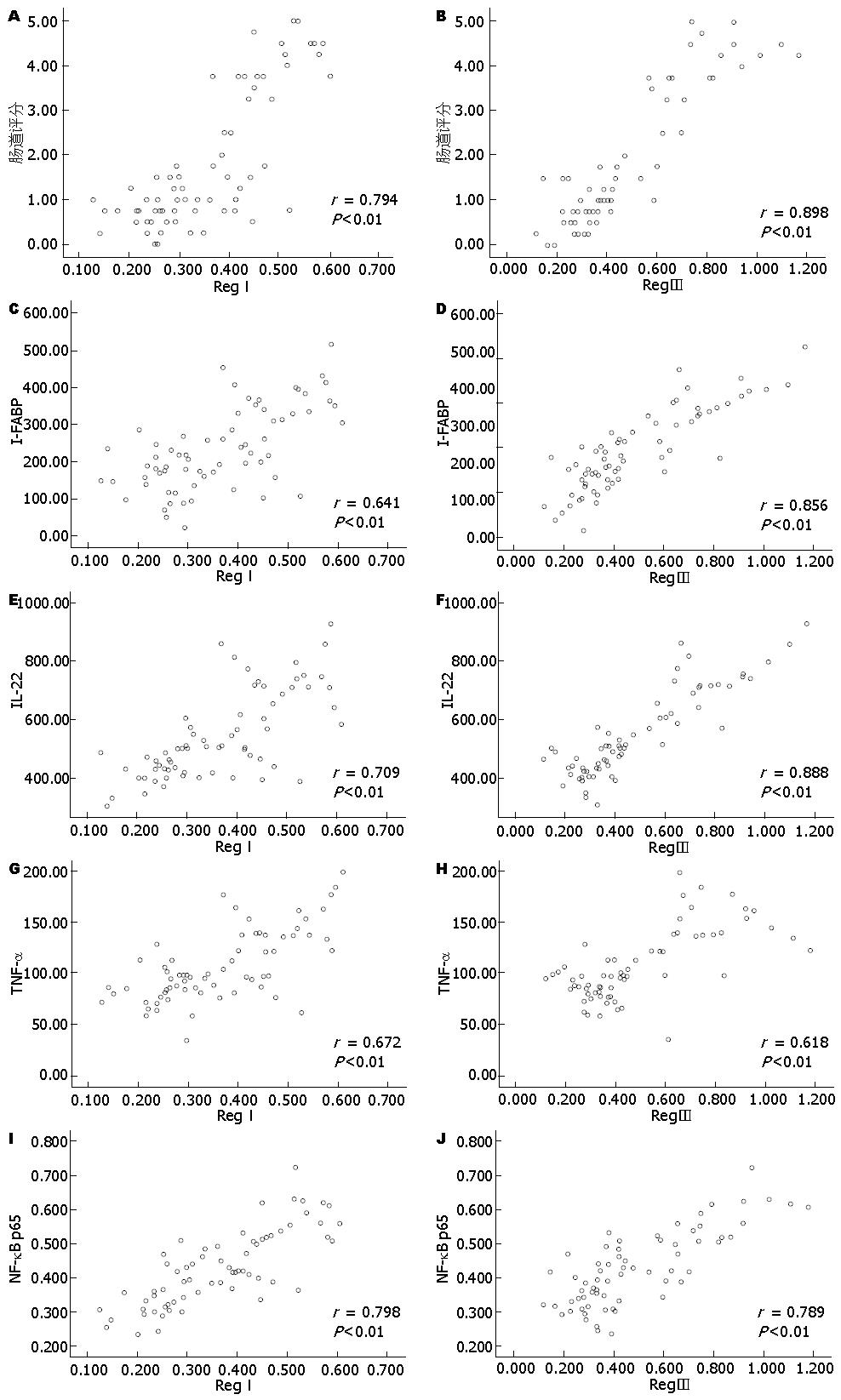
2.5.1 小肠黏膜病理评分与RegⅠ、Ⅲ蛋白表达的相关性: 小肠黏膜评分与RegⅠ蛋白表达呈正相关, 相关系数r = 0.794, 具有统计学意义(P<0.01)(图4A).小肠黏膜评分与RegⅢ蛋白表达呈正相关, 相关系数r = 0.898, 具有统计学意义(P<0.01)(图4B).
2.5.2 I-FABP与RegⅠ、Ⅲ蛋白表达的相关性: I-FABP与RegⅠ蛋白表达呈正相关, 相关系数r = 0.641, 具有统计学意义(P<0.01)(图4C). I-FABP与RegⅢ蛋白表达呈正相关, 相关系数r = 0.856, 具有统计学意义(P<0.01)(图4D).
2.5.3 IL-22与RegⅠ、Ⅲ蛋白表达的相关性: 血清IL-22与RegⅠ蛋白表达呈正相关, 相关系数r = 0.709, 具有统计学意义(P<0.01)(图4E). 血清IL-22与RegⅢ蛋白进行相关性分析, 示IL-22与RegⅢ蛋白表达呈正相关, 相关系数r = 0.888, 具有统计学意义(P<0.01)(图4F).
2.5.4 TNF-α与RegⅠ、Ⅲ蛋白表达的相关性: 血清TNF-α与RegⅠ蛋白表达呈正相关, 相关系数r = 0.672, 具有统计学意义(P<0.01)(图4G). 血清TNF-α与RegⅢ蛋白表达呈正相关, 相关系数r = 0.618, 具有统计学意义(P<0.01)(图4H).
2.5.5 小肠黏膜NF-κB p65与RegⅠ、Ⅲ蛋白表达的相关性: 小肠组织NF-κB P65与RegⅠ蛋白表达呈正相关, 相关系数r = 0.798, 具有统计学意义(P<0.01)(图4I). NF-κB p65与RegⅢ蛋白表达呈正相关, 相关系数r = 0.789, 具有统计学意义(P<0.01)(图4J).
Reg蛋白家族, 属于C-类凝集素(C-type lectin)家族超家族Ⅶ的成员, 是该家族中分子量最小的一组分泌蛋白. 大量的研究显示Reg普遍存在于原核及真核生物, 表达于胰液、肠道等多种组织, 参与机体多种生理及病理活动. 国内外研究显示SAP时Reg家族参与胰腺炎的发生、发展, 在胰腺组织中表达上调且对损伤的胰腺组织起修复作用[4,5], 但当SAP发生肠黏膜屏障受损时Reg在小肠组织的表达水平及作用尚不明了.
RegⅠ基因是Terazono等[6]作为促进胰腺再生的重要分子分离出来, 并命名为再生基因. 研究发现RegⅠ基因与多种疾病相关, 在糖尿病、消化系统肿瘤、胃溃疡、胰腺炎、心肌梗死等疾病的发生发展过程中均存在不同程度的RegⅠ基因的表达下调或者过度表达[7-12], 近几年的研究热点主要集中在炎症[13]及损伤修复方面. 研究发现在胰腺中RegⅠ与其他钙依赖性凝集素的结构相似, 可促进胰腺胰岛β细胞及导管细胞有丝分裂, 促进再生[4,5], 还可通过其受体发挥调节细胞再生的功能[14-16], 同时在胃肠组织细胞的实验中同样有RegⅠ基因的异常表达. 用水浸淹造成大鼠应激性胃黏膜损害的模型, 在胃黏膜的愈合过程中可见RegⅠ基因的表达增加, 这表明RegⅠ基因参与了胃损伤组织的再生和修复[11], 且发现其在康复阶段可促进黏膜愈合[17]. 另有研究显示鼠的RegⅠ基因可以促进小肠绒毛的增殖、再生和修复[18], 但其机制并未揭示. Vasseur等[19]发现RegⅠ的活化依赖于p8转录因子, 其对炎症产生的早期有很强的调节作用.
RegⅢ蛋白是一个16 kDa的分泌蛋白, 在正常人及大鼠胰腺中无法检测到, 但是在正常小肠及垂体、子宫等组织中可少量表达, 其存在α、β及γ 3种亚型, 研究发现RegⅢ蛋白不仅与细胞的增殖、调控细胞的凋亡及调节炎症反应[20-23]等作用相关, 还发现RegⅢ蛋白在胰腺、肝脏及小肠组织损伤后起修复作用[24,25]. 自2006年起, 人们更加专注于RegⅢ作为一种抗菌蛋白抑制损伤部位细菌生长的作用[26,27], 可抑制细菌感染肠道, 保护肠黏膜.
我们的实验发现: (1)SAP小肠组织中RegⅠ、Ⅲ蛋白水平表达均有明显上升, 且SAP组24 h明显高于12 h, 与小肠组织病理学评分及肠黏膜通透性指标(I-FABP)呈正相关. 基于RegⅠ、Ⅲ在胰腺及皮肤、肝脏组织中参与对损伤的修复, 我们推测SAP时小肠中RegⅠ、Ⅲ表达上调对受损肠黏膜修复过程可能起作用; (2)小肠组织中RegⅠ、Ⅲ表达与小肠组织中NF-κB p65表达呈正相关, 加用PDTC干预后, RegⅠ、Ⅲ及NF-κB p65均表达减低, 推测Reg表达可部分通过NF-κB通路调节, 对胰腺及小肠黏膜损伤起到作用, 但之间其相关系数偏低, 分析可能RegⅠ、Ⅲ蛋白的表达为多个通路的共同调节, 且不除外RegⅠ、Ⅲ基因之间的存在协同或拮抗作用; (3)IL-22、TNF-α与RegⅠ、Ⅲ表达趋势一致. Zheng等[28]的实验发现IL-22能够通过诱导RegⅢ的表达来抑制鼠类柠檬酸杆菌(Citrobacter rodentium)感染结肠, 以保护结肠上皮免受损伤. Brandl等[29,30]的实验证明小鼠肠道细菌可以通过激活TLR-MyD88信号通路诱导RegⅢγ表达, 来抑制肠道病原菌的生长. 2010年Sekikawa等[31]在溃疡性结肠炎的实验也发现IL-22可激活信号传导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)及丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路, 而STAT3及MAPK为Reg蛋白表达的重要调节因子, 提示IL-22可调节RegⅠ、Ⅲ的表达; RegⅠ、Ⅲ可调节TNF-α及其诱导的炎症因子的过表达, 从而抑制炎症加重; (4)本实验发现, 正常对照组小肠组织RegⅠ、Ⅲ有少量的表达, 在SAP发生IBFD时, 表达上调参与肠黏膜损伤与修复, 但是过度表达的RegⅠ、Ⅲ是否会加剧SAP时的肠黏膜损伤尚不清楚, 仍需进一步探讨. RegⅠ、Ⅲ之间是否存在协同或拮抗作用, 仍需进一步实验证实.
重症急性胰腺炎(severe acute pancreatitis, SAP)是临床常见的急腹症, 其发病急, 并发症多, 在治疗原发病的同时对于肠黏膜屏障的保护对减轻全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、多器官功能障碍综合症(multiple organ dysfunction syndrome, MODS)等的发生至关重要. 胰岛再生源蛋白(regenerating islet-derived protein, Reg)蛋白在多种生理、病理活动中发挥重要作用, 在消化系统肿瘤、胃溃疡、胰腺组织、心肌梗死方面有研究报道, 但其在肠黏膜屏障损伤中的作用研究甚少.
谭晓冬, 教授, 中国医科大学附属盛京医院
SAP时Reg家族参与胰腺炎的发生、发展, 在胰腺组织中表达上调且对损伤的胰腺组织起修复作用, 尤其再生基因RegⅠ、Ⅲ在急性胰腺炎中的作用在日益受到重视, 然在SAP肠黏膜损伤中研究甚少. Reg家族在炎症及损伤修复方面的作用已成为研究热点.
Zheng等报道白介素22(interleukin 22)能够通过诱导RegⅢ的表达来抑制鼠类柠檬酸杆菌(Citrobacter rodentium)感染结肠, 以保护结肠上皮免受损伤. Brandl等报道小鼠肠道细菌可以通过激活TLR-MyD88信号通路诱导RegⅢγ表达, 来抑制肠道病原菌的生长.
本实验旨在通过测定RegⅠ、Ⅲ蛋白在SAP大鼠小肠中的表达, 评价RegⅠ、Ⅲ水平与肠黏膜屏障损伤的关系; 并通过分析应用特异性核转录因子κB(nuclear-factor κB, NF-κB)抑制剂PDTC预处理后的小肠RegⅠ、Ⅲ的变化, 初步探讨Reg蛋白家族与NF-κB通路的关系. 为Reg蛋白在肠黏膜屏障中的作用打下基础.
SAP时肠黏膜屏障功能受损, 对肠黏膜屏障的保护至关重要. 本研究进一步探讨了SAP大鼠肠黏膜屏障的发生机制、细胞因子表达及发展过程, 为今后的临床治疗提供实验和理论依据.
Reg蛋白: 属于C-类凝集素(C-type lectin)家族超家族Ⅶ的成员, 是该家族中分子量最小的一组分泌蛋白, 根据其蛋白一级结构的不同, Reg家族共分为四型(Ⅰ型、Ⅱ型、Ⅲ型和Ⅳ型).
本文具有一定的科学性和创新性, 行文严谨, 提示RegⅠ、Ⅲ为肠黏膜屏障中调节因子之一, 为今后重症急性胰腺炎时肠黏膜屏障功能损伤防治研究具有一定的价值.
编辑: 郭鹏 电编:都珍珍
| 2. | Schmidt J, Lewandrowsi K, Warshaw AL, Compton CC, Rattner DW. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol. 1992;12:41-51. [PubMed] |
| 3. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 4. | Sanchez D, Mueller CM, Zenilman ME. Pancreatic regenerating gene I and acinar cell differentiation: influence on cellular lineage. Pancreas. 2009;38:572-577. [PubMed] |
| 5. | Huszarik K, Wright B, Keller C, Nikoopour E, Krougly O, Lee-Chan E, Qin HY, Cameron MJ, Gurr WK, Hill DJ. Adjuvant immunotherapy increases beta cell regenerative factor Reg2 in the pancreas of diabetic mice. J Immunol. 2010;185:5120-5129. [PubMed] |
| 6. | Terazono K, Yamamoto H, Takasawa S, Shiga K, Yonemura Y, Tochino Y, Okamoto H. A novel gene activated in regenerating islets. J Biol Chem. 1988;263:2111-2114. [PubMed] |
| 7. | Qiu L, List EO, Kopchick JJ. Differentially expressed proteins in the pancreas of diet-induced diabetic mice. Mol Cell Proteomics. 2005;4:1311-1318. [PubMed] [DOI] |
| 8. | Bluth MH, Patel SA, Dieckgraefe BK, Okamoto H, Zenilman ME. Pancreatic regenerating protein (reg I) and reg I receptor mRNA are upregulated in rat pancreas after induction of acute pancreatitis. World J Gastroenterol. 2006;12:4511-4516. [PubMed] |
| 9. | Sekikawa A, Fukui H, Fujii S, Takeda J, Nanakin A, Hisatsune H, Seno H, Takasawa S, Okamoto H, Fujimori T. REG Ialpha protein may function as a trophic and/or anti-apoptotic factor in the development of gastric cancer. Gastroenterology. 2005;128:642-653. [PubMed] [DOI] |
| 10. | Yuan RH, Jeng YM, Chen HL, Hsieh FJ, Yang CY, Lee PH, Hsu HC. Opposite roles of human pancreatitis-associated protein and REG1A expression in hepatocellular carcinoma: association of pancreatitis-associated protein expression with low-stage hepatocellular carcinoma, beta-catenin mutation, and favorable prognosis. Clin Cancer Res. 2005;11:2568-2575. [PubMed] [DOI] |
| 11. | Asahara M, Mushiake S, Shimada S, Fukui H, Kinoshita Y, Kawanami C, Watanabe T, Tanaka S, Ichikawa A, Uchiyama Y. Reg gene expression is increased in rat gastric enterochromaffin-like cells following water immersion stress. Gastroenterology. 1996;111:45-55. [PubMed] [DOI] |
| 12. | Malka D, Vasseur S, Bödeker H, Ortiz EM, Dusetti NJ, Verrando P, Dagorn JC, Iovanna JL. Tumor necrosis factor alpha triggers antiapoptotic mechanisms in rat pancreatic cells through pancreatitis-associated protein I activation. Gastroenterology. 2000;119:816-828. [PubMed] |
| 13. | Usami S, Motoyama S, Koyota S, Wang J, Hayashi-Shibuya K, Maruyama K, Takahashi N, Saito H, Minamiya Y, Takasawa S. Regenerating gene I regulates interleukin-6 production in squamous esophageal cancer cells. Biochem. Biophys Res Commun. 2010;392:4-8. [PubMed] [DOI] |
| 14. | Kobayashi S, Akiyama T, Nata K, Abe M, Tajima M, Shervani NJ, Unno M, Matsuno S, Sasaki H, Takasawa S. Identification of a receptor for reg (regenerating gene) protein, a pancreatic beta-cell regeneration factor. J Biol Chem. 2000;275:10723-10726. [PubMed] [DOI] |
| 15. | Acquatella-Tran Van Ba I, Marchal S, François F, Silhol M, Lleres C, Michel B, Benyamin Y, Verdier JM, Trousse F, Marcilhac A. Regenerating islet-derived 1α (Reg-1α) protein is new neuronal secreted factor that stimulates neurite outgrowth via exostosin Tumor-like 3 (EXTL3) receptor. J Biol Chem. 2012;287:4726-4739. [PubMed] [DOI] |
| 16. | Takasawa S, Ikeda T, Akiyama T, Nata K, Nakagawa K, Shervani NJ, Noguchi N, Murakami-Kawaguchi S, Yamauchi A, Takahashi I. Cyclin D1 activation through ATF-2 in Reg-induced pancreatic beta-cell regeneration. FEBS Lett. 2006;580:585-591. [PubMed] [DOI] |
| 17. | Fukuhara H, Kadowaki Y, Ose T, Monowar A, Imaoka H, Ishihara S, Takasawa S, Kinoshita Y. In vivo evidence for the role of RegI in gastric regeneration: transgenic overexpression of RegI accelerates the healing of experimental gastric ulcers. Lab Invest. 2010;90:556-565. [PubMed] [DOI] |
| 18. | Ose T, Kadowaki Y, Fukuhara H, Kazumori H, Ishihara S, Udagawa J, Otani H, Takasawa S, Okamoto H, Kinoshita Y. Reg I-knockout mice reveal its role in regulation of cell growth that is required in generation and maintenance of the villous structure of small intestine. Oncogene. 2007;26:349-359. [PubMed] [DOI] |
| 19. | Vasseur S, Folch-Puy E, Hlouschek V, Garcia S, Fiedler F, Lerch MM, Dagorn JC, Closa D, Iovanna JL. p8 improves pancreatic response to acute pancreatitis by enhancing the expression of the anti-inflammatory protein pancreatitis-associated protein I. J Biol Chem. 2004;279:7199-7207. [PubMed] [DOI] |
| 20. | Gironella M, Iovanna JL, Sans M, Gil F, Peñalva M, Closa D, Miquel R, Piqué JM, Panés J. Anti-inflammatory effects of pancreatitis associated protein in inflammatory bowel disease. Gut. 2005;54:1244-1253. [PubMed] [DOI] |
| 21. | Folch-Puy E, Granell S, Dagorn JC, Iovanna JL, Closa D. Pancreatitis-associated protein I suppresses NF-kappa B activation through a JAK/STAT-mediated mechanism in epithelial cells. J Immunol. 2006;176:3774-3779. [PubMed] [DOI] |
| 22. | Gironella M, Calvo C, Fernández A, Closa D, Iovanna JL, Rosello-Catafau J, Folch-Puy E. Reg3β deficiency impairs pancreatic tumor growth by skewing macrophage polarization. Cancer Res. 2013;73:5682-5694. [PubMed] [DOI] |
| 23. | Viterbo D, Bluth MH, Lin YY, Mueller CM, Wadgaonkar R, Zenilman ME. Pancreatitis-associated protein 2 modulates inflammatory responses in macrophages. J Immunol. 2008;181:1948-1958. [PubMed] [DOI] |
| 24. | Lieu HT, Batteux F, Simon MT, Cortes A, Nicco C, Zavala F, Pauloin A, Tralhao JG, Soubrane O, Weill B. HIP/PAP accelerates liver regeneration and protects against acetaminophen injury in mice. Hepatology. 2005;42:618-626. [PubMed] [DOI] |
| 25. | Lai Y, Li D, Li C, Muehleisen B, Radek KA, Park HJ, Jiang Z, Li Z, Lei H, Quan Y. The antimicrobial protein REG3A regulates keratinocyte proliferation and differentiation after skin injury. Immunity. 2012;37:74-84. [PubMed] [DOI] |
| 26. | Cash HL, Whitham CV, Behrendt CL, Hooper LV. Symbiotic bacteria direct expression of an intestinal bactericidal lectin. Science. 2006;313:1126-1130. [PubMed] [DOI] |
| 27. | Mukherjee S, Partch CL, Lehotzky RE, Whitham CV, Chu H, Bevins CL, Gardner KH, Hooper LV. Regulation of C-type lectin antimicrobial activity by a flexible N-terminal prosegment. J Biol Chem. 2009;284:4881-4888. [PubMed] [DOI] |
| 28. | Zheng Y, Valdez PA, Danilenko DM, Hu Y, Sa SM, Gong Q, Abbas AR, Modrusan Z, Ghilardi N, de Sauvage FJ. Interleukin-22 mediates early host defense against attaching and effacing bacterial pathogens. Nat Med. 2008;14:282-289. [PubMed] [DOI] |
| 29. | Brandl K, Plitas G, Schnabl B, DeMatteo RP, Pamer EG. MyD88-mediated signals induce the bactericidal lectin RegIII gamma and protect mice against intestinal Listeria monocytogenes infection. J Exp Med. 2007;204:1891-1900. [PubMed] [DOI] |
| 30. | Brandl K, Plitas G, Mihu CN, Ubeda C, Jia T, Fleisher M, Schnabl B, DeMatteo RP, Pamer EG. Vancomycin-resistant enterococci exploit antibiotic-induced innate immune deficits. Nature. 2008;455:804-807. [PubMed] [DOI] |
| 31. | Sekikawa A, Fukui H, Suzuki K, Karibe T, Fujii S, Ichikawa K, Tomita S, Imura J, Shiratori K, Chiba T. Involvement of the IL-22/REG Ialpha axis in ulcerative colitis. Lab Invest. 2010;90:496-505. [PubMed] [DOI] |