修回日期: 2014-06-19
接受日期: 2014-07-01
在线出版日期: 2014-08-28
目的: 通过用幽门螺杆菌(Helicobacter pylori, H. pylori)脂多糖(lipopolysaccharide, LPS)、环巴胺(cyclopamine)分别或联合作用于胃癌细胞AGS后, 观察刺猬蛋白(sonic hedgehog, Shh)信号通路中相关蛋白Ptch-1、Gli的表达变化, 并探讨其意义.
方法: (1)不同浓度H. pylori LPS作用于AGS细胞24 h, Western blot检测Ptch-1、Gli的表达, 找到最佳刺激浓度. 以最佳刺激浓度分别作用于AGS细胞24、48、72 h, Western blot法检测Ptch-1、Gli的表达; (2)不同浓度环巴胺作用于AGS细胞24 h后, MTT法检测对AGS的抑制率, 求得半数抑制浓度(50% concentration of inhibition, IC50). 以环巴胺IC50作用AGS细胞24、48、72 h后, Western blot检测Ptch-1、Gli的表达; (3)AGS细胞培养后分3组, 分别用H. pylori LPS、环巴胺、H. pylori LPS+环巴胺作用AGS细胞24 h, 另设阴性对照组, 应用Western blot法对各组细胞中Shh信号通路相关蛋白Ptch-1、Gli的表达水平进行检测.
结果: 不同浓度H. pylori LPS作用于AGS细胞24 h后Ptch-1、Gli的表达升高, 且随着浓度增加, 表达逐渐增高(P<0.05), 最终达到一个平台期, 以平台期浓度作为最佳刺激浓度, 分别刺激AGS细胞24、48、72 h, Western blot结果显示, Ptch-1、Gli的表达逐渐升高, 呈时间依赖性(P<0.05); 不同浓度环巴胺作用于AGS细胞24 h后, MTT结果显示环巴胺对AGS的抑制作用呈浓度依赖性(P<0.05); 以环巴胺IC50作用AGS细胞24 h后, Western blot结果显示随着时间的延长, Gli的表达逐渐减低, 而Ptch-1的表达无显著性差异. H. pylori LPS、环巴胺、H. pylori LPS+环巴胺组分别作用于AGS细胞24 h后, H. pylori LPS+环巴胺联合作用组的Ptch-1表达高于对照组及环巴胺组(P<0.05), 而与H. pylori LPS组无统计学差异; H. pylori LPS+环巴胺联合作用组Gli的表达低于对照组和H. pylori LPS组(P<0.05), 与环巴胺组无统计学差异.
结论: H. pylori通过其毒力因子LPS能够影响胃癌细胞AGS的Shh信号通路相关蛋白的表达. 环巴胺可通过抑制Shh信号通路抑制胃癌细胞AGS的生长. H. pylori LPS可能通过影响Shh信号通路的上游分子发挥作用.
核心提示: 通过用幽门螺杆菌(Helicobacter pylori, H. pylori)脂多糖(lipopolysaccharide, LPS)、环巴胺分别或联合作用于胃癌细胞AGS后, 发现H. pylori LPS可能通过影响Shh信号通路的上游分子发挥作用, 环巴胺可抑制胃癌细胞生长.
引文著录: 周慧, 张军, 张国新, 邰婷, 周晓颖, 苏静. 幽门螺杆菌脂多糖作用于胃癌细胞后刺猬蛋白信号通路中相关蛋白Ptch-1、Gli的表达及意义. 世界华人消化杂志 2014; 22(24): 3557-3564
Revised: June 19, 2014
Accepted: July 1, 2014
Published online: August 28, 2014
AIM: To explore the expression of Ptch-1 and Gli, two members in the sonic hedgehog (Shh) signaling pathway, in gastric cancer AGS cells after stimulation with Helicobacter pylori (H. pylori) lipopolysaccharide (LPS) and cyclopamine.
METHODS: Different concentrations of H. pylori LPS were used to stimulate AGS cells for 24 h, and the expression of Ptch-1 and Gli was assayed by Western blot to find the optimal stimulation concentration. AGS cells were then treated with H. pylori LPS at the optimal concentration for 24, 48 and 72 h, and the expression of Ptch-1 and Gli was detected by Western blot. MTT assay was applied to explore the effect of cyclopamine on AGS cell proliferation, and the half maximal inhibitory concentration (IC50) was calculated. AGS cells were then treated with cyclopamine at IC50 for 24, 48 and 72 h, and the expression of Ptch-1 and Gli was detected by Western blot. AGS cells were divided into three groups and stimulated with H. pylori LPS, cyclopamine and H. pylori LPS plus cyclopamine for 24 h, respectively, and the expression of Ptch-1 and Gli was then detected by Western blot.
RESULTS: After different concentrations of H. pylori LPS were used to stimulate AGS cells for 24 h, the expression of Ptch-1 and Gli was increased (P < 0.05) and eventually reached a plateau. After treatment of AGS cells with H. pylori LPS at the optimal concentration for 24, 48 and 72 h, the expression of Ptch-1 and Gli was increased in a time dependent manner (P < 0.05). After treatment of AGS cells with different concentrations of cyclopamine for 24 h, the proliferation of AGS cells was inhibited in a concentration dependent manner (P < 0.05). Treatment with cyclopamine at IC50 decreased the expression of Gli in a time dependent manner (P < 0.05), but showed no significant effect on expression of Ptch-1 (P > 0.05). The expression of Ptch-1 in the H. pylori LPS plus cyclopamine group was significantly higher than that in the control group and cyclopamine group (P < 0.05), but was not significantly different from that in the H. pylori LPS group (P > 0.05). The expression of Gli in the H. pylori LPS plus cyclopamine group was significantly lower than that in the control group and H. pylori LPS group (P < 0.05), but was not significantly different from that in the cyclopamine group (P > 0.05).
CONCLUSION: H. pylori may alter the expression of components of the Shh signaling pathway through its virulence factor LPS in AGS cells. Cyclopamine can inhibit the growth of AGS cells by inhibition of the Shh signaling pathway. H. pylori LPS may play a role by influencing the upstream molecules of the Shh signaling pathway.
- Citation: Zhou H, Zhang J, Zhang GX, Tai T, Zhou XY, Su J. Effect of Helicobacter pylori lipopolysaccharide on expression of Ptch-1 and Gli proteins in gastric cancer AGS cells. Shijie Huaren Xiaohua Zazhi 2014; 22(24): 3557-3564
- URL: https://www.wjgnet.com/1009-3079/full/v22/i24/3557.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i24.3557
脂多糖(lipopolysaccharide, LPS)是幽门螺杆菌(Helicobacter pylori, H. pylori)的毒力因子之一, 在H. pylori感染相关的疾病中起重要作用, 研究发现胃上皮细胞完整性的破坏大多数是通过H. pylori表面LPS减弱黏膜细胞和细胞外基质蛋白间的相互作用而发生的[1]. 刺猬蛋白(hedgehog, Hh)基因于1980年首先由Nusslein-Volhard在果蝇胚胎中发现[2]. 脊椎动物中存在3个同源基因, 即sonic hedgehog(Shh)、indian hedgehog(Ihh)和desert hedgehog(Dhh). Shh信号通路在胃肠道黏膜的发育以及维持黏膜的正常结构、形态、功能中发挥重要的作用[3]. 研究表明, Shh的表达与多种消化道肿瘤相关. 环巴胺(cyclopamine)是Shh信号通路的拮抗剂, 可诱导多种肿瘤细胞凋亡, 而对正常体细胞的生长无影响[4]. 研究发现, 环巴胺特异性结合中间信号分子Smo后, 通过阻断Shh信号通路, 能够抑制胃癌细胞的生长[5]. H. pylori和Shh均与胃癌的发生发展密切相关, 大多数研究显示H. pylori感染对Shh信号通路的表达有影响作用, 但具体机制尚未明确. LPS作为H. pylori的重要毒力因子之一, 可能参与这一过程. 本研究旨在通过体外实验, 选择H. pylori的毒力因子之一LPS作为刺激因子, 探讨H. pylori LPS对胃癌细胞Shh信号通路是否产生影响, 以及环巴胺作用后对胃癌细胞Shh信号通路的影响.
胃癌细胞AGS、H. pylori菌株SS1由江苏省人民医院消化科馈赠; 环巴胺购自美国Sigma公司; Ptch-1抗体购自美国cell signal公司; Gli抗体购自美国Santa Cruz公司; 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide, MTT)购自南京凯基生物科技发展有限公司.
1.2.1 H. pylori的培养: 微需氧环境中, 37 ℃培养, 厌氧孵箱内放置少量的水以保持湿度, 气体交换使箱内气体O2、CO2、N2的质量分数分别为5%、10%、85%. 将菌种接种于哥伦比亚培养基(加入10%的脱纤维羊血)培养后在48-72 h, 逐日观察结果, 培养物经快速尿素酶试验判定阳性.
1.2.2 H. pylori LPS的制备: 参考Luo等[6]的热酚水法提取出H. pylori LPS, 经动态比浊法证实为内毒素, 并且测得其浓度为90.87 μg/mL.
1.2.3 胃癌细胞AGS的培养: 常规复苏AGS细胞后, 使用高糖DMEM培养基, 于37 ℃, 5%CO2孵箱培养, 约24 h换液1次, 细胞生长至覆盖约70%-80%培养瓶底面时传代.
1.2.4 细胞增殖状态监测(MTT)法: 将处于对数生长期的细胞, 传代至96孔培养板中, 每孔体积200 μL, 培养12 h后, 弃去原培养基, 分别加入200 μL不同浓度环巴胺(5、10、15、20、25、30、35、40 μmol/L), 同时设不加环巴胺的阴性对照组以及只加入培养基而无AGS细胞的凋零孔, 培养24 h后, 加入50 μL 1×MTT, 培养4 h, 每孔加入150 μL二甲基亚砜, 平板摇床振荡10 min, 每组设8个复孔, 重复3次, 酶联免疫检测仪A490 nm处测量各孔的吸光度(A)值, 计算抑制率. 抑制率 = (阴性对照孔A值-加环巴胺孔A值)/(阴性对照组A值)×100%. Probit回归分析计算得出环巴胺半数抑制浓度(50% concentration of inhibition, IC50).
1.2.5 Western blot法检测各组Ptch-1、Gli蛋白水平: 分组: (1)将AGS细胞分为5组, 分别加入5 mL不同浓度H. pylori LPS(1、5、10、20、40 μg/mL), 并设阴性对照组, 干预24 h; 用上述处理中所得的H. pylori LPS最佳刺激浓度分别作用AGS细胞24、48、72 h; 环巴胺IC50分别作用AGS细胞24、48、72 h; 将AGS细胞分3组, 培养至细胞覆盖约60%-70%培养瓶瓶底时, 分别加入H. pylori LPS(最佳刺激浓度)、环巴胺IC50、H. pylori LPS(最佳刺激浓度)+环巴胺IC50, 并设阴性对照组, 干预24 h; (2)Western blot法检测各组Ptch-1、Gli蛋白水平: 上述各组细胞培养后, 加入蛋白裂解液, 得到全蛋白提取物, Bradford法进行蛋白浓度测定. 配制10%的分离胶, 5%浓缩胶, 进行SDS-PAGE凝胶电泳、转膜, 5%脱脂奶粉封闭液中封闭2 h后, 加入稀释的一抗(4 ℃, 过夜), TBST漂洗3次后加入二抗, 室温下摇荡孵育2 h, TBST漂洗3次, 然后使用ECL法显色, GIS凝胶图像分析系统照相并分析处理.
统计学处理 实验数据用mean±SD表示, 多组间比较采用双变量相关分析, 两组间两两比较用t检验分析, SPSS17.0软件进行数据处理及分析, P<0.05为差异有统计学意义.
用热酚水法提取出的H. pylori LPS水相, 经动态比浊法证实为内毒素, 浓度为90.87 μg/mL.
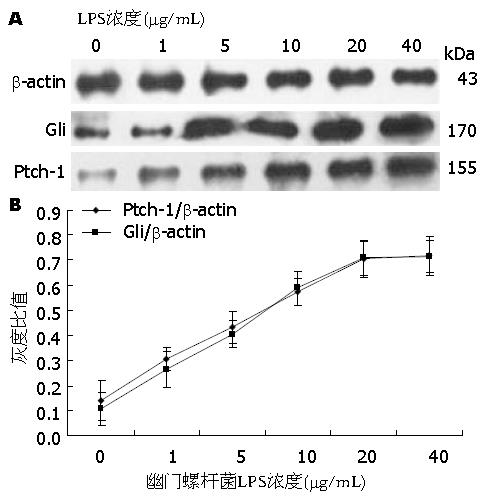
Western blot结果显示, H. pylori LPS 1、5、10、20、40 μg/mL分别作用胃癌细胞AGS 24 h后, Ptch-1、Gli的表达均较对照组升高(P<0.05)(表1), 且随着浓度增加, Ptch-1、Gli的表达逐渐升高, 最后出现平台期(图1).
不同浓度H. pylori LPS作用于AGS 24 h的Western blot显示随着浓度升高, Ptch-1、Gli的表达逐渐升高, 平台期H. pylori LPS浓度为20 μg/mL, 以此浓度作为最佳刺激浓度.
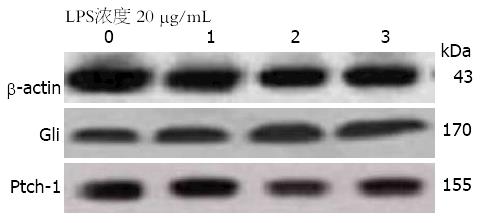
Western blot结果显示, H. pylori LPS 20 μg/mL作用于AGS 24、48、72 h后, Ptch-1、Gli的表达高于对照组(表2, 图2), 且随着作用时间的延长, Ptch-1、Gli的表达逐渐升高, 呈时间依赖性(P<0.05).
MTT检测结果显示, 5-40 μmol/L的环巴胺对胃癌细胞AGS均有抑制作用, 且随着浓度的增加, 抑制作用逐渐增强, 呈浓度依赖性(P<0.05)(表3). Probit回归分析计算得出环巴胺IC50为22.281 μmol/L.
| 环巴胺浓度(μmol/L) | 生长抑制率(%) |
| 5 | 5.263±0.307 |
| 10 | 12.133±1.203 |
| 15 | 27.195±0.616 |
| 20 | 40.988±0.921 |
| 25 | 50.785±1.355 |
| 30 | 67.548±0.470 |
| 35 | 81.955±0.624 |
| 40 | 86.960±1.938 |
| P值 | r = 0.996, P<0.05 |
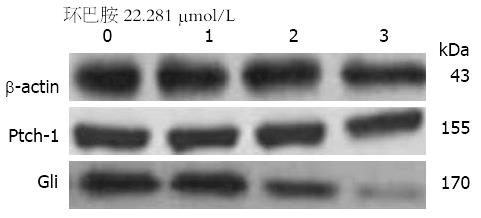
以环巴胺IC50 22.281 μmol/L作用于胃癌细胞AGS 24、48、72 h后, Gli的表达较对照组降低, 且随着时间延长, Gli的表达的逐渐减低, 呈时间依赖性(P<0.05), 而环巴胺作用24、48、72 h后Ptch-1的表达与对照组没有统计学差异(表4, 图3).
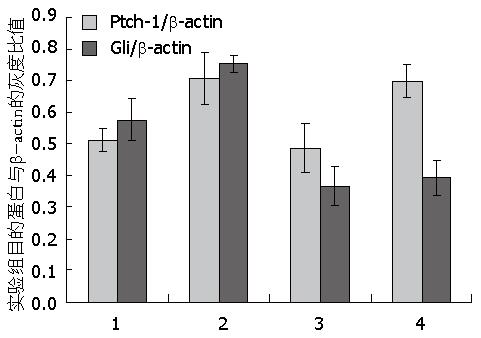
H. pylori LPS 20 μg/mL、环巴胺 22.281 μmol/L、H. pylori LPS 20 μg/mL+环巴胺22.281 μmol/L分别作用于AGS 24 h后Western blot结果显示, H. pylori LPS作用组Ptch-1、Gli的表达高于对照组(P<0.05); 环巴胺作用组的Ptch-1表达与对照组无统计学差异, 而Gli的表达低于对照组(P<0.05); H. pylori LPS+环巴胺联合作用组的Ptch-1表达高于对照组及环巴胺组(P<0.05), 而与LPS组相比无统计学差异; H. pylori LPS+环巴胺联合作用组的Gli的表达低于对照组及LPS组(P<0.05), 而与环巴胺组没有统计学差异(表5, 图4).
H. pylori是世界各地最常见的感染性疾病原之一, 他作为慢性胃炎、消化性溃疡、胃癌和胃黏膜相关性淋巴样组织淋巴瘤等上消化道疾病的重要发病因子, 已日益受到重视. 据报道, 亚洲人群H. pylori感染率达50%[7]. 1994年世界卫生组织国际癌症研究机构(International Agency for Research on Cancer, IARC)将H. pylori列为人类胃癌第Ⅰ类致癌原[8]. LPS是H. pylori的毒力因子之一, 具有内毒素的生物学活性, 在H. pylori感染及H. pylori相关疾病中起重要作用. 有研究表明[9]H. pylori LPS能介导多种细胞因子和趋化因子的释放, 如白介素1β(interleukin 1β, IL-1β)、IL-8及肿瘤坏死因子α等, 从而介导免疫反应的发生. Innocenti等[10]发现分别用H. pylori和H. pylori LPS刺激人外周血单核细胞后, 两者诱导产生的细胞表面趋化因子和IL-8的水平几乎一样高. 提示H. pylori LPS可能是促使中性粒细胞在胃黏膜中持续聚集, 进而导致黏膜炎症的原因之一. 可见, LPS作为H. pylori的毒力因子, 在H. pylori相关性疾病的发生、发展中发挥重要作用.
刺猬蛋白(Hedgehog)信号通路在人类胚胎发育过程中起着调控细胞增殖分化, 胚胎发育成熟的作用. Hedgehog家族包含3个同源基因, 即: Shh、Ihh和Dhh, 其中Shh信号通路在神经、胃肠道等系统的发育中起着重要作用[10-12]. Shh信号通路可简明表述为Shh-Ptch-Smo-Gli信号轴, 主要由分泌型信号蛋白Shh配体、跨膜蛋白受体Ptch和另一跨膜蛋白Smo以及下游转录因子Gli蛋白组成[13]. 当Shh配体存在时, Shh配体与跨膜蛋白受体Ptch结合后, 解除了Ptch对Smo的抑制, Smo进入胞质中, 引发细胞内信号的下传, 激活转录因子Gli, Gli以全长的形式进入细胞核内, 启动靶基因的转录, 把细胞外的Hedgehog信号传递到细胞内, 从而调控细胞的生长发育[14].
研究发现[15-18], 在前列腺癌、胰腺癌、肺癌、乳腺癌等恶性肿瘤中陆续发现Hedgehog信号通路均有不同程度的异常活化, 提示Hedgehog信号通路参与了多种恶性肿瘤的发生与发展.
尽管早期诊断和治疗技术已较前有巨大进步, 胃癌仍是全世界癌症死亡的第二大病因[19]. 胃癌的形成及发展是一个多阶段、多因素相互作用的结果. 最近研究发现Hedgehog信号通路的异常激活与胃癌的发生和发展有着非常密切的联系. Ohta等[20]发现在胃癌标本中, 8/14存在Shh的高表达, 定量测定癌组织中Shh是癌旁组织的12.8倍, 并在培养的5种胃癌细胞株(AGS、MKN1、MKN7、MKN45、MKN74)中均发现Shh的异常表达, 且应用Shh抗体阻断Hedgehog信号通路, 能抑制5种细胞的生长. Ma等[21]研究发现, Shh信号通路在胃癌组织中表达升高. Berman等[22]的一项体外培养实验显示, 6种人类胃癌细胞系中均可检测到Shh、Ptch及Gli的表达. Yoo等[23]在离体胃癌细胞中发现Shh的表达与胃癌的分化程度呈负相关. 有研究表明[24]种植胃癌小鼠模型中, Shh表达组肺转移发生率高于Shh不表达组, 提示Shh可刺激胃癌转移, 以上研究提示Shh与胃癌的发生发展有密切关系. Lee等[25]研究发现, 伴H. pylori感染的胃癌中, Shh表达明显上升, 其机制可能与抑制细胞凋亡有关. Schumacher等[26]研究发现, Shh基因敲除的小鼠在感染H. pylori 6 mo后依然没有发展成胃炎, 而对照组感染H. pylori 6 mo后出现炎症反应, 提示H. pylori感染引起的Shh信号通路相关基因表达可能是胃炎发生的关键. 由此可以推测, H. pylori感染后可能是通过引起Shh信号通路相关蛋白的表达而促进胃癌的发生发展, 但其通过何种毒力因子造成Shh信号通路中相关成员的表达发生变化仍然不确定. Yang等[27]研究证实, 在肺小血管上皮细胞中细菌LPS能影响Shh的表达. 由此, 我们推测, LPS作为H. pylori的一种重要毒力因子, 可能在这一过程中起着重要作用.
本研究用不同浓度的H. pylori LPS作用于胃癌细胞AGS 24 h, Western blot 结果提示H. pylori LPS作用后Ptch-1、Gli的表达增加(P<0.05), 且随着浓度增高, Ptch-1、Gli的表达逐渐增高, 最后出现平台期, 取此平台期浓度为最佳刺激浓度; 以最佳刺激浓度的H. pylori LPS分别作用于AGS 24、48、72 h后, Ptch-1、Gli的表达较对照组增加, 且随着时间的延长, 表达逐渐升高(P<0.05), 呈时间依赖性. 本实验结果提示H. pylori可能通过LPS的作用而引起Shh通路相关蛋白的表达变化, 但其机制尚需进一步研究. 研究显示[28]H. pylori LPS能通过TLR2和TLR5激活细胞核因子κB((nuclear factor-kappa B, NF-κB), 从而引起多种细胞因子的合成和释放. Nakashima等[29]发现NF-κB和Shh基因表达呈正相关, 激活NF-κB后能够诱导Shh的过度表达, 导致Shh信号通路激活, 若此时阻断NF-κB, Shh过度表达也会受到抑制. 提示胃癌组织中Shh的高表达, 其机制可能是H. pylori感染导致假性幽门腺化生时, NF-κB诱发Shh的再次活化[30]. 因此我们可以假设H. pylori LPS能通过NF-κB引起Shh的高表达.
环巴胺能与Hedgehog信号通路中的关键分子Smo蛋白结合, 使其空间构象发生改变, 从而抑制该蛋白活性, 导致Shh信号通路的失活. 本实验MTT结果提示环巴胺对胃癌细胞AGS有抑制作用, 且随着浓度的增加, 抑制作用逐渐增强, 呈浓度依赖性(P<0.05). MTT证实环巴胺可以抑制胃癌细胞AGS增殖, 而环巴胺究竟是通过哪些途径对胃癌细胞增殖凋亡产生影响尚不明确, 为此, 我们进行了初步的探讨.
本研究中, Western blot结果显示, 经22.281 μmol/L环巴胺作用胃癌细胞AGS后, Ptch-1的表达无明显变化, 而Gli的表达下降, 且随着作用时间的延长, 表达逐渐降低, 呈时间依赖性(P<0.05). 证明环巴胺抑制胃癌细胞生长可能是通过Shh通路的抑制达成的. 但环巴胺除了能阻断Hedgehog信号通路, 是否还有其他潜在的抗肿瘤机制及作用靶点, 仍需进一步的探讨.
本研究证明H. pylori LPS作用于AGS后, Ptch-1、Gli的表达增加, 而环巴胺作用后, Gli的表达下降, Ptch-1的表达无明显差异, 因此我们进一步探讨了两种干预条件同时作用于AGS时Ptch-1、Gli的变化. 结果表明, H. pylori LPS+环巴胺联合作用组Ptch-1的表达高于对照组及环巴胺组(P<0.05), 而与LPS组没有统计学差异; 联合作用组的Gli低于对照组及LPS组(P<0.05), 而与环巴胺组没有统计学差异. 结果提示H. pylori LPS的作用位点可能在Smo以上, 但仍需进一步探讨.
本研究证实, H. pylori LPS作用于AGS后可引起Shh通路中Ptch-1、Gli蛋白的高表达, 而Ptch-1、Gli的高表达可能与胃癌的预后有关, 积极探讨H. pylori LPS作用于该通路的机制对胃癌的防治研究有重要作用. 环巴胺抑制肿瘤细胞的生长可能是通过抑制Shh通路完成的, 是一种潜在的抗肿瘤药物, 但环巴胺要广泛应用于临床还需要进行多方面的研究, 值得研究者们进一步探讨.
总之, 本研究提示, H. pylori通过其毒力因子LPS能够影响胃癌细胞AGS的Shh信号通路相关蛋白的表达. 环巴胺可通过抑制Shh信号通路抑制胃癌细胞AGS的生长. H. pylori LPS可能通过影响Shh信号通路的上游分子发挥作用.
Shh在细胞的生长发育中起着重要作用, 已有研究证明, Shh信号通路在胃癌组织中高表达, 幽门螺杆菌(Helicobacter pylori, H. pylori)感染能影响Shh信号通路的表达, 但其具体机制不明, 有研究发现在肺小血管上皮细胞中细菌脂多糖(lipopolysaccharide, LPS)能影响Shh的表达, 因此我们设想H. pylori LPS也能影响Shh信号通路的表达变化.
邹小明, 教授, 哈尔滨医科大学附属第二医院普外二科; 郑鹏远, 教授, 主任医师, 郑州大学第二附属医院消化科
Shh信号通路在胃癌发生发展中所起的作用及其机制, 环巴胺抑癌作用.
Ma等通过RT-PCR、原位杂交及免疫组织化学法对56例胃切除标本进行Shh、Gli检测发现, Shh、Gli的表达较非癌组织明显升高, 说明Shh信号通路在胃癌组织中被激活.
本文思路清晰, 逻辑合理, 结论中肯, 具有一定的理论指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Slomiany A, Piotrowski J, Slomiany BL. Sucralfate counteracts the inhibition of gastric mucosal mucin receptor by Helicobacter pylori lipopolysaccharide. Scand J Gastroenterol Suppl. 1995;210:77-81. [PubMed] |
| 2. | Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila. Nature. 1980;287:795-801. [PubMed] |
| 3. | Kim JH, Choi YJ, Lee SH, Shin HS, Lee IO, Kim YJ, Kim H, Yang WI, Kim H, Lee YC. Effect of Helicobacter pylori infection on the sonic hedgehog signaling pathway in gastric cancer cells. Oncol Rep. 2010;23:1523-1528. [PubMed] |
| 4. | McCarthy FR, Brown AJ. Autonomous Hedgehog signalling is undetectable in PC-3 prostate cancer cells. Biochem Biophys Res Commun. 2008;373:109-112. [PubMed] [DOI] |
| 5. | Ma X, Chen K, Huang S, Zhang X, Adegboyega PA, Evers BM, Zhang H, Xie J. Frequent activation of the hedgehog pathway in advanced gastric adenocarcinomas. Carcinogenesis. 2005;26:1698-1705. [PubMed] |
| 6. | Luo YH, Yan J, Mao YF. Helicobacter pylori lipopolysaccharide: biological activities in vitro and in vivo, pathological correlation to human chronic gastritis and peptic ulcer. World J Gastroenterol. 2004;10:2055-2059. [PubMed] |
| 7. | Fock KM, Ang TL. Epidemiology of Helicobacter pylori infection and gastric cancer in Asia. J Gastroenterol Hepatol. 2010;25:479-486. [PubMed] [DOI] |
| 8. | Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [PubMed] |
| 9. | Bhattacharyya A, Pathak S, Datta S, Chattopadhyay S, Basu J, Kundu M. Mitogen-activated protein kinases and nuclear factor-kappaB regulate Helicobacter pylori-mediated interleukin-8 release from macrophages. Biochem J. 2002;368:121-129. [PubMed] |
| 10. | Innocenti M, Svennerholm AM, Quiding-Järbrink M. Helicobacter pylori lipopolysaccharides preferentially induce CXC chemokine production in human monocytes. Infect Immun. 2001;69:3800-3808. [PubMed] |
| 11. | Kim TH, Kim BM, Mao J, Rowan S, Shivdasani RA. Endodermal Hedgehog signals modulate Notch pathway activity in the developing digestive tract mesenchyme. Development. 2011;138:3225-3233. [PubMed] [DOI] |
| 12. | Cayuso J, Ulloa F, Cox B, Briscoe J, Martí E. The Sonic hedgehog pathway independently controls the patterning, proliferation and survival of neuroepithelial cells by regulating Gli activity. Development. 2006;133:517-528. [PubMed] |
| 13. | Sherman AE, Zavros Y. Role of Sonic Hedgehog signaling during progression from inflammation to cancer in the stomach. World J Gastrointest Pathophysiol. 2011;2:103-108. [PubMed] [DOI] |
| 14. | Katoh Y, Katoh M. Hedgehog signaling pathway and gastric cancer. Cancer Biol Ther. 2005;4:1050-1054. [PubMed] |
| 15. | Zhang J, Lipinski RJ, Gipp JJ, Shaw AK, Bushman W. Hedgehog pathway responsiveness correlates with the presence of primary cilia on prostate stromal cells. BMC Dev Biol. 2009;9:50. [PubMed] [DOI] |
| 16. | Olive KP, Jacobetz MA, Davidson CJ, Gopinathan A, McIntyre D, Honess D, Madhu B, Goldgraben MA, Caldwell ME, Allard D. Inhibition of Hedgehog signaling enhances delivery of chemotherapy in a mouse model of pancreatic cancer. Science. 2009;324:1457-1461. [PubMed] [DOI] |
| 17. | Mizuarai S, Kawagishi A, Kotani H. Inhibition of p70S6K2 down-regulates Hedgehog/GLI pathway in non-small cell lung cancer cell lines. Mol Cancer. 2009;8:44. [PubMed] [DOI] |
| 18. | ten Haaf A, Bektas N, von Serenyi S, Losen I, Arweiler EC, Hartmann A, Knüchel R, Dahl E. Expression of the glioma-associated oncogene homolog (GLI) 1 in human breast cancer is associated with unfavourable overall survival. BMC Cancer. 2009;9:298. [PubMed] [DOI] |
| 19. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 20. | Ohta M, Tateishi K, Kanai F, Watabe H, Kondo S, Guleng B, Tanaka Y, Asaoka Y, Jazag A, Imamura J. p53-Independent negative regulation of p21/cyclin-dependent kinase-interacting protein 1 by the sonic hedgehog-glioma-associated oncogene 1 pathway in gastric carcinoma cells. Cancer Res. 2005;65:10822-10829. [PubMed] |
| 21. | Ma XL, Sun HJ, Wang YS, Huang SH, Xie JW, Zhang HW. Study of Sonic hedgehog signaling pathway related molecules in gastric carcinoma. World J Gastroenterol. 2006;12:3965-3969. [PubMed] |
| 22. | Berman DM, Karhadkar SS, Maitra A, Montes De Oca R, Gerstenblith MR, Briggs K, Parker AR, Shimada Y, Eshleman JR, Watkins DN. Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours. Nature. 2003;425:846-851. [PubMed] |
| 23. | Yoo YA, Kang MH, Kim JS, Oh SC. Sonic hedgehog signaling promotes motility and invasiveness of gastric cancer cells through TGF-beta-mediated activation of the ALK5-Smad 3 pathway. Carcinogenesis. 2008;29:480-490. [PubMed] [DOI] |
| 24. | Yoo YA, Kang MH, Lee HJ, Kim BH, Park JK, Kim HK, Kim JS, Oh SC. Sonic hedgehog pathway promotes metastasis and lymphangiogenesis via activation of Akt, EMT, and MMP-9 pathway in gastric cancer. Cancer Res. 2011;71:7061-7070. [PubMed] [DOI] |
| 25. | Lee KM, Lee JS, Jung HS, Park DK, Park HS, Hahm KB. Late reactivation of sonic hedgehog by Helicobacter pylori results in population of gastric epithelial cells that are resistant to apoptosis: implication for gastric carcinogenesis. Cancer Lett. 2010;287:44-53. [PubMed] [DOI] |
| 26. | Schumacher MA, Donnelly JM, Engevik AC, Xiao C, Yang L, Kenny S, Varro A, Hollande F, Samuelson LC, Zavros Y. Gastric Sonic Hedgehog acts as a macrophage chemoattractant during the immune response to Helicobacter pylori. Gastroenterology. 2012;142:1150-1159.e6. [PubMed] [DOI] |
| 27. | Yang Y, Li Q, Deng Z, Zhang Z, Xu J, Qian G, Wang G. Protection from lipopolysaccharide-induced pulmonary microvascular endothelial cell injury by activation of hedgehog signaling pathway. Mol Biol Rep. 2011;38:3615-3622. [PubMed] [DOI] |
| 28. | Smith MF, Mitchell A, Li G, Ding S, Fitzmaurice AM, Ryan K, Crowe S, Goldberg JB. Toll-like receptor (TLR) 2 and TLR5, but not TLR4, are required for Helicobacter pylori-induced NF-kappa B activation and chemokine expression by epithelial cells. J Biol Chem. 2003;278:32552-32560. [PubMed] |
| 29. | Nakashima H, Nakamura M, Yamaguchi H, Yamanaka N, Akiyoshi T, Koga K, Yamaguchi K, Tsuneyoshi M, Tanaka M, Katano M. Nuclear factor-kappaB contributes to hedgehog signaling pathway activation through sonic hedgehog induction in pancreatic cancer. Cancer Res. 2006;66:7041-7049. [PubMed] |
| 30. | El-Zaatari M, Tobias A, Grabowska AM, Kumari R, Scotting PJ, Kaye P, Atherton J, Clarke PA, Powe DG, Watson SA. De-regulation of the sonic hedgehog pathway in the InsGas mouse model of gastric carcinogenesis. Br J Cancer. 2007;96:1855-1861. [PubMed] |