修回日期: 2014-06-15
接受日期: 2014-06-19
在线出版日期: 2014-08-18
目的: 为分析异体树突状细胞联合细胞因子诱导杀伤细胞(dendritic cells-cytokine induced killer, DCs-CIK)治疗e抗原持续阳性慢性乙型肝炎患者疗效.
方法: 将2011-10/2013-04于甘肃省第二人民医院肝病科接受聚乙二醇干扰素(polyethylene glycol interferon, PEG-IFN)联合恩替卡韦治疗1年后乙型肝炎病毒(hepatitis B virus, HBV) DNA阴性、乙型肝炎e抗原(hepatitis B e antigen, HBeAg)持续阳性的患者分为A、B两组, A组为在PEG-IFN联合恩替卡韦治疗1年后E系统未发生转换, 同意生物免疫治疗的患者, 在继续原方案抗病毒治疗的同时给予DCs-CIK治疗至96 wk, 共29例; B组为PEG-IFN联合恩替卡韦治疗1年后E系统未发生转换, 不同意接受DCs-CIK生物免疫治疗的患者, 继续原方案抗病毒治疗96 wk, 共32例, 对两种方法治疗后乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)及HBeAg的变化行χ2检验统计分析.
结果: 治疗6个疗程时, 治疗组三系统HBsAg及HBeAg阴转率分别为: 11/29(37.9%)、17/29(58.6%), HBsAg及HBeAg定量的消失率分别为: 5/29(17.2%)、15/29(51.7%), 对照组HBsAg及HBeAg阴转率分别为: 3/32(9.3%)、10/32(31.3%), 消失率为别为: 2/32(6.2%)、9/32(28.1%), 两组比较差异有统计学意义(P<0.05), DCs-CIK治疗组HBsAg及HBeAg阴转率及定量消失率显著高于对照组.
结论: DCs-CIK联合PEG-IFN、恩替卡韦治疗e抗原持续阳性肝病患者可取得更好疗效.
核心提示: 树突状细胞联合细胞因子诱导杀伤细胞(dendritic cell-cytokine induced killer, DC-CIK)目前临床主要应用于临床治疗各种恶性肿瘤, DC细胞具有强大的抗原提呈功能, 能激活、调动人体的免疫反应, 促使其他免疫细胞杀伤肿瘤细胞及受病毒感染的细胞. 其中CIK细胞能直接精确地杀伤肿瘤细胞及受病毒感染的细胞, 而不损伤任何正常组织. DC及CIK细胞是细胞免疫治疗的2个重要组成部分, 两者联合可确保高效的免疫反应.
引文著录: 张文杰, 杜鹏. 异体DCs-CIK应用于HBeAg持续阳性慢性乙型肝炎患者的临床疗效. 世界华人消化杂志 2014; 22(23): 3490-3494
Revised: June 15, 2014
Accepted: June 19, 2014
Published online: August 18, 2014
AIM: To analyze the curative effect of allogeneic dendritic cells-cytokine induced killer (DCs-CIK) in hepatitis B e antigen (HBeAg) positive patients with chronic hepatitis B.
METHODS: From October 2011 to April 2013, the chronic hepatitis B patients whose hepatitis B virus DNA became negative and HBeAg was positive persistently after treatment with pegylated interferon combined with entecavir at our department for 1 year were divided into two groups: A and B. Group A (n = 29) was treated with the original antiviral treatment combined with DCs-CIK for 96 wk, while group B (n = 32) was still treated with pegylated interferon combined with entecavir for 96 wk and did not receive DCs-CIK. The efficacy was compared between the two groups.
RESULTS: After 6 cycles of treatment, the negative conversion rates of hepatitis B surface antigen (HBsAg) and HBeAg in group A were 11/29 (37.9%) and 17/29 (58.6%), respectively. The disappearance rates of HBsAg and HBeAg were 5/29 (17.2%) and 15/29 (51.7%), respectively. In group B, the negative conversion rates of HBsAg and HBeAg were 3/32 (9.3%) and 10/32 (31.3%), respectively; and the disappearance rates of HBsAg and HBeAg were 2/32 (6.2%) and 9/32 (28.1%), respectively. The negative conversion rates and disappearance rates of HBsAg and HBeAg were significantly higher in group A than in group B (P < 0.05).
CONCLUSION: TCs-CIK combined with pegylated interferon and entecavir can achieve a better curative effect than pegylated interferon and entecavir in HBeAg positive chronic hepatitis B patients.
- Citation: Zhang WJ, Du P. Efficacy of allogeneic DCs-CIK in HBeAg positive chronic hepatitis B patients. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3490-3494
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3490.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3490
DNA复制的慢性乙型肝炎(chronic hepatitis B, CHB)患者, 如不积极治疗, 有进展为肝硬化、肝癌的风险[1], 其中80%的肝癌患者在亚洲, 中国最多, 原发性肝癌在中国癌症死亡患者中居第2位[2]. 研究表明e抗原阳性的CHB患者罹患原发性肝癌的风险显著升高[3], 现有的抗病毒治疗方案仍不尽人意[4], 这种持续的CHB状态与免疫耐受有关, 打破CHB患者对乙型肝炎病毒(hepatitis B virus, HBV)的免疫耐受促使E系统转换是有效的控制甚至清除HBV的方法, 在降低肝癌风险中有十分重要的作用, 树突状细胞(dendritic cell, DC)在打破这种免疫耐受的调节中起到了重要的作用, 通过调节其他免疫细胞对感染肝炎病毒的细胞清除[5], 通过体外细胞培养方法激活和大量增殖患者自身的树突状细胞(dendritic cell, DC)及细胞因子诱导的杀伤细胞(cytokine induced killer, CIK)后, 回输患者体内, 直接提高患者的抗病毒能力, 对乙型肝炎病毒(hepatitis B virus, HBV)有较强的抑制或清除作用[6,7]. 本文现将对甘肃省第二人民医院肝病科e抗原持续阳性的患者经树突状细胞联合细胞因子诱导杀伤细胞(dendritic cells-cytokine induced killer, DCs-CIK)治疗后的资料分析总结如下.
选择2011-10/2013-04于甘肃省第二人民医院肝病科经聚乙二醇干扰素α-2a(polyethylene glycol interferon alpha-2a, PEG-IFNα-2a)联合恩替卡韦治疗1年后e抗原持续阳性、HBV DNA阴性的CHB患者61例, 诊断均符合《慢性乙型肝炎防治指南》(2010)中关于慢性乙型病毒性肝炎的标准, 其中包括1例乙型肝炎进展为肝硬化、肝癌的患者, 分为A、B两组, A组为上述方案治疗1年后E系统未发生转换, 同意生物免疫治疗的患者, 继续PEG-IFN联合恩替卡韦抗病毒治疗的同时给予DC-CIK治疗至96 wk, 共29例; B组为PEG-IFN联合恩替卡韦治疗1年后E系统未发生转换, 不同意用DC-CIK生物免疫治疗的患者, 继续PEG-IFN联合恩替卡韦抗病毒治疗至96 wk, 共32例, 其中男性39例, 女性22例, 年龄30-65岁, 平均年龄46岁.
1.2.1 PEG-IFNα-2a联合恩替卡韦治疗1年后e抗原持续阳性的患者联合DC-CIK治疗至96 wk(A组): 本研究将PEG-IFNα-2a联合恩替卡韦治疗CHB 48 wk后HBeAg持续阳性, E系统未发生转换、HBV DNA阴性的患者作为研究对象, 同意联合DCs-CIK治疗的患者分至A组, 即研究组, 采用原方案联合DCs-CIK细胞治疗, 总疗程为96 wk, 具体方案为: PEG-IFNα-2a 180 μg, 皮下注射, 1次/wk, 恩替卡韦0.5 mg, 口服1次/d, DCs-CIK(1×107)每4 wk静脉输注1次, 每8 wk记一疗程, 每一疗程结束时用ELISA法检测乙型肝炎三系统及电化学发光法定量检测乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)、乙型肝炎表面抗体(hepatitis B surface antibody, HBsAb)及乙型肝炎e抗原(hepatitis B e antigen, HBeAg)的变化情况, 分析治疗效果. 比较HBsAg及HBeAg血清学转换率.
1.2.2 PEG-IFNα-2a联合恩替卡韦治疗1年后e抗原持续阳性患者延长疗程至96 wk: 本研究将PEG-IFNα-2a联合恩替卡韦治疗CHB 48 wk后HBV DNA阴性, HBeAg持续阳性不同意DCs-CIK治疗的患者分至B组, 即对照组, 继续给予PEG-IFNα-2a联合恩替卡韦治疗48 wk, 总疗程为96 wk, 具体方案为: PEG-IFNα-2a 180 μg, 皮下注射, 1次/wk, 恩替卡韦0.5 mg, 口服1次/d, 不给予DCs-CIK治疗, 每4 wk用ELISA法检测乙型肝炎三系统及电化学发光法定量检测HBsAg、HBsAb及HBeAg的变化情况, 分析治疗效果. 所用DCs-CIK由中国国家干细胞基地提供, 治疗前签署知情同意书, 并获得医院伦理委员会许可. ELISA法所用试剂由上海科华生物技术有限公司提供, 电化学发光法所用试剂由罗氏公司提供.
1.2.3 疗效判定: 两组患者经上述方案治疗后, 每4 wk检测乙型肝炎三系统及HBsAg、HBsAb及HBeAg定量情况, 两两比较统计学分析评价哪种方法更优.
统计学处理 所有数据均用SPSS19.0统计软件处理. χ2检验分析两种方案治疗后, 两组患者HBsAg及HBeAg变化有无统计学差异, P<0.05为差异有统计学意义.
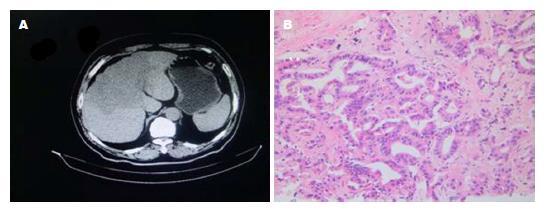
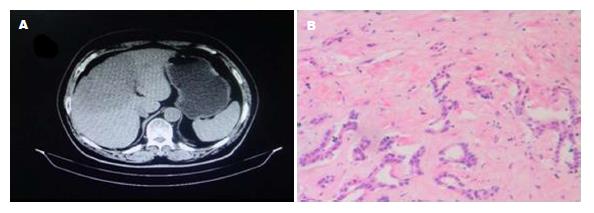
本研究资料显示, 一部分e抗原阳性的慢性乙型肝炎患者经PEG-IFNα-2a联合恩替卡韦治疗48 wk后, 虽然HBV DNA定性为阴性, 定量低于最低检测线, 但HBeAg在治疗48 wk后仍未发生转换, 表现为持续阳性, 通过延长疗程及延长疗程的同时联合DCs-CIK治疗至96 wk时发现, A组HBsAg及HBeAg阴转率显著高于B组(P<0.05), 多例患者经原方案联合DCs-CIK治疗3个疗程后出现乙型肝炎三系统HBsAg、HBeAg转阴, HBsAg、HBeAg定量小于最低检测值下线. 图1为一HBeAg阳性的CHB后肝癌患者典型病例图组, 此患者诊断为CHB(HBeAg阳性)后, 因不同意联合PEG-IFNα-2a治疗, 给予阿德福韦脂10 mg, 1次/d, 口服治疗, 约2年时间未来医院就诊, 2012-03再次就诊后, 查乙型肝炎三系统为HBeAg阳性, 计算机断层扫描(computer tomography, CT)示: 肝右叶占位, 已不能手术切除, 肝穿病理: 胆管细胞癌中分化(图1). 因患者卡氏评分90分以上, 给予PEG-IFNα-2a 180 μg, 皮下注射, 1次/wk, 联合恩替卡韦0.5 mg, 口服1次/d, 同时给予经皮选择性肝动脉造影栓塞3次, 48 wk后, 瘤体无明显增大, 但HBeAg仍阳性, HBsAg定量仍在2000 COI左右, 后继续原方案并联合DCs-CIK治疗48 wk, 患者CT示: 瘤体有所缩小, 再次肝穿病理: 胆管细胞癌高中分化(图2), 查乙型肝炎三系统: HBsAg及HBeAg均转阴, HbsAb转阳. HBsAg及HBeAg定量小于最低检测线, HBsAg: 456 IU/mL.
对于经PEG-IFNα-2a联合恩替卡韦治疗48 wk后, HBeAg持续阳性的CHB患者, 在原方案治疗的基础上联合DCs-CIK治疗, 治疗组患者在3、4、5、6个疗程时, 乙型肝炎三系统: HBsAg转阴率分别为: 1(3.4%)、5(17.2%)、8(27.6%)、11(37.9%), HBeAg转阴率分别为: 2(6.9%)、8(27.6%)、13(44.8%)、17(58.6%), HBsAg定量低于最低检测线的病例数分别为: 0、1(3.4%)、3(10.3%)、5(17.2%), HBeAg定量低于最低检测线的病例数分别为: 1(3.4%)、6(20.7%)、10(34.5%)、15(51.7%); 对照组患者在3、4、5、6个疗程时, 乙型肝炎三系统: HBsAg转阴率分别为: 0.0%、0.0%、3.1%、6.3%, HBeAg转阴率分别为: 0(0.0%)、2(6.3%)、7(21.8%)、10(31.3%), HBsAg定量低于最低检测线的病例数分别为: 0(0.0%)、0(0.0%)、1(3.1%)、2(6.2%), HBeAg定量低于最低检测线的病例数分别为: 0、2(6.2%)、5(15.6%)、9(28.1%). 乙型肝炎三系统检测A组患者HbsAb阳性3例, B组出现1例, 患者经统计学分析, 1、2个疗程时, 两组比较无统计学意义, 未在表中显示. 治疗4、5、6个疗程时, A、B两组均出现HBsAg及HBeAg下降及消失病例, 经χ2检验分析, 两组比较差异有统计学意义, 两组HbsAg变化比较χ2值为36.7, P<0.05, 两组HbeAg变化比较χ2值为30.39, P<0.05, 两组HBsAg及HBeAg变化综合比较, χ2值为67.1, P = 0.01, 得出结论: DCs-CIK治疗组疗效显著优于对照组. 具体结果如表1.
| 分组 | 3个疗程 | 4个疗程 | 5个疗程 | 6个疗程 | ||||
| HBsAg | HBeAg | HBsAg | HBeAg | HBsAg | HBeAg | HBsAg | HBeAg | |
| A组 | ||||||||
| 消失 | 0 | 1 | 1 | 6 | 3 | 10 | 5 | 15 |
| 下降 | 7 | 8 | 10 | 13 | 9 | 9 | 13 | 8 |
| 无应答 | 21 | 19 | 14 | 8 | 12 | 7 | 5 | 4 |
| 转阴n(%) | 1(3.4) | 2(6.9) | 5(17.2) | 8(27.6) | 8(27.6) | 13(44.8) | 11(37.9) | 17(58.6) |
| 合计 | 29 | 29 | 29 | 29 | 29 | 29 | 29 | 29 |
| B组 | ||||||||
| 消失 | 0 | 0 | 0 | 2 | 1 | 5 | 2 | 9 |
| 下降 | 5 | 6 | 9 | 11 | 13 | 14 | 16 | 14 |
| 无应答 | 27 | 26 | 23 | 19 | 17 | 11 | 12 | 9 |
| 转阴n(%) | 0(0.0) | 0(0.0) | 0(0.0) | 2(6.3) | 1(3.1) | 7(21.8) | 3(9.3) | 10(31.3) |
| 合计 | 32 | 32 | 32 | 32 | 32 | 32 | 32 | 32 |
特异性细胞免疫在抗病毒过程中发挥十分重要的作用, DC是已知的能力最强的抗原递呈细胞, 能在体内外直接激活其他免疫细胞, 如CIK、T细胞、DC-CIK及T细胞在诱导特异性免疫应答清除HBV感染中起关键作用[8,10]. DCs-CIK细胞免疫疗法目前被认为是打破肿瘤免疫逃逸及HBV感染后免疫耐受的有效方法[11], DC-CIK通过体外培养, 使之激活和大量扩增, 然后回输患者体内, 不但可以启动CHB患者抗病毒免疫应答反应, 而且还可以增强患者细胞毒性T淋巴细胞(cytotoxic lymphocyte)杀伤病毒感染细胞的能力及分泌抑制病毒复制的细胞因子的能力. IFN仅是最早应用于抗HBV感染的药物, 是具有抗病毒和免疫调节功能的细胞因子[12], 应用于治疗CHB后, 也取得了一定的可喜疗效, 但HBsAg及HBeAg消失、转换率仍较低, 本研究结果显示, DC-CIK细胞免疫疗法与干扰素的联合应用可以对患者体内的免疫细胞及细胞因子进行全面的调节, 可取得更好的疗效.
本研究资料中, 治疗组患者在3、4、5、6个疗程时, 乙型肝炎三系统化验提示HBsAg转阴率分别为: 1(3.4%)、5(17.2%)、8(27.6%)、11(37.9%), HBsAg定量结果提示低于最低检测线的病例数分别为: 0、1(3.4%)、3(10.3%)、5(17.2%), HBeAg转阴率分别为: 2(6.9%)、8(27.6%)、13(44.8%)、17(58.6%), HBeAg定量结果提示低于最低检测线的病例数分别为: 1(3.4%)、6(20.7%)、10(34.5%)、15(51.7%); 而未联合DC-CIK治疗的对照组患者在3、4、5、6个疗程时, 乙型肝炎三系统化验提示HBsAg转阴率分别为: 0.0%、0.0%、3.1%、6.3%, HBsAg定量结果提示低于最低检测线的病例数分别为: 0(0.0%)、0(0.0%)、1(3.1%)、2(6.2%), HBeAg转阴率分别为: 0(0.0%)、2(6.3%)、7(21.8%)、10(31.3%), HBeAg定量结果提示低于最低检测线的病例数分别为: 0、2(6.2%)、5(15.6%)、9(28.1%). 经统计学分析, 1、2个疗程时, 两组比较无统计学意义, 3-6个疗程时, 两组比较差异有统计学意义(P<0.05). 在PEG-IFN用于治疗CHB以来, CHB抗病毒治疗虽已取得一定进展, 但疗效仍有限, HBsAg消失率在干扰素联合核苷类药治疗1年后随访24 wk和3年时分别为3%和8%[13,14], HBeAg阳性患者, 经PEG-IFNα-2a联合恩替卡韦治疗48 wk后, 停药随访24、48 wk时, HBeAg血清学转换率也分别只有32%和42%[15], 这与显著低于本研究结果: 治疗6个疗程时HBsAg消失率17.2%, HBeAg阴转率58.6%, 且该结果在治疗过程中即观察得到. 两组患者HbsAg检测结果比较无统计学意义, 如果延长疗程, 可能获得不同的结果.
对于HBeAg持续阳性的患者, 目前诊断主要与免疫耐受有关, 且不易打破这种免疫耐受的状态, 此类患者肿瘤发生率会显著升高[16,17]. 本研究结果显示, DC-CIK细胞疗法联合干扰素治疗CHB, 其对患者的抗病毒免疫能力的调节是逐渐增强的, 这种方法的抗病毒能力是持续的, 随时间的延长, 治疗效果越好. 但因本研究为小样本的临床研究, 目前仍需临床大样本的研究来进一步论证.
目前, 慢性乙型肝炎抗病毒治疗效果仍不理想, 特别是乙型肝炎e抗原(hepatitis B e antigen, HBeAg)阳性的慢性乙型肝炎患者肿瘤发生的风险显著升高, 故需继续探索有效的抗乙型肝炎病毒(hepatitis B virus)治疗的方法.
王凯, 教授, 山东大学齐鲁医院肝病科; 杨江华, 副教授, 安徽省芜湖市, 皖南医学院弋矶山医院感染科.
树突状细胞联合细胞因子诱导杀伤细胞(dendritic cell-cytokine induced killer, DC-CIK)在肿瘤治疗中已广泛应用于临床, 属生物治疗领域的较新学科, 研究发现DC-CIK有较强的免疫调节功能. 因此, 生物治疗相关技术成为了目前研究的热点.
目前已有部分学者探索性的将DC-CIK应用于临床治疗慢性乙型肝炎, 但用异体DC-CIK治疗HBeAg"持续阳性"的慢性患者的报道, 国内外未见.
本文具有一定临床指导意义.
编辑 田滢 电编 都珍珍
| 1. | 耿 建章, 范 晓红, 陆 海英, 李 静, 田 秀兰, 徐 小元. 乙型肝炎肝硬化失代偿期初始拉米夫定和阿德福韦酯联合抗病毒治疗的疗效观察. 临床肝胆病杂志. 2011;27:837-839, 843. |
| 2. | Hao MZ, Lin HL, Chen Q, Ye YB, Chen QZ, Chen MS. Efficacy of transcatheter arterial chemoembolization combined with cytokine-induced killer cell therapy on hepatocellular carcinoma: a comparative study. Chin J Cancer. 2010;29:172-177. [PubMed] |
| 5. | Li RB, Chen HS, Xie Y, Fei R, Cong X, Jiang D, Wang SX, Wei L, Wang Y. Dendritic cells from chronic hepatitis B patients can induce HBV antigen-specific T cell responses. World J Gastroenterol. 2004;10:1578-1582. [PubMed] |
| 7. | Ma YJ, He M, Han JA, Yang L, Ji XY. A clinical study of HBsAg-activated dendritic cells and cytokine-induced killer cells during the treatment for chronic hepatitis B. Scand J Immunol. 2013;78:387-393. [PubMed] [DOI] |
| 8. | Shimizu Y. T cell immunopathogenesis and immunotherapeutic strategies for chronic hepatitis B virus infection. World J Gastroenterol. 2012;18:2443-2451. [PubMed] |
| 9. | 司 方明, 娄 海山, 郑 鹏远, 熊 灵军, 范 毅凯, 李 俊红, 白 经修. 树突状细胞治疗HBeAg阴性慢性乙型肝炎患者的临床观察. 世界华人消化杂志. 2007;15:3746-3748. [DOI] |
| 10. | Lu XY. Pathogenesis of hepatitis B virus (HBV)-mediated liver injury. NAJ Med Sci. 2011;4:1-6. |
| 13. | Marcellin P, Lau GK, Bonino F, Farci P, Hadziyannis S, Jin R, Lu ZM, Piratvisuth T, Germanidis G, Yurdaydin C. Peginterferon alfa-2a alone, lamivudine alone, and the two in combination in patients with HBeAg-negative chronic hepatitis B. N Engl J Med. 2004;351:1206-1217. [PubMed] |
| 14. | Marcellin P, Bonino F, Lau GK, Farci P, Yurdaydin C, Piratvisuth T, Jin R, Gurel S, Lu ZM, Wu J. Sustained response of hepatitis B e antigen-negative patients 3 years after treatment with peginterferon alpha-2a. Gastroenterology. 2009;136:2169-2179.e1-4. [PubMed] [DOI] |
| 16. | Lau GK, Piratvisuth T, Luo KX, Marcellin P, Thongsawat S, Cooksley G, Gane E, Fried MW, Chow WC, Paik SW. Peginterferon Alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B. N Engl J Med. 2005;352:2682-2695. [PubMed] |
| 17. | Piratvisuth T, Lau G, Chao YC, Jin R, Chutaputti A, Zhang QB, Tanwandee T, Button P, Popescu M. Sustained response to peginterferon alfa-2a (40 kD) with or without lamivudine in Asian patients with HBeAg-positive and HBeAg-negative chronic hepatitis B. Hepatol Int. 2008;2:102-110. [PubMed] [DOI] |