修回日期: 2014-06-15
接受日期: 2014-06-19
在线出版日期: 2014-08-18
目的: 探讨硫化氢(sodium hydrogen, H2S)在磷酯酰肌醇3激酶(phosphoinositide-3-kinase, PI3K)/AKT/糖原合成酶激酶-3β(glycogen synthesis kinase-3β, GSK-3β)信号通路中对大鼠肝纤维化的影响
方法: 选择硫氢化钠(sodium hydrogen, NaHS)作为H2S的供体, LY294002作为PI3K/AKT的特异性阻断剂. 将48只♀SD大鼠随机分为6组: 正常对照组(N组)8只、肝纤维化组(C组)8只、肝纤维化+DMSO溶剂对照组(D组)8只、肝纤维化+PI3K/AKT信号通路抑制剂LY294002组(LY组)8只、肝纤维化+NaHS组(S组)8只、肝纤维化+LY294002+NaHS组(LS组)8只, 采用四氯化碳复合因素复制肝纤维化模型, 干预剂以腹腔注射, 1次/d, 共注射12次. 具体如下: (1)N组和C组: 腹腔注射0.9%氯化钠注射液, 剂量为6 mL/kg体质量; (2)D组: 腹腔注射2‰DMSO溶液, 剂量为6 mL/kg体质量; (3)LY组: 腹腔注射LY294002溶液, 剂量为0.3 mg/(kg•d); (4)S组: 腹腔注射NaHS溶液, 剂量为56 μmol/(kg•d); (5)LS组, 同时注射LY294002溶液和NaHS溶液, 剂量同LY组和S组, 将两种溶液于腹腔的两侧注入, 而非同侧腹腔注射. 干预结束后, 宰杀大鼠留取肝脏行肝组织病理切片HE染色评价肝纤维化分期, 应用Western blot法检测肝脏中GSK-3β表达.
结果: NaHS干预组和肝硬化组相比, GSK-3β表达下降(P<0.01), 与肝纤维化分期结果一致(P<0.01). 与LY294002+NaHS干预组相比较, GSK-3β在LY294002干预组中表达增高(P<0.01); 在NaHS干预组中表达下降(P<0.01), 与肝纤维化分期结果一致(P<0.01).
结论: H2S可以通过PI3K/AKT信号通路抑制GSK-3β表达, 并延缓大鼠肝纤维化过程, 阻碍肝纤维化的发展.
核心提示: 硫化氢(sodium hydrogen, H2S)作为一种新型的气体信号分子, 其抗纤维化作用与其对肝细胞的保护作用相关. 本研究表明H2S可通过磷酯酰肌醇3激酶(phosphoinositide-3-kinase)/AKT信号通路抑制糖原合成酶激酶-3β蛋白的表达, 减轻大鼠肝纤维化过程中肝细胞的损伤及凋亡, 阻碍肝纤维化的发生、发展. 为肝纤维化的临床治疗提供了理论基础.
引文著录: 张传峰, 岳雅伦, 张宁, 宋丽秀, 赵强, 杨新疆, 陈卫刚, 郑勇. H2S在PI3K/AKT/GSK-3β信号通路中对大鼠肝纤维化的影响. 世界华人消化杂志 2014; 22(23): 3445-3451
Revised: June 15, 2014
Accepted: June 19, 2014
Published online: August 18, 2014
AIM: To investigate whether hydrogen sulfide (H2S) delays the process of experimental hepatic fibrosis through the phosphoinositide-3-kinase (PI3K)/AKT/glycogen synthesis kinase-3β (GSK-3β) signal pathway.
METHODS: Sodium hydrogen sulphide (NaHS) was selected as the donor of H2S and LY294002 as the specific blocker of PI3K/AKT signaling. Forty-eight female SD rats were divided randomly and equally into 6 groups: a normal group (N group), a liver fibrosis group (C group), a DMSO group (D group), an LY294002 intervention group (LY group), a NaHS intervention group (S group), and an LY294002 + NaHS intervention group (LS group). Liver fibrosis was induced in rats with carbon tetrachloride. The above agents were given by intraperitoneal injection, once a day for a total of 12 times. For the N group and C group, 0.9% sodium chloride injection (6 mL/kg of body mass) was intraperitoneally injected; for the D group, 2‰ DMSO (6 mL/kg of body mass) was given; for the LY group, LY294002 solution 0.3 mg/(kg•d) was given; for the S group, NaHS solution 56 μmol/(kg•d) was given; for the LS group, NaHS and LY294002 were given simultaneously. Fibrosis was staged using histopathological methods. The expression of GSK-3β was detected by Western blot.
RESULTS: Compared to the C group, the stage of fibrosis was downgraded (P < 0.01) and the expression of GSK-3β was decreased (P < 0.01) in the S group. Compared to the LS group, the expression of GSK-3β was increased in the LY group (P < 0.01) and was decreased in the S group (P < 0.01), and the stage of fibrosis in the S group was also downgraded (P < 0.01).
CONCLUSION: H2S can decrease the expression of GSK-3β and delay the process of liver fibrosis in rats through the PI3K/AKT/GSK-3β signal pathway.
- Citation: Zhang CF, Yue YL, Zhang N, Song LX, Zhao Q, Yang XJ, Chen WG, Zheng Y. Hydrogen sulfide delays process of experimental hepatic fibrosis in rats through PI3K/AKT/GSK-3β signal pathway. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3445-3451
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3445.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3445
肝细胞的损伤包括凋亡和坏死, 与肝纤维化的联系越来越引起重视[1,2]. 目前有文献报道磷酯酰肌醇3激酶(phosphoinositide-3-kinase, PI3K)/AKT信号通路对肝细胞保护发挥着调控作用[3-5]. 糖原合成酶激酶-3β(glycogen synthesis kinase-3β, GSK-3β)是PI3K/AKT信号通路的下游分子, GSK-3β可以激活细胞凋亡的相关蛋白激酶半胱氨酸特异的天门冬氨酸蛋白酶Caspase家族的Caspase3、Caspase9, 造成核蛋白的分解与DNA链的剪切断裂, 从而诱导细胞凋亡[6]. 硫化氢(sodium hydrogen, H2S)对肝纤维化有明显的细胞保护作用目前已为广泛接受[7-13]. 本实验组前期试验也表明[14]: 在H2S缺乏的状态下, 肝硬化大鼠肝细胞的凋亡增加, 但其具体机制尚不清楚, 有待于进一步研究. 对于H2S是否通过PI3K/AKT/GSK-3β信号通路参与肝细胞的保护作用以达到抗纤维化的研究仍不清楚. 因此本实验在建立肝纤维化模型的基础上给予H2S和PI3K/AKT信号通路的特异性抑制剂LY294002进行干预, 并观察GSK-3β的变化, 以探讨外源性H2S是否通过PI3K/AKT信号通路产生抗纤维化作用.
实验大鼠48只购自新疆医科大学实验动物中心, 均为同期出生、纯种系、SPF级4-5周龄的健康♀SD大鼠, 体质量180-220 g. 硫氢化钠(美国Sigma公司, MW: 56.06 g/mol), LY294002(美国Sigma公司, MW: 343.80 g/mol), DMSO(美国Amresco公司), 兔抗PI3K p110 α单克隆抗体、兔抗p-AKT(Ser473)单克隆抗体、兔抗GSAK-3β(美国CST公司), 小鼠抗β-actin单克隆抗体、山羊抗兔IgG/辣根酶标记二抗、山羊抗小鼠IgG/辣根酶标记二抗(北京中杉金桥生物技术有限公司). 其他试剂均为市售化学纯.
1.2.1 制备模型及实施干预: 将48只♀SD大鼠购回后适应性喂养1 wk后, 随机分为6组, 即正常对照组(N组)8只、肝纤维化组(C组)8只、肝纤维化+DMSO溶剂对照组(D组)8只、肝纤维化+PI3K/AKT信号通路抑制剂LY294002组(LY组)8只、肝纤维化+NaHS组(S组)8只、肝纤维化+LY294002+NaHS组(LS组)8只. 根据既往方法, 采用四氯化碳复合因素法复制肝纤维化模型. 自建模第6周开始, 干预剂以腹腔注射, 1次/d, 共注射12次. 具体如下: (1)N组和C组: 腹腔注射0.9%氯化钠注射液, 剂量为6 mL/kg体质量; (2)D组: 腹腔注射2‰DMSO溶液, 剂量为6 mL/kg体质量; (3)LY组: 腹腔注射LY294002溶液, 剂量为0.3 mg/(kg•d); (4)S组: 腹腔注射NaHS溶液, 剂量为56 μmol/(kg•d); (5)LS组: 同时两侧注入LY294002溶液和NaHS溶液, 剂量同LY组和S组. 干预结束后, 将大鼠用乙醚麻醉后, 切取肝组织, 取大鼠肝左叶以40 g/L中性甲醛溶液固定, 其余肝脏投入液氮速冻后置于-80 ℃备用.
1.2.2 肝组织学观察: 行病理组织切片HE染色评价肝纤维化分期, 行HE染色观察肝纤维化分期, 分期标准符合《病毒性肝炎肝炎防治方案》[15].
1.2.3 Western blot法检测肝组织中PI3K、p-AKT、GSK-3β的表达: 利用组织匀浆器提取蛋白后, 经10%SDS-PAGE凝胶分离后, 采用半干法转膜, 经5%BSA封闭后, 一抗4 ℃孵育过夜, 二抗内室温摇床上孵育2 h, 化学发光, 曝光, 于凝胶成像系统中采集图像分析.
统计学处理 采用SPSS17.0统计软件进行分析, 计量资料数据以mean±SD表示, 选择单因素方差分析进行均数差异性比较, 多样本两两比较选择Bonferron法; 肝纤维化分期半定量资料的比较采用多样本比较的秩和检验(Kruskal-Wallis法), 多样本间两两比较时选择Nemenyi法; P<0.05为差异有统计学意义.
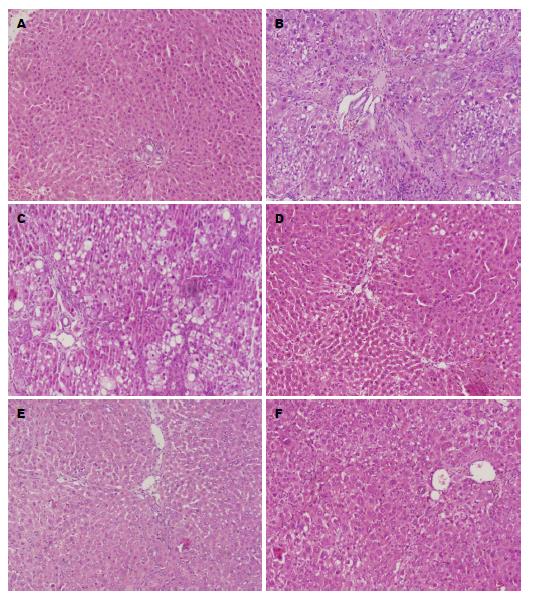
N组肝小叶结构清晰, 小叶内肝细胞排列整齐, 无脂肪变性、坏死, 无炎症细胞浸润及纤维结缔组织增生. C组肝小叶结构紊乱, 纤维结缔组织增生、假小叶形成; 部分肝细胞体积增大、胞浆内可见大小不等圆形空泡, 可见气球样变; 有大量炎性细胞浸润. D组肝组织形态学改变基本同C组, 肝细胞排列紊乱, 汇管区纤维结缔组织明显增生, 大量的纤维结缔组织向肝小叶内延伸, 包绕形成假小叶, 汇管区有明显的炎细胞浸润. LY组肝内肝细胞排列不整齐, 汇管区见纤维结缔组织增生, 纤维间隔菲薄, 部分溶解消失, 肝细胞脂肪变性、坏死以及炎性细胞浸润较D组减轻. S组肝组织仍可见假小叶结构, 但部分区假小叶纤维间隔变窄或局灶模糊不清, 肝细胞脂肪变性、坏死以及炎细胞浸润较C组为轻. LS组肝内肝细胞排列均不整齐, 有不同程度的纤维结缔组织增生, 和肝细胞脂肪变性、坏死以及炎性细胞浸润, 但介于S组、LY组之间. 各组间比较, 差异均具有统计学意义(表1, 图1).
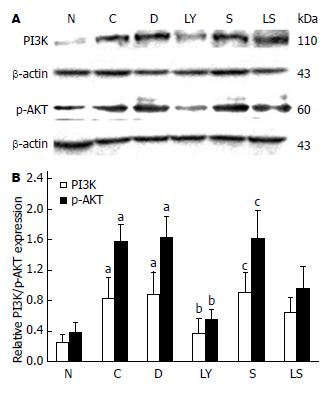
N组肝组织中有少量PI3K、p-AKT蛋白表达. C组、D组肝组织中PI3K、p-AKT蛋白较N组表达显著增多, 差异均具有统计学意义(P<0.01), 而C组与D组间表达则无差异. 给予特异性阻断剂LY294002干预的LY组肝脏中以上两蛋白较C组和D组显著减少, 差异均具有统计学意义(P<0.01). S组PI3K、p-AKT蛋白表达与C组、D组无明显差异. LS组中PI3K、p-AKT蛋白表达较LY组增多, 但较S组表达减少, 差异均具有统计学意义(P<0.01或P<0.05)(图2).
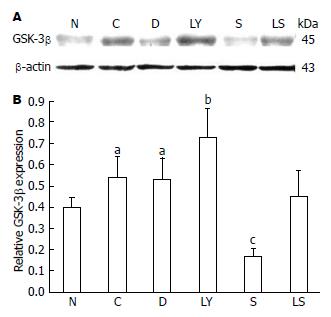
N组肝组织中有少量GSK-3β蛋白表达. C组、D组肝组织中GSK-3β蛋白较N组表达显著增多, 差异均具有统计学意义(P<0.05), 而C组与D组间表达则无差异. 给予特异性阻断剂LY294002干预的LY组肝脏中GSK-3β蛋白较C组和D组显著增多, 差异均具有统计学意义(P<0.01). S组GSK-3β蛋白表达与C组、D组显著减少, 差异均具有统计学意义(P<0.01). LS组中GSK-3β蛋白表达较LY组增多, 但较S组表达减少, 差异均具有统计学意义(均P<0.01)(图3).
在肝纤维化形成过程中, 肝细胞发生炎症、坏死及凋亡, 释放的脂质过氧化物等激活肝星状细胞(hepatic stellate cell, HSC), 活化后的HSC合成大量的细胞外基质(extracellular matrix, ECM), 过多的ECM不断在肝脏内沉积并最终导致肝纤维化[16]. 同时非实质细胞会侵入替代缺失的肝组织. 在这些共同的作用下, 肝小叶结构会慢慢变的紊乱, 肝实质细胞总数减少, 肝纤维化加重, 形成假小叶.
H2S作为继一氧化碳(carbonic oxide, CO)、一氧化氮(nitric oxide, NO)之后发现的第3种气体信使分子, 其发挥生物效应的重要机制就是调节细胞的增殖与凋亡[17-19]. 有研究显示: H2S同NO、CO一样都参与了肝纤维化的进程以及肝硬化门静脉高压的调节[20,21]; 在H2S缺乏的状态下, 肝硬化大鼠肝细胞的凋亡增加[14]; 这可能与H2S上调抗凋亡蛋白Bcl-2密切相关[10,11]. 本项目组前期给予肝硬化大鼠模型外源性H2S预处理后, 外源性H2S可明显下调肝组织中Ⅰ型、Ⅲ型胶原表达, 起到抗肝纤维化作用[22]. 这提示H2S可能通过减少肝细胞凋亡起到抗纤维化作用.
GSK-3是一种多功能的丝氨酸/苏氨酸蛋白激酶, 除参与糖代谢外, 还参与细胞的分化、增殖和凋亡. GSK-3主要有2种亚型: GSK-3α和GSK-3β, 其中GSK-3β与凋亡的发生关系尤为密切, 可抑制促存活转录因子如C反应元件结合蛋白(C response element binding)、热休克因子1(heat shock factor 1)、热休克蛋白70(heat shock protein 70), 同时GSK-3β可激活Bax、Bcl-2家族成员髓细胞淋巴瘤-1(myeloid cells lymphoma-1), 调节线粒体内多种凋亡相关蛋白的释放, 阻止线粒体通透性转换孔开放, 抑制细胞色素C及凋亡诱导因子释放, 致使Caspase9、Caspase3激活最终引起细胞凋亡[23,24]. GSK-3β在体内受PI3K/AKT信号通路的调控. PI3K/AKT信号通路广泛存在细胞中, 是参与细胞生长、增殖、分化调节、维持周期运行、抑制细胞凋亡的信号转导通路[25,26], PI3K通过具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用, 引起二聚体构象改变而被激活; 或通过Ras和p110直接结合导致PI3K活化[27]. 活化的PI3K促使PDK1磷酸化的Ser308导致AKT活化. 活化的AKT通过磷酸化GSK-3β[28,29], 抑制肝细胞的凋亡, 减轻凋亡肝细胞通过诱导巨噬细胞和细胞吞噬凋亡小体释放促纤维化因子并激活星形细胞的作用, 减轻肝纤维化.
本研究中肝纤维化大鼠中GSK-3β较正常组明显增加(P<0.05), 提示GSK-3β造成了肝细胞的损伤, 促进肝细胞凋亡, 加重了肝纤维化, 给予H2S干预的S组肝内PI3K、p-AKT蛋白比C组中的高, 但结果显示两组间的表达并无明显差异, 但其下游蛋白GSK-3β差异却有统计学意义(P<0.01), 这与其肝纤维化程度相符合(P<0.05). 在H2S组GSK-3β较肝纤维化组明显降低(P<0.01), 提示H2S很有可能通过激活PI3K/AKT信号通路, 使磷酸化的AKT增多, 活化的AKT通过磷酸化GSK-3β, 使肝纤维化肝脏中产生的GSK-3β大量减少, 从而达到细胞保护作用, 减少肝细胞的凋亡, 减轻肝纤维化的发展, 这与本项目组的前期实验结果相符合[22].
为了进一步明确H2S是否通过PI3K/AKT信号通路改善肝纤维化, 在给予H2S的基础上同时给予AKT上游激酶PI3K特异抑制剂LY294002, 观察在PI3K/AKT信号通路受到抑制的条件下, H2S对GSK-3β表达的影响. 在给予PI3K特异抑制剂LY294002后, PI3K、p-AKT、GSK-3β较C组、D组表达明显减少, 差异均具有统计学意义(P<0.01). 这是因为LY294002特异性抑制PI3K后, PI3K活化AKT的能力减少, 致使内源性的AKT抑制GSK-3β作用减弱, 从而导致LY组GSK-3β较C组、D组明显增多. 而同时给予H2S和LY94002后, 肝组织中PI3K、p-AKT、GSK-3β介于分别给予H2S和LY294002两组之间, 差异均具有统计学意义(P<0.01). 也就是说H2S逆转了LY294002阻断PI3K/AKT的作用, 这直接证明了H2S可通过PI3K/AKT信号通路发挥细胞保护作用, 从而减轻肝纤维化. 实验中肝纤维化程度从弱到强应依次为S组、LS组、LY组, 但实验中在给予LY294002后LY组并没有出现肝纤维化最严重的现象. 究其原因, 任嫱等[30]在其研究中发现: 当PI3K/AKT信号通路被阻断时, H2S的存在明显增强了LY294002诱导活化HSC的凋亡的作用, 与此同时LY294002对HSC增殖的抑制作用仍然持续. 在给予LY294002后, 内源性H2S可能增强了LY294002的药物敏感性, 抑制了在肝纤维化过程中处于中心环节的HSC的增殖, 并促进HSC的凋亡, 减轻肝纤维化.
本实验在前人基础上更加明确了H2S抗纤维化的作用的PI3K/AKT信号通路机制, 但H2S的抗纤维化作用可能通过多种途径产生的综合作用的结果. 比如钾离子通道、钙离子通道、氯离子通道等离子通道也是H2S发挥生物学效应的重要分子靶点, 以及细胞丝裂原活化蛋白激酶(mitogen activated protein kinase)信号通路、核因子-κB信号通路等也是H2S调节细胞增殖和凋亡的分子机制. 这些靶点及机制可能起到的相似作用以及相互作用还需要进一步深入研究[31-34].
总之, 本研究表明H2S可通过PI3K/AKT信号通路抑制GSK-3β蛋白的表达, 减轻大鼠肝纤维化过程中肝细胞的损伤及凋亡, 阻碍肝纤维化的发生、发展.
硫化氢(sodium hydrogen, H2S)作为一种新型的气体信号传导分子, 其与肝纤维化的联系越来越引起人们的重视, 其抗纤维化作用可能与调节肝细胞的增值与凋亡密切相关. 本课题组前期研究也证实, 其与肝硬化肝细胞凋亡有关.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所.
PI3K/AKT信号通路与细胞增殖、凋亡及转化等生物学行为密切相关, 近年来备受瞩目. H2S通过PI3K/AKT信号通路产生的细胞保护作用近年来成为研究中的热点. 但在抗肝纤维化方面的报道较少.
于水等研究发现外源性H2S后处理通过PI3K/AKT信号通路减轻离体大鼠心肌缺血再灌注的损伤. 而应用信号通路抑制剂(LY294002)阻断PI3K/AKT通路后, H2S对心肌细胞的保护作用被抵消, 这说明H2S通过PI3K/AKT信号通路参与了心肌细胞的保护作用.
本实验通过给予H2S供体(NaHS)及PI3K/AKT信号通路特异性阻断剂(LY294002)干预, 观察肝脏组织病理学变化以及PI3K、p-AKT及其下游蛋白GSK-3β表达的变化, 为明确H2S产生的抗肝纤维化机制提供了理论基础.
H2S通过PI3K/AKT信号通路抑制其下游蛋白GSK-3β的表达在保护肝细胞和缓解肝纤维化过程中起到重要的作用. 本文为肝纤维化的临床治疗提供了理论支持.
本文结果有一定的科学意义, 研究设计合理, 研究内容新颖.
编辑 田滢 电编 都珍珍
| 4. | Han JW, Zhan XR, Li XY, Xia B, Wang YY, Zhang J, Li BX. Impaired PI3K/Akt signal pathway and hepatocellular injury in high-fat fed rats. World J Gastroenterol. 2010;16:6111-6118. [PubMed] |
| 5. | Matsuda S, Kobayashi M, Kitagishi Y. Roles for PI3K/AKT/PTEN Pathway in Cell Signaling of Nonalcoholic Fatty Liver Disease. ISRN Endocrinol. 2013;2013:472432. [PubMed] [DOI] |
| 6. | Bijur GN, Jope RS. Proapoptotic stimuli induce nuclear accumulation of glycogen synthase kinase-3 beta. J Biol Chem. 2001;276:37436-37442. [PubMed] |
| 7. | Elrod JW, Calvert JW, Morrison J, Doeller JE, Kraus DW, Tao L, Jiao X, Scalia R, Kiss L, Szabo C. Hydrogen sulfide attenuates myocardial ischemia-reperfusion injury by preservation of mitochondrial function. Proc Natl Acad Sci U S A. 2007;104:15560-15565. [PubMed] |
| 8. | Qu K, Chen CP, Halliwell B, Moore PK, Wong PT. Hydrogen sulfide is a mediator of cerebral ischemic damage. Stroke. 2006;37:889-893. [PubMed] |
| 9. | Kang K, Zhao M, Jiang H, Tan G, Pan S, Sun X. Role of hydrogen sulfide in hepatic ischemia-reperfusion-induced injury in rats. Liver Transpl. 2009;15:1306-1314. [PubMed] |
| 10. | Jha S, Calvert JW, Duranski MR, Ramachandran A, Lefer DJ. Hydrogen sulfide attenuates hepatic ischemia-reperfusion injury: role of antioxidant and antiapoptotic signaling. Am J Physiol Heart Circ Physiol. 2008;295:H801-H806. [PubMed] |
| 11. | Bos EM, Snijder PM, Jekel H, Weij M, Leemans JC, van Dijk MC, Hillebrands JL, Lisman T, van Goor H, Leuvenink HG. Beneficial effects of gaseous hydrogen sulfide in hepatic ischemia/reperfusion injury. Transpl Int. 2012;25:897-908. [PubMed] [DOI] |
| 12. | Tripatara P, Patel NS, Collino M, Gallicchio M, Kieswich J, Castiglia S, Benetti E, Stewart KN, Brown PA, Yaqoob MM. Generation of endogenous hydrogen sulfide by cystathionine gamma-lyase limits renal ischemia/reperfusion injury and dysfunction. Lab Invest. 2008;88:1038-1048. [PubMed] [DOI] |
| 13. | Fu H, Chen H, Wang C, Xu H, Liu F, Guo M, Wang Q, Shi X. Flurbiprofen, a cyclooxygenase inhibitor, protects mice from hepatic ischemia/reperfusion injury by inhibiting GSK-3β signaling and mitochondrial permeability transition. Mol Med. 2012;18:1128-1135. [PubMed] [DOI] |
| 14. | 刘 浩, 郑 勇, 陈 卫刚, 赵 瑾, 李 睿, 张 宁, 刘 芳, 阎 继攀. 内源性硫化氢对肝硬化大鼠肝细胞凋亡的影响. 世界华人消化杂志. 2012;20:670-674. [DOI] |
| 16. | Jiao J, Friedman SL, Aloman C. Hepatic fibrosis. Curr Opin Gastroenterol. 2009;25:223-229. [PubMed] |
| 17. | Bhambhani Y, Singh M. Physiological effects of hydrogen sulfide inhalation during exercise in healthy men. J Appl Physiol (1985). 1991;71:1872-1877. [PubMed] |
| 18. | Couch L, Martin L, Rankin N. Near death episode after exposure to toxic gases from liquid manure. N Z Med J. 2005;118:U1414. [PubMed] |
| 19. | Truong DH, Eghbal MA, Hindmarsh W, Roth SH, O'Brien PJ. Molecular mechanisms of hydrogen sulfide toxicity. Drug Metab Rev. 2006;38:733-744. [PubMed] |
| 20. | Poliakova VS, Shakhlamov VA, Stadnikov AA, Solnyshkova TG. [Structural-biochemical reorganization of rat liver caused by hydrogen sulfide-containing gas mixture]. Morfologiia. 2003;124:84-87. [PubMed] |
| 21. | Fiorucci S, Antonelli E, Mencarelli A, Orlandi S, Renga B, Rizzo G, Distrutti E, Shah V, Morelli A. The third gas: H2S regulates perfusion pressure in both the isolated and perfused normal rat liver and in cirrhosis. Hepatology. 2005;42:539-548. [PubMed] |
| 22. | 赵 强, 陈 卫刚, 赵 瑾, 李 睿, 宋 丽秀, 任 嫱, 杨 新疆, 郑 勇. 硫化氢对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原表达的影响. 世界华人消化杂志. 2013;21:300-306. [DOI] |
| 23. | Frame S, Cohen P. GSK3 takes centre stage more than 20 years after its discovery. Biochem J. 2001;359:1-16. [PubMed] |
| 24. | Doble BW, Woodgett JR. GSK-3: tricks of the trade for a multi-tasking kinase. J Cell Sci. 2003;116:1175-1186. [PubMed] |
| 25. | King FW, Skeen J, Hay N, Shtivelman E. Inhibition of Chk1 by activated PKB/Akt. Cell Cycle. 2004;3:634-637. [PubMed] |
| 26. | Coffey JC, Wang JH, Smith MJ, Laing A, Bouchier-Hayes D, Cotter TG, Redmond HP. Phosphoinositide 3-kinase accelerates postoperative tumor growth by inhibiting apoptosis and enhancing resistance to chemotherapy-induced apoptosis. Novel role for an old enemy. J Biol Chem. 2005;280:20968-20977. [PubMed] |
| 27. | Ward SG, Finan P. Isoform-specific phosphoinositide 3-kinase inhibitors as therapeutic agents. Curr Opin Pharmacol. 2003;3:426-434. [PubMed] |
| 28. | Halestrap AP, Clarke SJ, Javadov SA. Mitochondrial permeability transition pore opening during myocardial reperfusion--a target for cardioprotection. Cardiovasc Res. 2004;61:372-385. [PubMed] |
| 29. | Siegfried E, Chou TB, Perrimon N. wingless signaling acts through zeste-white 3, the Drosophila homolog of glycogen synthase kinase-3, to regulate engrailed and establish cell fate. Cell. 1992;71:1167-1179. [PubMed] |
| 30. | 任 嫱, 李 睿, 赵 强, 徐 霞, 杨 新疆, 陈 卫刚, 郑 勇. LY294002在外源性预处理肝纤维化大鼠肝星状细胞增殖、凋亡中的作用. 胃肠病学和肝病学杂志. 2013;22:804-807. |
| 31. | Calvert JW, Coetzee WA, Lefer DJ. Novel insights into hydrogen sulfide--mediated cytoprotection. Antioxid Redox Signal. 2010;12:1203-1217. [PubMed] |
| 32. | Mustafa AK, Gadalla MM, Snyder SH. Signaling by gasotransmitters. Sci Signal. 2009;2:re2. [PubMed] [DOI] |
| 33. | Zhao W, Zhang J, Lu Y, Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. EMBO J. 2001;20:6008-6016. [PubMed] |
| 34. | Tang G, Wu L, Wang R. Interaction of hydrogen sulfide with ion channels. Clin Exp Pharmacol Physiol. 2010;37:753-763. [PubMed] |