修回日期: 2014-06-19
接受日期: 2014-07-01
在线出版日期: 2014-08-18
目的: 研究核转录因子-κB(nuclear factor-kappa B, NF-κB)对人结肠癌细胞上皮间质转化(epithelial-mesenchymal transition, EMT)及侵袭和转移的影响.
方法: 将人结肠癌HCT116细胞分为NF-κB激活组, 抑制组和空白对照组. 分别用NF-κB活化激活剂肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α), 终浓度为20 ng/mL, NF-κB活化抑制剂吡咯烷二硫代甲酸铵(ammonium pyrrolidine- dithiocarbamate, PDTC), 终浓度为20 μmol/L干预HCT116细胞4 d. 采用相差显微镜观察细胞形态变化, Transwell小室模型观察细胞侵袭迁移能力变化, Western blot检测p65、P-p65、E-cadherin和N-cadherin的蛋白表达, QT-PCR检测E-cadherin和N-cadherin的mRNA表达.
结果: TNF-α可上调P-p65和N-cadherin的表达, 抑制E-cadherin的表达, 同时明显促进HCT116细胞的EMT形态发生(如细长丝状伪足和纺锤状细胞形成), 并使侵袭和迁移能力增强; 相反, PDTC则降低P-p65和N-cadherin的表达, 而增加E-cadherin的表达, 且抑制细胞的EMT形态发生(如伪足不明显, 细胞成多角形并紧密排列)及减弱细胞的侵袭迁移能力. 对照组、TNF-α组及PDTC组的侵袭细胞数(97.75±3.77 vs 118.50±1.95, 51.00±1.83); 迁移细胞数(140.00±4.32 vs 167.00±6.36, 80.00±2.53); N-cadherin mRNA的表达(1.00±0.00 vs 3.90±0.47, 0.08±0.02); E-cadherin mRNA的表达(1.00±0.00 vs 0.26±0.08, 6.03±0.59, 均P<0.05).
结论: NF-κB可以促进结肠癌HCT116细胞的EMT发生、侵袭和转移.
核心提示: 本研究采用化学方法调控转录因子-κB(nuclear factor-kappa B, NF-κB)的活性, 随后观察NF-κB不同活化状态下的上皮间质转化(epithelial-mesenchymal transition, EMT)现象发生及细胞侵袭迁移能力改变, 从而评价NF-κB对结肠癌细胞株HCT116发生EMT及侵袭迁移能力的影响.
引文著录: 刘宝玉, 黄杰安, 刘诗权, 李素艳, 徐春燕, 梁梦紫, 谭林, 覃蒙斌. NF-κB对人结肠癌细胞上皮间质转化及侵袭转移的影响. 世界华人消化杂志 2014; 22(23): 3403-3409
Revised: June 19, 2014
Accepted: July 1, 2014
Published online: August 18, 2014
AIM: To investigate the role of nuclear factor-kappa B (NF-κB) in the induction of epithelial-mesenchymal transition (EMT), migration and invasion of human colon cancer cell line HCT116.
METHODS: HCT116 cells were divided into three groups and treated with 20 ng/mL of tumor necrosis factor-α (TNF-α) (NF-κB activation group), 20 μmol/L of ammonium pyrrolidinedithiocarbamate (PDTC) (NF-κB suppression group), and equal volume of culture medium (control group), respectively. Four days later, cell morphological changes associated with EMT were observed under a phase contrast microscope, and the migration ability and invasiveness were assessed by Transwell chamber assays. The protein expression of p65, P-p65, E-cadherin and N-cadherin was analyzed by Western blot, and the mRNA expression of E-cadherin and N-cadherin was detected by quantitative real-time PCR.
RESULTS: TNF-α up-regulated the expression of P-p65 and N-cadherin, suppressed the expression of E-cadherin, and caused a complete EMT-phenotype, which manifested as the formation of large filopodia-like processes and spindle-cell shape. Also, TNF-α promoted cell invasion and migration. In contrast, PDTC down-regulated the expression of P-p65 and N-cadherin, up-regulated the expression of E-cadherin, inhibited the occurrence of typical EMT phenomenon, and suppressed cell invasion and migration. Compared with the control group, TNF-α group and PDTC group showed significantly different cell invasion (97.75 ± 3.77 vs 118.50 ± 1.95, 51.00 ± 1.83, P < 0.05 for both), cell migration (140.00 ± 4.32 vs 167.00 ± 6.36, 80.00 ± 2.53, P < 0.05 for both), and mRNA expression of N-cadherin (1.00 ± 0.00 vs 3.90 ± 0.47, 0.08 ± 0.02, P < 0.05 for both) and E-cadherin (1.00 ± 0.00 vs 0.26 ± 0.08, 6.03 ± 0.59, P < 0.05 for both).
CONCLUSION: NF-κB induces the occurrence of typical EMT phenomenon and promotes cell invasion and migration in human colon cancer cell line HCT116.
- Citation: Liu BY, Huang JA, Liu SQ, Li SY, Xu CY, Liang MZ, Tan L, Qin MB. Role of NF-κB in induction of epithelial-mesenchymal transition, migration and invasion of human colon cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3403-3409
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3403.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3403
结肠癌是我国最常见恶性肿瘤之一. 近年来, 发病率和死亡率呈上升趋势. 结肠癌的预后与其是否发生转移有关, 绝大部分患者最终死于肿瘤转移. 然而目前用于预测包括结肠癌在内的恶性肿瘤侵袭转移的临床指标尚未明确. 研究发现, 肿瘤侵袭转移的关键是肿瘤细胞获得侵袭性, 并从原发灶逃离, 而上皮间质转化(epithelial-mesenchymal transition, EMT)在此过程中发挥了重要的作用[1]. EMT是指上皮细胞失去了细胞极性及细胞间紧密连接, 形成具有迁移能力的纺锤形间充质细胞. EMT与恶性肿瘤的侵袭转移密切相关[2].
核转录因子-κB(nuclear factor-kappa B, NF-κB)是一种多功能的核转录因子, 其不仅可以调控机体的多种生理病理反应, 还对肿瘤的发生发展、侵袭转移起着重要作用[3-5]. 大量研究表明, NF-κB的持续活化是肿瘤恶性转化的一个关键点[6,7]. 然而, NF-κB调控肿瘤的转变机制尚未完全阐明. 有研究报道, NF-κB可促进转录因子Snail[8]、ZEB-1和ZEB-2[9]的表达来抑制上皮特定基因E-cadherin和桥粒斑蛋白的表达, 同时诱导间质特定基因Vimentin的表达, 从而诱导EMT的发生. 在与单核细胞共培养的HK-2细胞中, NF-κB信号通路被激活, 使ICAM-1表达上调, 进而诱导EMT[10]. 在胰腺癌细胞中, NF-κB的活化也可以诱导EMT表型的发生[11]. 而对于不同活化状态下的NF-κB与结肠癌EMT的关系尚未见报道.
本实验试图通过调控NF-κB的活性, 观察NF-κB对结肠癌细胞株HCT116发生EMT及侵袭迁移能力的影响, 以期探讨NF-κB在结肠癌细胞EMT及侵袭转移中的作用, 寻找预测结肠癌上皮形态变化的相关指标, 为研究结肠癌的侵袭转移机制及其结肠癌治疗潜在靶点提供实验室依据.
人结肠癌HCT116细胞购自中国科学院细胞库; 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、吡咯烷二硫代甲酸铵(ammonium pyrrolidinedithiocarbamate, PDTC)和四氮唑蓝(MTT)均购自美国Sigma-Aldrich公司; 兔抗人P-p65、p65、E-cadherin和N-cadherin单克隆抗体均购自美国Cell Signaling technology公司; GAPDH购自上海康成生物有限公司; RNAsio、逆转录聚合酶链反应(RT-PCR)试剂和SYBR®Premix Ex Taq™ Ⅱ(Tli RNaseH Plus)购自日本TaKaRa Biotechnoly公司; 引物由TaKaRa Biotechnoly公司合成; 胎牛血清购自美国ExCell公司; DMEM高糖培养基购自美国HyClone公司; 人工基质Matrigel购自BD Biosciences公司.
1.2.1 细胞培养: 人结肠癌HCT116细胞株用含10%胎牛血清的培养液培养于5%CO2、37 ℃的细胞培养箱中, 细胞在培养瓶中长满约90%时传代. 传代时常规吸去培养液, PBS润洗3遍后用0.25%的胰蛋白酶消化, 按所需细胞密度接种.
1.2.2 相差显微镜观察细胞形态: 取对数生长期细胞, 消化后制成合适浓度的细胞悬液, 接种至六孔板, 贴壁后分别用20 ng/mL的TNF-α和20 μmol/L的PDTC干预4 d, 对照组加等量培养基, 相差显微镜观察细胞形态变化并拍照.
1.2.3 细胞侵袭迁移试验: 实验分3组, 分别为正常对照组、TNF-α(20 ng/mL)组和PDTC(20 μmol/L)组, 干预4 d后, 胰蛋白酶消化细胞, 用无血清培养基重悬, 使细胞浓度调整为5×105个/mL, 侵袭实验取200 μL细胞悬液种于铺好Matrigel胶的Transwell上室中, 下室加入600 μL含20%血清的培养基, 37 ℃孵育24 h, 棉签擦去上室的非迁移细胞, 移出Transwell小室, 倒置风干, 甲醛固定30 min后用0.1%结晶紫染色15 min, PBS清洗, 倒置风干, 倒置相差显微镜下观察并拍照(×200), 每个样片随机取4个视野拍照并计数侵袭细胞数, 计算平均值, 以空白试剂为对照, 分析数据. 细胞迁移试验不需要铺胶, 其余操作均同侵袭实验.
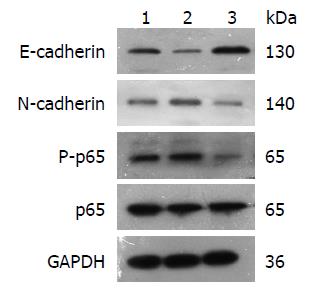
1.2.4 Western blot法检测NF-κB活性调节剂处理细胞后p65、P-p65、E-cadherin和N-cadherin蛋白的表达: 各组细胞处理4 d后提取总蛋白, BCA法测蛋白浓度. 各组取35 μg蛋白上样, 按电泳、转膜、牛奶封闭后一抗4 ℃孵育过夜, 室温孵育二抗1 h的流程进行操作, 化学发光胶片曝光显影. 图像分析仪行胶片扫描, 分析灰度值.
1.2.5 QT-PCR检测mRNA的表达: 细胞分组处理4 d后, 采用RNAsio提取细胞总RNA, 并采用分光光度计检测RNA浓度及纯度. 取1 μg总RNA按逆转录说明书合成cDNA备用. QT-PCR反应参数为95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 34 s, 72 ℃ 45 s , 40个循环, 72 ℃ 7 min. 以GAPDH作为管家基因, 每个基因的每个样品设3个重复扩增管. 对实时定量PCR的产物进行凝胶电泳, 观察扩增产物. 实验重复3次, 数据采用相对双∆Ct法, 按公式2-∆∆Ct行定量分析. 各基因引物系列及扩增片段如表1.
| 基因名称 | 引物序列 | 扩增片段(bp) |
| GAPDH | 上游: 5'-GCACCGTCAAGGCTGAGAAC-3' | 138 |
| 下游: 5'-TGGTGAAGACGCCAGTGGA-3' | ||
| E-cadherin | 上游: 5'-GAGTGCCAACTGGACCATTCAGTA-3' | 86 |
| 下游: 5'-AGTCACCCACCTCTAAGGCCATC-3' | ||
| N-cadherin | 上游: 5' -AGCACAGTGGCCACCTACAAAG-3' | 162 |
| 下游: 5' -CAGCTCCTGGCCCAGTTACA-3' |
统计学处理 应用SPSS16.0统计学软件, 以上实验均重复3次, 数据以mean±SD表示, 统计分析采用t检验和One-way ANOVA方差分析, P<0.05为差异有统计学意义.
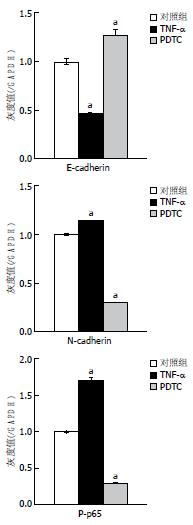
QT-PCR(表2)和Western blot(图1, 图2)结果显示, 与对照组相比, 经20 ng/mL的TNF-α处理4 d后, P-p65的蛋白、N-cadherin的mRNA(1.00±0.00 vs 3.90±0.47)和蛋白表达水平均显著提高(均P<0.05), 而E-cadherin的mRNA(1.00±0.00 vs 0.26±0.08)和蛋白表达水平较对照组显著下降(均P<0.05); 20 μmol/L的PDTC处理组的P-p65的蛋白、N-cadherin mRNA(1.00±0.00 vs 0.08±0.02)和蛋白表达水平则较对照组显著降低(均P<0.05), 而E-cadherin的mRNA(1.00±0.00 vs 6.03±0.59)和蛋白表达水平较对照组显著上调(均P<0.05). p65的蛋白表达与对照组相比, 均无明显改变.
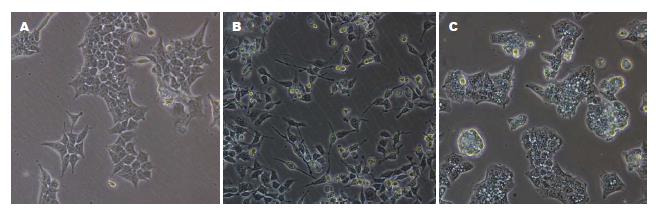
对照组细胞呈现过渡期细胞形态, 即轻微的EMT形态, 细胞大多数为多边形, 极少细胞出现短小的丝状伪足, 细胞间存在一定的紧密连接; TNF-α组可见细胞呈现间充质样的纺锤形/细长形, 大多数细胞出现细长的丝状伪足, 细胞间紧密连接松散; PDTC组细胞呈现明显的上皮样形态, 几乎看不到伪足, 细胞间连接紧密, 未见明显间隙(图3).
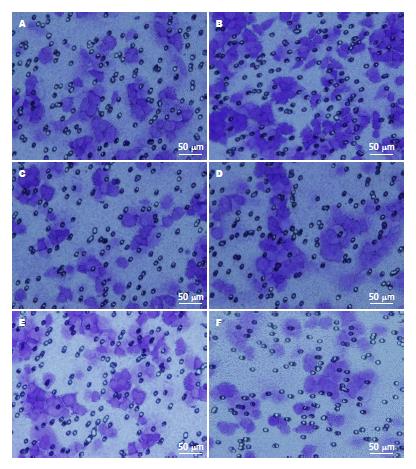
TNF-α激活NF-κB活性后, HCT116细胞侵袭迁移能力明显增强, 细胞侵袭迁移如图4所示, 细胞数增多, 对照组、TNF-α组侵袭细胞数(97.75±3.77 vs 118.50±1.95); 迁移细胞数(140.00±4.32 vs 167.00±6.36, 均P<0.05). PDTC抑制NF-κB活性后细胞侵袭迁移能力则明显减弱, 细胞数减少, 侵袭细胞数(97.75±3.77 vs 51.00±1.83); 迁移细胞数(140.00±4.32 vs 80.00±2.53, 均P<0.05)(表3).
哺乳动物的NF-κB是一个蛋白家族, 由p65、c-Rel、RelB、p50/p105和p52/p100 5个成员组成. 静息状态下, 经典通路的NF-κB是以非活化的二聚体形式(主要为p65/p50)与抑制蛋白-κB(inhibitor protein-κB, IκB)结合存在于胞质中, 当受到TNF-α、LPS、白介素(interleukin)-1等细胞外信号刺激时, IκB就会被IKK复合体磷酸化、泛素化, 最后迅速降解, 使NF-κB二聚体中的p65亚基释放并进入胞核磷酸化, 进而发挥各种生物学功能作用[12-15], 如参与炎症免疫反应、调控细胞增殖和凋亡及参与肿瘤发生发展及转移等[16,17]. 研究表明NF-κB可调控结肠癌肿瘤血管生成及侵袭相关的基因[18]. 人参皂苷代谢物还可通过阻断NF-κB, 从而抑制由TNF-α诱导的小鼠结肠癌细胞的远处转移. 这些研究表明NF-κB与结肠癌的侵袭转移密切相关. 本研究通过采用化学方法调控NF-κB活性, 发现NF-κB不同活化状态下, 细胞侵袭迁移能力发生相应的改变. 这与上述报道的结论一致.
研究报道, 上皮来源肿瘤的发生发展及恶性转化与EMT关系密切.EMT被认为是肿瘤进展的一个病理过程, 其在恶性肿瘤的原位浸润和远处转移中发挥着重要作用, 如可以促进乳腺癌、肝癌、卵巢癌、肾癌、结肠癌和肺癌等多种细胞株的侵袭迁移[19-23]. EMT的过程中, 不仅出现细胞形态学的变化, 同时还伴随着相关标志物的改变. 比如细胞发生EMT现象时, 上皮标志物E-cadherin表达降低, 而N-cadherin、波形蛋白和Fibronetin等间质标志物的表达上升, 还有相关的转录因子的上调, 如Snail、Slug、ZEB1/2、Twist1/2. 研究已证实这种现象存在于结直肠癌的发生发展过程[24]. EMT的发生主要与E-cadherin的表达及稳定性有关, 在正常组织中, E-cadherin表达明显且稳定, 而在癌组织中, E-cadherin的表达会降低, 并呈现其不稳定性. E-cadherin是钙黏蛋白家族中的一种细胞黏附分子, 对维持细胞形态及调节细胞黏附具有重要作用, 其表达上调可增加细胞间的黏附作用, 从而抑制肿瘤侵袭转移[25]. 本实验结果显示EMT过程中, E-cadherin下调同时细胞侵袭迁移能力增强.
TNF-α和PDTC分别为NF-κB经典通路的激活剂和抑制剂, 研究发现TNF-α可通过活化p38/丝裂原活化蛋白激酶(mitogen-activated protein kinase)[26]和AKT/糖原合成酶激酶-3β(glycogen synthase kinase-3β)[24]信号通路促进结肠癌细胞EMT的发生. TNF-α还可通过激活NF-κB, 进而诱导肾癌、乳腺癌和胰腺癌的EMT. 同时, 越来越多的研究表明NF-κB的活化对于EMT的诱导和维持是必需的. 结肠癌细胞中, 缺氧/复氧可以诱导EMT的发生, 其机制可能与NF-κB活化有关[27]. 本研究也发现TNF-α可活化NF-κB, 使P-p65表达升高, 从而促进结肠癌细胞EMT及侵袭迁移; 而PDTC则抑制NF-κB, 使P-p65的表达降低, 结肠癌细胞的EMT及侵袭迁移也受到抑制.
总之, 本研究结果表明在结肠癌HCT116细胞中, NF-κB与EMT及细胞侵袭转移密切相关, 而NF-κB对肿瘤的侵袭转移的促进作用在某种程度上可能是由于发生EMT引起的. 这可能为结肠癌的侵袭转移机制及临床治疗等提供实验依据.
肿瘤的侵袭转移影响其预后, 结肠癌患者绝大部分死于肿瘤的侵袭转移, 而上皮间质转化(epithelial-mesenchymal tran-sition, EMT)与恶性肿瘤的侵袭转移密切相关. 近年来, EMT在肿瘤浸润转移中的作用及其机制越来越备受关注.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科.
本研究采用化学方法调控核转录因子-κB(nuclear factor-kappa B, NF-κB)的活性, 随后检测NF-κB p65、P-p65及EMT标志物表达变化, 并观察细胞形态学改变及细胞侵袭迁移能力变化, 以期探讨NF-κB对结肠癌细胞株HCT116发生EMT及侵袭迁移能力的影响.
研究报道, NF-κB的活化对于EMT的诱导和维持是必需的, 如TNF-α可活化NF-κB, 从而诱导肾癌、乳腺癌和胰腺癌等的EMT发生, 其可能是促进转录因子Snail、ZEB-1和ZEB-2的表达来实现的. 而对于结肠癌中不同活化状态下的NF-κB 与EMT关系鲜有报道.
NF-κB持续活化与肿瘤的恶性转化密切相关, 而其有关机制尚未明了. 近年来研究认为, 其可能与EMT的发生有着密切联系, 如有报道认为, NF-κB的活化可诱导肾癌、乳腺癌和胰腺癌等的EMT发生, 而在结肠癌中, 不同活化状态下的NF-κB与EMT关系的报道罕见.
本研究提示NF-κB的活化可诱导结肠癌细胞株HCT116 EMT的发生及促进其侵袭迁移, 这为寻找预测结肠癌上皮形态变化的相关指标提供参考依据, 并为研究结肠癌的侵袭转移机制及结肠癌的治疗潜在靶点提供实验室依据.
本研究内容客观, 分析方法成熟, 观点真实, 具有一定的科学意义.
编辑 田滢 电编 都珍珍
| 1. | Thiery JP. Epithelial-mesenchymal transitions in development and pathologies. Curr Opin Cell Biol. 2003;15:740-746. [PubMed] |
| 2. | Chen X, Halberg RB, Burch RP, Dove WF. Intestinal adenomagenesis involves core molecular signatures of the epithelial-mesenchymal transition. J Mol Histol. 2008;39:283-294. [PubMed] [DOI] |
| 3. | Shishodia S, Aggarwal BB. Nuclear factor-kappaB: a friend or a foe in cancer? Biochem Pharmacol. 2004;68:1071-1080. [PubMed] [DOI] |
| 4. | Perkins ND. The diverse and complex roles of NF-κB subunits in cancer. Nat Rev Cancer. 2012;12:121-132. [PubMed] [DOI] |
| 5. | Yang Z, Li C, Wang X, Zhai C, Yi Z, Wang L, Liu B, Du B, Wu H, Guo X. Dauricine induces apoptosis, inhibits proliferation and invasion through inhibiting NF-kappaB signaling pathway in colon cancer cells. J Cell Physiol. 2010;225:266-275. [PubMed] [DOI] |
| 6. | Cooks T, Pateras IS, Tarcic O, Solomon H, Schetter AJ, Wilder S, Lozano G, Pikarsky E, Forshew T, Rosenfeld N. Mutant p53 prolongs NF-κB activation and promotes chronic inflammation and inflammation-associated colorectal cancer. Cancer Cell. 2013;23:634-646. [PubMed] [DOI] |
| 7. | Shaked H, Hofseth LJ, Chumanevich A, Chumanevich AA, Wang J, Wang Y, Taniguchi K, Guma M, Shenouda S, Clevers H. Chronic epithelial NF-κB activation accelerates APC loss and intestinal tumor initiation through iNOS up-regulation. Proc Natl Acad Sci U S A. 2012;109:14007-14012. [PubMed] [DOI] |
| 8. | Hsu YL, Chen CY, Lin IP, Tsai EM, Kuo PL, Hou MF. 4-Shogaol, an active constituent of dietary ginger, inhibits metastasis of MDA-MB-231 human breast adenocarcinoma cells by decreasing the repression of NF-κB/Snail on RKIP. J Agric Food Chem. 2012;60:852-861. [PubMed] [DOI] |
| 9. | Chua HL, Bhat-Nakshatri P, Clare SE, Morimiya A, Badve S, Nakshatri H. NF-kappaB represses E-cadherin expression and enhances epithelial to mesenchymal transition of mammary epithelial cells: potential involvement of ZEB-1 and ZEB-2. Oncogene. 2007;26:711-724. [PubMed] [DOI] |
| 10. | Li Q, Liu BC, Lv LL, Ma KL, Zhang XL, Phillips AO. Monocytes induce proximal tubular epithelial-mesenchymal transition through NF-kappa B dependent upregulation of ICAM-1. J Cell Biochem. 2011;112:1585-1592. [PubMed] [DOI] |
| 11. | Maier HJ, Schmidt-Strassburger U, Huber MA, Wiedemann EM, Beug H, Wirth T. NF-kappaB promotes epithelial-mesenchymal transition, migration and invasion of pancreatic carcinoma cells. Cancer Lett. 2010;295:214-228. [PubMed] [DOI] |
| 12. | Xiao G, Harhaj EW, Sun SC. NF-kappaB-inducing kinase regulates the processing of NF-kappaB2 p100. Mol Cell. 2001;7:401-409. [PubMed] |
| 13. | Desai A, Konda VR, Darland G, Austin M, Prabhu KS, Bland JS, Carroll BJ, Tripp ML. META060 inhibits multiple kinases in the NF-kappaB pathway and suppresses LPS--mediated inflammation in vitro and ex vivo. Inflamm Res. 2009;58:229-234. [PubMed] [DOI] |
| 14. | Pindolia KR, Noth CJ, Xu YX, Janakiraman N, Chapman RA, Gautam SC. IL-4 upregulates IL-1-induced chemokine gene expression in bone marrow stromal cells by enhancing NF-kB activation. Hematopathol Mol Hematol. 1996;10:171-185. [PubMed] |
| 15. | Hayden MS, Ghosh S. Shared principles in NF-kappaB signaling. Cell. 2008;132:344-362. [PubMed] [DOI] |
| 17. | Sakurai H, Chiba H, Miyoshi H, Sugita T, Toriumi W. IkappaB kinases phosphorylate NF-kappaB p65 subunit on serine 536 in the transactivation domain. J Biol Chem. 1999;274:30353-30356. [PubMed] |
| 18. | Wang S, Liu Z, Wang L, Zhang X. NF-kappaB signaling pathway, inflammation and colorectal cancer. Cell Mol Immunol. 2009;6:327-334. [PubMed] [DOI] |
| 19. | Blick T, Widodo E, Hugo H, Waltham M, Lenburg ME, Neve RM, Thompson EW. Epithelial mesenchymal transition traits in human breast cancer cell lines. Clin Exp Metastasis. 2008;25:629-642. [PubMed] [DOI] |
| 20. | Savagner P. The epithelial-mesenchymal transition (EMT) phenomenon. Ann Oncol. 2010;21 Suppl 7:vii89-vii92. [PubMed] [DOI] |
| 21. | Bonnomet A, Brysse A, Tachsidis A, Waltham M, Thompson EW, Polette M, Gilles C. Epithelial-to-mesenchymal transitions and circulating tumor cells. J Mammary Gland Biol Neoplasia. 2010;15:261-273. [PubMed] [DOI] |
| 22. | Lan M, Kojima T, Osanai M, Chiba H, Sawada N. Oncogenic Raf-1 regulates epithelial to mesenchymal transition via distinct signal transduction pathways in an immortalized mouse hepatic cell line. Carcinogenesis. 2004;25:2385-2395. [PubMed] [DOI] |
| 23. | Wu ST, Sun GH, Hsu CY, Huang CS, Wu YH, Wang HH, Sun KH. Tumor necrosis factor-α induces epithelial-mesenchymal transition of renal cell carcinoma cells via a nuclear factor kappa B-independent mechanism. Exp Biol Med (Maywood). 2011;236:1022-1029. [PubMed] [DOI] |
| 24. | Wang H, Wang HS, Zhou BH, Li CL, Zhang F, Wang XF, Zhang G, Bu XZ, Cai SH, Du J. Epithelial-mesenchymal transition (EMT) induced by TNF-α requires AKT/GSK-3β-mediated stabilization of snail in colorectal cancer. PLoS One. 2013;8:e56664. [PubMed] [DOI] |
| 26. | Bates RC, Mercurio AM. Tumor necrosis factor-alpha stimulates the epithelial-to-mesenchymal transition of human colonic organoids. Mol Biol Cell. 2003;14:1790-1800. [PubMed] [DOI] |