修回日期: 2014-06-09
接受日期: 2014-06-22
在线出版日期: 2014-08-08
目的: 探讨胃神经内分泌癌(gastric neuroendocrine carcinoma, GNEC)的临床病理特征及影响预后因素.
方法: 回顾性分析2007-11-01/2014-03-31上海交通大学医学院附属仁济医院及上海交通大学医学院附属九龙医院收治的50例胃神经内分泌癌患者的临床病理特征、治疗及生存资料. 采用Kaplan-Meier法绘制生存曲线, Log-rank检验法进行单因素分析, Cox比例风险回归模型进行多因素分析.
结果: 全组胃神经内分泌癌44例(G3级)、胃混合型腺神经内分泌癌(G2-3级)6例. 男39例, 女11例; 平均年龄61.32岁±10.48岁. 其中, Ⅱ期6例(12.0%), Ⅲ期患者34例(68.0%), Ⅳ期患者10例(20.0%). 全部患者接受根治性胃及转移病灶切除手术治疗, 其中34例存在淋巴结转移, 17例存在血管、神经或淋巴管浸润. 25例接受术后化疗, 占50.0%; 随访时间1-50 mo, 15例患者复发, 18例死亡. 患者中位生存时间30.18 mo±3.50 mo(95%CI: 23.31-37.04 mo). 单因素分析结果显示: 患者中性粒细胞淋巴细胞比率(ratio of neutrophils to lymphocytes, NLR)、Ki67及化疗与否是影响GNEC患者预后的因素(P<0.05). 多因素分析结果显示: Ki67是影响GNEC患者预后的独立因素(P<0.05).
结论: GNEC相对罕见并恶性程度高, Ki67水平是影响患者预后的独立因素.
核心提示: 胃神经内分泌肿瘤相对罕见, 依据2010年世界卫生组织(World Health Organization)新的分类方法, 胃镜检查是发现胃神经内分泌肿瘤的重要手段, CD56、突触素(synaptophysin)和嗜铬粒素A(chromogranin)是神经内分泌分化标志物, 采用以手术治疗为主的多学科综合治疗模式, Ki67及中性粒细胞淋巴细胞比率(ratio of neutrophils to lymphocytes)为重要的影响预后因素.
引文著录: 徐海燕, 张志影, 任芳, 唐雷, 张凤春. 胃神经内分泌癌的临床病理特征及预后因素. 世界华人消化杂志 2014; 22(22): 3291-3299
Revised: June 9, 2014
Accepted: June 22, 2014
Published online: August 8, 2014
AIM: To evaluate the clinical characteristics and prognostic factors of gastric neuroendocrine carcinoma (GNEC).
METHODS: The clinical data for 50 GNEC patients treated at our hospital between November 1, 2007 and March 31, 2014 were reviewed and analyzed retrospectively. Kaplan-Meier survival curves were plotted, and log-rank tests and Cox proportional hazards analysis were used for univariate and multivariate comparisons of overall survival (OS).
RESULTS: There were 44 neuroendocrine carcinoma (NEC) (G3) and 6 mixed adenoneuroendocrine carcinoma (MANEC) (G2-3) patients enrolled in this study. Among them, 39 were male and 11 were female, with a median age of 61.32±10.48 years. At presentation, 6 (12.0%) cases were diagnosed with stage Ⅱ, and the percentages of stage Ⅲ and Ⅳ patients was 68.0% and 20.0%, respectively. All of the cases received radical surgery for the primary and metastatic masses. 36 (72.0%) cases had lymph node metastasis and intravascular tumor thrombi were found in 17 (34.0%) cases. The percentage of patients receiving chemotherapy was 50.0% (25/50). The follow-up duration was 1 to 50 mo. 15 cases developed relapse and 18 patients died. Univariate analysis revealed that the ratio of neutrophils to lymphocytes (NLR), Ki67 and chemotherapy were significant prognostic factors (P < 0.05). Cox regression analysis showed that Ki67 was an independent prognostic factor.
CONCLUSION: GNEC is a relatively uncommon and highly aggressive malignancy, and Ki67 is an important independent prognostic factor.
- Citation: Xu HY, Zhang ZY, Ren F, Tang L, Zhang FC. Clinicopathological characteristics and prognostic factors of gastric neuroendocrine carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3291-3299
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3291.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3291
神经内分泌肿瘤(neuroendocrine tumor, NET)是一类临床少见的能够摄取胺的前体通过脱羧作用合成和分泌胺及多肽激素的恶性肿瘤[1]. 发病率为1/100万-2/100万, 约占全部胃肠神经内分泌肿瘤的8.7%[2]. 近年来, 由于上消化道内镜检查的普及, 胃神经内分泌癌(gastric neuroendocrine carcinoma, GNEC)发病率有所上升. 据世界卫生组织(World Health Organization, WHO)(2010年)消化系肿瘤分类, 采用神经内分泌肿瘤(neuroendocrine neoplasm, NEN)泛指所有源自神经内分泌细胞的肿瘤, 将低分化神经内分泌肿瘤命名为NET, 据组织学分级进一步分为NET1和NET2, 神经内分泌癌(neuroendocrine cancer, NEC)和混合性腺神经内分泌癌(mixed adenoneuroendocrinecarcinoma, MANEC)[3]. 据报道NET1占70%-80%, NET2占5%-6%, NEC占14%-25%, MANEC较为罕见[4]. 本研究回顾性分析了50例胃NEC及MANEC患者的临床病理及治疗资料, 对影响预后的因素进行了分析, 现将结果报告如下.
收集上海交通大学医学院附属仁济医院及上海交通大学医学院附属九龙医院2007-11-01/2014-03-31手术治疗的胃NEC和MANEC患者, 均为病理证实. 其中男39例, 女11例; 年龄36-81岁, 平均年龄61.32岁±10.48岁; 其中贲门24例, 胃体9例, 胃窦2例; 36例以腹痛起病, 占72.0%, 其次为吞咽困难, 呕血或黑便及体检时发现, 分别为8例, 4例和2例; 肿瘤最大直径1-22 cm, 平均5.95 cm±3.71 cm,≤8 cm 38例,>8 cm 9例; 手术方式: 所有患者均行根治性切除术, 其中1例切缘阳性, 余均为R0切除; 2例患者术后并发严重肺部感染、心律失常和多器官系统功能衰竭而围手术期死亡.
1.2.1 诊断、分类、分级及分期标准: 诊断胃神经内分泌肿瘤通过镜下组织形态学特点及免疫组织化学染色检测相关生物标志物, 包括突触素(synaptophysin, Syn)、嗜铬粒素A(chromogranin A, CgA)及神经细胞黏连分子(neural cell adhesion protein, NCAM, CD56)等, 并按细胞分裂指数和Ki67指数进行分型和分级. 分类采用2010年WHO新的分级分类方法. 组织块进行常规苏木精-伊红染色(hematoxylin-eosin staining, HE)染色, NEC为低分化高度恶性肿瘤, 由小细胞或中至大细胞组成, 有显著核异型性、多灶性坏死和分裂象数高特点, 组织学分级定为3级(G3: 核分裂象数>20/10个高倍视野, Ki67阳性指数>20%). MANEC是一种形态学上能形成可识别的腺上皮和神经内分泌细胞两种成分的恶性肿瘤, 两种成分的任何一种至少占30%. 为了确定肿瘤细胞内分泌性质, 应用免疫组织化学ABC法进行免疫染色(ABC试剂盒, DAKO公司产品). 每次染色均设立阳性对照、阴性对照. 阳性标准判定: 阳性细胞胞膜、胞浆或胞核内呈棕黄色颗粒. 按照美国肿瘤联合会(American Joint Committee on Cancer, AJCC)(7th ed. 2010)推荐的GET的最新肿瘤-淋巴结-远处转移(tumor-node-metastasis, TNM)分期标准.
1.2.2 随访: 本研究共50例患者, 均通过门诊复诊、电话或通信方式随访, 随访截止时间为2014-04.
统计学处理 采用SPSS16.0软件处理统计数据; 计数资料比较采用χ2检验或Fisher精确检验, 总生存期的计算为患者确诊至证实患者死亡的时间距离, 生存曲线采用Kaplan-Meier法进行绘制, Log-rank检验比较生存期之间的差异, Cox比例风险回归模型进行多因素分析, P<0.05为差异有统计学意义.
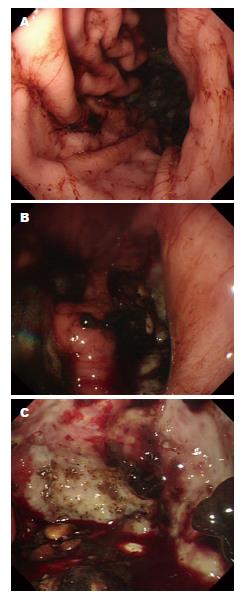
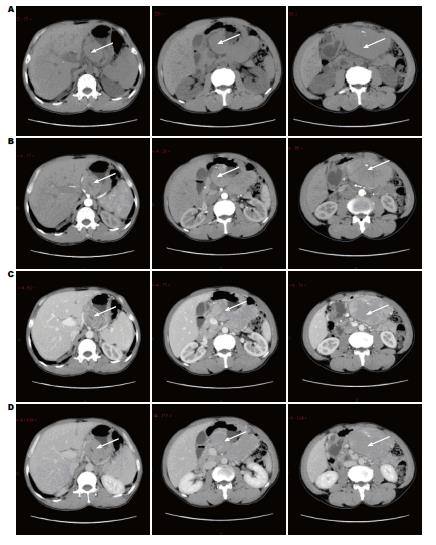
全组男39例, 女11例; 年龄≥60岁者为29例(58.0%), 系统回顾提示16例有既往疾病史, 其中乙型肝炎7例, 高血压4例, 窦性心动过缓2例, 糖尿病1例, 直肠癌术后1例, 皮肤基底细胞癌术后1例. 主要临床症状表现为上腹疼痛不适36例(72.0%), 其次为吞咽困难8例(16.0%), 呕血和/或黑便4例(8.0%), 体检发现2例(4.0%); 全组无类癌综合征表现. 肿瘤位于贲门胃底25例(50.0%), 胃体13例(26.0%), 胃窦12例(24.0%). 全部患者接受胃镜检查, 绝大多数表现为占位性病变(图1), 少数为溃疡性病变. 全部患者接受术前CT影像学检查, 多表现为胃部占位, CT增强后可见病灶区明显强化(图2).
本研究50例患者神经内分泌癌44例, 混合性腺神经内分泌癌6例, 详尽临床病理分析如表1. 肿瘤大小平均为5.95 cm±3.71 cm, 以T4病变为主41例, 占82.0%, T2 6例占12.0%, T3 3例占6%; 36例(72.0%)患者初诊时伴有淋巴结转移, 17例伴有血管、淋巴管或神经浸润(vascular, lymphatic vessel and neural invasion, VLNI), 远处转移10例, 以肝转移最多见, 为7例, 其次为胰腺转移2例, 盆腔淋巴结转移1例.
| 特征 | n(%) | 事件数 总生存时间(mo) | 95%可信区间 | P值 | |
| 发病年龄(岁) | 0.657 | ||||
| <60 | 21(42.0) | 6 | 30.92±4.87 | 21.38-40.46 | |
| ≥60 | 29(58.0) | 12 | 28.65±4.44 | 19.95-37.35 | |
| 性别 | 0.251 | ||||
| 男 | 39(78.0) | 13 | 32.14±4.05 | 24.20-40.08 | |
| 女 | 11(22.0) | 5 | 18.41±3.38 | 11.79-25.03 | |
| 既往病史 | 0.336 | ||||
| 无 | 34(68.0) | 12 | 32.02±4.13 | 23.92-40.12 | |
| 有 | 16(32.0) | 6 | 23.88±5.50 | 13.09-34.67 | |
| 部位 | 0.893 | ||||
| 贲门 | 25(50.0) | 10 | 31.30±4.41 | 22.66-39.95 | |
| 胃体 | 13(26.0) | 5 | 22.01±4.53 | 13.13-30.89 | |
| 幽门 | 12(24.0) | 3 | 28.28±7.92 | 12.76-43.80 | |
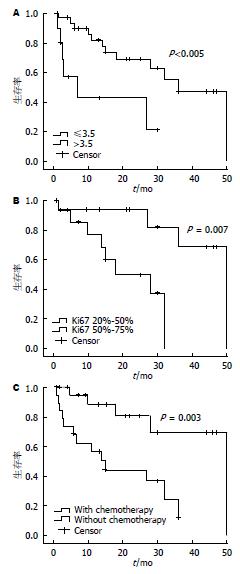
| 粒细胞淋巴细胞比值 | 0.005 | ||||
| ≤3.5 | 38(76.0) | 12 | 33.98±3.79 | 26.55-41.42 | |
| >3.5 | 12(24.0) | 6 | 14.20±4.34 | 5.69-22.72 | |
| 贫血 | 0.375 | ||||
| 无 | 35(70.0) | 13 | 31.67±3.95 | 23.94-39.40 | |
| 有 | 15(30.0) | 5 | 18.40±3.87 | 10.81-25.98 | |
| 低蛋白血症 | 0.680 | ||||
| 无 | 45(90.0) | 17 | 29.78±3.65 | 22.63-36.92 | |
| 有 | 5(10.0) | 1 | 22.33±6.26 | 10.06-34.60 | |
| 癌胚抗原 | 0.229 | ||||
| 正常 | 22(73.3 ) | 6 | 29.47±4.60 | 20.47-38.48 | |
| 升高 | 8(26.7) | 4 | 17.63±6.79 | 4.32-30.93 | |
| 大小(cm) | 0.917 | ||||
| ≤8 | 38(80.9) | 12 | 31.21±4.26 | 22.87-39.55 | |
| >8 | 9(19.1) | 4 | 29.05±6.57 | 16.18-41.92 | |
| 病理 | 0.551 | ||||
| NEC | 44(88.0) | 0 | 30.95±3.69 | 23.73-38.17 | |
| MANEC | 6(12.0) | 1 | 17.00±2.63 | 11.86-22.14 | |
| T分期 | 0.845 | ||||
| T2-3 | 9(18.0) | 3 | 29.51±6.97 | 15.85-43.18 | |
| T4 | 41(82.0) | 15 | 29.68±3.92 | 22.01-37.36 | |
| 分级 | 0.989 | ||||
| G2 | 2(4.0) | 2 | 27.00±0.00 | 27.00-27.00 | |
| G3 | 48(96.0) | 16 | 30.18±3.66 | 23.00-37.36 | |
| 淋巴结 | 0.508 | ||||
| 无转移 | 14(28.0) | 4 | 32.97±5.03 | 23.10-42.84 | |
| 有转移 | 36(72.0) | 14 | 28.80±4.27 | 20.44-37.17 | |
| 分期 | 0.446 | ||||
| Ⅱ | 6(12.0) | 3 | 25.60±7.47 | 10.96-40.25 | |
| Ⅲ | 34(68.0) | 10 | 32.90±4.46 | 24.16-41.64 | |
| Ⅳ | 10(20.0) | 5 | 22.26±6.43 | 9.65-34.87 | |
| 淋巴血管神经浸润 | 0.488 | ||||
| 无 | 33(66.0) | 13 | 28.45±4.29 | 20.04-36.85 | |
| 有 | 17(34.0) | 5 | 32.22±5.22 | 21.99-42.45 | |
| Ki67 | 0.007 | ||||
| 20%-50% | 19(51.4) | 4 | 42.35±4.50 | 33.52-51.17 | |
| 51%-90% | 18(48.6) | 8 | 21.09±3.28 | 14.67-27.52 | |
| 突触素 | 0.734 | ||||
| - | 7(14.0) | 2 | 17.75±4.21 | 9.51-25.99 | |
| +-++ | 43(86.0) | 16 | 30.51±3.68 | 23.31-37.04 | |
| 嗜铬粒素A | 0.646 | ||||
| - | 4(9.8) | 2 | 39.00±11.00 | 17.44-60.56 | |
| + | 37(90.2) | 12 | 28.67±3.51 | 21.79-35.55 | |
| 神经细胞黏连分子 | 0.285 | ||||
| - | 9(90.2) | 2 | 43.00±7.00 | 29.28-56.72 | |
| + | 25(73.5) | 6 | 31.92±4.41 | 23.27-40.57 | |
| 突变型P53 | 0.964 | ||||
| - | 12(46.2) | 2 | 33.71±6.47 | 21.02-46.41 | |
| +-+++ | 14(53.8) | 5 | 35.64±6.37 | 23.16-48.12 | |
| 化疗 | 0.003 | ||||
| 无 | 25(50.0) | 13 | 18.54±3.45 | 11.78-25.30 | |
| 有 | 25(50.0) | 5 | 40.09±4.75 | 30.78-49.41 | |
50例NEC G3级全部经根治性胃大部切除及转移肿瘤病灶切除术, R0切除49例, 1例患者切缘阳性. 25例患者术后行辅助化疗. 化疗药物主要包括顺铂、依托泊苷、奥沙利铂、阿霉素, 替吉奥及多西紫杉醇、紫杉醇等, 14例患者接受联合化疗, 标准依托泊苷联合顺铂方案(etoposide plus cisplatin, EP)化疗1例, 目前无复发生存7 mo. 此外, 尚有1例NEC术后接受奥曲肽辅助治疗.
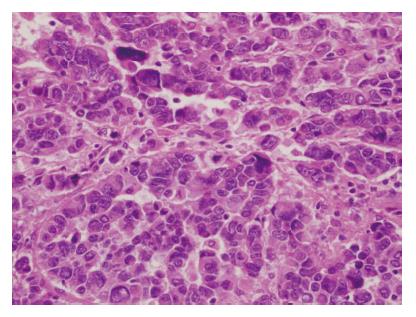
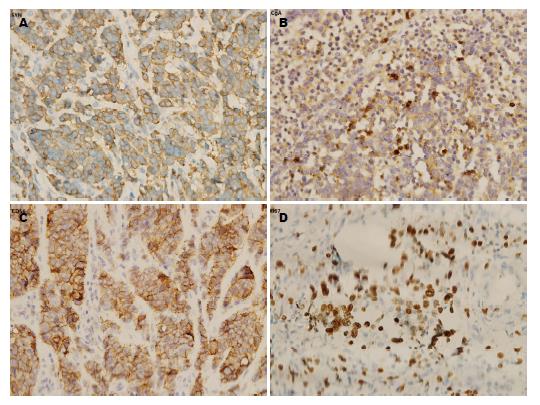
NEC由圆形、多角形和梭形细胞组成, 排列成梁状、巢状或片状结构. 胞质少, 核大, 核分裂异常活跃, 核分裂象数>20/10个高倍视野, 如图3所示. MANEC含腺上皮和神经内分泌细胞两种成分, 且任何一种至少占30%. 免疫组织化学检查提示有神经内分泌标志物CgA、Syn及CD56表达(图4A-C). Ki67指数(图4D)20%-50%表达19例, 为51.4%, 51%-90%表达18例, 为48.6%. 全组CgA、Syn、CD56、NSE阳性率分别为86.0%, 90.2%, 73.5%及80.0%, 另有53.8%患者P53阳性(表2).
| 序号 | 免疫组织化学标志物 | 阳性 | 阴性 | n1/ n(%) |
| 1 | 突触素 | 43 | 7 | 43/50(86.0) |
| 2 | 嗜铬粒素A | 37 | 4 | 37/41(90.2) |
| 3 | 神经细胞粘连分子 | 25 | 9 | 25/34(73.5) |
| 4 | 神经元烯醇酶 | 4 | 1 | 4/5(80.0) |
| 5 | 突变型P53 | 14 | 12 | 14/26(53.8) |
中位随访时间1-50 mo, 15例患者复发, 18例死亡, 失访率为16.0%. 患者中位生存时间30.18 mo±3.50 mo(95%CI: 23.31-37.04 mo). 而患者年龄、性别、发病部位、肿瘤分期与预后无相关性(表1, 图4). 本组患者NLR均值3.50, 以3.5为界值分组进行预后分析; 关于临床病理特征的单因素分析提示, NLR<3.5、Ki67指数<50%及术后辅助化疗患者生存率, 组间相比差异有统计学意义(P<0.050)(表1, 图5). 多因素分析应用Cox回归模型, 纳入因素为单因素分析具有统计学差异因素, 结果显示Ki67是影响GEC患者预后的独立因素(P<0.05)(表3).
| 指标 | χ2值 | 标准误 | 比数比 | 95%可信区间 | P值 |
| 粒细胞淋巴细胞比值 | 0.002 | 0.855 | 0.966 | 0.181-5.156 | 0.967 |
| Ki67指数 | 4.382 | 0.806 | 5.400 | 1.113-26.192 | 0.036 |
| 化疗与否 | 2.803 | 0.684 | 0.318 | 0.083-1.216 | 0.094 |
胃神经内分泌肿瘤相对罕见, 据文献报道发病率约0.2/10万, 其中低分化的NEC及MANEC占约15%-20%[3]. 既往研究中, 通常采用WHO 2000分类标准, Kim等[5]收集了15年间诊断NET的97例患者, 男73例, 女24例, 其中NEC 52例, 43例接受根治性胃切除术. 本组研究依据2010年WHO新的分类方法, 纳入的是恶性程度相对较高的NEC和MANEC.
NEC多见于男性患者, 平均发病年龄55岁[6]. 本组研究提示男、女比例为3.5:1.0, 发病部位以近端胃底、贲门区域为主占50%, 与文献报道相似. 胃NEC的临床症状缺乏特异性, 典型的类癌综合征发生率<3%[7]. 本组患者主要表现为上腹疼痛不适和吞咽不畅, 无类癌综合征伴随症状. NEC往往肿瘤较大, 侵犯深度多达到或穿透浆膜, 且淋巴结转移及远处转移明显高于NET[4], 本组肿瘤大小平均5.95 cm±3.71 cm(1-22 cm). 除侵及肌层6例, 其余全部侵及或穿透浆膜, 胰腺局部受累2例, 淋巴结转移36例, 脉管瘤栓14例, 伴发肝转移7例, 盆腔淋巴结转移1例.
胃镜检查是发现胃神经内分泌肿瘤的重要手段, 但因其镜下形态学与腺癌难以区分, 常被误诊为分化差的腺癌, 足够量的和深度达到黏膜肌层的活检取材结合IHC检测有助于提高诊断准确性, 其中CD56、Syn和CgA是神经内分泌分化标志物, 特别是CgA, 属于神经内分泌细胞中分泌颗粒所释放物质, 血清CgA检查对神经内分泌癌的诊断有重要意义[8].
手术是胃神经内分泌癌的首选根治性治疗手段, 一般应遵循胃腺癌的治疗原则进行根治性胃切除及淋巴结清扫术[9]. NEC及MANEC患者往往分化差, 高核分裂及细胞增殖指数, 根治性手术治疗后应辅助化疗及多学科综合治疗[4]. 本组大部分NEC及MANEC患者在确诊时已为进展期或伴有转移, 对这类患者应采取多种治疗模式, 包括手术、化疗、放疗及靶向治疗等. 治疗神经内分泌癌有效的化学治疗方案主要为EP方案, 其总有效率为53%-67%[10], 总生存时间<16 mo. 美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)治疗指南推荐对于所有低分化的NET采用小细胞肺癌方法进行EP方案化疗, 仅仅对于那些伴有类癌综合征者考虑加用奥曲肽. Noda等[11]采用顺铂和伊立替康姑息治疗12例已复发或转移的胃NEC患者, 总反应率达75%, 无进展生存期212 d. 本组共25例患者因肿瘤局部进展或转移而进行化疗, 化疗药物包括顺铂、依托泊苷、奥沙利铂、阿霉素及替吉奥、紫衫类等, 仅有1例患者采用标准EP方案治疗, 提示对于本病治疗认识尚有待进一步提高. 即便如此, 单因素分析术后采用辅助化疗治疗患者的生存期明显延长, 提示对于局部晚期及晚期NEC患者化疗具有举足轻重的地位. 生长抑素类似物通过与生长抑素受体结合抑制多肽释放而改善临床症状并抑制肿瘤生长; 因此对有功能的生长抑素受体阳性神经内分泌肿瘤有较好疗效[12], 本组患者1例接受SST类似物治疗. 近年来, 一些分子靶向药物如依维莫斯、舒尼替尼等正在进行临床试验, 已批准用于胰腺NEC治疗, 希望能在治疗胃神经内分泌肿瘤方面有所突破.
胃神经内分泌癌预后极差, 其5年生存率仅为21%. 影响NEC预后因素尚不明确, Ki67是一个重要的影响预后及分级因子, 但对于其界值确定尚存争议, 一般以>2%作为低分化G3标准[13,14], 其预后价值尚未见报道, 本研究提示Ki67对于GNEC的预后具有良好的预测价值, 其高表达患者生存期短, 多因素分析结果进一步证实Ki67是影响GNEC患者预后的独立因素(P<0.05). 免疫炎症反应在肿瘤发生发展中起重要作用, 有研究表明NLR作为机体免疫系统的评价指标之一, 在一定程度上反映了机体的炎症状态, 是肿瘤预后不良的独立危险因素, 一项包含了10例GEC的关于神经内分泌肿瘤预后分析研究提示NLR为影响预后因素[15]. NLR的升高, 反映了中性粒细胞计数相对增多或淋巴细胞计数相对减少, 而中性粒细胞可分泌血管内皮细胞生长因子(vascular endothelial growth factor, VEGF), VEGF的过度表达可促进肿瘤血管生成及远处转移. 同时, 由于癌旁组织淋巴细胞减少, 形成了适合癌细胞增殖及转移的低淋巴细胞浸润的环境, 本组资料发现术前高NLR GNEC患者生存期明显低于低NLR患者(P<0.05).
总之, NEC相对罕见并恶性程度高, 本组资料针对局部晚期及晚期NEC患者进行了临床病理特征及预后影响因素的初步分析, 尚存在病例数较少的不足, 仍有待进一步研究证实.
神经内分泌肿瘤(neuroendocrine tumor, NET)是一类临床少见的能够摄取胺的前体通过脱羧作用合成和分泌胺及多肽激素的恶性肿瘤, 其影响预后因素尚不明确. 目前最新的NET分类标准为依据世界卫生组织(World Health Organization, WHO)2010诊断标准, 既往研究多采用WHO 2000分类标准, 本研究利用最新的分类标准, 回顾性分析了50例胃神经内分泌癌(gastric neuroendocrine cancer, GNEC)和混合性腺神经内分泌癌(mixed adenoneuroendocrinecarcinoma, MANEC)患者的临床病理及治疗资料, 对影响预后的因素进行了分析.
刘宝瑞, 教授, 南京大学医学院附属鼓楼医院肿瘤中心
因胃神经内分泌肿瘤(gastric neuroendocrine tumor, GNET)发病率低, 现有治疗指南多为神经内分泌肿瘤综合性指导, GNET多归属于胃肠胰神经内分泌肿瘤, 但近年来, 随着内镜检查普及, 越来越多的GNET被发现, 而GNEC及MANEC属于NET中恶性程度高的部分, 有必要将其分解出来进行独立研究.
既往报道GNEC患者肿块最大16 cm, 本研究中肿块最大22 cm; Ki67作为一个重要分级因素, 其预后价值有待进一步验证, 本研究证明其为独立预后因素; 另既往一篇文献报道中性粒细胞淋巴细胞比率(ratio of neutrophils to lymphocytes, NLR)意义, 本研究进一步证实其为影响预后因素.
提高广大医务人员对NET认识, 特别是术后辅助治疗标准治疗方案依托泊苷联合顺铂方案(etoposide plus cisplatin, EP)选择.
本文对50例胃神经内分泌癌的临床资料及生存资料进行了统计分析, 同类研究中相对样本量较大, Ki67, NLR, 化疗为影响预后因素.
编辑 郭鹏 电编 闫晋利
| 2. | Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer. 2003;97:934-959. [PubMed] [DOI] |
| 3. | Endo S, Dousei T, Yoshikawa Y, Hatanaka N, Taniyama K, Yamauchi A, Kamiike W, Nishijima J. Gastric neuroendocrine tumors in our institutions according to the WHO 2010 classification. Int Surg. 2012;97:335-339. [PubMed] [DOI] |
| 4. | Li TT, Qiu F, Qian ZR, Wan J, Qi XK, Wu BY. Classification, clinicopathologic features and treatment of gastric neuroendocrine tumors. World J Gastroenterol. 2014;20:118-125. [PubMed] [DOI] |
| 5. | Kim BS, Oh ST, Yook JH, Kim KC, Kim MG, Jeong JW, Kim BS. Typical carcinoids and neuroendocrine carcinomas of the stomach: differing clinical courses and prognoses. Am J Surg. 2010;200:328-333. [PubMed] [DOI] |
| 6. | Basuroy R, Srirajaskanthan R, Prachalias A, Quaglia A, Ramage JK. Review article: the investigation and management of gastric neuroendocrine tumours. Aliment Pharmacol Ther. 2014;39:1071-1084. [PubMed] [DOI] |
| 9. | Knigge U, Hansen CP. Surgery for GEP-NETs. Best Pract Res Clin Gastroenterol. 2012;26:819-831. [PubMed] [DOI] |
| 10. | Moertel CG, Kvols LK, O'Connell MJ, Rubin J. Treatment of neuroendocrine carcinomas with combined etoposide and cisplatin. Evidence of major therapeutic activity in the anaplastic variants of these neoplasms. Cancer. 1991;68:227-232. [PubMed] |
| 11. | Noda K, Nishiwaki Y, Kawahara M, Negoro S, Sugiura T, Yokoyama A, Fukuoka M, Mori K, Watanabe K, Tamura T. Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer. N Engl J Med. 2002;346:85-91. [PubMed] |
| 13. | Yang F, Jin C, Long J, Fu DL, Ni QX. Options for gastroenteropancreatic neuroendocrine tumours. Lancet Oncol. 2008;9:202-203. [PubMed] [DOI] |
| 14. | Sorbye H, Strosberg J, Baudin E, Klimstra DS, Yao JC. Gastroenteropancreatic high-grade neuroendocrine carcinoma. Cancer. 2014; Apr 25. [Epub ahead of print]. [PubMed] [DOI] |
| 15. | Yucel B, Babacan NA, Kacan T, Eren AA, Eren MF, Bahar S, Celasun MG, Seker MM, Hasbek Z. Survival analysis and prognostic factors for neuroendocrine tumors in Turkey. Asian Pac J Cancer Prev. 2013;14:6687-6692. [PubMed] |