修回日期: 2014-06-10
接受日期: 2014-06-19
在线出版日期: 2014-08-08
目的: 探讨趋化因子受体CCR7诱导血管生成拟态形成促进了QBC939细胞的增殖、迁移和侵袭以及CCR7作用的信号途径.
方法: 应用三维细胞培养检测各组QBC939细胞中血管生成拟态形成; 细胞划痕实验、Transwell小室和Boyden小室检测CCL21-CCR7对QBC939细胞体外迁移、侵袭能力的影响; 应用MTT法检测CCL21-CCR7对QBC939细胞增殖能力的影响. Real-time PCR检测三组细胞株中CCR7及相关6个基因Twist1/GAPDH/IL-8/VEGF/PDEF/PDCD4的表达. 方差分析后组间比较采用LSD-t检验.
结果: 与对照组相比, CCR7过表达组形成VM能力和细胞增殖明显增强(t = 3.104, P<0.05), 而在CCR7沉默表达组形成VM和细胞增殖能力减弱(t = 2.971, P<0.05), 3组不同CCR7表达组加入CCL21形成VM和细胞增殖能力没有变化. 划痕实验、Transwell小室和Boyden小室测定细胞的运动、迁移和侵袭能力得到的结果一致, 与对照组相比, CCR7过表达组爬行能力、穿膜细胞数量明显增加(Transwell: t = 2.652; Boyden: t = 2.967, P<0.05), 而CCR7沉默组爬行能力、穿膜细胞数量明显减少(Transwell: t = 2.691; Boyden: t = 2.330, P<0.05); 在对照组和CCR7过表达组加入CCL21后爬行能力、穿膜细胞数量明显增加. qPCR检测发现, Twist1基因在3组细胞中的变化趋势同CCR7的变化一致.
结论: CCL21-CCR7生物学轴的不同表达影响了血管生成拟态的形成, 从而使胆管癌细胞的增殖能力、迁移和侵袭能力改变; CCR7影响VM形成、细胞增殖、迁移和侵袭的信号途径可能是通过Twist1的上皮-间质转化来实现的.
核心提示:肝门部胆管癌术后肝门区和肝脏的转移率及复发率很高, 血管生成拟态是肝门部胆管癌发生微转移的重要途径, CCL21-CCR7是一种重要的引诱物、在肿瘤淋巴归巢、血管生成及神经浸润方面有一定的作用, 本研究观察CCR7的不同表达对胆管癌的和血管生成拟态形成、增殖、迁移和侵袭的影响, 并探讨CCR7诱导血管生成拟态形成的分子信号途径. 为肝门部胆管癌临床治疗提供一定的基础.
引文著录: 成雨, 欧琨, 朱文涛, 管清海, 林绪涛, 曹学峰, 陈雨信. CCL21-CCR7诱导血管生成拟态形成在肝门部胆管癌微转移中的作用及机制. 世界华人消化杂志 2014; 22(22): 3274-3280
Revised: June 10, 2014
Accepted: June 19, 2014
Published online: August 8, 2014
AIM: To explore whether chemokine receptor CCR7 promotes QBC939 cell proliferation, migration and invasion by inducing vasculogenic mimicry formation as well as the underlying mechanisms.
METHODS: Vasculogenic mimicry in QBC939 cells was tested by three-dimensional cell culture. Cell migration capabilities of groups of cells were detected by scratch test and Transwell chamber assay. Boyden chamber assay was used to detect the impact of CCL21-CCR7 on the invasive ability of QBC939 cells in vitro. MTT assay was used to detect the effect of CCL21-CCR7 on proliferation of QBC939 cells. The expression of CCR7 and the related six genes (Twist1, GAPDH, IL-8, VEGF, PDEF, PDCD4) in three groups of cells was detected by real-time PCR. All data were analyzed by analysis of variance and LSD-t test.
RESULTS: Compared with control cells, VM formation ability and cell proliferation were strengthened significantly in cells overexpressing CCR7 (t = 3.104, P < 0.05) and reduced in CCR7 silenced cells (t = 2.971, P < 0.05). Compared with control cells, cell migration capabilities were significantly increased in cells overexpressing CCR7 (Transwell: t = 2.652; Boyden: t = 2.967, P < 0.05) and reduced in CCR7-silenced cells (Transwell: t = 2.691; Boyden: t = 2.330, P < 0.05). Addition of CCL21 in control cells and cells overexpressing CCR7 significantly increased cell migration capabilities. Real-time PCR showed that the expression patterns of Twist1 in three groups of cells were consistent with those of CCR7.
CONCLUSION: Differential expression of CCL21-CCR7 has an effect on the formation of vasculogenic mimicry and can change bile duct cancer cell proliferation, migration and invasion, possibly through epithelial-mesenchymal transformation mediated by Twist1.
- Citation: Cheng Y, Ou K, Zhu WT, Guan QH, Lin XT, Cao XF, Chen YX. Role and mechanism of vasculogenic mimicry induced by CCL21-CCR7 in micrometastasis of hilar cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(22): 3274-3280
- URL: https://www.wjgnet.com/1009-3079/full/v22/i22/3274.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i22.3274
肝门部胆管癌行根治性切除后肝门区和肝脏的转移率及复发率很高[1]. 肿瘤转移的发生不是随机的, 而是有转移途径的倾向性. 血管生成拟态是肝门部胆管癌发生微转移的重要途径. 血管生成拟态是指没有血管内皮细胞的参与, 肿瘤细胞形成输送血液的管道系统[2]. 肿瘤的转移和复发是由趋化因子、黏附因子等诸多因素共同调节的结果[3], 而CCL21-CCR7是一种重要的引诱物, 配体CCL21属于CC类趋化因子; CCR7是1998年由Yashida等[4]在EB病毒感染的B细胞中发现的, 是CCL21的高亲合力受体. CCL21-CCR7生物学轴在肿瘤淋巴归巢、血管生成及神经浸润方面有一定的作用, 并且可以调控其他趋化因子的分泌[5]. 本实验应用带有CCR7高表达、沉默表达和正常表达的QBC939细胞进行实验, 观察CCR7的不同表达对胆管癌的和血管生成拟态形成、增殖、迁移和侵袭的影响, 并初步探讨CCR7诱导血管生成拟态形成的分子信号途径.
Transwell迁移小室和Boyden侵袭小室均购自美国BD公司; MTT检测试剂盒购自美国Promega公司; SYBR Green Master Mix购自美国Kapa公司. CCR7引物由中国宝生物工程有限公司合成; Twist1、GAPDH、白介素-8(interleukin-8, IL-8)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、PDEF、PDCD4引物由美国Invitrogen公司合成; 人胆管癌细胞株QBC939由中国人民解放军第三军医大学西南医院肝胆外科研究所王曙光教授惠赠, DMEM完全培养基培养细胞.
1.2.1 细胞培养及实验分组: 构建CCR7高表达和沉默表达质粒后转染QBC939细胞, 筛选各组表达不同质粒的QBC939细胞分成3组细胞: (1)空白对照组: pEGFP组; (2)CCR7过表达组: CCR7-pEGFP组; (3)CCR7沉默组: CCR7-shRNA-pEGFP组; (4)空白对照+CCL21组; (5)CCR7过表达+CCL21组; (6)CCR7沉默+CCL21组.
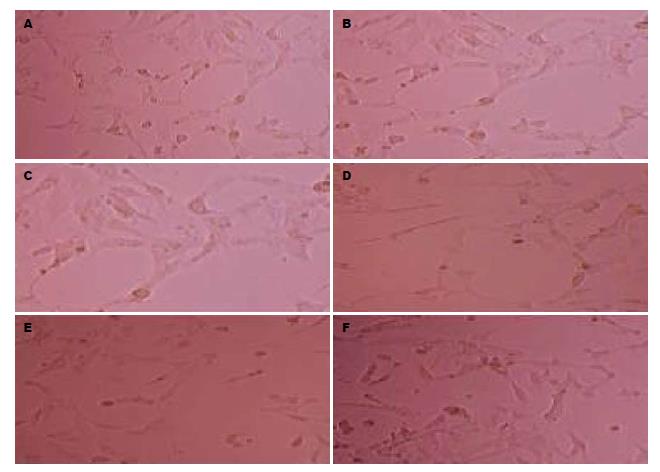
1.2.2 三维细胞培养检测细胞中血管生成拟态: 将6组细胞(每孔3.2×104个细胞)种植于加入Matrigel的24孔板中, 每组细胞设立3个复孔, 37 ℃培养12 h后置于倒置显微镜观察QBC939细胞管状结构排列情况和完整程度, 并在200倍视野下随机选取上、下、左、右、中心5个视野摄像记录并计数管状结构数量.
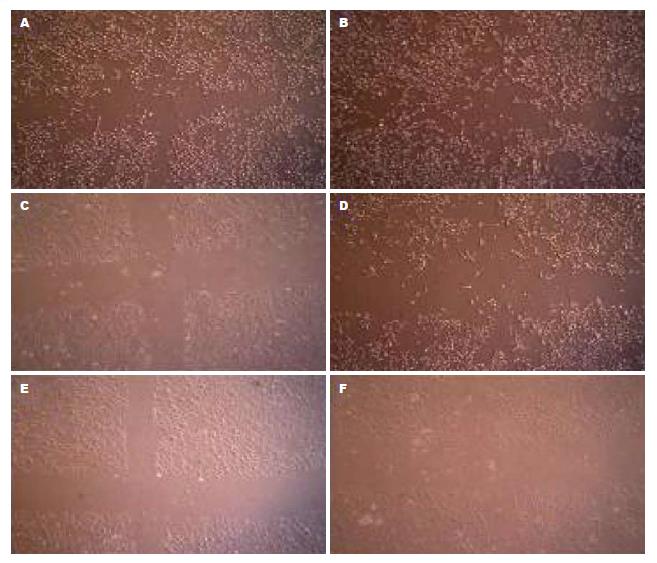
1.2.3 细胞划痕实验: 将6组QBC939细胞以3.2×104接种于24孔培养板中, 待细胞密度>80%时, 用10 μL枪头在每孔单层细胞上划"十"字划痕, 造成培养细胞伤口模型, 划痕后PBS清洗2次. 用无血清培养基继续培养, 倒置显微镜定时观察伤口愈合程度.
1.2.4 细胞体外迁移试验: 将Transwell小室置24孔板中, 分别取对数生长期的pEGFP组细胞、CCR7-pEGFP组细胞和CCR7-shRNA-pEGFP组细胞, 0.25%胰酶消化, 离心弃上清后, 用不含血清的DMEM培养基把3组细胞分别制成3.0×105/mL细胞悬液, 后分别加入放置了Transwell上室的24孔板中, 每孔0.2 mL(每孔0.6×105个细胞). 在下室内加入含或不含100 mg/L CCL21培养基, 如上分为6组, 每组细胞设立3个复孔, 继续培养24 h, 取出Transwell小室, 用棉签蘸无血清的DMED培养基拭残留细胞. 应用Diff-Quik染色试剂盒固定、染色. 普通光学显微镜下观察, 每个滤膜随机选取5个200倍视野, 计数穿透至滤膜下室面的细胞数, 取3个复孔的平均值.
1.2.5 细胞体外侵袭能力试验: 试验方法同上, 不同之处在于Boyden侵袭小室在Transwell小室滤膜上铺一层Matrigel胶.
1.2.6 细胞增殖能力试验: 分别取对数生长期(70%-80%融合状态)的pEGFP组细胞、CCR7-pEGFP组细胞和CCR7-shRNA-pEGFP组细胞, 0.25%胰酶消化, 制成细胞悬液, 接种于96孔细胞培养板中, 每孔200 μL含8000个细胞, 将上述3组细胞分别加入200 μL培养液和含100 mg/L CCL21的200 μL培养液, 将细胞分成6组, 每组细胞设3个复孔. 培养24 h后, 每孔加15 μL MTT溶液(5 mg/mL, pH 7.4), 孵育4 h, 加入150 μL反应终止液后, 在酶联免疫监测仪上选择570 nm波长测定各孔吸光度(A)值.
1.2.7 Real-time PCR检测3组细胞中CCR7及相关基因的表达: TRIzol裂解各组细胞并按照试剂说明书的操作提取总RNA, 后按说明书逆转录合成cDNA. 各引物Twist1、GAPDH、IL-8、VEGF、PDEF、PDCD4由美国Invitrogen公司合成. PCR反应体系为20 μL, 扩增条件: 95 ℃预变性30 s, 95 ℃变性5 s, 55 ℃退火5 s, 72 ℃退火延伸30 s, 扩增40个循环, 建立溶解曲线. 设立2个复孔, 反应在PRISM@StepOneTM PCR仪上进行, 方法采用SYBR Green法, 以基因Ct值与β-actin Ct值之比值, 即为待测基因mRNA的相对表达量, 以β-actin作为内参照.
统计学处理 所有数据均以mean±SD表示, 采用SPSS16.0统计软件进行处理, 方差分析后组间比较采用LSD-t检验, P<0.05为差异有统计学意义.
在QBC939细胞对照组中, 肿瘤细胞相互接触形成环状结构、多个环状结构相互连接成网状结构, 表明了血管生成拟态的形成. 与对照组相比, CCR7过表达组形成环状结构数目明显增加(t = 3.104, P<0.05), CCR7沉默组网状结构稀疏, 形成环状结构数目较对照组明显减少(t = 2.971, P<0.05); 3个CCR7不同表达组加入CCL21后与对应组相比形成环状结构数目没有明显变化(t<2.228, P>0.05)(表1, 图1).
| 分组 | 环状结构数目 | Transwell穿膜细胞数 | Boyden穿膜细胞数 | MTT(570 nm波长) |
| A: 空白对照组 | 19±6 | 42±6 | 30±1 | 0.510±0.108 |
| B: CCR7过表达组 | 36±2 | 71±2 | 63±5 | 0.876±0.132 |
| C: CCR7沉默组 | 2±2 | 29±3 | 21±4 | 0.210±0.241 |
| D: 空白对照+CCL21组 | 17±3 | 63±3 | 49±6 | 0.549±0.212 |
| E: CCR7过表达+CCL21组 | 39±2 | 98±5 | 82±2 | 0.887±0.201 |
| F: CCR7沉默+CCL21组 | 3±1 | 31±5 | 25±2 | 0.198±0.101 |
| 统计值 | B-A: t = 3.104 C-A: t = 2.971 | B-A: t = 2.652 C-A: t = 2.691 D-A/E-B: t>2.131 | B-A: t = 2.967 C-A: t = 2.130 D-A/E-B: t>2.131 | B-A: t = 3.187 C-A: t = 2.829 |
| P值 | <0.05 | <0.05 | <0.05 | <0.05 |
在QBC939细胞对照组中, 划痕边缘细胞缓慢向中央伸展、爬行, 缺损处修复缓慢; 加入CCL21后, 细胞向划痕处爬行的速度明显加快, 细胞铺展迅速, 越过划痕边缘细胞明显增多. CCR7过表达组与对照组比较, 细胞爬行速度明显增快, 越过边缘细胞明显增多; CCR7过表达组加入CCL21后, 细胞移行速度更快, 培养24 h划痕基本愈合. 在CCR7沉默组与对照组比较, 细胞爬行速度变慢, 培育24 h后划痕依旧明显; CCR7沉默组加入CCL21后, 与对应组相比细胞对划痕修复的未出现明显改善(图2).
应用Transwell小室和Boyden小室测定各组QBAC939细胞的迁移和侵袭能力得到的结果大致一致. 在200倍视野下, 光镜观察各组细胞穿透情况, 计算穿膜细胞平均数(表1). 与对照组相比, CCR7过表达组穿膜细胞数量明显增加(Transwell: t = 2.652; Boyden: t = 2.967, P<0.05), 而CCR7沉默组穿膜细胞数量明显减少(Transwell: t = 2.691; Boyden: t = 2.330, P<0.05); 在对照组和CCR7过表达组加入CCL21后与对应组相比穿膜细胞数量明显增加(所有组t>1.31, P<0.05); 在CCR7沉默表达组加入CCL21后, 穿膜细胞数量没有明显变化(Transwell: t = 0.843; Boyden: t = 0.768, P>0.05)(表1).
MTT法检测各组细胞的增殖能力, 与对照组相比, CCR7过表达组吸光值明显增高、细胞增殖能力明显增强(t = 3.187, P<0.05), 而CCR7沉默组表达组吸光值明显降低、细胞增殖能力明显减弱(t = 2.829, P<0.05); 三组CCR7不同表达细胞分别加入CCL21培养, 与未加入CCL21各组两两比较, 均无显著性差异(t<2.447, P>0.05)(表1).
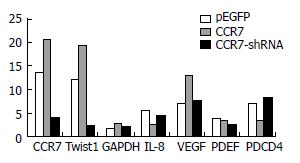
采用之前设计的CCR7引物进行Real-time PCR检测发现: 与正常对照组相比, CCR7-pEGFP过表达组CCR7表达水平明显增强; 而CCR7-shRNA-pEGFP沉默组CCR7的水平表达微弱(图3). 除此之外, 我们应用美国Invitrogen公司设计Twist1/GAPDH/IL-8/VEGF/PDEF/PDCD4 6个基因的引物对3组样本进行qPCR检测发现: Twist1基因在3组细胞中的变化趋势同CCR7的变化一致, 即在CCR7过表达组同时也高表达Twist1, 而在CCR7沉默组Twist1基因也低表达(图3). 说明这两种基因在胆管癌细胞中有着非常亲密的关系, CCR7在细胞中量的变化影响了Twist1基因的改变.
Yamada等[6]报道肝门部胆管癌占肝外胆管癌的58%-75%. 近年来肝门部胆管癌的发病率呈上升趋势[7]. 而且其起病隐匿, 出现临床症状已属中晚期, 手术根治性切除率仅18.0%-26.2%[8]. 近几年由于联合肝叶切除等手术方式的出现, 生存率明显提高, 1、3、5年生存率分别为75.4%、24.0%和12.2%; 但是并发症的发生率却高达36.5%[9]. Seyama等[10]同时也报道联合肝叶切除的肝门部胆管癌肝功能衰竭的发生率高达29.8%, 目前Seyama等[10]报道肝功能衰竭发生率明显下降. 我们统计了了105例肝门高位切除、肝门实质-空肠吻合的手术患者手术切除率86.7%, 根治性切除(R0切除)率36.2%. 尽管如此, 肝门部胆管癌患者长期治愈的病例极少, 术后转移和复发率很高. 既然肝门部胆管癌很少发生远处转移、而主要是肝脏和肝门区的转移. 那么, 为什么行根治性切除术后(切缘及周围组织常规病理检查无瘤细胞残余), 肝门部胆管癌复发率依然很高, 且同样多见于肝脏和肝门区的转移. 微转移可能是其主要原因. 微转移是指常规临床病理学方法不能检出的非血液系统恶性肿瘤的转移, 是离开原发灶的镜检(<2 mm)癌细胞沉积, 在逃避免疫监视后侵犯血管并发展成肉眼可见的病变, 常无任何临床表现[11]. 血管生成拟态是肿瘤发生微转移的重要途径. 血管生成拟态的特点是管道内没有血管内皮细胞衬覆, 肿瘤细胞形成瘤细胞条索并围成管道, 而血液则在无内皮细胞的管道中流动, 该管道外周是一层厚薄不均的PAS阳性物质构成的基底膜[12]. VM是一种不同于肿瘤内皮依赖性血管生成的新的肿瘤微循环模式, 脱落的肿瘤细胞随血液流动发生远处转移, 使肿瘤的转移率增高、预后差[13,14]. VM的形成可有效缓解肿瘤快速生长早期肿瘤细胞微环境的缺氧状态, VM逐渐被马赛克血管(mosaic vessels, MV)取代, 最后被正常血管内皮则(endothelium vessels, EV)过渡为正常血液供应模式, 这就是肿瘤血管生成的三阶段学说[15]. 另外, 能形成血管生成拟态的肿瘤细胞恶性程度高, 分化程度低[16,17], 可产生多种肿瘤浸润转移相关基因参与肿瘤的浸润与转移. 本课题组已经通过体内、体外实验证实: 肝门部胆管癌组织标本存在血管生成拟态形成, 正常组织中无VM形成; 并且所有低分化的肝门部胆管癌中VM全部阳性; 从三维细胞培养肝门部胆管癌细胞也显示其有形成血管生成拟态的能力. 上述结果表明血管生成拟态形成促进了肝门部胆管癌的微转移. 那么是什么原因诱导肿瘤细胞形成血管生成拟态而促进肝门部胆管癌微转移. 肿瘤细胞的组织趋向性表现肿瘤细胞迁徙至首选器官或组织, 可能是由转移前微龛(premetastatia niche)所分泌的化学引诱物形成浓度梯度介导[18]. 而CCL21-CCR7是一种重要的引诱物. 本实验应用CCR7正常表达、CCR7高表达和沉默表达QBC939细胞进行了血管生成拟态的检测发现: 正常对照组中存在血管生成拟态的形成, 在CCR7过表达组形成环状结构数目(血管生成拟态)较对照组明显增加, 而在CCR7沉默表达组网状结构稀疏, 形成环状结构数目较对照组明显减少. 从而证实了CCR7影响了VM的变化, 诱导了VM的形成. 在MTT增殖实验中, CCR7过表达组细胞增殖能力显著高于正常组和沉默组; 正常对照组细胞增殖能力显著高于沉默组, 说明CCR7是QBC939细胞增殖能力增强. 但各组细胞增殖能力的变化与是否加入CCL21无关. 可能原因为CCL21对CCR7的趋化作用只是增加了细胞的迁移和浸润能力, 与细胞增殖生长无关. 同时, 在CCR7不同表达对QBC939细胞的迁移、侵袭能力检测中发现: 与对照组相比, CCR7过表达组穿膜细胞数量明显增加, 而CCR7沉默组穿膜细胞数量明显减少; 在对照组和CCR7过表达组加入CCL21后穿膜细胞数量明显增加, 而在CCR7沉默表达组加入CCL21后, 穿膜细胞数量没有明显变化. 在CCR7沉默组并不能完全阻断肿瘤细胞的侵袭和浸润, 因为肿瘤的转移是非常复杂的多因素综合作用的结果, 如肿瘤细胞的浸润、侵袭、免疫逃避等是由趋化因子、黏附因子等诸多因素共同调节的结果. 在CCR7沉默组加入CCL21无变化, 可能是因为此组细胞含有少量或不含有CCR7, CCL21对细胞没有趋化作用. 研究发现, 许多肿瘤细胞也不同程度的表达CCR7, 而CCL21在肿瘤组织中表达量极少或没有. 以往及我们的研究表明CCL21-CCR7轴在肿瘤中的作用主要体现在促进肿瘤迁移和侵袭方面. 肿瘤转移是一个严格的器官选择性的过程, 其特异性决于他所表达的趋化因子受体及靶器官所表达的趋化因子. Zlotnik[19]研究表明肿瘤细胞高表达趋化因子受体主要有CXCR4和CCR7, 转移的靶器官可以释放相应配体促进其定向转移. 而在这一过程的初始阶段, 血管生成拟态提供了肿瘤转移所需要的营养及血液供应.
总之, CCR7诱导了血管生成拟态形成提供了肿瘤的营养, 从而促进了肿瘤的迁移和侵袭. 并且我们通过Real-time PCR检测, 应用了Twist1/GAPDH/IL-8/VEGF/PDEF/PDCD4六组引物连同CCR7引物一起检测发现: Twist1基因与CCR7的变化趋势完全一致: 在CCR7组Twist1高表达, 在CCR7-shRNA组Twist1低表达, 在正常对照组Twist1表达在两者之间. 说明CCR7在胆管癌细胞中的表达影响了Twist1的表达. Twist1调控上皮-间充质转化使上皮细胞失去上皮表型转变为有迁移能力的间充质表型, EMT参与了血管生成拟态的形成过程[20]. Twist1已被证实与肿瘤转移、肿瘤血管生成拟态的形成具有密切关联性[21]具体的详细信号途径需要进一步实验证实.
肝门部胆管癌术后复发率高, 且主要沿胆管壁血管、神经、淋巴结局部转移很少远处转移, 前期研究发现肝门部胆管癌高表达CCR7且CCL21-CCR7可诱导肿瘤转移, 因此, 此研究CCL21-CCR7诱导肝门部胆管癌转移具有重要意义.
薛东波, 教授, 哈尔滨医科大学附属第一医院; 康春博, 副主任医师, 北京大学航天临床医院普通外科
目前研究发现CCL21-CCR7与胃癌、结肠癌淋巴转移密切相关, 在肝癌、肺癌、头颈部鳞状细胞癌及食管癌中也证实CCL21-CCR7与肿瘤复发和淋巴结转移有关, 但在肝门部胆管癌中作用及其作用途径和机制如何, 需要进一步研究.
Zlotnik研究肿瘤细胞高表达CXCR4和CCR7, 转移的靶器官可以释放相应配体促进其定向转移. 而在其初始阶段, 血管生成拟态提供肿瘤转移所需要的营养及血液供应, 其具体机制尚未报道.
CCL21-CCR7对多种肿瘤转移复发有关, 尤其是淋巴结转移, 但其诱导血管生成拟态在肝门部胆管癌中的作用是创新之处, 诱导转移的途径和机制是另一创新点.
初步建立肝门部胆管癌的微转移检测指标, 为术中确定肿瘤切除范围、术后病情分析、预后评估和选择术后个体化治疗方案提供依据.
本文对了解肝门部胆管癌术后微转移中的机制提供了科学的、有意义的信息, 具有一定的创新性与开拓性, 能较好的反映目前临床和基础研究工作的先进水平.
编辑 田滢 电编 闫晋利
| 2. | Maniotis AJ, Folberg R, Hess A, Seftor EA, Gardner LM, Pe'er J, Trent JM, Meltzer PS, Hendrix MJ. Vascular channel formation by human melanoma cells in vivo and in vitro: vasculogenic mimicry. Am J Pathol. 1999;155:739-752. [PubMed] [DOI] |
| 3. | Oliveira-Neto HH, de Souza PP, da Silva MR, Mendonça EF, Silva TA, Batista AC. The expression of chemokines CCL19, CCL21 and their receptor CCR7 in oral squamous cell carcinoma and its relevance to cervical lymph node metastasis. Tumour Biol. 2013;34:65-70. [PubMed] [DOI] |
| 4. | Yoshida R, Nagira M, Kitaura M, Imagawa N, Imai T, Yoshie O. Secondary lymphoid-tissue chemokine is a functional ligand for the CC chemokine receptor CCR7. J Biol Chem. 1998;273:7118-7122. [PubMed] [DOI] |
| 5. | Mburu YK, Egloff AM, Walker WH, Wang L, Seethala RR, van Waes C, Ferris RL. Chemokine receptor 7 (CCR7) gene expression is regulated by NF-κB and activator protein 1 (AP1) in metastatic squamous cell carcinoma of head and neck (SCCHN). J Biol Chem. 2012;287:3581-3590. [PubMed] [DOI] |
| 6. | Yamada Y, Mori H, Hijiya N, Matsumoto S, Takaji R, Kiyonaga M, Ohta M, Kitano S, Moriyama M, Takaki H. Extrahepatic bile duct cancer: invasion of the posterior hepatic plexuses--evaluation using multidetector CT. Radiology. 2012;263:419-428. [PubMed] [DOI] |
| 7. | 邹 声泉. 胆管癌外科治疗的现状和展望. 中国普外基础与临床杂志. 2008;15:77-80. |
| 10. | Seyama Y, Kubota K, Sano K, Noie T, Takayama T, Kosuge T, Makuuchi M. Long-term outcome of extended hemihepatectomy for hilar bile duct cancer with no mortality and high survival rate. Ann Surg. 2003;238:73-83. [PubMed] [DOI] |
| 11. | Liang WC, Sickle-Santanello BJ, Nims TA. Is a completion axillary dissection indicated for micrometastases in the sentinel lymph node? Am J Surg. 2001;182:365-368. [PubMed] |
| 13. | Sun D, Sun B, Liu T, Zhao X, Che N, Gu Q, Dong X, Yao Z, Li R, Li J. Slug promoted vasculogenic mimicry in hepatocellular carcinoma. J Cell Mol Med. 2013;17:1038-1047. [PubMed] [DOI] |
| 14. | Hess AR, Seftor EA, Gardner LM, Carles-Kinch K, Schneider GB, Seftor RE, Kinch MS, Hendrix MJ. Molecular regulation of tumor cell vasculogenic mimicry by tyrosine phosphorylation: role of epithelial cell kinase (Eck/EphA2). Cancer Res. 2001;61:3250-3255. [PubMed] |
| 15. | Hendrix MJ, Seftor EA, Hess AR, Seftor RE. Vasculogenic mimicry and tumour-cell plasticity: lessons from melanoma. Nat Rev Cancer. 2003;3:411-421. [PubMed] [DOI] |
| 16. | Itzhaki O, Greenberg E, Shalmon B, Kubi A, Treves AJ, Shapira-Frommer R, Avivi C, Ortenberg R, Ben-Ami E, Schachter J. Nicotinamide inhibits vasculogenic mimicry, an alternative vascularization pathway observed in highly aggressive melanoma. PLoS One. 2013;8:e57160. [PubMed] [DOI] |
| 17. | 刘 文斌, 许 戈良, 荚 卫东, 李 建生, 马 金良, 葛 勇胜, 任 维华, 余 继海, 王 伟, 胡 晔. 缺氧对肝癌血管生成拟态的影响及其机制. 世界华人消化杂志. 2010;18:3294-3300. [DOI] |
| 18. | Kaplan RN, Riba RD, Zacharoulis S, Bramley AH, Vincent L, Costa C, MacDonald DD, Jin DK, Shido K, Kerns SA. VEGFR1-positive haematopoietic bone marrow progenitors initiate the pre-metastatic niche. Nature. 2005;438:820-827. [PubMed] [DOI] |
| 19. | Zlotnik A. Chemokines and cancer. Int J Cancer. 2006;119:2026-2029. [PubMed] [DOI] |
| 20. | Sun T, Zhao N, Zhao XL, Gu Q, Zhang SW, Che N, Wang XH, Du J, Liu YX, Sun BC. Expression and functional significance of Twist1 in hepatocellular carcinoma: its role in vasculogenic mimicry. Hepatology. 2010;51:545-556. [PubMed] [DOI] |