修回日期: 2014-05-16
接受日期: 2014-05-21
在线出版日期: 2014-07-18
目的: 评估粪便中转录因子GATA结合蛋白5(GATA binding protein 5, GATA5)和波形蛋白(Vimentin)基因启动子甲基化标志的检测用于结直肠癌(colorectal cancer, CRC)早期无创诊断的可行性.
方法: 收集浙江省宁波市医疗中心李惠利医院2012-02/2012-12的49例CRC患者和37例正常对照者的粪便, 从中分别提取DNA, 并采用甲基化特异性PCR(methylation-specific polymerase chain reaction, MSP)技术分析GATA5和Vimentin基因启动子的甲基化状态.
结果: 在CRC患者中, 检测GATA5基因甲基化诊断CRC的敏感性和特异性分别为81.63%和86.49%, Vimentin基因甲基化的敏感性和特异性分别为44.90%和86.49%, 两个基因中至少有一个基因甲基化的概率为95.1%, 相比之下, 37个正常样本中只有10个(27.0%)显示有DNA甲基化. 单因素相关分析显示, GATA5和Vimentin基因甲基化的阳性状态与CRC患者年龄、性别、肿瘤的分期和位置无统计学相关性.
结论: CRC粪便DNA中GATA5和Vimentin基因异常甲基化发生率明显高于正常对照组, 粪便样本中检测GATA5和Vimentin基因甲基化可能成为CRC早期无创诊断的一个新方法, 并且联合检测多基因甲基化筛查结直肠肿瘤的方法优于单基因检测方法.
核心提示: GATA结合蛋白5(GATA binding protein 5, GATA5)和波形蛋白(Vimentin)基因甲基化状态与结直肠癌(colorectal cancer, CRC)的发生及发展密切相关, 粪便DNA中这两个基因甲基化检测方法筛查CRC有较高的敏感性和特异性, 具有成为非侵入性CRC筛查方法的前景, 并且, GATA5有望成为CRC无创筛查手段的一个新的肿瘤生物标志物.
引文著录: 叶群群, 陆宏娜, 张谢, 王丹萍, 黄志刚. GATA5和Vimentin基因启动子甲基化在结直肠癌患者粪便中的检测及临床意义. 世界华人消化杂志 2014; 22(20): 2971-2976
Revised: May 16, 2014
Accepted: May 21, 2014
Published online: July 18, 2014
AIM: To evaluate the possibility of using GATA binding protein 5 (GATA5) and Vimentin promoter methylation as markers for the noninvasive detection of colorectal cancer (CRC).
METHODS: Stool samples were collected from 49 patients with CRC and 37 endoscopically normal subjects who underwent colonoscopy at our hospital from February 2012 to December 2012, and DNA was isolated from all samples. Methylation-specific polymerase chain reaction (MSP) was then utilized to analyze promoter CpG methylation of GATA5 and Vimentin.
RESULTS: The sensitivity and specificity of GATA5 gene methylation assay for detection of colorectal cancer were 81.63% and 86.49%, respectively. The sensitivity and specificity of Vimentin gene methylation were 44.90% and 86.49%, respectively. The overall sensitivity of detection of fecal DNA with at least one methylated gene was 95.1% in patients with CRC. In contrast, only 10 of the 37 (27.0%) normal individuals exhibited methylated DNA in the above promoter regions. GATA5 and Vimentin promoter methylation showed no significant correlation with gender, age, tumor-node-metastasis (TNM) stage or tumor location.
CONCLUSION: The abnormal methylation of GATA5 and Vimentin occurs frequently in fecal samples of patients with colorectal cancer. Detection of aberrantly methylated GATA5 and Vimentin in fecal samples may be a promising, noninvasive screening method for colorectal cancer, and the combined detection of multiple gene methylation for colorectal neoplasia screening is superior to single gene detection.
- Citation: Ye QQ, Lu HN, Zhang X, Wang DP, Huang ZG. Analysis of GATA5 and Vimentin methylation in fecal DNA for detection of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2971-2976
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2971.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2971
结直肠癌(colorectal cance, CRC)是全球发病率和死亡率都排名第3位的恶性肿瘤[1]. 从病因学角度分析, 良性肿瘤如息肉、腺瘤发展到恶性肿瘤是遗传学和表遗传学改变积累的过程[2]. 表观遗传学改变可以定义为在细胞分裂过程中可遗传的不涉及DNA序列改变的基因组修饰作用[3], 包括染色体不稳定性(chromosomal instability, CIN)、微卫星不稳定性(microsatellite instability, MSI)、基因突变以及基因甲基化[4]. DNA甲基化是CpG二核苷酸5'端的胞嘧啶在DNA甲基化转移酶(DNA methyltransferases, DNMTs)的作用下加上一个甲基[5], 这样可以使某些基因失活, 而去甲基化则可以诱导一些基因重新活化和表达. 当发生肿瘤时, 抑癌基因CpG岛中的CpG呈高度甲基化状态, 以致于抑癌基因表达丢失[6]. 基因启动子CpG岛甲基化发生早于肿瘤细胞的恶性增生, 因此基因甲基化的检测可以用于肿瘤的早期诊断[7], 已有研究表明[8]通过粪便检测肿瘤相关基因启动子CpG岛甲基化状况有助于进行CRC的早期诊断. 波形蛋白(Vimentin)属中间纤维家族, 他在细胞黏附、迁移、增殖、凋亡、信号传导及炎症发生等多方面起着重要作用, 最近研究发现了在CRC中Vimentin基因可作为甲基化标志物的实用性和潜力. 并且, 检测Vimentin基因的甲基化标志物作为早期CRC的非侵入性筛查方法已被商业化. 而转录因子GATA结合蛋白5(GATA binding protein 5, GATA5)基因的甲基化也经常发生在结直肠肿瘤患者中, 该基因是抑癌基因DAB2(disabled homolog 2), 上游的转录调控因子, 这种抑癌基因的启动子CpG岛甲基化可导致该基因沉默. 此次我们采用MSP技术分析粪便DNA中GATA5和Vimentin的基因启动子甲基化状态, 以评估其在CRC早期诊断中的潜在临床应用价值.
收集49例CRC(所有诊断均经内镜病理证实, 病例入选标准: (1)不伴有身体其他部位肿瘤; (2)留取标本前未经任何治疗; (3)收集粪便前5 d内未进行任何侵入性操作, 包括结肠镜检查、灌肠等及37例内镜检查正常的健康者(所有研究对象年龄在35-65岁之间)的粪便标本, 粪便标本于手术前或内镜检查前收集, 保存在-80 ℃备用. 所有研究对象均知情同意. 粪便DNA提取试剂盒(Qiagen, 德国): QIAamp Mini Spin Columns 50, Collection Tubes(2 mL) 200, Inhibit EX Tablets 50, Buffer ASL 140 mL, Buffer AL 33 mL, Buffer AW1(使用前加25 mL无水乙醇)19 mL, Buffer AW2(使用前加30 mL无水乙醇)13 mL, Buffer AE 12 mL, Proteinase K 1.4 mL. DNA重亚硫酸氢盐处理试剂盒(Qiagen, 德国): Bisulfite Mix 6 tubes, DNA Protect Buffer 1.9 mL, RNase-Free Water 3×1.9 mL, DNA Spin Columns 48, Collection Tubes(2 mL) 96, Buffer BL 31 mL Buffer BW(使用前加30 mL无水乙醇)2×13 mL, Buffer BD(使用前加27 mL无水乙醇)3 mL, Buffer EB 15 mL, Carrier RNA 310 µg.
1.2.1 粪便DNA提取: 取600-800 mg左右冷冻粪便样本, 按照QiaAmp DNA Stool Mini-Kit试剂盒(Qiagen, 德国)提取DNA, 操作按照说明进行, 纯化的DNA储存于-20 ℃下.
1.2.2 DNA重亚硫酸氢盐处理: DNA经过重亚硫酸氢盐处理后, CpG岛中甲基化的胞嘧啶不变, 未甲基化的胞嘧啶则转变为尿嘧啶, 粪便DNA的重亚硫酸氢盐处理使用EpiTect Bisulfite Kit试剂盒(Qiagen, 德国), 操作按照说明进行.
1.2.3 甲基化特异性PCR(MSP)及电泳:GATA5和Vimentin基因特异性甲基化和非甲基化引物序列、退火温度和扩增长度如表1, MS-PCR反应体系总体积为50 µL: DNA样品2 µL, 缓冲液Buffer B 10 µL, 无菌水34.8 µL, dNTP 1 µL, 上下游引物各1 µL, Taq酶0.2 µL, MS-PCR反应条件: 第1步, 95 ℃预变性5 min ; 第2步, 95 ℃ 30 s , Tm+8 ℃ 30 s, 每个循环降0.8 ℃, 72 ℃ 1 min, 共10个循环; 第3步, 95 ℃ 30 s , Tm ℃ 30 s, 72 ℃ 1 min, 共38个循环; 最后, 72 ℃延伸7 min. 将5 µL PCR产物在1.2%琼脂糖凝胶上进行电泳, 将凝胶放入凝胶成像系统中, 用Quantity One分析软件对电泳条带进行分析、取图.
| 基因 | Primer | 片段 (5'-3') | 退火温度 (℃) | 扩增长度(bp) |
| GATA5 | M | F: 5'-TTAGAAATCGAGGAAATCGC-3' | 54 | 133 |
| R: 5'-GTAAACCCCCTCGTTACGTA-3' | ||||
| U | F: 5'-TGTTTAGAAATTGAGGAAATTGT-3' | 48 | 133 | |
| R: 5'-CCCATAAACCCCCTCATTACATA-3' | ||||
| Vimentin | M | F: 5'-AGGAAAGTATAAATTTCGGGTGC-3' | 52 | 173 |
| R: 5'-ATAAACGACGTCTTTCACCCTTAC-3' | ||||
| U | F: 5'-AAAAGGAAAGTATAAATTTTGGGTGT-3' | 48 | 173 | |
| R: 5'-TATAAACAACATCTTTCACCCTTACCT-3' |
统计学处理 各项数据结果的统计学SPSS11.0分析软件处理, 各组间比较采用t检验, 阳性率比较采用χ2检验或Fisher精确检验法. P<0.05为差异有统计学意义.
此次研究有CRC患者49例, 正常对照组37例, 在CRC患者中男性占40.8%(20/49), 女性占59.2%(29/49), 并且年龄≤50岁的患者占18.4%(9/49),>50岁的CRC患者占81.6%(40/49), 根据肿瘤术后病理进行肿瘤TNM分期, 49例CRC患者中Ⅰ/Ⅱ期的患者有26例, 占总数的53.1%, Ⅲ/Ⅳ期患者占46.9%, 肿瘤位于直肠的患者占总数的67.3%(33/49), 右结肠患者占10.2%(5/49), 左结肠患者占22.4%(11/49). 本研究结果发现: CRC患者粪便中GATA5基因的甲基化水平与患者的年龄(P = 1)、性别(P = 1)及肿瘤的分期(P = 0.15)和位置(P = 0.07)无统计学相关性, 并且Vimentin基因甲基化与患者的年龄(P = 0.25)、性别(P = 0.71)及肿瘤的分期(P = 0.85)和位置(P = 0.76)也无统计学相关性(表2).
| 特征 | n | GATA5 | Vimentin | Combined |
| CRC | 49 | 40/49(81.6) | 22/49(44.9) | 47/49(95.1) |
| 性别 | ||||
| 男 | 20 | 16/20(80.0) | 7/20(35.0) | 19/20(95.0) |
| 女 | 29 | 24/29(82.8) | 15/29(51.7) | 28/29(96.6) |
| P值 | 1.0 | 0.25 | 1.0 | |
| 年龄(岁) | ||||
| ≤50 | 9 | 8/9(88.9) | 5/9(55.6) | 9/9(1.0) |
| >50 | 40 | 32/40(80.0) | 17/40(42.5) | 38/40(95.0) |
| P值 | 1.0 | 0.71 | 1.0 | |
| TNM 分期 | ||||
| I/II期 | 26 | 19/26(73.1) | 12/26(46.2) | 24/26(92.3) |
| III/IV期 | 23 | 21/23(91.3) | 10/23(43.5) | 23/23(1.00) |
| P值 | 0.15 | 0.85 | 0.49 | |
| 肿瘤位置 | ||||
| 直肠 | 33 | 24/33(72.7) | 16/33(48.5) | 31/33(93.9) |
| 右结肠 | 5 | 5/5(1.0) | 2/5(40.0) | 5/5(1.0) |
| 左结肠 | 11 | 11/11(1.0) | 4/11(36.4) | 11/11(1.0) |
| P值 | 0.07 | 0.76 | 0.60 | |
| 正常样本 | 37 | 5/37(13.5) | 5/37(13.5) | 10/37(27.0) |
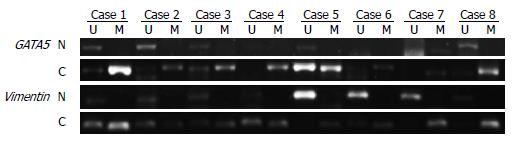
2.2.1 MSP结果: DNA经重亚硫酸盐处理后, 以处理后的DNA作为模板, 加入甲基化特异性和非甲基化引物进行扩增, 只有结合完全的甲基化或非甲基化特异性引物的片段才能扩增出产物. 基因甲基化判定标准: 经过MSP扩增后产物出现甲基化条带, 而不出现非甲基化条带的样品, 或者两者均出现, 而甲基化条带显色明显于为甲基化条带的样品, 均定义为基因甲基化; 出现未甲基化条带, 而不出现甲基化条带的样品, 定义为基因未甲基化. 通过凝胶成像系统显像, 我们发现正常对照组粪便DNA经过MSP扩增出非甲基化产物, 而CRC患者粪便DNA经过MSP扩增出甲基化产物(图1).
2.2.2 粪便样本中基因甲基化检测的敏感性和特异性及OR值: 在CRC患者中, GATA5和Vimentin基因甲基化的阳性率分别为81.63%(40/49)、44.90%(22/49), 特异性分别为86.49%(5/37)、86.49%(5/37). CRC患者粪便DNA中, 至少有一个基因甲基化的概率为95.92%(47/49), 相比之下, 37个正常样本中只有10个显示有DNA甲基化, 特异性为72.97%. 在粪便DNA中检测GATA5和Vimentin基因的甲基化情况的OR值分别为28.44(95%CI: 8.67-93.33, P<0.01)、5.22(95%CI: 1.74-15.64, P<0.01), 联合检测者这两个基因甲基化水平的OR值为63.4(95%CI: 12.93-311.3, P<0.01)(表3), 我们发现研究的P值
| 基因 | 敏感性 | 特异性 | OR值 | P值 |
| GATA5 | 81.63(67.98-91.24) | 86.49(71.23-95.46) | 28.44(8.67-93.33) | <0.01 |
| Vimentin | 44.90(30.67- 59.77) | 86.49(71.2- 95.46) | 5.22(1.74-15.64) | <0.01 |
| 联合检测 | 95.92(86.02-99.50) | 72.97(55.88-86.21) | 63.45(12.93-311.3) | <0.01 |
均<0.05, 结果表明: CRC患者粪便中这两个基因的甲基化水平与正常对照组样本之间差异有统计学意义.
虽然对50岁以上的个人进行CRC筛查可以明显减少肠癌的发病率和死亡率, 但由于结肠镜需清洁灌肠、痛苦、检查时间较长并有一定并发症, 有许多患者不愿接受以结肠镜检查为基础的侵入性筛查方式. 在结直肠肿瘤的各种筛选方法中, 粪便隐血试验(fecal occult-blood test, FOBT)是被临床广泛使用的非侵入性的检查方式, 然而, FOBT的灵敏度只有15%-35% , 而且部分不引起结直肠出血的肿瘤不容易被检测出来[9]. 由于结肠癌的细胞包括从早期癌症生长的细胞不断脱落进入结肠腔并与粪便混合, 因此我们可以从粪便标本中提取出人类肿瘤细胞的DNA, 并进行分析, 在理论上, 可用于早期CRC的无创性检测[10]. 有研究表明检测DNA突变在CRC的粪便存在潜在可行性. Ahlquist等[11]分析了22例CRC, 11例腺瘤>1 cm的患者和28例正常人的粪便DNA, 检测K-ras、p53和结肠腺瘤样息肉病(adenomatous polyposis coli, APC)基因的15个常见的突变位点的突变情况. 该试验对检测CRC的灵敏度为91%, 腺瘤为82%, 特异性为93%. 然而, 由于试验的高成本及繁琐的样本收集过程, DNA突变检测作为CRC筛选使用的临床应用受到了限制. 许多研究发现在粪便DNA中检测表遗传学改变如基因甲基化可以作为有效的无创检测手段来筛查结直肠肿瘤[12]. 有研究对使用粪便DNA甲基化基因来检测CRC进行Meta分析, 发现检测结直肠肿瘤的敏感性为62%, 特异性为80%[13].
在本研究中, 我们对粪便样品中检测甲基化DNA作为一种非侵入性筛检方法的可行性进行了评估. 由于Vimentin基因的甲基化标志物检测作为早期CRC的非侵入性筛查方法已被商业化, 因此, 我们的研究一方面可以进一步评估Vimentin基因甲基化检测应用于CRC筛查的可行性, 另一方面, 通过比较CRC患者粪便DNA中GATA5和Vimentin基因甲基化情况来评估GATA5基因甲基化作为生物标志物来检测CRC的潜在可能性. Chen等[14]发现, 位于Vimentin第一个外显子上游的CpG岛, 在正常情况下非甲基化, 在CRC中却有密集的甲基化, 并与Dukes'分期及肿瘤转移显著相关, 并从46%的CRC患者的粪便DNA中可检测到异常甲基化的Vimentin, 特异性为90%, 但很少在正常结肠组织和正常人粪便DNA中检测到. 我们经过对粪便DNA基因甲基化检测, 发现有44.9%的CRC患者粪便DNA中可以检测异常甲基化的Vimentin基因, 特异性为86.49%, 与上诉研究结果相似. 为了评价GATA5基因作为甲基化标志物来检测结直肠肿瘤的可行性, Hellebrekers等[15]对CRC及正常对照的结直肠黏膜进行GATA5基因甲基化分析, 发现有79%的CRC中有GATA5基因甲基化, 而在正常结直肠黏膜中只有13%. 在本研究中, 我们在CRC患者的粪便DNA中检测GATA5甲基化, 敏感性为81.63%, 特异性为86.49%, 高于以往在CRC组织中的检出率, 并远远高于粪便中Vimentin基因甲基化的阳性率(44.9%), 因此, 在粪便DNA中检测GATA5基因甲基化有望作为一种潜在的生物标志物来筛查CRC.
我们还对这两个基因联合检测CRC进行了研究, 发现有95.92%的CRC患者粪便DNA中至少有1个基因甲基化, 而在正常对照组中只有27.03%. 说明联合检测基因甲基化的敏感性高于单独检测一个基因, 但假阳性率也相对增加. 而且, 粪便DNA甲基化检测与患者的性别、年龄、肿瘤淋巴结转移的分期(TNM分期)以及肿瘤位置之间没有相关性. 这些研究结果表明, 这种检测方法对早期或晚期的CRC患者以及肿瘤发生在结直肠近端或远端并无差别. 但本次研究也存在一定的局限性, 如样本量、样本选择的随机性、患者的地域局限性, 因此, 我们可以进一步加大样本量及扩大样本选择范围进行实验, 减少误差, 这样可以更好的评估这种检测方法的可行性.
总之, 我们可以发现, GATA5和Vimentin基因甲基化状态与CRC的发生及发展密切相关, 粪便DNA中这两个基因甲基化检测方法筛查CRC有较高的敏感性和特异性, 具有成为非侵入性CRC筛查方法的前景, 并且, GATA5有望成为CRC无创筛查手段的一个新的肿瘤生物标志物. 然而, 这种基因甲基化检测方法及其灵敏度仍需要进一步改进和标准化, 这样将有助于粪便甲基化检测能够尽早应用于临床.
结直肠癌(colorectal cancer, CRC)是全球发病率和死亡率都排名第3的恶性肿瘤, 针对普通人群的CRC筛查可显著降低CRC死亡率. 基因启动子CpG岛甲基化发生早于肿瘤细胞的恶性增生, 因此基因甲基化的检测可以用于肿瘤的早期诊断.
卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科
此次我们采用MSP技术分析粪便DNA中GATA5和Vimentin的基因启动子甲基化状态, 以评估其在CRC早期诊断中的潜在临床应用价值.
Chen等发现, 位于Vimentin第一个外显子上游的CpG岛, 在正常情况下非甲基化, 在CRC中却有密集的甲基化, 并从46%的CRC患者的粪便DNA中可检测到异常甲基化的Vimentin, 特异性为90%, 但很少在正常结肠组织和正常人粪便DNA中检测到.
以往的研究对CRC及正常对照的结直肠黏膜进行GATA5基因甲基化分析, 而本次研究的创新点是通过无创性的粪便DNA甲基化检测来筛查CRC.
粪便DNA中GATA5和Vimentin这两个基因甲基化检测方法筛查CRC有较高的敏感性和特异性, 具有成为非侵入性CRC筛查方法的前景, 并且, GATA5有望成为CRC无创筛查手段的一个新的肿瘤生物标志物.
表观遗传学改变: 在细胞分裂过程中可遗传的不涉及DNA序列改变的基因组修饰作用. DNA甲基化: CpG二核苷酸5'端的胞嘧啶在DNA甲基化转移酶(DNMTs)的作用下加上一个甲基.
本文对49例CRC患者和37例正常对照者的粪便中分别提取DNA, 并采用甲基化特异性PCR技术分析GATA5和Vimentin的基因启动子甲基化状态. 结果表明粪便样本中检测GATA5和Vimentin基因甲基化可能成为CRC早期无创诊断的一个新方法. 内容客观, 实验方法成熟, 观点新颖, 具有一定的科学意义.
编辑 郭鹏 电编 闫晋利
| 1. | Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30. [PubMed] [DOI] |
| 2. | Kinzler KW, Vogelstein B. Lessons from hereditary colorectal cancer. Cell. 1996;87:159-170. [PubMed] [DOI] |
| 3. | Jones PA, Baylin SB. The fundamental role of epigenetic events in cancer. Nat Rev Genet. 2002;3:415-428. [PubMed] |
| 4. | Rennie PS, Nelson CC. Epigenetic mechanisms for progression of prostate cancer. Cancer Metastasis Rev 1998-. 1999;17:401-409. [PubMed] |
| 5. | Dahl C, Guldberg P. DNA methylation analysis techniques. Biogerontology. 2003;4:233-250. [PubMed] |
| 6. | Cottrell SE. Molecular diagnostic applications of DNA methylation technology. Clin Biochem. 2004;37:595-604. [PubMed] [DOI] |
| 7. | Nuovo GJ, Plaia TW, Belinsky SA, Baylin SB, Herman JG. In situ detection of the hypermethylation-induced inactivation of the p16 gene as an early event in oncogenesis. Proc Natl Acad Sci U S A. 1999;96:12754-12759. [PubMed] |
| 9. | Winawer S, Fletcher R, Rex D, Bond J, Burt R, Ferrucci J, Ganiats T, Levin T, Woolf S, Johnson D. Colorectal cancer screening and surveillance: clinical guidelines and rationale-Update based on new evidence. Gastroenterology. 2003;124:544-560. [PubMed] [DOI] |
| 10. | Ahlquist DA, Shuber AP. Stool screening for colorectal cancer: evolution from occult blood to molecular markers. Clin Chim Acta. 2002;315:157-168. [PubMed] [DOI] |
| 11. | Ahlquist DA, Skoletsky JE, Boynton KA, Harrington JJ, Mahoney DW, Pierceall WE, Thibodeau SN, Shuber AP. Colorectal cancer screening by detection of altered human DNA in stool: feasibility of a multitarget assay panel. Gastroenterology. 2000;119:1219-1227. [PubMed] [DOI] |
| 12. | Wu GH, Wang YM, Yen AM, Wong JM, Lai HC, Warwick J, Chen TH. Cost-effectiveness analysis of colorectal cancer screening with stool DNA testing in intermediate-incidence countries. BMC Cancer. 2006;6:136. [PubMed] [DOI] |
| 13. | Luo YX, Chen DK, Song SX, Wang L, Wang JP. Aberrant methylation of genes in stool samples as diagnostic biomarkers for colorectal cancer or adenomas: a meta-analysis. Int J Clin Pract. 2011;65:1313-1320. [PubMed] [DOI] |
| 14. | Chen WD, Han ZJ, Skoletsky J, Olson J, Sah J, Myeroff L, Platzer P, Lu S, Dawson D, Willis J. Detection in fecal DNA of colon cancer-specific methylation of the nonexpressed vimentin gene. J Natl Cancer Inst. 2005;97:1124-1132. [PubMed] [DOI] |
| 15. | Hellebrekers DM, Lentjes MH, van den Bosch SM, Melotte V, Wouters KA, Daenen KL, Smits KM, Akiyama Y, Yuasa Y, Sanduleanu S. GATA4 and GATA5 are potential tumor suppressors and biomarkers in colorectal cancer. Clin Cancer Res. 2009;15:3990-3997. [PubMed] [DOI] |