修回日期: 2014-05-04
接受日期: 2014-05-06
在线出版日期: 2014-06-28
目的: 探讨urotensin Ⅱ(UⅡ)受体拮抗剂urantide对急性肝衰竭小鼠肝组织干扰素调节因子3(interferon regulatory factor 3, IRF3)表达的影响.
方法: ♂Balb/c小鼠随机分为4组(每组6只). A组: 健康对照组; B组: 预处理对照组; C组: 模型组; D组: 预处理模型组. 预处理组给予0.6 mg/kg urantide尾静脉注射. 30 min后模型(包括预处理模型)组立即以脂多糖(lipopolysaccharide, LPS)联合D-半乳糖胺(D-galactosamin, D-GalN)腹腔注射诱导急性肝衰竭. LPS/D-GalN攻击12 h后采集小鼠肝组织标本. 采用RT-PCR和实时荧光定量PCR(Real-time PCR)检测小鼠肝组织中IRF3 mRNA表达水平, 免疫印迹(Western blot)检测IRF3蛋白表达含量.
结果: C组小鼠肝组织中IRF3 mRNA经RT-PCR和Real-time PCR检测, 其相对表达水平显著高于A组和B组(均P<0.001), D组显著低于C组(均P<0.001), 而A和B组之间无明显差异(P>0.05); C组IRF3蛋白表达水平显著高于A组和B组(均P<0.001), D组显著低于C组(P<0.001), 而A和B组之间无明显差异(P>0.05).
结论: UⅡ受体特异性拮抗剂urantide可抑制LPS/D-GalN诱导ALF小鼠肝组织IRF3 mRNA和蛋白质表达.
核心提示: 脂多糖(lipopolysaccharide, LPS)/D-半乳糖胺(D-galactosamin, D-GalN)诱导急性肝衰竭(acute liver failure, ALF)小鼠肝组织干扰素调节因子3(interferon regulatory factor 3, IRF3)表达显著上调; urotensin Ⅱ(UⅡ)受体特异性拮抗剂urantide可抑制LPS/D-GalN诱导的肝内IRF3表达上调. 这提示ALF肝内IRF3的上调是UⅡ/UT系统依赖性的.
引文著录: 汪小庭, 涂文娟, 刘亮明, 梁冬雨, 于芳苹, 赵亮, 叶长根, 杨志文, 高得勇. Urantide对急性肝衰竭小鼠肝组织中IRF3表达的影响. 世界华人消化杂志 2014; 22(18): 2559-2564
Revised: May 4, 2014
Accepted: May 6, 2014
Published online: June 28, 2014
AIM: To investigate the effect of urantide, a urotensin Ⅱ (UⅡ) receptor inhibitor, on interferon regulatory factor 3 (IRF3) expression in the liver tissue of mice with acute liver failure (ALF).
METHODS: Male Balb/c mice were randomly divided into four groups (n = 6 for each group): normal control, pre-treatment control, model and pre-treatment model. The pre-treatment mice received urantide (0.6 mg/kg body weight) via a caudal vein injection. At 30 min post-injection, the model (including pre-treatment model) mice were treated with lipopolysaccharide (LPS)/D-galactosamine (D-GalN) to induce ALF via an intraperitoneal injection. Liver tissues were sampled 12 h after LPS/D-GalN injection. IRF3 mRNA expression was detected by RT-PCR and real-time polymerase chain reaction (PCR), and protein expression was detected by Western blot assay.
RESULTS: The relative levels of IRF3 mRNA were significantly higher in model mice than in control and pretreatment control mice (P < 0.001 for all). Compared with the model group, pretreatment model mice had significant lower levels of IRF3 mRNA (P < 0.001). IRF3 protein levels were also significantly higher in model mice than in control and pretreatment control mice (P < 0.001 for all), while the protein levels were significantly lower in pretreatment model mice than in model mice (P < 0.05).
CONCLUSION: Urantide can inhibit the up-regulation of IRF3 mRNA and protein expression in the liver tissue of mice with LPS/D-GalN-induced ALF.
- Citation: Wang XT, Tu WJ, Liu LM, Liang DY, Yu FP, Zhao L, Ye CG, Yang ZW, Gao DY. Urantide inhibits hepatic IRF3 expression in acute liver failure mice. Shijie Huaren Xiaohua Zazhi 2014; 22(18): 2559-2564
- URL: https://www.wjgnet.com/1009-3079/full/v22/i18/2559.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i18.2559
急性肝衰竭(acute liver failure, ALF)是一种与免疫炎性反应密切相关的肝损伤性疾病[1]. 近年有研究发现urotensin Ⅱ(UⅡ)/UT系统与免疫炎症损伤性疾病关系密切[2-4]. 本课题组前期研究发现, 在脂多糖(lipopolysaccharide, LPS)/D-半乳糖(D-galactosamin, D-GalN)诱导ALF动物模型中urotensin Ⅱ(UⅡ)/UT表达上调[5], 且UⅡ/UT系统通过促进前炎细胞因子[包括: 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白介素-1β(interleukin-1β, IL-1β)等]的分泌介导了肝脏急性炎症损伤的发生[6]. 已知, 组织炎症损伤反应与固有免疫细胞Toll样受体4(Toll like Receptor 4, TLR4)信号通路的激活密切相关[7]. 损伤因子(如: LPS)结合TLR4后, 通过接头蛋白TRIF启动MyD88非依赖信号通路, 激活转录因子干扰素调节因子3(interferon regulatory factor 3, IRF3), 并在后期激活核因子-κB(nuclear factor-κB, NF-κB)[8,9], 从而进一步诱导Ⅰ型干扰素(interferon, IFN)和炎症细胞因子的产生[10]. 我们前期的研究已观察到在ALF, UⅡ/UT可促进NF-κB p65亚基的核转位并增强其与DNA的结合活性[11]. 在本实验中, 我们借助前期研究中建立的与重度炎症反应相关的ALF小鼠模型[11], 采用UⅡ受体特异性拮抗剂urantide, 进一步研究了UⅡ信号对IRF3表达的影响, 以期更全面地了解UⅡ/UT系统介导ALF的机制.
LPS和D-GalN购自美国sigma公司; UT受体拮抗剂Urantide购自日本PEPTIDES; TRIzol购自美国Invitrogen公司; SYBRGreen PCR试剂盒和逆转录试剂盒购自美国Thermo公司; PCR引物由上海生工生物工程有限公司合成; IRF3抗体购自美国Cell signaling公司; 健康♂Balb/c小鼠, 清洁级, 鼠龄6 wk, 体质量20-22 g, 由上海交通大学附属第一人民医院实验动物中心提供, 动物合格证号: SYXK(沪)2009-0086, 实验动物的使用符合国家动物保护法.
1.2.1 动物分组及处置: ♂Balb/c小鼠按照随机数字表随机分为4组(每组6只). A组: 健康对照组; B组: 预处理对照组; C组: 模型组; D组预处理模型组. 预处理对照组和预处理模型组给予尾静脉注射0.6 mg/kg urantide预处理, 健康对照组和模型组则给予相同体积生理盐水. 30 min后模型组及与处理组立即以LPS联合D-GalN腹腔注射诱导ALF模型, 健康对照组和预处理对照组则给予相应体积的生理盐水. LPS攻击12 h后采集小鼠肝组织标本.
1.2.2 RT-PCR检测: 肝组织采用TRIzol处理, 总RNA抽提按说明书进行. 总RNA作为模板用于第一链cDNA的合成(Rnasin 1 μL, 随机引物1 μL, dNTP混合物2 μL, AMV反转录酶1 μL, 5×反转录酶缓冲液4.0 μL, 以无核酶水补至终体积20 μL, 室温放置10 min后, 42 ℃孵育60 min, 95 ℃加热5 min, 将cDNA产物置于-20 ℃保存). 引物设计借助Primer Premier 6.0软件设计, 基因检测引物序列和产物长度如表1. 按试剂盒说明书建立反应体系(取4.0 μL cDNA为模板, 于扩增管中加入10×PCR缓冲液2 μL, dNTP混合物4 μL, TaqDNA聚合酶2 μL, 上、下游引物各2 μL, 补充无核酶水至25 μL, 置于PCR仪中进行聚合扩增), 以GAPDH作为内参照. IRF3基因的反应条件为: 94 ℃预变性5 min; 94 ℃ 1 min, 51 ℃ 45 s, 72 ℃ 45 s, 共32个循环; 72 ℃延伸10 min. 所得PCR产物经1.5%的琼脂糖凝胶电泳. 电泳结果经BIO-RAD Quantity-One 4.7成像分析软件检测并计算待测基因灰度相对相应GAPDH的表达量.
| 基因 | 引物序列(5'→3') | 产物长度(bp) | |
| 干扰素调节因子3 | Primer F | 5' CGGAAAGAAGTGTTGCGGTTAG 3' | 132 |
| Primer R | 5' TTTGCCATTGGTGTCAGGAGAG 3' | ||
| GAPDH | Primer F | 5' ATCACTGCCACCCAGAAG 3' | 191 |
| Primer R | 5' TCCACGACGGACACATTG 3' |
1.2.3 Real-time PCR检测: cDNA合成按照RT-PCR步骤进行. 引物设计借助Primer Premier 6.0软件设计, 基因检测引物序列和产物长度如表1. RT-PCR操作方法按试剂盒说明书进行: 2×Premix Ex TaqTM Ⅱ 10 μL, 正反义链引物各0.8 μL, ROX Reference Dye Ⅱ 0.4 μL, DNA模板2.0 μL, 加灭菌蒸馏水至20 μL, 建立反应体系. 在ABI7500仪器中按两步法进行扩增: 第1步: 50 ℃ 2 min, 1个循环; 第2步: 95 ℃ 5 min, 40个循环. GAPDH作为内参照, 用计算机分析Ct值, 采用2-∆∆Ct公式计算mRNA表达量.
1.2.4 免疫印迹(Western blot)分析: 将组织剪成细小的碎片, 按每20 mg组织加入150-250 μL的比例加入裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂), 匀浆器匀浆直至完全裂解. 裂解后的样品4 ℃ 12000 g离心15 min, 取上清, 进行蛋白质定量后贮存于-80 ℃冰箱. 取50 μg蛋白, 水浴煮沸10 min后进行10%十二烷基硫酸钠/聚丙烯酰胺(SDS-PAGE)电泳, 转移至PVDF膜上. 5%脱脂牛奶4℃过夜封闭结合有蛋白质的PVDF膜. 封闭结束后, 分别加入适量的IRF3及内参GAPDH抗体, 室温下孵育2 h. 0.1%的PBST漂洗3次, 每次5 min. 加辣根过氧化物酶标记的Ⅱ抗, 室温下孵育1 h后, 0.1%的PBST漂洗3次, 每次5 min. 结果用ECL-Plus化学发光试剂盒检测, X光片曝光. X光片显影和定影后观察结果.
统计学处理 采用SPSS13.0统计软件进行统计学处理, 计量资料用mean±SD表示, 组间比较采用独立样本t检验. P<0.05为差异有统计学差异.
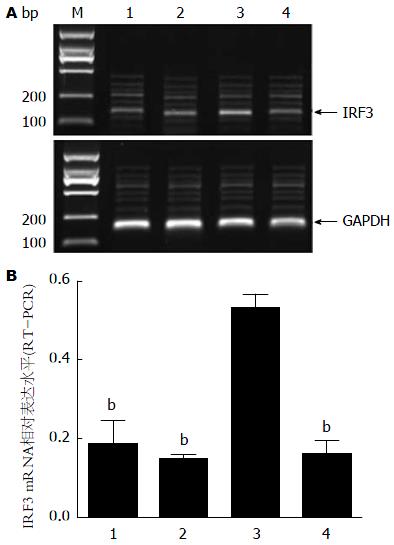
各组小鼠肝组织IRF3 mRNA(RT-PCR)相对表达水平如图1. 结果显示, C组(模型组)IRF3 mRNA相对表达水平显著高于A(健康对照组)和B组(预处理对照组)(0.530±0.037 vs 0.182±0.062、0.146±0.014, t值分别为11.708、23.616, 均P<0.001), D组(预处理模型组)显著低于C组(0.158±0.035 vs 0.530±0.037)(t = 17.770, P<0.001), 而A和B组之间无明显差异(t = 1.404, P = 0.19).
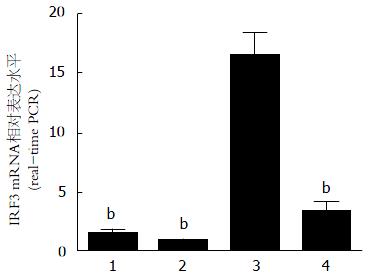
各组小鼠肝组织IRF3 mRNA(real-time PCR分析)相对表达水平(图2). 结果显示, C组IRF3 mRNA相对表达水平显著高于A和B组(16.415±2.036 vs 1.464±0.429、0.869±0.187, t值分别为17.599、18.642, 均P<0.001), D组显著低于C组(3.277±0.999 vs 16.415±2.036)(t = 14.189, P<0.001), 而A和B组之间无明显差异(t = 3.119, P>0.05). 这提示ALF可诱导小鼠肝组织IRF3 mRNA表达, 使用UⅡ受体特异性拮抗剂urantide后能抑制ALF小鼠肝内IRF3 mRNA表达.
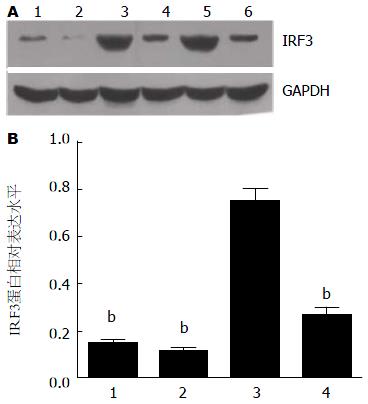
Western blot检测小鼠肝组织中IRF3蛋白表达水平(图3). 结果表明, C组小鼠肝组织中IRF3蛋白表达水平显著高于A和B组(0.746±0.055 vs 0.146±0.018、0.108±0.020, t值分别为17.838、18.928, 均P<0.001), D组显著低于C组(0.263±0.038 vs 0.746±0.055)(t = 17.712, P<0.001), 而A和B组之间无明显差异(t = 2.486, P = 0.06). 这提示ALF小鼠肝组织IRF3 蛋白表达上调, 使用UⅡ受体特异性拮抗剂urantide后能抑制ALF小鼠IRF3蛋白表达.
研究显示, ALF患者肝内UⅡ/UT表达显著升高[12]. 我们前期研究进一步证实, UⅡ/UT系统介导了LPS/D-GalN诱导ALF的发生[11]. 在本实验中, 我们发现LPS/D-GalN诱导的ALF小鼠肝内转录因子IRF3的表达显著上调.
已知, IRF3是TLR4信号下游TRIF依赖通路中的关键分子[13], 在机体抗病毒免疫应答中起重要作用[14]. 各种病毒(包括RNA病毒、DNA病毒或逆转录病毒等)可作用于细胞或内涵体浆膜内的模式识别受体(pattern recognition receptors, PRRs)TLRs(特别是TLR4/3), 通过TRIF依赖通路, 激活IRF3, 从而诱导Ⅰ型IFN产生, 启动抗病毒免疫反应[15]. 除病毒外, 其他病原体(如细菌、寄生虫等)同样可激活TLRs-IRF3信号, 诱导机体的抗感染反应[16,17]. 近年发现, IRF3不仅是宿主抵御外来病原体保护性固有免疫机制的重要成分, 也在炎症反应的发生发展中起关键作用[18,19]. 在LPS诱导的损伤组织中及LPS刺激的巨噬细胞内, IRF3的表达均显著升高[20,21]. 研究证实, LPS可通过增强IRF3蛋白的磷酸化诱导前炎细胞因子包括TNF-α和IL-6等的表达和分泌, 从而引起组织的炎症损伤[22].
在肝脏, IRF3被证实参与了HCV感染诱导的免疫性肝损伤[23,24], 并在酒精性肝损伤及缺血再灌注性肝损伤的发生中有重要作用[25,26]. IRF3敲除后, 可保护实验鼠免于发生酒精诱导的肝脂肪变、酒精性肝炎和肝损伤[26]. 在ALF肝内IRF3表达上调尚是首次被证实. 该结果提示, IRF3可能与UⅡ/UT信号系统一样也参与了ALF的肝组织免疫炎症损伤过程.
为进一步分析在ALF发生中UⅡ/UT系统与IRF3表达之间的关系, 我们采用了UT特异性拮抗剂urantide阻断UⅡ信号的传导. 我们发现, urantide的应用显著抑制了IRF3的转录表达, 并使其蛋白质水平明显降低. 这提示IRF3的表达依赖于UⅡ/UT信号系统. 在前期研究中, 我们证实, 在LPS/D-GalN诱导的ALF, UⅡ/UT系统可通过激活NF-κB通路介导TNF-α等前炎细胞因子的产生[10]. NF-κB是TLR4信号下游经典MyD88依赖通路中的关键分子, 在组织及细胞的免疫炎症机制中有重要作用[27].
总之, UⅡ/UT系统在ALF肝组织中的免疫炎症损伤效应的产生是由于其激活了TLR4信号下游两条关键信号通路, 包括MyD88依赖(NF-κB)和MyD88非依赖(IRF3)通路实现的.
急性肝衰竭(acute liver failure, ALF)是肝组织的免疫炎症损伤性疾病, 其发生发展与肝内TLR4信号激活并启动固有免疫应答有密切关系. IRF3是TLR4信号通路中的关键分子, 活化的IRF3可诱导Ⅰ型IFN表达, 并在后期激活NF-κB, 引起前炎细胞因子级联式释放. 另外, 研究证实ALF肝内UⅡ/UT表达显著上调, 且UⅡ/UT系统可介导肝组织前炎细胞因子分泌和急性损伤性炎症. 然而, 目前尚不清楚UⅡ/UT系统产生这些效应的机制. 因此, 在本研究中, 我们借助UT拮抗剂urantide的应用, 在UⅡ/UT信号阻断的基础上, 观察IRF3的表达情况, 以期阐明UⅡ/UT系统对肝组织的免疫炎症损伤机制.
唐世刚, 教授, 湖南省人民医院
肝组织免疫炎症损伤机制是近年来急性肝衰竭研究领域的焦点, 固有免疫系统受损伤因素刺激活化过程中, 细胞内信号分子网络特别是关键性信号分子的变化情况是目前亟待研究的问题.
Liu等近年证实在ALF, UⅡ/UT可促进NF-κB p65亚基的核转位并增强其与DNA的结合活性. 其他作者研究显示, TLR4活化后, 可通过接头蛋白TRIF启动MyD88非依赖信号通路, 激活转录因子IRF3(interferon regulatory factor 3), 并在后期激活NF-κB, 从而进一步诱导Ⅰ型IFN和炎症细胞因子的产生.
首次证实, ALF小鼠肝组织内IRF3基因表达上调, 且IRF3的上调依赖于UⅡ/UT信号系统.
主要体现在阐明UⅡ/UT系统介导ALF的机制, 以期更加深该地揭示ALF发生发展的规律.
本文对急性肝衰竭形成的原因有很好的实验价值.
编辑: 田滢 电编:鲁亚静
| 1. | Wu Z, Han M, Chen T, Yan W, Ning Q. Acute liver failure: mechanisms of immune-mediated liver injury. Liver Int. 2010;30:782-794. [PubMed] [DOI] |
| 2. | Watanabe T, Arita S, Shiraishi Y, Suguro T, Sakai T, Hongo S, Miyazaki A. Human urotensin II promotes hypertension and atherosclerotic cardiovascular diseases. Curr Med Chem. 2009;16:550-563. [PubMed] |
| 3. | Ross B, McKendy K, Giaid A. Role of urotensin II in health and disease. Am J Physiol Regul Integr Comp Physiol. 2010;298:R1156-R1172. [PubMed] [DOI] |
| 4. | Xu S, Jiang H, Wu B, Yang J, Chen S. Urotensin II induces migration of endothelial progenitor cells via activation of the RhoA/Rho kinase pathway. Tohoku J Exp Med. 2009;219:283-288. [PubMed] |
| 5. | 刘 亮明, 梁 冬雨, 张 芳芳, 于 芳苹, 赵 亮, 叶 长根. Urotensin II在急性肝衰竭小鼠肝组织中的表达及损伤作用研究. 世界华人消化杂志. 2012;20:1616-1622. |
| 6. | 赵亮, 梁冬雨, 刘亮明,于芳苹,叶长根. 急性肝衰竭早期尾加压素II表达及其与前炎细胞因子TNF-α和IL-1β的关系. 上海交通大学学报(医学版). 2012;32:543-549. |
| 7. | Ben Ari Z, Avlas O, Pappo O, Zilbermints V, Cheporko Y, Bachmetov L, Zemel R, Shainberg A, Sharon E, Grief F. Reduced hepatic injury in Toll-like receptor 4-deficient mice following D-galactosamine/lipopolysaccharide-induced fulminant hepatic failure. Cell Physiol Biochem. 2012;29:41-50. [PubMed] [DOI] |
| 8. | Yamamoto M, Sato S, Hemmi H, Hoshino K, Kaisho T, Sanjo H, Takeuchi O, Sugiyama M, Okabe M, Takeda K. Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway. Science. 2003;301:640-643. [PubMed] |
| 9. | Covert MW, Leung TH, Gaston JE, Baltimore D. Achieving stability of lipopolysaccharide-induced NF-kappaB activation. Science. 2005;309:1854-1857. [PubMed] |
| 10. | Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell. 2006;124:783-801. [PubMed] |
| 11. | Liang DY, Liu LM, Ye CG, Zhao L, Yu FP, Gao DY, Wang YY, Yang ZW, Wang YY. Inhibition of UII/UTR system relieves acute inflammation of liver through preventing activation of NF-κB pathway in ALF mice. PLoS One. 2013;8:e64895. [PubMed] [DOI] |
| 12. | Leifeld L, Clemens C, Heller J, Trebicka J, Sauerbruch T, Spengler U. Expression of urotensin II and its receptor in human liver cirrhosis and fulminant hepatic failure. Dig Dis Sci. 2010;55:1458-1464. [PubMed] [DOI] |
| 13. | O'Neill LA, Golenbock D, Bowie AG. The history of Toll-like receptors - redefining innate immunity. Nat Rev Immunol. 2013;13:453-460. [PubMed] [DOI] |
| 14. | Rustagi A, Gale M. Innate antiviral immune signaling, viral evasion and modulation by HIV-1. J Mol Biol. 2014;426:1161-1177. [PubMed] [DOI] |
| 15. | Zhao W. Negative regulation of TBK1-mediated antiviral immunity. FEBS Lett. 2013;587:542-548. [PubMed] [DOI] |
| 16. | Liehl P, Zuzarte-Luís V, Chan J, Zillinger T, Baptista F, Carapau D, Konert M, Hanson KK, Carret C, Lassnig C. Host-cell sensors for Plasmodium activate innate immunity against liver-stage infection. Nat Med. 2014;20:47-53. [PubMed] [DOI] |
| 17. | Royer PJ, Rogers AJ, Wooldridge KG, Tighe P, Mahdavi J, Rittig MG, Ala'Aldeen D. Deciphering the contribution of human meningothelial cells to the inflammatory and antimicrobial response at the meninges. Infect Immun. 2013;81:4299-4310. [PubMed] [DOI] |
| 18. | Di Paolo NC, Doronin K, Baldwin LK, Papayannopoulou T, Shayakhmetov DM. The transcription factor IRF3 triggers "defensive suicide" necrosis in response to viral and bacterial pathogens. Cell Rep. 2013;3:1840-1846. [PubMed] [DOI] |
| 19. | Shaik-Dasthagirisaheb YB, Huang N, Gibson FC. Inflammatory response to Porphyromonas gingivalis partially requires interferon regulatory factor (IRF) 3. Innate Immun. 2014;20:312-319. [PubMed] [DOI] |
| 20. | Shim DW, Han JW, Sun X, Jang CH, Koppula S, Kim TJ, Kang TB, Lee KH. Lysimachia clethroides Duby extract attenuates inflammatory response in Raw 264.7 macrophages stimulated with lipopolysaccharide and in acute lung injury mouse model. J Ethnopharmacol. 2013;150:1007-1015. [PubMed] [DOI] |
| 21. | Song Y, Dou H, Gong W, Liu X, Yu Z, Li E, Tan R, Hou Y. Bis-N-norgliovictin, a small-molecule compound from marine fungus, inhibits LPS-induced inflammation in macrophages and improves survival in sepsis. Eur J Pharmacol. 2013;705:49-60. [PubMed] [DOI] |
| 22. | Siegfried A, Berchtold S, Manncke B, Deuschle E, Reber J, Ott T, Weber M, Kalinke U, Hofer MJ, Hatesuer B. IFIT2 is an effector protein of type I IFN-mediated amplification of lipopolysaccharide (LPS)-induced TNF-α secretion and LPS-induced endotoxin shock. J Immunol. 2013;191:3913-3921. [PubMed] [DOI] |
| 23. | Thomas E, Gonzalez VD, Li Q, Modi AA, Chen W, Noureddin M, Rotman Y, Liang TJ. HCV infection induces a unique hepatic innate immune response associated with robust production of type III interferons. Gastroenterology. 2012;142:978-988. [PubMed] [DOI] |
| 24. | Yu GY, He G, Li CY, Tang M, Grivennikov S, Tsai WT, Wu MS, Hsu CW, Tsai Y, Wang LH. Hepatic expression of HCV RNA-dependent RNA polymerase triggers innate immune signaling and cytokine production. Mol Cell. 2012;48:313-321. [PubMed] [DOI] |
| 25. | Kang JW, Koh EJ, Lee SM. Melatonin protects liver against ischemia and reperfusion injury through inhibition of toll-like receptor signaling pathway. J Pineal Res. 2011;50:403-411. [PubMed] [DOI] |
| 26. | Szabo G, Petrasek J, Bala S. Innate immunity and alcoholic liver disease. Dig Dis. 2012;30 Suppl 1:55-60. [PubMed] [DOI] |
| 27. | Cerezo LA, Remáková M, Tomčik M, Gay S, Neidhart M, Lukanidin E, Pavelka K, Grigorian M, Vencovský J, Šenolt L. The metastasis-associated protein S100A4 promotes the inflammatory response of mononuclear cells via the TLR4 signalling pathway in rheumatoid arthritis. Rheumatology (Oxford). 2014;53:1520-1526. [PubMed] |