修回日期: 2014-04-08
接受日期: 2014-04-20
在线出版日期: 2014-06-18
目的: 评价紫杉醇联合卡培他滨一线治疗晚期胃癌后卡培他滨维持治疗的疗效及安全性.
方法: 将76例符合标准的晚期胃癌患者随机分为A、B两组. A组36例给予紫杉醇联合卡培他滨(paclitaxel/xeloda, PACX)化疗, 21 d为1周期, 4周期后无进展者行卡培他滨维持治疗(1000 mg/m2, bid, d1-14, q3w)直至疾病进展或出现不能耐受的不良反应; B组40例给予卡培他滨联合顺铂(xeloda/cisplatin, XP)化疗, 21 d为1周期, 最多6周期后单纯观察.
结果: PACX方案和XP方案的缓解率(remission rate, RR)分别为52.78%(19/36)和45.00%(18/40), 疾病控制率(disease control rate, DCR)分别为80.56%(29/36)和75.00%(30/40), 两者比较差异无统计学意义(P = 0.42); 维持组和随访组的缓解率(RR)分别为17.24%(5/29)和0.00%(0/30), DCR分别为72.4%(21/29)和46.67%(14/30), 两者比较有明显差异(P = 0.024, P = 0.043). 维持组中位无疾病进展时间(median progression free survival time, mPFS)比随访组提高了1.23 mo(8.10 mo vs 6.86 mo, P = 0.021), 中位总生存时间(median overall survival time, mOS)和1年生存率分别提高了2.41 mo(14.74 mo vs 12.33 mo)和21.08%(69.23% vs 48.15%), 但无统计学意义(P = 0.081, P = 0.118). PACX方案脱发及周围神经毒性的发生率较XP方案明显增高, 但多为Ⅰ/Ⅱ度, 而恶心呕吐的发生率则显著降低; 维持组除手足综合症的发生率增高之外, 余不良反应的发生率明显减少, 无治疗相关性死亡.
结论: 紫杉醇联合卡培他滨一线治疗晚期胃癌后卡培他滨维持治疗的方案能增加缓解率和疾病控制率, 延长无疾病进展时间, 总生存时间和1年生存率有提高趋势, 耐受性良好, 较为经济和安全, 值得进一步研究和临床应用.
核心提示: 紫杉醇/卡培他滨联合化疗4周期后卡培他滨维持的化疗方案一线治疗进展期胃癌, 近期疗效和远期无疾病进展时间(progression free survival time)得到显著性提高、生存时间(overall survival time)和1年生存率有提高趋势, 不良反应轻, 经济方便, 是治疗进展期胃癌的新选择, 值得更深入的临床研究.
引文著录: 周然, 王峰, 曹蕾, 庞丽娜, 樊青霞. 紫杉醇联合卡培他滨一线治疗晚期胃癌后卡培他滨维持治疗的疗效和安全性. 世界华人消化杂志 2014; 22(17): 2456-2462
Revised: April 8, 2014
Accepted: April 20, 2014
Published online: June 18, 2014
AIM: To evaluate the efficacy and safety of paclitaxel plus capecitabine (PACX) with subsequent capecitabine maintenance as first-line chemotherapy for patients with advanced gastric cancer.
METHODS: Seventy-six eligible patients were randomly assigned to either group A or group B. In group A, 36 patient were treated with the paclitaxel/capecitabine (PACX) regimen, with 21 days as a cycle. Patients who responded to the therapy after 4 cycles were given capecitabine maintenance (1000 mg/m2, bid, d1-14, q3w) therapy until disease progression or intolerable toxicity. In group B, 40 patients were treated with the cisplatin/capecitabine (XP) regimen. A maximum of six cycles was given.
RESULTS: There was no significant difference in remission rate (RR) or disease control rate (DCR) between groups A and B (52.78% vs 45.00%, 80.56% vs 75.00%, P = 0.42). The RR and DCR were 17.24% and 72.4% in the maintenance group, and 0.00% and 46.67% in the follow-up group (P = 0.024, 0.043). The median progression free survival time (mPFS) in the maintenance group was 1.3 mo longer than that in the follow-up group (8.10 mo vs 6.86 mo, P = 0.021). The median overall survival time (mOS) and one-year survival rate were 2.41 mo longer (14.74 mo vs 12.33 mo) and 21.08% higher (69.23% vs 48.15%) than those in the follow-up group, but the differences were not statistically significant (P = 0.081, 0.118). Compared with the XP regimen, the incidence rates of alopecia and peripheral neurotoxicity associated with the PACX regimen were significantly higher, although most of them were mild (grade Ⅰ/Ⅱ). The incidence rate of nausea and vomiting was lower in patients receiving the PACX regimen. In the maintenance group, only the incidence rate of hand-foot syndrome was raised, and the other toxicities were reduced obviously. No treatment-related death was found.
CONCLUSION: Paclitaxel plus capecitabine with subsequent capecitabine maintenance therapy can increase the RR and DCR, prolong the PFS and OS and improve one-year survival rate, with good tolerance and safety.
- Citation: Zhou R, Wang F, Cao L, Pang LN, Fan QX. Efficacy and safety of capecitabine maintenance therapy after first-line paclitaxel/capecitabine chemotherapy in patients with advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(17): 2456-2462
- URL: https://www.wjgnet.com/1009-3079/full/v22/i17/2456.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i17.2456
胃癌是全球排名第4位的常见恶性肿瘤及第2位肿瘤相关死亡原因[1], 其发病率居我国恶性肿瘤第2位, 同期死亡率居恶性肿瘤死因第3位[2]. 因早期症状不典型, 确诊时60%以上的患者失去手术根治的机会, 或者部分患者术后复发、转移. 分析研究表明, 化疗与最佳支持治疗相比, 能提高晚期胃癌患者的中位生存期(HR = 0.37)和生活质量, 且联合方案较单药方案更具有生存优势(HR = 0.82)[3], 因此对于这些患者以联合化疗为主的综合治疗被视为标准治疗. 几十余年来, 胃癌的化疗方案经过FAM、FAMTX、EAP、ELF、ECF、DCF等一系列的演变, 21世纪新药出现后又有EOX、XP、S-1/CDDP、IF、FOLFOX、XELOX等化疗方案的提出, 使晚期胃癌的治疗效果有了进一步的提高, 化疗的总有效率在20%-58%, 但仍未得到有明显生存优势的治疗方案. 如何合理的选用并联合应用化疗药物从而找出高效低毒的治疗方法, 一直是目前研究的热点. 本篇报道为紫杉醇联合卡培他滨后序贯卡培他滨维持治疗对比卡培他滨联合顺铂一线治疗晚期胃癌的Ⅲ期临床研究(ML22697)的分中心结果, 现报到如下.
选取2009-11/2012-06郑州大学第一附属医院收治的晚期胃癌患者. 入组标准: 均经病理学或组织学证实为胃癌; 评估为不能手术的局部进展期、复发或转移的初治晚期胃癌患者; 至少有一个可测量病灶; 未接受过放疗或放疗结束>4 wk(放疗部位位于本实验评估部位之外); 预计寿命≥3 mo; ECOG评分为0-2分; 入组前血常规及生化指标无化疗禁忌; 心肺功能基本正常; 年龄≥18岁; 签署书面知情同意书. 排除标准: 孕妇及哺乳期妇女; 对氟尿嘧啶类、顺铂或紫杉类药物过敏, 或代谢障碍; 曾长期接受全身类固醇治疗; 存在外周神经系统或中枢神经系统障碍或明显精神障碍; 伴有吞咽困难、完全或不全消化道梗阻、消化系活动性出血或穿孔等至口服卡培他滨有困难者; 患有其他恶性肿瘤. 共入组76例患者, 其中男47例、女29例, 年龄为37-77岁, 平均年龄为62.5岁±10.7岁, 中位年龄为61岁. 随机分为A、B两组, 其中A组36例, B组40例, 两组患者的一般资料无明显差异, 具有可比性(P>0.05)(表1). 紫杉醇(paclitaxel, PTX, 海南海药股份有限公司, 批号: H10980170); 卡培他滨(希罗达, capecitabine/xeloda, 上海罗氏公司, 批号: H20073024); 顺铂(cisplatin, DDP, 江苏豪森药业股份有限公司, 批号: H20010743);
| 临床资料 | A组 | B组 | P值 |
| n | 36 | 40 | |
| 性别 | 0.241 | ||
| 男 | 25 | 22 | |
| 女 | 11 | 18 | |
| 分期 | 0.316 | ||
| Ⅲb期 | 12 | 9 | |
| Ⅳ期 | 24 | 31 | |
| ECOG(分) | 0.499 | ||
| 0 | 11 | 13 | |
| 1 | 18 | 23 | |
| 2 | 7 | 4 | |
| 年龄(岁) | 0.092 | ||
| <65 | 22 | 24 | |
| ≥65 | 14 | 16 | |
| 肿瘤位置 | 0.590 | ||
| 胃食管结合部 | 10 | 8 | |
| 非胃食管结合部 | 26 | 32 | |
| 病理类型 | 0.454 | ||
| 高分化腺 | 1 | 3 | |
| 中低分化腺 | 29 | 27 | |
| 黏液腺 | 3 | 5 | |
| 印戒 | 1 | 0 | |
| 其他 | 2 | 5 | |
| 体质量减轻 | 0.342 | ||
| 是 | 21 | 28 | |
| 否 | 15 | 12 | |
| 原发病灶切除 | 0.324 | ||
| 是 | 9 | 15 | |
| 否 | 27 | 25 | |
| 受累器官数(个) | 0.423 | ||
| ≤2 | 27 | 33 | |
| >2 | 9 | 7 |
1.2.1 给药: A组患者接受PACX方案治疗: 紫杉醇80 mg/m2, 加入250 mL NS中静滴3 h, d1、8, q3w; 卡培他滨, 1000 mg/m2, bid, 餐后30 min口服, d1-14, q3w; B组患者接受XP方案治疗: 顺铂80 mg/m2, 加入500 mL的NS中静滴2 h, d1, q3w; 卡培他滨1000 mg/m2, bid, 餐后30 min口服, d1-14, q3w. 所用方案至少连续应用2周期, 可根据血液学及非血液学的不良反应进行剂量的调整. A组应用PACX方案4周期治疗未进展者, 继续卡培他滨1000 mg/m2, bid, d1-14, q3w的维持治疗至疾病进展或不能耐受的不良反应; B组接受XP方案治疗最多6周期, 若未进展则定期随访观察.
1.2.2 合并用药: 注射紫杉醇12 h前给予地塞米松10 mg肌注, 30 min前给予地塞米松10 mg肌注、西咪替丁400 mg静滴; 注射顺铂前给予生理盐水或葡萄糖盐水1000 mL滴注, 顺铂给药后一次给予20%甘露醇250 mL, 一般每日液体总量3000 mL左右, 输液中根据尿量每次给速尿20-40 mg静脉冲入; 所有患者化疗前常规给予托烷司琼5 mg静推、苯海拉明20 mg肌注、泮托拉唑80 mg静滴, 化疗后常规给予托烷司琼5 mg静推. 化疗周期中如需服用氢氧化铝或氢氧化镁制剂, 需在卡培他滨2 h之后, 出现骨髓抑制给予相应的升血药物, 恶心、呕吐、腹泻可对症治疗, 出现手足综合症者给予维生素B6口服, 禁冷食、冷水并注意手脚保暖.
1.2.3 观察指标: (1)近期疗效: 按实体瘤疗效评价标准(response evaluation criteria in solid tumors 1.0, RECIST 1.0), 每2周期进行一次影像学(病灶部位的增强CT、浅表淋巴结彩超、胸片、视情况行骨扫描等)肿瘤评估, 分为完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、稳定(stable disease, SD)和进展(progressive disease, PD), 缓解率(remission rate RR)为(CR+PR)/总例数×100%, 疾病控制率(disease control rate, DCR)为(RR+SD)/总例数×100%; (2)远期疗效: 远期疗效的主要研究终点为无疾病进展时间(progression free survival time, PFS), 次要研究终点为生存时间(overall survival time, OS). PFS指从化疗开始至疾病进展的时间, OS指从化疗开始至死亡或末次随访时间; (3)不良反应: 化疗前后复查血常规、生化(肝肾功、血脂、电解质)、血凝、心电图, 每天观察患者的症状、体征, 及时记录并判断与研究用药的关系, 按抗肿瘤药物毒性反应分级标准分级(National Cancer Institute-Common Toxicity Criteria 3.0, NCI-CTC3.0). 手足综合症分为Ⅰ-Ⅲ度; Ⅰ度为麻木、瘙痒、无痛性红肿和肿胀, 但不影响正常生活; Ⅱ度为疼痛性红斑和肿胀, 影响患者的日常生活; Ⅲ度为潮湿性蜕皮、溃疡、水泡和重度疼痛, 致患者不能工作和日常生活严重不适.
统计学处理 采用SPSS16.0统计软件进行分析. 无序分类资料采用χ2检验和Fisher精确概率检验、分级资料采用Kruskal Wallis H检验、生存资料分析采用Kaplan-Meier法(Log-rank检验). P<0.05为差异有统计学意义.
76例患者均完成了4周期化疗. A组CR 5.56%(2/36)、PR 47.22%(17/36)、SD 27.78%(10/36)、PD 19.44%(7/36), B组CR 2.50%(1/40)、PR 42.50%(17/40)、SD 30.00%(12/40)、PD 25.00%(10/40), 两组比较差异无统计学意义(χ2 = 0.65, P = 0.42).
将A组中完成了4周期PACX方案未进展的患者定义为C亚组, 共29例; B组中完成了4周期XP方案化疗的患者定义为D亚组, 共30例. C、D组患者最长每隔2周期复查(表2). C组接受单药卡培他滨化疗, 进展8例, DCR为72.4%, 其中5例缓解, RR为17.24%; D组接受2周期XP方案化疗后定期复查, 进展22例, DCR为46.67%, 无1例缓解. 两组的RR和DCR比较均有统计学差异(P = 0.024, P = 0.043).
| 疗效评价 | 第1次 | 第2次 | 第3次 |
| C组 | 0 | 3 | 5 |
| D组 | 0 | 6 | 10 |
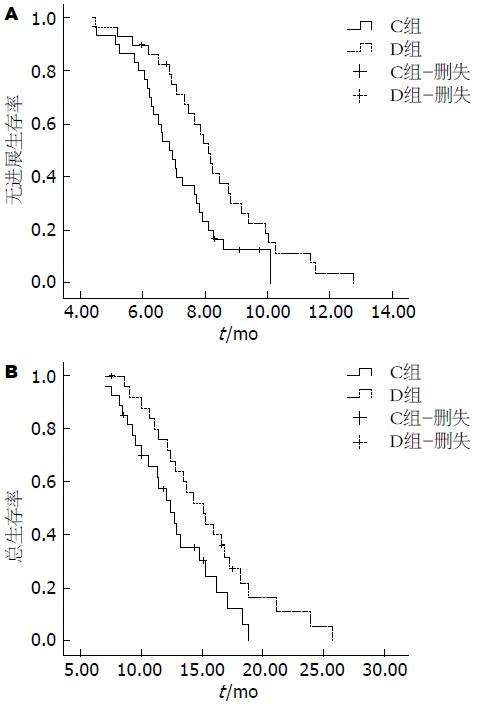
末次随访时间为2014-01-21, 仅评价进入卡培他滨维持治疗患者(C组)29例和进入随访观察患者(D组)30例患者的远期疗效. C组中位无进展生存时间(median PFS, mPFS)为8.10 mo(95%CI: 7.51-8.68), 中位总生存时间(median OS, mOS)为14.74 mo(95%CI: 12.14-17.33), 1年总生存率为69.23%; D组mPFS为6.87 mo(95%CI: 6.23-7.51), mOS为12.33 mo(95%CI: 10.31-14.34), 1年总生存率为48.15%. 两组比较, mPFS有明显差异(P = 0.021), 而mOS和1年总生存率差异无统计学意义, P值分别为0.081和0.118. 生存曲线如图1.
76例患者均可评价不良反应, 主要为恶心、呕吐、手足综合症、脱发、腹泻、骨髓抑制等, 多为轻中度且经对症处理后均好转, 未发生化疗相关性死亡. PACX组患者脱发的发生率高达97.22%, 明显高于XP组(5.00%), 但均为Ⅰ/Ⅱ度, 停用紫杉醇后头发均可再生; 周围神经毒性的发生率为75.00%, 其中有1例为Ⅲ度, 表现为感觉异常、肢端麻木、疼痛, 给予止痛、营养神经及紫杉醇减量治疗后好转; 恶心呕吐的发生率明显低于XP组(36.11% vs 70%), 且无Ⅲ/Ⅳ度不良反应发生; 余常见不良反应两组发生率无明显差异(P>0.05)(表3). 接受卡培他滨单药维持治疗(29例)或是随访观察(30例)的患者Ⅰ/Ⅱ度不良反应的发生率明显减少, 其中维持组骨髓抑制共4例(3例白细胞Ⅰ度降低、4例血红蛋白Ⅰ度降低)、恶心呕吐5例(17.24%)、腹泻3例(10.34%)、口腔炎2例(6.90%)、神经症状10例(34.48%). 维持组仅手足综合症的发生率增高(62.09%), 其中发生Ⅲ/Ⅳ度不良反应者10例(34.48%), 在适当减少卡培他滨用量及对症治疗后改善, 未影响后续的治疗.
| 分组 | n | 中性粒细胞降低 | 血红蛋白降低 | 血小板降低 | 恶心呕吐 | 腹泻 | 口腔炎 | 手足综合症 | 周围神经毒性 | 脱发 |
| PACX组 | 36 | |||||||||
| Ⅰ/Ⅱ度 | 11(30.56) | 30(83.33) | 3(19.44) | 13(36.11) | 12(33.33) | 10(27.78) | 15(41.67) | 26(72.22) | 35(97.22) | |
| Ⅲ/Ⅳ度 | 7(19.44) | 1(2.78) | 0(0.00) | 0(0.00) | 0(0.00) | 0(0.00) | 3(8.33) | 1(2.78) | 0(0.00) | |
| XP组 | 40 | |||||||||
| Ⅰ/Ⅱ度 | 13(32.5) | 26(65.00) | 10(25.00) | 25(62.50) | 15(37.50) | 8(20.00) | 17(42.50) | 2(5.00) | 2(5.00) | |
| Ⅲ/Ⅳ度 | 3(7.50) | 1(2.50) | 0(0.00) | 3(7.50) | 4(10.00) | 2(5.00) | 1(2.50) | 0(0.00) | 0(0.00) | |
| χ2值 | 1.384 | 3.214 | 3.660 | 9.670 | 2.298 | 0.018 | 0.405 | 38.678 | 63.654 | |
| P值 | 0.239 | 0.073 | 0.056 | 0.002 | 0.13 | 0.892 | 0.525 | 0.00 | 0.00 |
卡培他滨是一种新型口服氟尿嘧啶氨甲酸酯类抗肿瘤药, 口服后完整地通过胃肠壁, 经肝脏羧酸酯酶催化为5-脱氧-5-氟胞苷, 再经肝脏和肿瘤细胞中的胞苷脱氨酶催化为5-脱氧-氟尿嘧啶, 后经胸苷酸磷酸化酶(TP, 在肿瘤组织中浓度较高)催化为有活性的5-Fu而发挥抗肿瘤作用, 主要作用于S期细胞, 但对其他期的肿瘤细胞也有抑制作用, 具有明显的细胞靶向性且能模拟5-Fu持续静脉滴注的效果, 单药用于胃癌治疗的客观缓解率(objective response rate, ORR)为19%-34%, 联合应用时达30%-50%, mOS为9.0-11.0 mo[4-6]. Okines等[7]对著名的REAL-2研究和ML17032研究进行了多因素分析, 结果显示卡培他滨组的ORR明显高于5-Fu(45.6% vs 38.4%)、mOS也显著延长(322 d vs 285 d)、死亡风险下降了13%, 而且卡培他滨显示出的明显生存优势(P = 0.02)与年龄大小、体力状况、病变范围无关. 多亚组分析显示, 卡培他滨为基础的联合化疗, 无论两药或是三药, 在ORR和生存期方面都有明显优势; 而不良反应方面, 除了手足综合症以外其他均优于5-Fu. Kang等[8]将316例首次治疗的进展期或复发性胃癌患者随机分为XP(卡培他滨/顺铂)和FP(氟尿嘧啶/顺铂)组, 结果XP组的ORR、mPFS、mOS分别为46%、5.6、10.5 mo, 均高于FP组. Yamaguchi等[9]对AVAGAST研究和ToGA 研究进行了亚组分析, 两研究中日本人群应用XP方案的有效率分别为58.5%和49.2%, mPFS和mOS分别为5.7、14.2和5.6、17.7 mo, 且耐受性良好. 因此, 卡培他滨替代5-Fu的XP方案被推荐为晚期胃癌的一线治疗方案.
Van Cutsem等[10]研究确立了多西他赛在治疗转移或局部进展期胃癌中的疗效, 但其较高的治疗相关不良反应, 尤其是血液毒性, 限制了他的应用. 紫杉醇与多西他赛同属于紫杉类, 他通过促进微管蛋白聚集使纺锤体失去正常功能、诱导细胞的凋亡、诱导肿瘤坏死因子-α基因的表达[11]而导致胃癌细胞死亡, 是细胞周期特异性药物, 主要作用于G期和M期, 与多西他赛不良反应谱及疗效不完全相同. Chon等[12]对126例进展期胃癌患者中进行了DFL方案和PFL方案的临床比较, 结果显示紫杉醇组RR、PFS均较多西他赛组有轻微优势且其血液学毒性低于多西他赛(62% vs 71%), 国内刘丽琴等[13]也有相似的报道. 另外, 紫杉醇能够上调肿瘤组织内的TP酶表达, 与卡培他滨联合治疗胃癌有协同作用且不良反应无交叉, 英国的一项Ⅱ期临床研究结果显示紫杉醇与卡培他滨联合一线治疗晚期胃癌的有效率为48.9%, 其中2例获得CR, mPFS为5.6 mo, mOS 为11.3 mo, 耐受性良好[14]. 一系列证据表明紫杉醇可代替多西他赛与氟尿嘧啶类联合作为晚期胃癌一线化疗的新选择.
尽管晚期胃癌的治疗效果通过不同药物间的联合稍有提高, 但临床意义不显著. 近年来"维持治疗"概念的提出, 给晚期胃癌的治疗带来了新的希望. 这一治疗模式是基于Goldie等[15]假说及Jacobs等[16]模型, 目前已应用于结直肠癌、非小细胞肺癌等疾病的治疗, 并取得了较好的效果, 但关于胃癌维持治疗的研究较少. 潘战和等[17]和Qiu等[18]均对奥沙利铂联合卡培他滨6周期化疗后卡培他滨维持治疗进展期胃癌进行了研究. Qiu报道了64例进入维持化疗的患者血液学毒性发生率低于5%且程度轻、余Ⅲ/Ⅳ度不良反应不常见, 维持治疗的mPFS比对照组提高了4.3 mo(11.4 mo vs 7.1 mo), 且多因素分析表明维持治疗是进展期胃癌预后的独立因素; 潘报道了32例进入维持化疗, 其RR和DCR均好于随访观察组、mPFS提高了2.2 mo(7.9 mo vs 5.7 mo), 两个研究都初步肯定了卡培他滨维持治疗的效果及安全性. 关于紫杉醇联合卡培他滨一线治疗进展期胃癌后卡培他滨维持治疗的化疗模式, 有一项前瞻性的Ⅱ期临床研究[19]. 共入组175例患者, 均接受紫杉醇/卡培他滨方案化疗, 其中45例在6周期后进入卡培他滨维持治疗, 结果维持治疗组的mOS比未接受组延长了531 d, 但多因素COX回归分析却并未得到维持治疗是OS的独立预测因素. 因此在此基础上, 我们进行了该化疗模式与经典XP方案对比的Ⅲ期临床研究, 为确保疗效并降低多周期的联合化疗所带来的较高的不良反应, 实验组给予紫杉醇联合卡培他滨治疗4周期后即序贯卡培他滨维持治疗, 与对照组经典的XP方案对比, 近期的RR和DCR无显著差异(52.78% vs 45.00%, 80.56% vs 75.00%), 而后期维持治疗的RR和DCR明显高于单纯观察治疗(17.24% vs 0.00%, 72.4% vs 46.67%). 实验组mPFS为8.10 mo, 较对照组6.87 mo提高了1.23 mo; 虽然两组mOS和1年总生存率的差异无统计学意义, 但都有提高趋势(14.74 mo vs 12.33 mo, 69.23% vs 48.15%). 不良反应方面, PACX方案脱发及周围神经毒性的发生率较XP方案明显增高, 但多为Ⅰ/Ⅱ度, 而恶心呕吐的发生率则显著降低; 后续的维持治疗中除手足综合症的发生率(62.09%)增高之外, 余不良反应的发生率则明显减少. 该试验将实验组的联合化疗减至4周期, 仍得到有统计学差异的治疗效果, 提示可能4周期后即给予单药的维持治疗是个更好的化疗模式. 在生存时间的分析时维持治疗组因医保、经济、依从性等原因共失访了8例患者, 失访率相对较高(27.59% vs 16.67%), 可能会使得到的mOS和1年生存率的值比实际偏小, 从而影响统计结果, 但本试验提示两者有提高的趋势.
总之, 紫杉醇联合卡培他滨后序贯卡培他滨维持治疗的方案一线用于晚期胃癌治疗时, 显示出较高的疗效及良好的安全性. 考虑到紫杉醇的价格相对较低, 而卡培他滨口服给药方便、可随时调整剂量、维持治疗时不良反应发生率低, 不仅降低了静脉穿刺的风险及并发症, 同时减少住院的天数及次数, 因此该方案依从性更高、更经济, 临床上值得应用. 有报道紫杉醇在HER-2阳性的患者[20]中疗效更高, 而本研究并未对实验组及对照组患者进行HER-2的检测及差异比较, 且本实验的研究例数较少、失访比例较大, 这些因素都会干扰实验结果, 为进一步确定疗效及安全性尚需样本量更大、分层更细的研究.
胃癌是全球第4大常见恶性肿瘤及第2位肿瘤相关死亡原因, 早期症状不典型, 大多数患者已处于进展期, 以联合化疗为主的综合治疗被视为标准治疗, 但进展期胃癌的化疗至今缺少世界公认的一线化疗"金方案".
潘阳林, 副教授, 副主任医师, 第四军医大学西京医院消化病医院消化六科
紫杉醇和卡培他滨为新一代胃癌化疗药物, 维持治疗是近几年新提出的治疗模式, 本研究将新药与新的治疗模式相结合, 以寻求进展期胃癌更佳的一线化疗方案.
潘战和、Qiu等肯定了奥沙利铂与卡培他滨联合一线治疗进展期胃癌后卡培他滨维持治疗的效果和安全性, Gong等确定了紫杉醇/卡培他滨一线化疗6周期后卡培他滨维持治疗的可行性.
本研究实验组的两药不良反应谱无交叉, 而且紫杉醇对卡培他滨有增敏作用; 在给予4周期的联合化疗后即行维持治疗, 联合化疗周期数减少.
该研究方案减少了多周期化疗带来的较高的不良反应发生率, 紫杉醇的价格相对较低, 而卡培他滨口服给药方便、可随时调整剂量、维持治疗时不良反应发生率低, 不仅降低了静脉穿刺的风险及并发症, 同时减少住院的天数及次数, 临床上值得应用.
本文具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 3. | Wagner AD, Unverzagt S, Grothe W, Kleber G, Grothey A, Haerting J, Fleig WE. Chemotherapy for advanced gastric cancer. Cochrane Database Syst Rev. 2010;CD004064. [PubMed] [DOI] |
| 4. | Barthel W, Markwardt F. Aggregation of blood platelets by adrenaline and its uptake. Biochem Pharmacol. 1975;24:1903-1904. [PubMed] [DOI] |
| 5. | Lo SS, Khorana AA, Javle M, Simon S, Kiefer G, Rajasenan K, Wang H, Hantel A, Shayne M, Hwang J. A phase II study of weekly docetaxel in combination with capecitabine in advanced gastric and gastroesophageal adenocarcinomas. Oncology. 2010;78:125-129. [PubMed] [DOI] |
| 6. | Salah-Eldin MA, Ebrahim MA, AL-Ashry MS. Phase II study of capecitabine plus cisplatin in patients with gastric cancer. Anticancer Drugs. 2009;20:191-196. [PubMed] [DOI] |
| 7. | Okines AF, Norman AR, McCloud P, Kang YK, Cunningham D. Meta-analysis of the REAL-2 and ML17032 trials: evaluating capecitabine-based combination chemotherapy and infused 5-fluorouracil-based combination chemotherapy for the treatment of advanced oesophago-gastric cancer. Ann Oncol. 2009;20:1529-1534. [PubMed] [DOI] |
| 8. | Kang YK, Kang WK, Shin DB, Chen J, Xiong J, Wang J, Lichinitser M, Guan Z, Khasanov R, Zheng L. Capecitabine/cisplatin versus 5-fluorouracil/cisplatin as first-line therapy in patients with advanced gastric cancer: a randomised phase III noninferiority trial. Ann Oncol. 2009;20:666-673. [PubMed] [DOI] |
| 9. | Yamaguchi K, Sawaki A, Doi T, Satoh T, Yamada Y, Omuro Y, Nishina T, Boku N, Chin K, Hamamoto Y. Efficacy and safety of capecitabine plus cisplatin in Japanese patients with advanced or metastatic gastric cancer: subset analyses of the AVAGAST study and the ToGA study. Gastric Cancer. 2013;16:175-182. [PubMed] [DOI] |
| 10. | Van Cutsem E, Moiseyenko VM, Tjulandin S, Majlis A, Constenla M, Boni C, Rodrigues A, Fodor M, Chao Y, Voznyi E. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol. 2006;24:4991-4997. [PubMed] |
| 11. | Emi Y, Yamamoto M, Takahashi I, Orita H, Kakeji Y, Kohnoe S, Maehara Y. Phase II study of weekly paclitaxel by one-hour infusion for advanced gastric cancer. Surg Today. 2008;38:1013-1020. [PubMed] [DOI] |
| 12. | Chon HJ, Rha SY, Im CK, Kim C, Hong MH, Kim HR, An JR, Noh SH, Chung HC, Jeung HC. Docetaxel versus paclitaxel combined with 5-Fu and leucovorin in advanced gastric cancer: combined analysis of two phase II trials. Cancer Res Treat. 2009;41:196-204. [PubMed] [DOI] |
| 14. | Kang HJ, Chang HM, Kim TW, Ryu MH, Sohn HJ, Yook JH, Oh ST, Kim BS, Lee JS, Kang YK. A phase II study of paclitaxel and capecitabine as a first-line combination chemotherapy for advanced gastric cancer. Br J Cancer. 2008;98:316-322. [PubMed] [DOI] |
| 15. | Goldie JH, Coldman AJ. A mathematic model for relating the drug sensitivity of tumors to their spontaneous mutation rate. Cancer Treat Rep. 1979;63:1727-1733. [PubMed] |
| 16. | Jacobs JA, Dellarco AJ, Manfredi RA, Harclerode J. The effects of delta 9-tetrahydrocannabinol, cannabidiol, and shock on plasma corticosterone concentrations in rats. J Pharm Pharmacol. 1979;31:341-342. [PubMed] |
| 18. | Qiu MZ, Wei XL, Zhang DS, Jin Y, Zhou YX, Wang DS, Ren C, Bai L, Luo HY, Wang ZQ. Efficacy and safety of capecitabine as maintenance treatment after first-line chemotherapy using oxaliplatin and capecitabine in advanced gastric adenocarcinoma patients: a prospective observation. Tumour Biol. 2014;35:4369-4375. [PubMed] |
| 19. | Gong J, Hu B, Zhang X, Zhang F, Zhang J, Xu N, Fan Q, Bai Y, Jiao S, Wang J. The multicenter, phase II prospective study of paclitaxel plus capecitabine as first-line chemotherapy in advanced gastric carcinoma. Oncologist. 2014;19:173-174. [PubMed] [DOI] |