修回日期: 2014-04-02
接受日期: 2014-04-09
在线出版日期: 2014-06-08
目的: 探讨Ghrelin对急性重症胰腺炎(severe acute pancreatitis, SAP)血清淀粉酶(amylase, AMY)、白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平及病理学的影响效果.
方法: 按照随机数字表法将60只SPF级Wistar大鼠均分为A、B、C、D 4组, A组大鼠不使用牛磺胆酸钠诱发SAP, B、C、D三组大鼠均使用牛磺胆酸钠诱发SAP, C组术后使用Ghrelin治疗, D组术前使用[D-Lys3]GHRP-6, 术后使用Ghrelin治疗, 比较4组大鼠血清AMY、IL-6、TNF-α水平、胰腺含水量, 并切片比较光镜下胰腺组织病理学图像及光镜下胰腺组织病理评分.
结果: C组大鼠血清AMY、IL-6和TNF-α水平均明显低于B组(3806.02 U/L±536.27 U/L vs 4794.86 U/L±477.98 U/L、167.22 pg/mL±11.75 pg/mL vs 204.96 pg/mL±17.44 pg/mL、2.62 pg/mL±0.72 pg/mL vs 3.25 pg/mL±0.92 pg/mL), 差异具有统计学意义(P<0.05); D组大鼠血清AMY、IL-6和TNF-α水平均明显高于C组(4451.16 U/L±238.86 U/L vs 3806.02 U/L±536.27 U/L、197.73 pg/mL±17.38 pg/mL vs 167.22 pg/mL±11.75 pg/mL、3.17 pg/mL±0.69 pg/mL vs 2.62 pg/mL±0.72 pg/mL), 差异具有统计学意义(P<0.05); C组和D组大鼠胰腺含水量均明显低于B组(28.65%±0.77% vs 35.41%±0.78%、29.30%±0.40% vs 35.41%±0.78%), 差异具有显著统计学意义(P<0.01); C组大鼠水肿、炎症、出血及坏死评分均明显低于B组(2.06分±0.41分 vs 2.82分±0.55分、2.52分±0.63分 vs 3.18分±0.47分、1.93分±0.64分 vs 2.79分±0.58分、2.22分±0.74分 vs 2.84分±0.63分), 差异具有显著统计学意义(P<0.01); D组大鼠水肿、炎症、出血及坏死评分均明显高于C组(2.66分±0.32分 vs 2.06分±0.41分、3.09分±0.78分 vs 2.52分±0.63分、2.42分±0.39分 vs 1.93分±0.64分、2.63分±0.26分 vs 2.22分±0.74分), 差异具有统计学意义(P<0.05).
结论: Ghrelin治疗能够有效改善大鼠AMY、IL-6和TNF-α水平, 改善胰腺病理损害, 对SAP有良好的治疗效果.
核心提示: 本研究中使用Ghrelin治疗急性重症胰腺炎(severe acute pancreatitis, SAP), 结果显示C组大鼠血清淀粉酶(amylase, AMY)、白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)水平、胰腺含水量、水肿、炎症、出血及坏死评分均明显低于B组. 表明Ghrelin对SAP有确切的临床疗效, 能够有效改善炎性因子释放聚集, 减轻胰腺受损程度. 而加用[D-Lys3]GHRP-6的D组大鼠血清AMY、IL-6和TNF-α水平以及水肿、炎症、出血、坏死评分均明显高于C组, 差异具有显著性, B、D两组大鼠血清AMY、IL-6和TNF-α水平以及水肿、炎症、出血、坏死评分比较, 差异无统计学意义. 表明GHS-R拮抗剂[D-Lys3]GHRP-6能够抑制Ghrelin与受体结合而影响其作用发挥, 与相关文献报道相似.
引文著录: 哈红萍, 李建华. 胃饥饿素对大鼠急性重症胰腺炎AMY、IL-6和TNF-α水平及病理学的影响. 世界华人消化杂志 2014; 22(16): 2285-2289
Revised: April 2, 2014
Accepted: April 9, 2014
Published online: June 8, 2014
AIM: To explore the effect of ghrelin on serum levels of amylase (AMY), interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) in rats with severe acute pancreatitis.
METHODS: Sixty Wistar rats were randomly divided into four groups: A, B, C and D. Groups B, C and D were treated with sodium taurocholate hydrate to induce SAP, while group A did not. Before induction of SAP, group D was treated with [D-Lys3]GHRP-6. After induction of SAP, groups C and D were treated with ghrelin. Serum levels of AMY, IL-6, and TNF-α, the moisture content of the pancreas, and the pathological changes in the pancreatic tissue were determined and compared between different groups.
RESULTS: Serum levels of AMY, IL-6 and THF-α in group C were significantly lower than those in group B (3806.02 U/L ± 536.27 U/L vs 4794.86 U/L ± 477.98 U/L, 167.22 pg/mL ± 11.75 pg/mL vs 204.96 pg/mL ± 17.44 pg/mL, 2.62 pg/mL ± 0.72 pg/mL vs 3.25 pg/mL ± 0.92 pg/mL; P < 0.05 for all). Serum levels of AMY, IL-6 and THF-α in group D were significantly higher than those in group C (4451.16 U/L ± 238.86 U/L vs 3806.02 U/L ± 536.27 U/L, 197.73 pg/mL ± 17.38 pg/mL vs 167.22 pg/mL ± 11.75 pg/mL, 3.17 pg/mL ± 0.69 pg/mL vs 2.62 pg/mL ± 0.72 pg/mL; P < 0.05 for all). The moisture contents of the pancreas in groups C and D were significantly lower than that in group B (28.65% ± 0.77% vs 35.41% ± 0.78%, 29.30% ± 0.40% vs 35.41% ± 0.78%; P < 0.01 for both). The edema, inflammation, hemorrhage and necrosis scores in group C were significantly lower than those in group B (2.06 ± 0.41 vs 2.82 ± 0.55, 2.52 ± 0.63 vs 3.18 ± 0.47, 1.93 ± 0.64 vs 2.79 ± 0.58, 2.22 ± 0.74 vs 2.84 ± 0.63; P < 0.01 for all), while edema, inflammation, hemorrhage and necrosis scores in group D were significantly higher than those in group C (2.66 ± 0.32 vs 2.06 ± 0.41, 3.09 ± 0.78 vs 2.52 ± 0.63, 2.42 ± 0.39 vs 1.93 ± 0.64, 2.63 ± 0.26 vs 2.22 ± 0.74, P < 0.05 for all).
CONCLUSION: Ghrelin can improve serum levels of AMT, IL-6 and TNF-α and the pathological injury in the pancreas in rats with SAP.
- Citation: Ha HP, Li JH. Effect of ghrelin on serum levels of amylase, interleukin-6 and tumor necrosis factor-α in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(16): 2285-2289
- URL: https://www.wjgnet.com/1009-3079/full/v22/i16/2285.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i16.2285
急性重症胰腺炎(severe acute pancreatitis, SAP)是指胰酶在胰腺内受到多种因素刺激导致胰腺组织自身消化、水肿、出血、坏死的炎症反应, 在临床上较为常见[1]. SAP发病原因复杂, 患者死亡率较高. 临床研究表明Ghrelin属于一个生长激素促分泌受体(growth hormone secretagogue receptor, GHS-R)的内源性配体, 具有改善胰腺功能的生物学作用[2]. 现对Ghrelin应用于大鼠重症胰腺炎的临床效果和作用机制进行研究分析, 探讨其在重症胰腺炎临床治疗中的应用价值, 报道如下.
选取60只健康SPF级Wistar大鼠(实验动物合格证号: SCXK(新)2003-0002), 作为本研究研究对象, 所有大鼠均购自南京市模式动物研究所, 雌雄各半. 大鼠平均体质量为205.41 g±20.06 g, 分为5只/笼, 在22.0 ℃±1.0 ℃和40%-70%湿度下进行明暗各12 h喂养[3]. 注意保持鼠笼通风和清洁, 每日更换饮水和饲料. 在使用普通基础饲料喂养适应性喂养1 wk后, 按照随机数字表法将60只大鼠均分为A、B、C、D 4组, 4组大鼠平均体质量比较差异无统计学意义(P>0.05), 具有可比性.
1.2.1 实验: 4组大鼠术前均禁食12 h, 称质量并进行麻醉药物和牛磺胆酸钠(美国Sigma公司, 批号: T4009-088K0097)用药剂量. B、C、D三组大鼠术前腹腔注射10%水合氯酸(我院药剂科)3-4 mL/kg进行麻醉, 效果满意后进行腹部备皮, 常规消毒铺巾后取剑突下腹正中2 cm切口开腹, 探查游离十二指肠及其系膜内胆胰管, 使用止血钳阻断胆总管出肝门处动脉, 并将一次性静脉留置套管针穿刺进入胆胰管开口处十二指肠对侧壁, 进入肠腔后退出针芯并将套管沿胆胰管开口进入1 cm左右[4]. 使用微量注射泵缓慢注入5%质量浓度的牛磺胆酸钠诱发SAP, 注射速度为0.1 mL/min, 注射剂量为1 mL/kg[5]. 拔出套管并使用止血钳夹闭胆总管入十二指肠处, 5 min后缝合穿刺孔并清洗腹腔, 逐层关腹. A组大鼠与其余三组大鼠麻醉和手术方式相同, 但不注射牛磺胆酸钠.
C组大鼠于制模后1 h给予Ghrelin腹腔注射治疗, 剂量为20 nmol/kg; D组大鼠于制模前0.5 h腹腔注射[D-Lys3]GHRP-6(美国Sigma公司, 批号: 136054-22-3), 注射剂量为l μmol/kg, 制模后模后1 h给予Ghrelin腹腔注射治疗, 剂量与C组
相同.
1.2.2 观察指标: 术后24 h比较4组大鼠血清AMY、IL-6、TNF-α、胰腺含水量, 并切片比较光镜下胰腺组织病理学图像及光镜下胰腺组织病理评分[6].
统计学处理 本研究数据均采用SPSS18.0进行统计学处理, 计量资料采用mean±SD表示, 差异性比较使用t检验, P<0.05为差异具有统计学意义.
B、C、D三组大鼠血清AMY、IL-6和TNF-α水平均明显高于A组, 差异极显著(P<0.01); C组大鼠血清AMY、IL-6和TNF-α水平均明显低于B组, 差异具有显著性(P<0.05); D组大鼠血清AMY、IL-6和TNF-α水平均明显高于C组, 差异具有显著性(P<0.05); B、D两组大鼠血清AMY、IL-6和TNF-α水平比较, 差异无统计学意义(P>0.05)(表1).
B、C、D三组大鼠胰腺含水量均明显高于A组, 差异极显著(35.41%±0.78%, 28.65%±0.77%, 29.30%±0.40% vs 21.36%±0.85%, P<0.01); C组和D组大鼠胰腺含水量均明显低于B组, 差异极显著(P<0.01); C、D两组大鼠胰腺含水量比较, 差异无统计学意义(P>0.05).
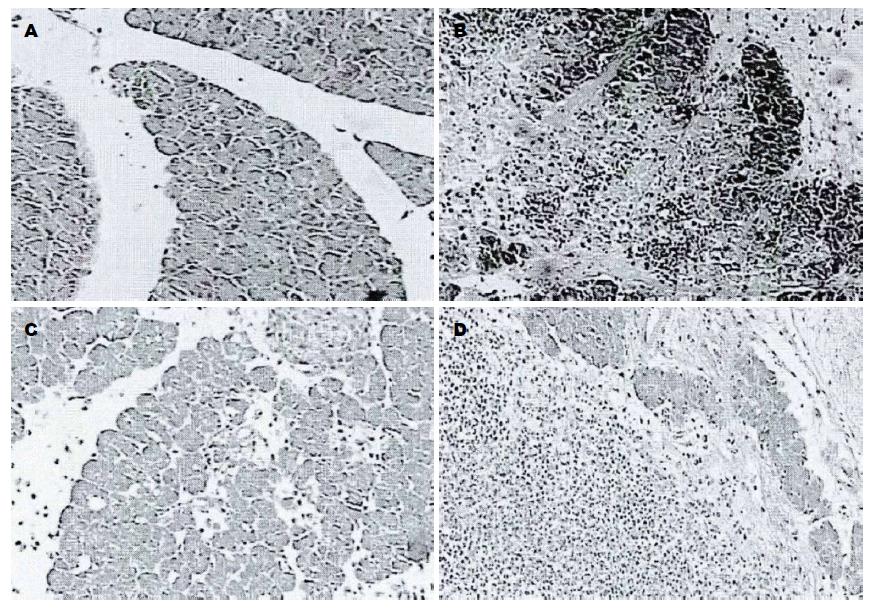
A组大鼠为正常胰腺组织(图1A), 光镜下胰腺边界清晰, 小叶结构完整, 腺泡轮廓清楚, 核仁及胞装成分着色清楚, 无明显水肿、中性粒细胞浸润、出血及坏死. B组大鼠光镜下胰腺边界不清晰, 胰腺实质内有散在的灶状凝固性坏死且坏死区结构模糊, 腺泡破裂且内部细胞核固缩、坏死, 局部可见灶性及片状出血, 大量炎性细胞浸润(图1B). C组大鼠光镜下胰腺组织出现不同程度水肿、腺细胞变性坏死及炎症细胞浸润等, 但明显好于B组(图1C). D组大鼠光镜下胰腺组织表现与C组相似, 但严重程度高于C组(图1D).
B、C、D三组大鼠水肿、炎症、出血及坏死评分均明显高于A组, 差异极显著(P<0.01); C组大鼠水肿、炎症、出血及坏死评分均明显低于B组, 差异极显著(P<0.01); D组大鼠水肿、炎症、出血及坏死评分均明显高于C组, 差异具有显著性(P<0.05); B、D两组大鼠水肿、炎症、出血及坏死评分比较, 差异无统计学意义(P>0.05)(表2).
SAP具有发病急骤、病情进展迅速、并发症多及死亡率较高等特点, 其中全身炎症反应综合征最为严重, 能够进一步引发多器官功能障碍及多器官功能衰竭, 导致患者死亡[7]. 目前, 临床上尚无对其发病机制的明确研究结果, 也缺乏特效治疗药物.
临床研究表明炎症介质和细胞因子在SAP的发病及病情进展中有关键作用[8]. 相关文献报道指出, SAP发病后引起胰腺组织病损, 从而激活巨噬细胞等炎症细胞, 并释放大量细胞因子[9]. 这些细胞因子通过扳机样作用引发炎症介质瀑布样级联反应. 其中IL-6、TNF-α均被证实在SAP发病过程中起核心作用, 同时也是诱发全身炎症反应综合征和多器官功能障碍的重要危险因
素[10]. 因此, IL-6和TNF-α水平可作为SAP临床诊断和判断疗效的重要依据.
AMY为胰腺分泌的消化酶, 大部分进入十二指肠参与消化, 少部分可进入血液中[9]. SAP发病后引起胰腺外分泌异常增加, 胰管内压力剧增, 破裂后大量胰酶释放入间质, 不仅对胰腺组织产生损害, 也导致血清中胰酶含量异常升高[11]. 目前血清AMY测定仍是多数医院诊断SAP的重要指标, 但其升高程度并不与SAP严重程度呈正比.
本研究结果显示, B、C、D三组大鼠经牛磺胆酸钠诱发SAP后血清AMY、IL-6和TNF-α水平均明显高于A组, 与上述文献报道相符.
Ghrelin是日本科学家首次从大鼠胃组织中分离纯化得到的小分子多肽, 属于GHS-R的内源性配体, 具有促进生长激素释放、促进胃肠螺动以及抑制炎症因子释放等多种生物学作用[12]. 临床研究表明, Ghrelin能够准确反映炎症性疾病的严重程度及机体营养状况[13]. 本研究中使用Ghrelin治疗SAP, 结果显示C组大鼠血清AMY、IL-6、TNF-α水平、胰腺含水量、水肿、炎症、出血及坏死评分均明显低于B组. 表明Ghrelin对SAP有确切的临床疗效, 能够有效改善炎性因子释放聚集, 减轻胰腺受损程度. 而加用[D-Lys3]GHRP-6的D组大鼠血清AMY、IL-6和TNF-α水平以及水肿、炎症、出血、坏死评分均明显高于C组, 差异具有显著性, B、D两组大鼠血清AMY、IL-6和TNF-α水平以及水肿、炎症、出血、坏死评分比较, 差异无统计学意义. 表明GHS-R拮抗剂[D-Lys3]GHRP-6能够抑制Ghrelin与受体结合而影响其作用发挥, 与相关文献报道相似[14].
总之, Ghrelin治疗能够有效改善大鼠AMY、IL-6和TNF-α水平, 改善胰腺病理损害, 对SAP有良好的治疗效果. 但其在人SAP临床治疗中的确切疗效还需要进一步深入研究.
临床研究表明炎症介质和细胞因子在急性重症胰腺炎(severe acute pancreatitis, SAP)的发病及病情进展中有关键作用. 相关文献报道指出, SAP发病后引起胰腺组织病损, 从而激活巨噬细胞等炎症细胞, 并释放大量细胞因子. 这些细胞因子通过扳机样作用引发炎症介质瀑布样级联反应. 其中白介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)均被证实在SAP发病过程中起核心作用, 同时也是诱发全身炎症反应综合征和多器官功能障碍的重要危险因素. 因此, IL-6和TNF-α水平可作为SAP临床诊断和判断疗效的重要依据.
江建新, 副主任医师, 贵阳医学院附属医院肝胆外科
SAP具有发病急骤、病情进展迅速、并发症多及死亡率较高等特点, 其中全身炎症反应综合征最为严重, 能够进一步引发多器官功能障碍及多器官功能衰竭, 导致患者死亡. 目前, 临床上尚无对其发病机制的明确研究结果, 也缺乏特效治疗药物.
Ghrelin是日本科学家首次从大鼠胃组织中分离纯化得到的小分子多肽, 属于GHS-R的内源性配体, 具有促进生长激素释放、促进胃肠螺动以及抑制炎症因子释放等多种生物学作用.
Ghrelin治疗能够有效改善大鼠血清淀粉酶(amylase)、IL-6和TNF-α水平, 改善胰腺病理损害, 对SAP有良好的治疗效果. 但其在人SAP临床治疗中的确切疗效还需要进一步深入研究.
本文设计合理, 结果可靠, 有一定的学术价值.
编辑: 田滢 电编:鲁亚静
| 2. | 陈 锐, 朱 尤庆. 脑肠肽Ghrelin的研究进展. 武汉大学学报(医学版). 2010;31:417-420. |
| 5. | 孔 雷, 杨 华丽, 谢 爽, 张 敏, 奉 典旭, 秦 建民, 陈 腾, 韩 峰, 韩 天权, 张 圣道. 牛磺胆酸钠诱导的急性坏死性胰腺炎大鼠脏器功能障碍观察. 肝胆胰外科杂志. 2009;21:91-94. |
| 8. | Karpavicius A, Dambrauskas Z, Sileikis A, Vitkus D, Strupas K. Value of adipokines in predicting the severityof acute pancreatitis: comprehensive review. World J Gastroenterol. 2012;18:6620-6627. [PubMed] [DOI] |
| 9. | Dhaliwal R, Madden SM, Cahill N, Jeejeebhoy K, Kutsogiannis J, Muscedere J, McClave S, HeylandDK . Guidelines, guidelines, guidelines: what are weto do with all of these North American guidelines? JPEN J Parenter Enteral Nutr. 2010;34:625-643. [PubMed] [DOI] |
| 11. | Yang C, Guanghua F, Wei Z, Zhong J, Penghui J, Xin F, Xiping Z. Combination of hemofiltrationand peritoneal dialysis in the treatment of severeacute pancreatitis. Pancreas. 2010;39:16-19. [PubMed] [DOI] |
| 12. | 王 丽晔, 李 峰, 宋 月晗, 马 佳美, 李 思耐, 关 冰河. Ghrelin发现和结构的研究现状. 现代生物医学进展. 2011;11:3589-359113 齐文杰, 张淑文, 王红, 张苗苗, 文艳, 王宝恩. 急性重症胰腺炎湿热证动物模型建立初探. 中国中医药信息杂志 2011; 18: 47-50. |
| 13. | Tian C, Ye F, Xu T, Wang S, Wang X, Wang H, WanF , Lei T. GHRP-6 induces CREB phosphorylationand growth hormone secretion via a protein kinaseCsigma-dependent pathway in GH3 cells. J HuazhongUniv Sci Technolog Med Sci. 2010;30:183-187. [PubMed] [DOI] |