修回日期: 2014-03-11
接受日期: 2014-04-24
在线出版日期: 2014-06-08
目的: 通过异硫氰酸苄酯(benzyl-isothiocyanate, BITC)对体外培养的人肝癌细胞株HLE和Bel 7402的凋亡影响, 初步探讨BITC调控肝癌细胞凋亡的可能机制.
方法: 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)染色法检测不同浓度BITC对肝癌细胞增殖的影响; 选择具有抑制肝癌细胞生长的BITC浓度处理肝癌细胞后4,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染色法进行凋亡的形态学观察; Caspase3酶活性检测试剂盒检测细胞中的Caspase3酶活性; Western blot法检测具代表性的凋亡相关蛋白Caspase8和Caspase3, 细胞周期相关蛋白Cyclin D1的表达.
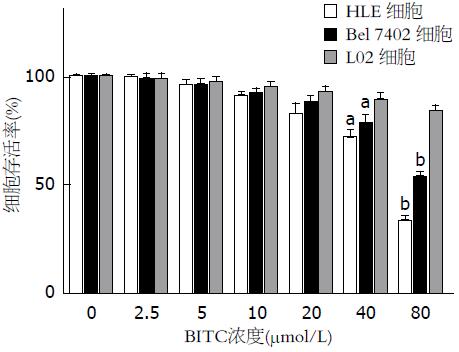
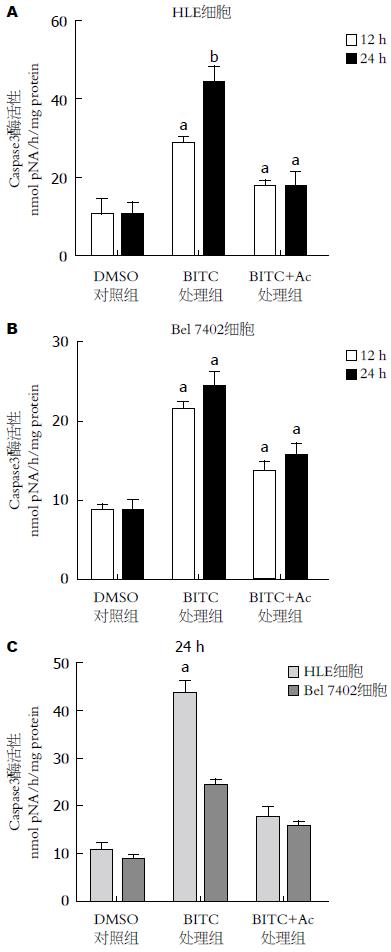
结果: MTT结果显示BITC对人肝癌细胞的增殖有明显的抑制作用, 用浓度为40 µmol/L的BITC处理时, HLE和Bel 7402细胞存活率分别为71.56%和78.09%, 和对照组比较, 有统计学差异(P<0.05); 当用浓度为80 µmol/L的BITC处理时, HLE和Bel 7402生长率分别为32.91%和53.06%, 和对照组比较, 有统计学显著性差异(P<0.01); 经BITC处理后的细胞, DAPI染色显示细胞特征性凋亡变化; Western blot和Caspase活性检测结果显示, 随着BITC浓度增加, Caspase8和Caspase3蛋白表达水平及活性呈上升趋势, 而细胞周期蛋白Cyclin D1的表达则明显下降.
结论: BITC对人肝癌细胞增殖有抑制作用, 并能诱导肝癌细胞凋亡; BITC通过激活Caspase8和Caspase3信号途径以及抑制细胞周期进展诱导细胞凋亡.
核心提示: 肝癌是常见的恶性肿瘤之一, 其恶性程度大, 死亡率很高, 目前没有良好的治疗方法, 寻找理想的化疗药物给肝癌的治疗带来新的希望. 目前研究已经发现, 番木瓜种子提取物-异硫氰酸苄酯(benzyl isothiocyanate, BITC)不仅具有预防肿瘤发生的作用, 而且还具有较好的抗肿瘤作用, 但其是否能抑制肝癌细胞增殖和诱导癌细胞凋亡的作用尚不清楚. 本研究证实BITC能够抑制肝癌细胞增殖和诱导癌细胞凋亡, 通过激活Caspases信号途径以及抑制细胞周期进展发挥其抑癌作用, 这为将来BITC应用于肝癌的临床治疗奠定了一定的基础.
引文著录: 朱明月, 李伟, 鲁琰, 蔡小妹, 董栩, 陈栘, 郭峻莉, 李孟森. 番木瓜种子提取物异硫氰酸苄酯对肝癌细胞凋亡的影响. 世界华人消化杂志 2014; 22(16): 2277-2284
Revised: March 11, 2014
Accepted: April 24, 2014
Published online: June 8, 2014
AIM: To investigate the influence of benzyl isothiocyanate (BITC) on apoptosis of hepatoma carcinoma cell lines HLE and Bel-7402 in vitro, and to explore the possible mechanism involved.
METHODS: After HLE and Bel-7402 cells were treated with an optimal concentration of BITC for 24 h, cell proliferation was tested by MTT assay, the morphology of apoptotic hepatoma cells was observed after DAPI staining, the enzymatic activity of caspase 3 was assayed using Caspase3 Activity Assay Kit, and expression of caspase 8, caspase 3 and cell cycle related protein cyclin D1 were detected by Western blot.
RESULTS: MTT analysis showed that BITC had an obvious inhibitory effect on the proliferation of hepatoma cells. The growth rates of HLE and Bel-7402 cells treated with 40 µmol/L BITC were 71.56% and 78.09% (P < 0.05 vs control groups), respectively, and the growth rates of HLE and Bel-7402 cells treated with 80 µmol/BITC were 32.91% and 53.06% (P < 0.01 vs control groups), respectively. Hepatoma cells treated with BITC tended to showed characteristic morphological changes of apoptosis. BITC treatment elevated the activity of caspase 3 in hepatoma cells, stimulated the expression of caspase 3 and caspase 8, but inhibited cyclin D1 expression.
CONCLUSION: BITC induces apoptosis of hepatoma cells possibly by activating the caspase signal pathway and inhibiting cell cycle progression.
- Citation: Zhu MY, Li W, Lu Y, Cai XM, Dong X, Chen Y, Guo JL, Li MS. Benzyl isothiocyanate induces apoptosis of hepatocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2014; 22(16): 2277-2284
- URL: https://www.wjgnet.com/1009-3079/full/v22/i16/2277.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i16.2277
近年有研究发现, 番木瓜中含有丰富的具芳香烷侧链的异硫氰酸盐(isothiocyanates, ITCs)成分-异硫氰酸苄酯(benzyl isothiocyanate, BITC)[1]. 早期的研究结果表明, BITC可通过抑制Ⅰ相酶的活性[2]或诱导Ⅱ相解毒酶的活性[3]从而抑制化学致癌物的致癌作用. 而近年来研究发现, BITC除了具有优越的化学预防作用外, 还可直接作用于肿瘤细胞, 对前列腺癌[4]、乳腺癌[5,6]、宫颈癌[7]、肺癌[8,9]、胰腺癌[10-12]和卵巢癌[13]等肿瘤细胞系均具有较好的抗肿瘤作用, 但BITC是否能诱导肝癌细胞凋亡及凋亡的机制如何尚未有报道. 本研究主要探讨BITC对肝癌细胞凋亡的影响及其可能机制.
BITC从番木瓜种子中提取获得, 由中国热带农业科学院热带生物技术研究所提供; 人肝癌细胞株Bel 7402和HLE以及正常人肝细胞株L02购自中科院上海细胞所; DMEM培养基为Gibco公司产品; 胎牛血清(fetal calf serum, FCS)为Hyclone公司产品, 牛血清白蛋白(bovine serum albumin, BSA), 四甲基偶氮唑盐[3-(4,5-Dimethylthiazol-2-yl)-2,5- diphenyltetrazolium bromide, MTT], 二甲基亚砜(DMSO)为Sigma公司产品; 脂质体2000购自Invitrogen公司; 预染彩虹蛋白Marker为Fermentas公司产品; Anti-Caspase3抗体、Anti-Caspase8抗体、Anti-Cyclin D1抗体等购自Abcam公司(Britain, Cambridge); 4,6-二脒基-2-苯基吲哚二盐酸盐(4,6-diamidino-2-phenyl indole dihydrochlorid, DAPI), Caspase3活性检测试剂盒和Caspase3抑制剂Ac-DEVD-CHO购自碧云天生物技术有限公司(中国江苏省海门市), 其他试剂为国产分析纯级或进口分装.
1.2.1 细胞培养: 用含有10%胎牛血清的DMEM培养基培养人正常肝细胞L02和肝癌细胞Bel 7402、HLE, 待细胞长到90%融合时, 用0.25%的胰蛋白酶消化细胞, 再用含有10%胎牛血清的DMEM培养基吹散细胞, 把细胞调整到一定的数目, 进行相关的实验研究.
1.2.2 MTT法检测不同浓度BITC对肝癌细胞增殖的影响: Bel 7402和HLE细胞达到90%融合后, 用0.25%的胰蛋白酶消化, 再用含有10%胎牛血清的DMEM培养基吹散细胞, 调整细胞数目为2.5×104个/mL, 培养于96孔培养板中, 每孔100 μL, 每组设6个平行孔, 适应培养24 h后, 细胞被饥饿处理12 h(用不加血清的培养液), 换成含10%胎牛血清的培养液培养12 h, 加入各种浓度的BITC(10、20、30、40、50、60、70、80 μmol/L), 处理24 h后, 每孔加入20 μL的MTT(5 g/L), 37 ℃孵育4 h, 去掉所有的液体, 每孔加入150 μL DMSO, 震荡30 min, 用酶标仪测定570 nm的吸光度(A)值.
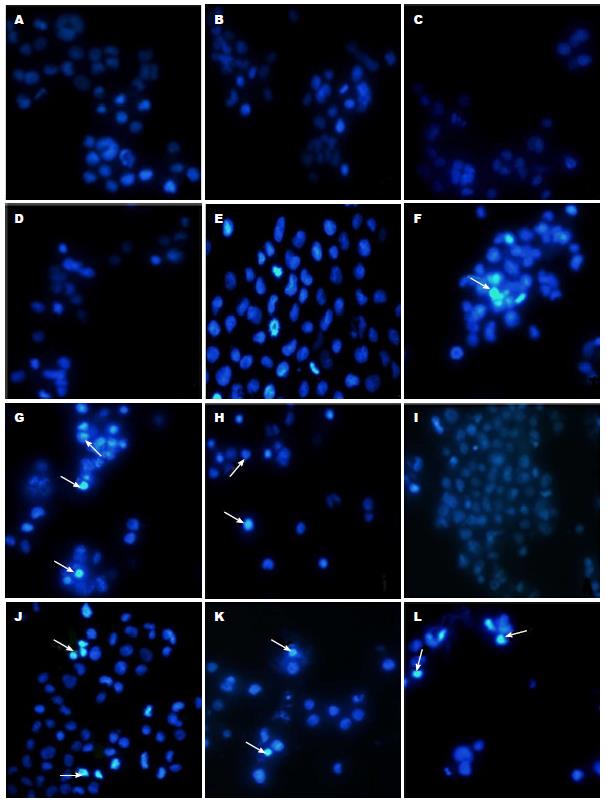
1.2.3 DAPI染色检测BITC诱导肝癌细胞凋亡: 用含有10%胎牛血清的DMEM培养液把HLE和Bel 7402细胞调整到2.0×104个/mL, 取2 mL细胞悬液培养于6孔细胞培养板中, 待细胞长到80%融合, 加入BITC(40、80 μmol/L)处理24 h后, 收集悬浮细胞到离心管, 再用0.25%的胰蛋白酶消化贴壁细胞, 用先收集的悬浮细胞培养液把细胞轻轻吹下, 收集到原来的离心管中, 离心(1000 r/min, 5 min), PBS漂洗3次后, 用1 mL PBS把细胞轻轻吹散, 加入10 μL浓度为10 μg/mL DAPI, 室温避光15 min后, 离心(1000 r/min, 5 min), 用1 mL PBS把细胞轻轻吹散, 清洗细胞3次, 去掉上清液, 加入100 μL PBS把细胞吹散, 吸出20 μL细胞悬液加到已经滴加了1滴抗荧光淬灭剂的干净的载玻片上, 再轻轻压上盖玻片, 静置5 min后, 用荧光显微镜观察细胞凋亡小体, 用荧光显微镜观察并拍摄图像.
1.2.4 Caspase3蛋白酶活性测定: 人肝癌细胞Bel 7402和HLE按1.0×105个/mL, 培养于33 cm2培养瓶中, 每组设3个平行瓶, 每瓶5 mL, 待细胞长到70%-80%融合, 饥饿细胞(不加血清的培养液)24 h后换成含10%胎牛血清的培养液培养12 h, 加入BITC(40和80 μmol/L)处理24 h后, 收集细胞, 按测定Caspase3活性检测试剂盒的操作说明裂解细胞, 提取蛋白质. 考马斯亮蓝法测定蛋白含量, 蛋白质浓度调整到2-3 mg/mL, 把相同蛋白量加到96孔平底酶标板, 每组设3个平行孔, 然后按照要求加入相应的反应底物、提取的蛋白、酶活性抑制物等, 充分混匀, 避光置于37 ℃保温6 h, 在波长405 nm测光密度(A)的改变.
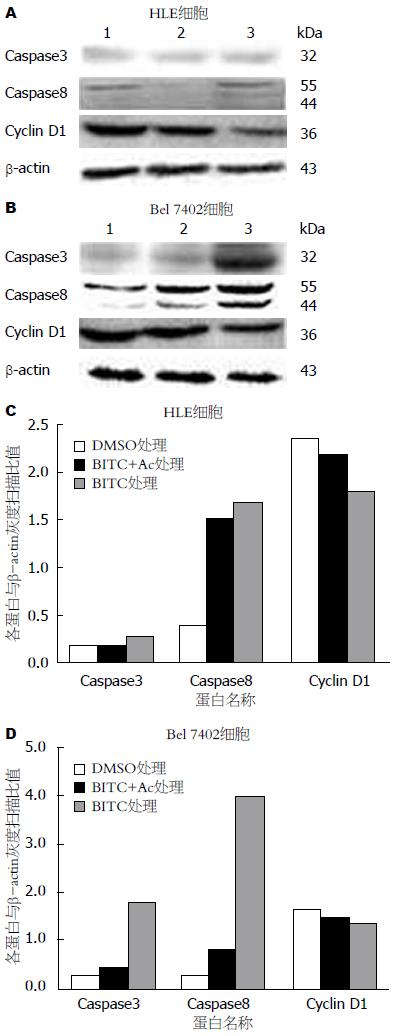
1.2.5 Western blot检测细胞周期相关蛋白及细胞凋亡相关蛋白的表达: 人肝癌细胞Bel 7402和HLE按1.0×105个/mL, 培养于33 cm2培养瓶中, 每组设3个平行瓶, 每瓶5 mL, 待细胞长到70%-80%融合, 饥饿细胞(不加血清的培养液)24 h后换成含10%胎牛血清的培养液培养12 h, 加入BITC(40 μmol/L和80 μmol/L)处理24 h后, 收集并裂解细胞, 提取细胞蛋白质, 行聚丙烯酰胺凝胶电泳(SDS-PAGE), 转膜, 加入一抗在4 ℃轻轻混合12 h, 用辣根过氧化物酶标记的羊抗鼠或羊抗兔的二抗在室温轻轻摇动2 h后, 用发光显影法(Western blot Luminol Reagent)检测Caspase3、Caspase8、Cyclin D1和β-actin蛋白的表达, 并用化学发光/荧光仪拍摄杂交蛋白质条带. 详细方法按文献[14]进行.
统计学处理 所有数据采用SPSS11.5统计软件用t检验方法进行分析, 数据的表示为mean±SD, P<0.05为差异有统计学意义.
为检测BITC是否对肝癌细胞HLE和Bel 7402的细胞增殖有影响, 我们用不同浓度的BITC处理HLE和Bel 7402细胞并进行MTT检测. 结果如图1所示, BITC作用于肝癌细胞时, 对细胞增殖的抑制作用具有浓度依赖性, 作用相同的时间(24 h), 随药物浓度的增加, 细胞存活率逐渐下降. 当BITC浓度为40 μmol/L时HLE和Bel 7402细胞存活率均受到显著性抑制(HLE细胞生长率为71.56%, Bel 7402细胞生长率为78.09%), 当BITC浓度为80 μmol/L时HLE和Bel 7402生长率均受到更显著抑制(分别为32.91%和53.06%). 光镜下观察显示, 当浓度为80 μmol/L时, 肝癌细胞几乎都皱缩成圆形, 大部分漂浮于培养基上层, 仅有少部分贴壁. 作为空白对照的DMSO对HLE和Bel 7402细胞的增殖和存活率均没有影响, 而BITC对正常肝细胞L02的生长率无明显影响, 细胞生长状态良好. 这些结果显示BITC对人肝癌细胞生长具有明显的抑制作用, 且对HLE的抑制作用比对Bel 7402的抑制作用更显著, 但对人正常肝细胞的生长则没有明显的抑制作用.
为检测BITC诱导HLE、Bel 7402细胞死亡是否具有凋亡的形态特征, 我们用不同浓度的BITC处理HLE、Bel7402细胞后进行DAPI染色. 结果如图2所示. 经BITC处理HLE、Bel 7402细胞24 h后, 随着作用浓度的增加, HLE、Bel 7402细胞呈现出显著的形态学变化, 细胞皱缩、变圆、体积变小, 细胞核断裂, 并有凋亡小体的产生, 当BITC浓度为80 μmol/L时, HLE、Bel 7402细胞的形态变化最显著. Caspase3抑制剂和BITC共同作用细胞后, HLE、Bel 7402细胞的形态变化较未加抑制剂的细胞的形态变化小. 加入DMSO为对照的HLE、Bel 7402细胞以及加入BITC的L02细胞, 其细胞形态和核结构完整, 未见有细胞凋亡的形态. 这些结果表明, BITC能够诱导HLE、Bel 7402细胞的凋亡, 而对人正常肝细胞L02则没有明显作用(图2).
为进一步检测BITC诱导细胞凋亡是否通过Caspase途径, 我们检测了不同浓度BITC及抑制剂处理HLE、Bel 7402细胞后Caspase3的活性的改变. 结果如图3所示, 随着药物浓度的升高, 细胞中Caspase3的活性也逐渐增强, 而在Caspase抑制剂处理的细胞中, BTIC诱导的Caspase3酶活性比单独用BITC处理的细胞中的酶活性较低, 而比DMSO单独处理(对照)的细胞中的酶活性又偏高, 有统计学意义(P<0.05). BITC诱导的HLE细胞和Bel 7402的Caspase3酶活性之间也有极显著的差异(P<0.01). BITC处理HLE细胞和Bel 7402细胞24 h后, HLE细胞的Caspase3酶活性升高程度明显高于Bel 7402细胞的Caspase3酶活性(图3C). 这些结果表明, BITC诱导肝癌细胞凋亡至少部分地通过Caspase3途径; BITC诱导HLE Caspase3酶活性升高比对诱导Bel 7402 Caspase3酶活性升高程度更显著.
为检测BITC诱导细胞凋亡引起的蛋白表达的变化, 我们用不同浓度BITC作用于HLE, Bel 7402细胞24 h后提取总蛋白并对Caspase3、Caspase8、Cyclin D1等蛋白进行了Western blot分析. 结果如图4所示. 与对照组相比, BITC作用后, 对于HLE细胞Caspase3的表达没有显著性改变, 但却能明显的促进Caspase8的断裂(从酶原变成有活性的酶), 而对Cyclin D1的表达则有明显的抑制作用; 对于Bel 7402细胞, BITC作用后, 不仅能显著性诱导Caspase3的表达, 而且也能促进Caspase8断裂和抑制Cyclin D1表达, 这些改变随着BITC浓度增加而有逐渐上升趋势. 与BITC单独作用细胞相比较, Caspase3抑制剂和BITC共同处理的HLE, Bel 7402细胞后, 能有效的抑制BITC对细胞诱导Caspase8的表达和断裂以及对细胞Cyclin D1蛋白表达降低的影响. 以上结果说明BITC可能部分地通过Caspase3或8的途径诱导肝癌细胞凋亡.
ITCs是主要存在于十字花科植物中的一类天然活性成分, 其具有防癌、抗癌、抗氧化、免疫调节、抗炎、抗高血压、抗辐射、抗菌等多种药理作用[15,16]. 目前, 已有20余种天然和人工合成的ITCs被鉴定为致癌作用的有效抑制剂. 据文献[17]报道, 番木瓜科植物(carica papaya)中BITC含量很丰富, 可以在各个组织中检测到, 但成熟果肉中含量较低, 而以种子含量最高. 我们的研究证实从番木瓜种子中提取的BITC具有诱导肝癌细胞HLE和Bel 7402细胞凋亡的作用. 从MTT法测定细胞生长率到DAPI染色法观察细胞形态, 均从不同侧面反映BITC具有诱导肝癌细胞凋亡, 抑制肝癌细胞生长的作用, 且表现出明显的剂量依赖性.
Caspases是在凋亡执行中起关键作用的半胱氨酸蛋白酶, 多种化疗和化学预防制剂被证明通过介导Caspases而引起凋亡性细胞死亡[18,19]. 例如, Yu等[20]首次用一种BITC的结构类似物-PITC处理的HeLa细胞后, 观察到Caspase3活性被诱导. Caspase3是Caspase信号途径诱导凋亡的执行者, 他的活化能通过剪切重要的蛋白如PARP[18,19]而系统地摧毁细胞. 尽管细胞凋亡的通路包括线粒体通路, 死亡受体通路和内质网通路, 但这三条通路最后都存在Caspases的激活[21-24], 这说明Caspases是诸多调控通路的关键. 我们的研究也证实, 在BITC诱导的肝癌细胞凋亡中, Caspase3的酶活性均有升高, 且酶活性部分地受到Caspase3抑制剂的抑制作用. 这表明BITC至少部分地通过Caspase3途径诱导肝癌细胞凋亡. 在本研究过程中, 令我们感到惊讶的是, BITC作用后, 对于HLE细胞, 能提升Caspase3的活性, 但是对该蛋白的表达没有显著性影响, 提示蛋白酶的表达量不能代表酶活性的改变; 而对于Bel 7402细胞, BITC不仅能提升Caspase3的活性, 而且也能促进Caspase3的表达以及Caspase8的断裂, 显示BITC对诱导不同肝癌细胞系的凋亡侧重于不同Caspases酶系. 我们前期研究显示, Bel 7402细胞表达甲胎蛋白(alpha fetoprotein, AFP), 而HLE细胞则不表达AFP, AFP能选择性抑制Caspase3的活性, 从而抗通过Caspase3途径诱导细胞凋亡的药物作用[24], 沉默AFP基因能诱导Caspase3的表达并能促进肝癌细胞凋亡[25,26], 这些结果提示, AFP存在是肝癌细胞抗凋亡的一个重要的因素. 本研究结果显示, HLE细胞在BITC作用后, 其对BITC敏感性高于Bel 7402细胞, 我们推测这可能与Bel 7402细胞表达AFP有密切的相关性.
肿瘤的增殖异常主要是由于细胞周期相关机制的调控失衡所致. 细胞周期是在一系列检验点的严格检控下进行的, 主要的检验点包括: Gl/S检验点、S期检验点、G2/M检验点和中-后期检验点. 当DNA发生损伤, 复制不完全或纺锤体形成不正常时, 周期将被阻断. 在已存在的细胞周期复合物添加外在的细胞周期调节子可能会阻断癌症的发生或发展. 相同的ITC可能会以细胞株依赖的方式诱导细胞在不同的周期停滞, 如G0/G1期或G2/M期, 而BITC在G1期和G2/M期都能引起阻滞[27]. Cyclin D1是调控细胞周期G1期的关键蛋白[28], 对细胞周期调控至关重要, 其主要功能是促进细胞增殖. 多项研究[29-32]表明在外来细胞周期调控因子诱导的G1期阻滞中Cyclin D1的表达明显降低. 我们的研究也证实, 在BITC诱导的肝癌细胞中, Cyclin D1的表达有所降低. 这表明BITC除了能通过Caspase途径诱导肝癌细胞凋亡, 还能通过诱导细胞周期阻滞而抑制细胞增殖. 本研究结果显示, BITC能诱导肝癌细胞凋亡, 但是对正常肝细胞的生长没有抑制作用, 提示BITC是一种新的有效治疗肝癌的药物.
肝癌是常见恶性肿瘤, 但目前没有良好的药物治疗方法, 寻找理想的药物治疗是本领域研究的重点和热点之一. 近年研究发现, 异硫氰酸苄酯(benzyl isothiocyanate, BITC)除了具有优越的对肿瘤发生有预防作用外, 还具有较好的抗肿瘤作用. 所以研究BITC抗肝癌细胞生长有重要的科学意义.
郭俊明, 教授, 宁波大学医学院生物化学与分子生物学研究所
研究表明BITC对前列腺癌、乳腺癌、宫颈癌、肺癌、胰腺癌和卵巢癌等肿瘤细胞系均具有较好的抗肿瘤作用, 其机制主要与阻滞细胞周期, 抑制细胞增殖, 诱导肿瘤细胞凋亡以及抑制肿瘤转移等有关, 但具体机制仍需进一步研究.
Hwang等研究表明BITC通过抑制MAPK激酶导致基质金属蛋白酶-2/-9(MMP-2/ -9)表达下调从而抑制肝癌细胞SK-Hep1生长, 但BITC是否能诱导肝癌细胞凋亡及凋亡的机制如何尚未有报道.
BITC对多种肿瘤细胞系具有较好的抗肿瘤作用, 但其对肝癌细胞的作用研究报道较少, 以肝癌细胞Bel 7402和HLE作为其作用对象是本研究的创新之一; 研究BITC对肝癌细胞增殖和凋亡及其可能分子机制是本研究的另一个创新之处.
本研究证实BITC能够诱导肝癌细胞凋亡以及抑制细胞周期进展, 这为将来BITC应用于肝癌的临床治疗奠定了一定的基础.
研究内容较新颖, 在国内尚未查到BITC对肝癌细胞作用的相关文献, 具有一定的指导意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Rossetto MR, Oliveira do Nascimento JR, Purgatto E, Fabi JP, Lajolo FM, Cordenunsi BR. Benzylglucosinolate, benzylisothiocyanate, and myrosinase activity in papaya fruit during development and ripening. J Agric Food Chem. 2008;56:9592-9599. [PubMed] [DOI] |
| 2. | Chung EL. Chemoprevention of lung cancer by isothiocyanates and their conjugates in A/J mouse. Exp Lung Res. 2001;27:319-330. [PubMed] |
| 3. | Barceló S, Macé K, Pfeifer AM, Chipman JK. Production of DNA strand breaks by N-nitrosodimethylamine and 2-amino-3-methylimidazo[4,5-f]quinoline in THLE cells expressing human CYP isoenzymes and inhibition by sulforaphane. Mutat Res. 1998;402:111-120. [PubMed] |
| 4. | Basu A, Haldar S. Dietary isothiocyanate mediated apoptosis of human cancer cells is associated with Bcl-xL phosphorylation. Int J Oncol. 2008;33:657-663. [PubMed] |
| 5. | Xiao D, Powolny AA, Singh SV. Benzyl isothiocyanate targets mitochondrial respiratory chain to trigger reactive oxygen species-dependent apoptosis in human breast cancer cells. J Biol Chem. 2008;283:30151-30163. [PubMed] [DOI] |
| 6. | Kim EJ, Eom SJ, Hong JE, Lee JY, Choi MS, Park JH. Benzyl isothiocyanate inhibits basal and hepatocyte growth factor-stimulated migration of breast cancer cells. Mol Cell Biochem. 2012;359:431-440. [PubMed] [DOI] |
| 7. | Miyoshi N, Watanabe E, Osawa T, Okuhira M, Murata Y, Ohshima H, Nakamura Y. ATP depletion alters the mode of cell death induced by benzyl isothiocyanate. Biochim Biophys Acta. 2008;1782:566-573. [PubMed] [DOI] |
| 8. | Mi L, Gan N, Cheema A, Dakshanamurthy S, Wang X, Yang DC, Chung FL. Cancer preventive isothiocyanates induce selective degradation of cellular alpha- and beta-tubulins by proteasomes. J Biol Chem. 2009;284:17039-17051. [PubMed] [DOI] |
| 9. | Yan H, Zhu Y, Liu B, Wu H, Li Y, Wu X, Zhou Q, Xu K. Mitogen-activated protein kinase mediates the apoptosis of highly metastatic human non-small cell lung cancer cells induced by isothiocyanates. Br J Nutr. 2011;106:1779-1791. [PubMed] [DOI] |
| 10. | Srivastava SK, Singh SV. Cell cycle arrest, apoptosis induction and inhibition of nuclear factor kappa B activation in anti-proliferative activity of benzyl isothiocyanate against human pancreatic cancer cells. Carcinogenesis. 2004;25:1701-1709. [PubMed] [DOI] |
| 11. | Boreddy SR, Pramanik KC, Srivastava SK. Pancreatic tumor suppression by benzyl isothiocyanate is associated with inhibition of PI3K/AKT/FOXO pathway. Clin Cancer Res. 2011;17:1784-1795. [PubMed] [DOI] |
| 12. | Ohara M, Kimura S, Tanaka A, Ohnishi K, Okayasu R, Kubota N. Benzyl isothiocyanate sensitizes human pancreatic cancer cells to radiation by inducing apoptosis. Int J Mol Med. 2011;28:1043-1047. [PubMed] [DOI] |
| 13. | Kalkunte S, Swamy N, Dizon DS, Brard L. Benzyl isothiocyanate (BITC) induces apoptosis in ovarian cancer cells in vitro. J Exp Ther Oncol. 2006;5:287-300. [PubMed] |
| 14. | Sambrook J, Fritsch E F, Maniatis T. Molecular cloning: A laboratory manual. 2nd. New York: Cold Spring Harbor Laboratory Press 1989; 888-897. |
| 15. | Keum YS, Jeong WS, Kong AN. Chemoprevention by isothiocyanates and their underlying molecular signaling mechanisms. Mutat Res. 2004;555:191-202. [PubMed] [DOI] |
| 16. | Talalay P, Fahey JW. Phytochemicals from cruciferous plants protect against cancer by modulating carcinogen metabolism. J Nutr. 2001;131:3027S-3033S. [PubMed] |
| 17. | Nakamura Y, Yoshimoto M, Murata Y, Shimoishi Y, Asai Y, Park EY, Sato K, Nakamura Y. Papaya seed represents a rich source of biologically active isothiocyanate. J Agric Food Chem. 2007;55:4407-4413. [PubMed] [DOI] |
| 18. | Earnshaw WC, Martins LM, Kaufmann SH. Mammalian caspases: structure, activation, substrates, and functions during apoptosis. Annu Rev Biochem. 1999;68:383-424. [PubMed] [DOI] |
| 20. | Yu R, Mandlekar S, Harvey KJ, Ucker DS, Kong AN. Chemopreventive isothiocyanates induce apoptosis and caspase-3-like protease activity. Cancer Res. 1998;58:402-408. [PubMed] |
| 21. | Chen J, Li HM, Zhang XN, Xiong CM, Ruan JL. Dioscin-induced apoptosis of human LNCaP prostate carcinoma cells through activation of caspase-3 and modulation of Bcl-2 protein family. J Huazhong Univ Sci Technolog Med Sci. 2014;34:125-130. [PubMed] [DOI] |
| 22. | Xia T, Wang JC, Xu W, Xu LH, Lao CH, Ye QX, Fang JP. 20S-Ginsenoside Rh2 induces apoptosis in human Leukaemia Reh cells through mitochondrial signaling pathways. Biol Pharm Bull. 2014;37:248-254. [PubMed] |
| 23. | Zhou J, Luo YH, Wang JR, Lu BB, Wang KM, Tian Y. Gambogenic acid induction of apoptosis in a breast cancer cell line. Asian Pac J Cancer Prev. 2013;14:7601-7605. [PubMed] |
| 24. | Li M, Li H, Li C, Zhou S, Guo L, Liu H, Jiang W, Liu X, Li P, McNutt MA. Alpha fetoprotein is a novel protein-binding partner for caspase-3 and blocks the apoptotic signaling pathway in human hepatoma cells. Int J Cancer. 2009;124:2845-2854. [PubMed] [DOI] |
| 25. | Zhang L, He T, Cui H, Wang Y, Huang C, Han F. Effects of AFP gene silencing on apoptosis and proliferation of a hepatocellular carcinoma cell line. Discov Med. 2012;14:115-124. [PubMed] |
| 26. | Yang X, Zhang Y, Zhang L, Zhang L, Mao J. Silencing alpha-fetoprotein expression induces growth arrest and apoptosis in human hepatocellular cancer cell. Cancer Lett. 2008;271:281-293. [PubMed] [DOI] |
| 27. | Zhang Y, Tang L, Gonzalez V. Selected isothiocyanates rapidly induce growth inhibition of cancer cells. Mol Cancer Ther. 2003;2:1045-1052. [PubMed] |
| 28. | Guo L, Xue TY, Xu W, Gao JZ. Matrine promotes G0/G1 arrest and down-regulates cyclin D1 expression in human rhabdomyosarcoma cells. Panminerva Med. 2013;55:291-296. [PubMed] |
| 29. | Leu WJ, Chang HS, Chan SH, Hsu JL, Yu CC, Hsu LC, Chen IS, Guh JH. Reevesioside A, a cardenolide glycoside, induces anticancer activity against human hormone-refractory prostate cancers through suppression of c-myc expression and induction of G1 arrest of the cell cycle. PLoS One. 2014;9:e87323. [PubMed] [DOI] |
| 30. | Liang X, Wang P, Gao Q, Tao X. Exogenous activation of LKB1/AMPK signaling induces G₁ arrest in cells with endogenous LKB1 expression. Mol Med Rep. 2014;9:1019-1024. [PubMed] [DOI] |
| 31. | Xu WS, Li T, Wu GS, Dang YY, Hao WH, Chen XP, Lu JJ, Wang YT. Effects of furanodiene on 95-D lung cancer cells: apoptosis, autophagy and G1 phase cell cycle arrest. Am J Chin Med. 2014;42:243-255. [PubMed] [DOI] |
| 32. | Zhang S, Cheng B, Li H, Xu W, Zhai B, Pan S, Wang L, Liu M, Sun X. Matrine inhibits proliferation and induces apoptosis of human colon cancer LoVo cells by inactivating Akt pathway. Mol Biol Rep. 2014;41:2101-2108. [PubMed] [DOI] |