修回日期: 2014-04-18
接受日期: 2014-04-24
在线出版日期: 2014-06-08
目的: 探讨DC-CIK细胞治疗联合肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)及射频消融(radiofrequency ablation, RFA)治疗小肝癌(small hepatic carcinoma, SHCC)的临床效果及免疫状态变化.
方法: 2008-03/2012-03本院收治SHCC患者85例, 纳入对象分为2组, 所有患者均先行TACE联合RFA治疗. 其中研究组41例, 术后7 d均完成6次DC-CIK细胞治疗, 每次回输细胞>1×1010, 检测患者在DC-CIK治疗前后外周血甲胎蛋白(alpha fetoprotein, AFP)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、T细胞及NK细胞水平变化; 对照组44例, 未行DC-CIK过继性免疫治疗.
结果: 对照组A组治疗前 vs 治疗后AFP均值为494.5 mg/L±51.3 mg/L vs 226.5 mg/L±39.4 mg/L, P<0.05; 研究组B组治疗前 vs 治疗后AFP均值为486.4 mg/L±54.8 mg/L vs 168.7 mg/L±49.5 mg/L, P<0.01. B组ALT、AST治疗前 vs 治疗后为66 U/L±6.3 U/L、68 U/L±7.7 U/L vs 31 U/L±5.9 U/L、45 U/L±3.7 U/L, P<0.05; 对照组为67 U/L±7.4 U/L、63 U/L±4.5 U/L vs 65 U/L±6.2 U/L、61 U/L±5.2 U/L, P>0.05. 治疗后6 mo影像学检查B组 vs A组有效率分别为87.80% vs 79.54%, P<0.05. B组vs A组1、2、3年生存率分别为95.1%, 71.6%, 68.3% vs 90.9%, 65.9%, 59.1%, P<0.05. B组治疗后外周血CD3+、CD16+CD56+和CD4+/CD8+细胞比值均上升(P<0.05), CD8+效应细胞比例下降(P<0.05).
结论: DC-CIK细胞治疗序贯TACE联合RFA治疗可改善SHCC患者术后肝功能, 提高患者免疫水平, 降低肿瘤复发, 延长SHCC患者生存期.
核心提示: 综合治疗已经成为小肝癌(small hepatic carcinoma, SHCC)治疗的首选, DC-CIK细胞治疗序贯动脉化疗栓塞(transcatheter arterial chemoembolization)联合射频消融(radiofrequency ablation)治疗明显不仅直接作用于肿瘤, 且直接清除体内残存的HCC细胞, 同时改善肝功能, 提高患者术后机体免疫功能, 较单一治疗延长患者生存期, 改善生活质量, 减缓复发, 显示出综合治疗在SHCC治疗中的良好前景.
引文著录: 张泉成, 潘国政, 李国强, 袁庆忠, 徐教邦, 孔阳, 王立明. DC-CIK细胞治疗联合TACE及RFA治疗小肝癌的疗效. 世界华人消化杂志 2014; 22(16): 2237-2242
Revised: April 18, 2014
Accepted: April 24, 2014
Published online: June 8, 2014
AIM: To evaluate the efficacy of dendritic and cytokine-induced killer cell therapy (DC-CIK) after transcatheter arterial chemoembolization combined with radiofrequency ablation in patients with small hepatocellular carcinoma (SHCC) and to investigate the changes in immunologic indexes in patients with SHCC.
METHODS: Eighty-five patients with SHCC treated at our hospital from April 2008 to April 2012 were recruited and divided into two groups after transcatheter arterial chemoembolization (TACE) and radiofrequency ablation (RFA): a study group and a control group. The study group (n = 41) received DC-CIK therapy 6 times 7 days after TACE and RFA, and the number of DC-CIK cells was above 1.0×1010. The control group (n = 44) only received TACE and RFA.
RESULTS: AFP differed significantly between before and after treatment in both the control group (494.5 mg/L ± 51.3 mg/L vs 226.5 mg/L ± 39.4 mg/L, P < 0.05) and the study group (486.4 mg/L ± 54.8 mg/L vs 168.7 mg/L ± 49.5 mg/L, P < 0.01). ALT and AST differed significantly between before and after treatment in the study group (66 U/L ± 6.3 U/L vs 31 U/L ± 5.9 U/L, 68 U/L ± 7.7 U/L vs 45 U/L ± 3.7 U/L, P < 0.05 for both), but showed no significant differences in the control group (67 U/L ± 7.4 U/L vs 65 U/L ± 6.2 U/L, 63 U/L ± 4.5 U/L vs 61 U/L ± 5.2 U/L, P > 0.05 for both). The efficacy evaluated by imaging examination in the study group was better than that in the control group (87.80% vs 79.54%, P < 0.05). The 1-, 2- and 3-year survival rates were significantly better in the study group than in the control group (95.1% vs 90.9%, 71.6% vs 65.9%, 68.3% vs 59.1%, P < 0.05 for all). The percentages of CD3+ and CD16+CD56+ cells and the ratio of CD4+/CD8+ cells were significantly increased after DC-CIK therapy (P < 0.05 for all), while the percentage of CD8+ cells was decreased in the study group (P < 0.05).
CONCLUSION: Sequential DC-CIK therapy after TACE and RFA can improve hepatic function and immune function of patients with SHCC, and may play an important role in reducing recurrence of SHCC and prolonging the survival time.
- Citation: Zhang QC, Pan GZ, Li GQ, Yuan QZ, Xu JB, Kong Y, Wang LM. DC-CIK cell therapy combined with transcatheter arterial chemoembolization and radiofrequency ablation for treatment of small hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(16): 2237-2242
- URL: https://www.wjgnet.com/1009-3079/full/v22/i16/2237.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i16.2237
原发性肝癌(hepatic carcinoma, HCC)因其病情发展快、预后差、术后存活率低, 已成为消化道疾病中致死率最高的原因之一. 外科手术一直是小肝癌(small hepatic carcinoma, SHCC)首选治疗手段, 但HCC患者多合并肝炎、肝硬化, 患者肝功能分级较差, 免疫力低, 手术创伤大, 适应症严格, 所以手术切除的SHCC患者不足30%, 并且术后复发率高[1]. 目前肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)、射频消融(radiofrequency ablation, RFA)、微波固化消融及生物治疗是SHCC最常用的非手术疗法, 但任何一种单一治疗方法对SHCC的远期治疗效果都不理想, 综合治疗成为SHCC的首选[2,3]. TACE联合RFA治疗能较有效的使肿瘤坏死, 同时控制肿瘤的局部进展及复发[4]. DC-CIK过继性免疫治疗能较有效地改善患者术后免疫功能, 预防肿瘤复发及转移, 延长患者生存期、改善患者生存质量[5]. 目前对DC-CIK细胞治疗、TACE、RFA三种方式联合治疗SHCC的临床疗效研究较少, 其实用性及安全性尚待验证. 本研究是对DC-CIK、TACE、RFA三种治疗方式联合治疗SHCC安全性及疗效的初步分析, 为今后多中心大规模临床试验提供依据.
2008-03/2012-03胜利油田中心医院肝胆外与肿瘤科收治HCC癌患者85例, 将纳入对象分为2组, 其中对照组A组(TACE+RAF)44例, 研究组B组(DC-CIK+TACE+RAF)41例, 两组患者一般资料比较无统计学意义(P>0.05), 具有可比性. 纳入标准: (1)既往乙型肝炎病史; (2)增强CT符合SHCC诊断且为富血供肿瘤, 即: 肿瘤数目≤3个, 单一瘤体≤5 cm或多个肿瘤体积之和≤5 cm3; (3)无门静脉、腔静脉或胆管癌栓; (4)肿瘤临床分期Ⅰ-Ⅱ期; (5)肝功能Child-Pugh分级A级或B级; (6)年龄在36-75岁, Karnofsky评分≥70分; (7)治疗前血常规、肾功能及心电图均正常; (8)无DC-CIK生物治疗、行TACE及RFA治疗的禁忌; (9)预期生存期>3 mo. 排除标准: (1)不可控制的系统性疾病如: 高血压、心脏病史; (2)此前或现在有其他部位的恶性肿瘤; (3)2 mo内接受过放化疗或影响免疫功能药物; (4)不稳定的免疫系统或感染性疾病. 本研究经过胜利油田中心医院伦理委员会的审核与批准. 所有患者在入组前均在治疗同意协议书上亲笔签字. 主要试剂包括: 抗CD3-PE、抗CD4-PE、抗CD16-PE、抗CD56-PE、抗CD8-PE(均为美国BD公司产品).
1.2.1 治疗方案: 85例患者均行TACE联合RFA治疗, TACE注射化疗药物方案为: 顺铂(dichlorodiamineplatinum, DDP)40-80 mg、氟尿嘧啶(5-fluorouracil, 5-FU)750-1000 mg、丝裂霉素(mitomycin, MMC)20 mg或表阿霉素(epirubicin, EADM)40-60 mg、超液化碘油5-20 mL. RFA每个病灶消融12 min, 消融至肿瘤边缘1 cm. B组采集自身外周血, 分离培养DC与CIK细胞, 检测细胞表型, 分别于RFA术后1 wk回输, 连用6次, 每次分别输入DC及CIK细胞各1×1010.
1.2.2 疗效评价标准: (1)临床疗效: 随访两组患者, 治疗后1 mo复查血浆甲胎蛋白(alpha fetoprotein, AFP)及肝功能指标, 如谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)变化, 治疗后6 mo复查腹部CT、MRI或 PET/CT, 评价肿瘤标志物、肝功能及肿瘤大小变化. 按RECIST对实体瘤疗效判定标准: 完全缓解(complete remission, CR); 部分缓解(partial remission, PR); 稳定(steady disease, SD); 进展(progressive disease, PD), 有效为 CR+PR; (2)生活质量: 用Karnofsky计分法统计, 治疗后较治疗前提高>10分为改善, 下降>10分为恶化, 提高或下降10分以内为稳定, 总提高率 = 改善+稳定; (3)外周血淋巴细胞亚群分析: 患者治疗前1 wk及治疗后1 mo后外周血淋巴细胞表型分析用流失细胞仪检测.
统计学处理 用SPSS13.0软件包进行数据的统计处理. 计量资料用mean±SD表示, 组间比较采用t检验, 组内比较采用配对t检验; 率和构成比的比较采用χ2检验, 生存率分析用Kaplan-Meier法, 生存时间比较采用Log-rank检验. 检验水准α = 0.05. P<0.05为差异有统计学意义.
A组AFP异常者41例, 治疗后41例患者中AFP经治疗下降者39例, 2例降至正常; B组41例中AFP异常者40例, 40例经治疗后均下降, 其中降至正常4例.
A组治疗前AFP均值为494.5 mg/L±51.3 mg/L, 治疗后为226.5 mg/L±39.4 mg/L, P<0.05; B组治疗前AFP均值为486.4 mg/L±54.8 mg/L, 治疗后为168.7 mg/L±49.5 mg/L, P<0.01.
治疗结束后6 mo, 两组均行CT或/和MRI或/和PET-CT检查, 根据治疗前后影像学的变化判断肿瘤的坏死程度, 经统计学分析, A组完全缓解率、稳定率及有效率分别为: 50.0%、29.5%、79.5%, B组分别为: 73.1%、14.6%、87.8%, A组完全缓解率、稳定率及有效率均高于B组, 其差异有统计学意义(P<0.05)(表1).
| 分组 | n | CR | PR | SD | PD |
| A组 | 44 | 22 | 13 | 6 | 3 |
| B组 | 41 | 30 | 6 | 3 | 1 |
A组术后ALT、AST无明显下降, 肝功能无明显变化, B组治疗后ALT、AST下降明显, 肝功明显好转(表2).
B组Karnofsky评分提高率68.3%, 高于A组50.0%, 两组比较, B组生活质量改善明显(P<0.05)(表3).
B组治疗T细胞亚群CD3+、CD4+、CD4+/CD8+比值及NK(CD3+CD56+)显著上升, CD8+下降, 治疗前后差异有统计学意义(P<0.05); 与A组治疗后比较, 差异也有统计学意义(P<0.05)(表4).
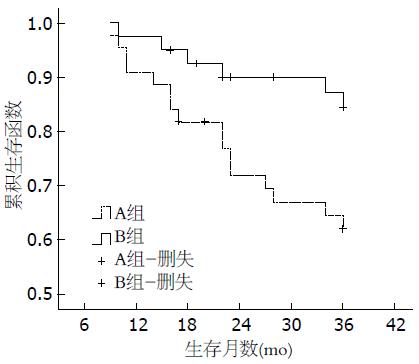
A、B两组生存时间相比, 研究组B组生存时间明显高于对照组A组, 研究组B组1、2、3年生存率分别为95.1%、71.6%、68.3%, 对照组1、2、3年生存率分别为90.9%、65.9%、59.1%, 研究组生存率高于对照组, 差异有统计学意义(P<0.05)(图1).
TACE联合RFA治疗已成为SHCC主要治疗模式之一. 肝TACE的理论基础是栓塞HCC中心部分是肝动脉供血(占HCC供血95%-99%), 而未栓塞由门静脉供血的肝实质交界的部分[6]. 这些特点导致TACE后侧支循环开放及新生血管形成, 造成癌灶的残存、继续发展和肝内转移, 因此单纯TACE治疗不能使肿瘤细胞完全坏死(完全坏死率只有20%左右)[7]. 患者多伴发肝炎、肝硬化背景, TACE可加重肝硬化, 导致部分患者最后死于严重肝硬化及免疫功能下降等并发症[8,9]. RFA利用恶性肿瘤细胞不耐热特点, 局部加温至肿瘤细胞变性, 细胞崩解, 有效杀灭直径<3 cm的HCC[10,11]. 但对于部位不易消融的病灶, 如邻近膈肌、肝门部大血管或胆管及肝被膜的病灶, 联合TACE可明显增加局部控制率, 减少肿瘤原位复发, 延长患者生存期[12-14]. 肝TACE术后联合RFA治疗SHCC将有利于发挥各自的优点, 提高疗效: (1)RFA在对肿瘤加热时, 瘤内及瘤周的血液循环可起到冷却作用, TACE可减少HCC组织的血供, 减少血流的冷却作用[15]; (2)TACE阻断肝血供, 化疗药物杀伤肿瘤, 缩小肿瘤体积, 同时使SHCC局部坏死, 形成一个乏氧环境, 增加其余肿瘤细胞对热的敏感性, 提高RFA的治疗效果. 同时RFA的热效应增加肿瘤组织对化疗药物的摄取及其敏感性[16,17]; (3)RFA后细胞坏死刺激炎症因子形成, 可暂时增强机体局部和全身的细胞免疫功能, 帮助消灭残存癌细胞[18]; (4)TACE可发现术前影像学检查难以发现的肝内微小病灶, 特别是小的病变由于碘油沉积, 对肝内潜在的病灶也可起到治疗作用, 并且有利于方便定位和实施消融治疗[19]. 本研究85例患者术前影像学检查, 常规行肝TACE术明确肝内病灶103个, TACE术中新发现较小病灶11个, 与前期报道相符. 行TACE术2-8 wk后再行RFA治疗, 可明显缓解HCC患者TACE造成的肝功能一过性损伤. 虽然RFA证实可部分改善HCC患者免疫功能, 但Mizukoshi等[20]报道RFA术后24 wk, 大多数患者肿瘤相关抗原特性性T淋巴细胞比例下降, 表明RFA并不能诱导T细胞长期存活. 本研究证明TACE联合RFA并不能完全改善TACE术后及肝硬化引起的肝功能及免疫功能损害, 患者治疗前1 wk及治疗后1 mo患者肝功能指标(ALT、AST)无明显降低, 外周血T淋巴细胞亚群及NK细胞无明显升高. 而DC-CIK序贯治疗, 可明显改善患者肝功能, 其原因部分可能与HCC患者免疫功能改善相关.
我国HCC的主要病因多是乙型肝炎病毒感染合并不同程度肝硬化, 患者自身免疫机制紊乱, 存在细胞免疫抑制, CD3+、CD4+ T效应细胞较正常低, CD8+效应细胞水平增加明显, 且与HCC临床分期相关, 行TACE后又进一步加重患者原有免疫抑制[21]. DC和CIK细胞是患者外周血单个核细胞体外经过多重细胞因子共同诱导获得的一群以CD3+、CD8+和CD3+CD56+ T细胞为主的异质细胞群, 前者识别抗原、激活获得性免疫系统, 后者通过发挥自身细胞毒性和分泌细胞因子杀伤肿瘤细胞, 是肿瘤免疫治疗的两个重要部分[22]. 其兼具有T淋巴细胞强大的抗肿瘤活性和NK非MHC限制性杀瘤作用, 且体内外增殖能力强, 是一类杀瘤活性高和杀瘤谱广的一类新型抗肿瘤效应细胞, 两者联合确保了一个高效和谐的免疫体系[23]. 本研究41例患者在TACE联合RFA术后7 d时输入DC-CIK细胞, 可明显改善患者因术后及肝硬化造成的免疫功能缺陷, 同时在清除微小残留病灶, 预防肿瘤复发方面及提高肿瘤患者的生存率方面也发挥着重要作用. 研究组CD3+、CD4+、CD16+CD56+ T效应细胞升高, CD8+ T效应细胞下降, CD4+/CD8+ T细胞升高, 患者免疫功能改善明显. 两组患者治疗后6 mo评估临床疗效, 研究组缓解率87.8%, 高于对照组79.5%, 说明DC-CIK细胞治疗在清除小病灶及预防肿瘤复发方面发挥作用显著. 本研究表明, 联合治疗可明显改善患者远期生存率, 研究组1、2、3年生存率分别为95.1%、71.6%、68.3%, 均高于对照组. DC-CIK明显改善SHCC患者行TACE联合RFA后预后, 其机制可能有与以下几个方面有关: (1)通过淋巴细胞功能相关抗原-1/细胞间黏附分子-1(intercellular adhesion molecule-1/lymphocyte function association antigen-1, LFA-1/ICAM-1)途径与肿瘤细胞表面受体结合后, 分泌BIL酯酶颗粒, 直接杀伤肿瘤细胞[24,25]; (2)分泌大量的白介素-2、干扰素-γ炎性因子, 其为CD4+或CD8+细胞产生的同源二聚体糖蛋白, 可通过多种途径直接或间接发挥抗肿瘤作用[26,27]; (3)DC-CIK细胞活化肿瘤细胞凋亡基因, 使得FLIP、Bcl-2、Bcl-Xl、DAD1和survivin基因表达上调, 诱导肿瘤细胞凋亡, 同时CIK细胞表达FasL, 可诱导肿瘤细胞凋亡[28,29]; (4)CD3+CD56+ T细胞在输注DC-CIK细胞后在宿主体内转变成具有杀伤肿瘤活性的细胞毒性T细胞[30].
DC-CIK序贯TACE联合RFA治疗既能直接作用于瘤体, 又能直接清除体内残存HCC细胞, 还能提高患者术后机体整体免疫功能, 提高患者肝功能, 改善HCC患者生活质量, 延长生存期, 减缓复发, 显示了联合治疗SHCC的良好前景. 但DC-CIK细胞过继免疫疗法作为一种新免疫治疗方法, 尚缺乏大规模的前瞻性随机试验数据及长期的疗效观察, 没有统一的治疗标准和方案, 其作用机制及不良反应都有待进一步研究.
因小肝癌(small hepatic carcinoma, SHCC)患者多合并肝硬化, 肝功能差, 手术切除SHCC率较低, 且复发率高. 肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)、射频消融(radiofrequency ablation, RFA)、微波固化消融及生物治疗等综合治疗成为首选. 目前对DC-CIK细胞治疗、TACE、RFA三种方式联合治疗SHCC的临床疗效研究较少, 其实用性及安全性尚待验证.
孙星, 副教授, 副主任医师, 上海交通大学附属第一人民医院普外科
DC-CIK细胞治疗联合TACE及RFA治疗SHCC的实用性及安全性尚待验证, 目前对其联合治疗研究较少, 对联合治疗是否可提高患者生存率及改善生活质量尚不确定, 对其具体机制研究尚不清楚.
此前, TACE联合RFA治疗肝癌证实其联合治疗方案既可协助发现影像学检查难以发现的肝内微小病灶, 同时通过阻断肿瘤动脉血供, 化疗药物杀伤及对肿瘤的直接加热等途径杀伤肿瘤细胞. 而DC-CIK细胞被证实可明显改善患者免疫功能, 激活肿瘤坏死因子. 本文联合DC-CIK细胞治疗, TACE及RFA治疗, 证实联合方案通过直接及间接手段杀伤肿瘤细胞, 改善患者长期预后.
本文验证了肝癌综合治疗的可靠性及实用性, 证实综合治疗较单一治疗手段明显改善患者生活质量, 提高远期SHCC患者生存率. 同时, 通过探讨术后患者甲胎蛋白(alpha fetoprotein, AFP)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)及免疫细胞水平变化, 对综合治疗机制进行了探讨.
本文证实DC-CIK序贯TACE联合RFA治疗既能直接作用于瘤体, 又能直接清除体内残存HCC细胞, 还能提高患者术后机体整体免疫功能, 提高患者肝功能, 改善HCC患者生活质量, 延长生存期, 减缓复发, 显示联合治疗SHCC良好前景.
文章有一定的临床指导意义与实用价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Wu FS, Zhao WH, Liang TB, Ma ZM, Teng LS, Wang M, Zheng SS. Survival factors after resection of small hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2005;4:379-384. [PubMed] |
| 2. | Shen A, Zhang H, Tang C, Chen Y, Wang Y, Zhang C, Wu Z. Systematic review of radiofrequency ablation versus percutaneous ethanol injection for small hepatocellular carcinoma up to 3 cm. J Gastroenterol Hepatol. 2013;28:793-800. [PubMed] [DOI] |
| 3. | 卢 琳琳, 曹 茜, 潘 洋. 微波消融联合自体CIK细胞治疗中晚期肝癌的临床疗效分析. 中国慢性病预防与控制. 2013;3:353-355. |
| 4. | Min JH, Lee MW, Cha DI, Jeon YH, Shin SW, Cho SK, Rhim H, Lim HK. Radiofrequency ablation combined with chemoembolization for intermediate-sized (3-5 cm) hepatocellular carcinomas under dual guidance of biplane fluoroscopy and ultrasonography. Korean J Radiol. 2013;14:248-258. [PubMed] [DOI] |
| 5. | Li H, Wang C, Yu J, Cao S, Wei F, Zhang W, Han Y, Ren XB. Dendritic cell-activated cytokine-induced killer cells enhance the anti-tumor effect of chemotherapy on non-small cell lung cancer in patients after surgery. Cytotherapy. 2009;11:1076-1083. [PubMed] [DOI] |
| 6. | Marelli L, Stigliano R, Triantos C, Senzolo M, Cholongitas E, Davies N, Tibballs J, Meyer T, Patch DW, Burroughs AK. Transarterial therapy for hepatocellular carcinoma: which technique is more effective? A systematic review of cohort and randomized studies. Cardiovasc Intervent Radiol. 2007;30:6-25. [PubMed] [DOI] |
| 8. | Miyayama S, Yamashiro M, Okuda M, Yoshie Y, Nakashima Y, Ikeno H, Orito N, Matsui O. The march of extrahepatic collaterals: analysis of blood supply to hepatocellular carcinoma located in the bare area of the liver after chemoembolization. Cardiovasc Intervent Radiol. 2010;33:513-522. [PubMed] [DOI] |
| 9. | Xiao EH, Guo D, Bian DJ. Effect of preoperative transcatheter arterial chemoembolization on angiogenesis of hepatocellular carcinoma cells. World J Gastroenterol. 2009;15:4582-4586. [PubMed] [DOI] |
| 10. | Abitabile P, Maurer CA. Radiofrequency ablation of liver tumors: a novel needle perfusion technique enhances efficiency. J Surg Res. 2010;159:532-537. [PubMed] [DOI] |
| 12. | Lin SM. Local ablation for hepatocellular carcinoma in Taiwan: different points between Japan, Asia and West. Oncology. 2010;78 Suppl 1:102-106. [PubMed] [DOI] |
| 13. | Kim JW, Kim JH, Won HJ, Shin YM, Yoon HK, Sung KB, Kim PN. Hepatocellular carcinomas 2-3 cm in diameter: transarterial chemoembolization plus radiofrequency ablation vs. radiofrequency ablation alone. Eur J Radiol. 2012;81:e189-e193. [PubMed] [DOI] |
| 15. | 董 永生, 张 震翼, 杨 小岗. 肝动脉化疗栓塞联合射频消融治疗打肝癌的临床疗效. 中国现代普通外科进展. 2013;6:486-488. |
| 17. | Chan WS, Poon WL, Cho DH, Chiu SS, Luk SH. Transcatheter embolisation of intrahepatic arteriovenous shunts in patients with hepatocellular carcinoma. Hong Kong Med J. 2010;16:48-55. [PubMed] |
| 18. | Peng ZW, Zhang YJ, Chen MS, Xu L, Liang HH, Lin XJ, Guo RP, Zhang YQ, Lau WY. Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma: a prospective randomized trial. J Clin Oncol. 2013;31:426-432. [PubMed] [DOI] |
| 19. | Hou YB, Chen MH, Yan K, Wu JY, Yang W. Adjuvant percutaneous radiofrequency ablation of feeding artery of hepatocellular carcinoma before treatment. World J Gastroenterol. 2009;15:2638-2643. [PubMed] [DOI] |
| 20. | Mizukoshi E, Yamashita T, Arai K, Sunagozaka H, Ueda T, Arihara F, Kagaya T, Yamashita T, Fushimi K, Kaneko S. Enhancement of tumor-associated antigen-specific T cell responses by radiofrequency ablation of hepatocellular carcinoma. Hepatology. 2013;57:1448-1457. [PubMed] [DOI] |
| 21. | Hui D, Qiang L, Jian W, Ti Z, Da-Lu K. A randomized, controlled trial of postoperative adjuvant cytokine-induced killer cells immunotherapy after radical resection of hepatocellular carcinoma. Dig Liver Dis. 2009;41:36-41. [PubMed] [DOI] |
| 22. | Chen J, Huang X, Huang G, Chen Y, Chen L, Song H. Preconditioning chemotherapy with cisplatin enhances the antitumor activity of cytokine-induced killer cells in a murine melanoma model. Cancer Biother Radiopharm. 2012;27:210-220. [PubMed] [DOI] |
| 23. | Sangiolo D, Mesiano G, Carnevale-Schianca F, Piacibello W, Aglietta M, Cignetti A. Cytokine induced killer cells as adoptive immunotherapy strategy to augment graft versus tumor after hematopoietic cell transplantation. Expert Opin Biol Ther. 2009;9:831-840. [PubMed] [DOI] |
| 24. | Huang B, Sikorski R, Sampath P, Thorne SH. Modulation of NKG2D-ligand cell surface expression enhances immune cell therapy of cancer. J Immunother. 2011;34:289-296. [PubMed] [DOI] |
| 26. | Su X, Zhang L, Jin L, Ye J, Guan Z, Chen R, Guo T. Immunotherapy with cytokine-induced killer cells in metastatic renal cell carcinoma. Cancer Biother Radiopharm. 2010;25:465-470. [PubMed] [DOI] |
| 27. | Lin G, Wang J, Lao X, Wang J, Li L, Li S, Zhang J, Dong Y, Chang AE, Li Q. Interleukin-6 inhibits regulatory T cells and improves the proliferation and cytotoxic activity of cytokine-induced killer cells. J Immunother. 2012;35:337-343. [PubMed] |