修回日期: 2014-03-30
接受日期: 2014-04-09
在线出版日期: 2014-05-28
目的: 探讨三维重建技术在精准肝切除治疗原发性肝癌中的临床应用价值.
方法: 我院引进3D虚拟手术规划系统(IQQA-Liver), 可临床应用于精准肝切除. 本研究分别收集并统计了应用三维重建技术治疗原发性肝癌前手术临床资料53例, 应用后临床资料39例, 作为A、B两组. A组的手术是医院在引进三维重建技术之前实施的, 手术设计、规划和具体实施是基于传统的二维影像资料. 本研究统计和分析了A组术中、术后情况诸如手术时间、出血量、并发症等, 并与B组相关数据比较; B组分别应用二维和三维方法测量肝脏总体积、预切除体积等, 并根据三维重建技术术前评估得出的切除方式进行手术.
结果: (1)根据对A、B两组术后并发症情况统计分析, B组术后并发症情况少于A组, 但无明显差异, 说明实施三维重建技术行精准肝切除术至少不会比二维术前规划结果差; (2)B组二维计算的切除肝体积和三维计算的数据无显著差异(t = 1.985, P>0.05).
结论: 三维重建技术可以实现精准肝切除术确定性、预见性和可控性的目标.
核心提示: 实施三维重建技术行精准肝切除术, 术后并发症, 诸如胸腔积液胆漏、肺部感染、伤口感染等以及术中实际情况如术中出血量和手术时间等出现的概率少于传统二维规划, 并且二维计算的切除肝体积和三维计算的数据无显著差异.
引文著录: 王松平, 李建生, 马金良, 荚卫东, 葛勇胜, 余继海. 三维重建技术在精准肝切除中的临床应用. 世界华人消化杂志 2014; 22(15): 2169-2174
Revised: March 30, 2014
Accepted: April 9, 2014
Published online: May 28, 2014
AIM: To explore the clinical application of three-dimensional reconstruction in precise hepatectomy for primary liver cancer.
METHODS: 3D virtual surgical planning system (IQQA-Liver) can be applied clinically to precise hepatectomy. Fifty-three patients with primary liver cancer who did not undergo three-dimensional reconstruction (group A) and 39 who underwent three-dimensional reconstruction (group B) were included. The design, planning and implementation of the operation were based on the traditional two-dimensional image data in group A. Intraoperative and postoperative conditions such as operative time, blood loss and complications were analyzed and compared with those in group B. In group B, two-dimensional and three-dimensional measures were used to measure total liver volume and pre-cut volume, and the operation was performed based on preoperative assessments using three-dimensional reconstruction technology.
RESULTS: The rate of complications in group B was lower than that in group A, but there was no significant difference. The results of precision hepatectomy based on three-dimensional reconstruction data were not worse than those on two-dimensional preoperative data. No significant difference (t = 1.985, P > 0.05) was found in the resected liver volume calculated based on three-dimensional reconstruction data and on two-dimensional reconstruction data.
CONCLUSION: Three-dimensional reconstruction can help achieve the goals of certainty, predictability and controllability of precise hepatectomy.
- Citation: Wang SP, Li JS, Ma JL, Jia WD, Ge YS, Yu JH. Clinical application of three-dimensional reconstruction in precise hepatectomy. Shijie Huaren Xiaohua Zazhi 2014; 22(15): 2169-2174
- URL: https://www.wjgnet.com/1009-3079/full/v22/i15/2169.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i15.2169
原发性肝癌(primar liver cancer)是指在肝细胞或肝内胆管上皮细胞发生的恶性肿瘤, 其患者一般已进入肝硬化阶段[1]. 尽管科学研究已证实, 肝脏移植是治疗原发性肝癌的最理想方案[2,3], 但是肝脏供源的短缺以及高昂的手术成本等因素严重制约了其在临床的实际应用. 肝移植术发展的桎梏给治疗原发性肝癌的另一大重要技术-肝切除术, 提供了良好的发展契机[4]. 根据董家鸿提出的精准肝切除概念, 精确的术前评估、计算残肝体积和残肝储备功能是避免术后肝功能衰竭, 提高术后生存率, 最终保证手术成功的重要助力. 但如何在精准计算切除肿瘤的体积和尽可能地保留剩余肝组织二者之间进行有效的选择, 是临床应用的两难问题[5]. 传统的二维断层MRI、CT等影像扫描, 以及肝功能的半定量检查评估并不能对病灶的解剖定位、肝内脉管结构的毗邻关系以及残肝体积等提供精准量化的立体构象分析, 术中超声虽然在一定程度上提高了肝切除的精准性, 但在离断肝实质时仍旧无法从不同方位定位. 因此, 能够提供更加精确的剩余肝脏体积和虚拟仿真肝切除手术的三维重建技术应运而生, 他的大力发展和临床应用为减少术后肝功能衰竭、确保肝切除手术安全性和精确性提供了保证[6].
本研究参照相关标准收集并统计了我院应用三维重建技术前行肝切除术的原发性肝癌患者手术临床资料53例, 应用后资料39例, 作为A、B两组. 本研究仅对A组术中、术后情况诸如手术时间、出血量、并发症等进行统计分析, 并与B组相关数据对比; B组则分别应用二维和三维测量肝脏总体积、预切除体积等, 并根据三维重建技术术前评估得出的切除方式行肝切除术. 其中B组病患三维重建技术是在传统二维影像数据的基础上进行, 显示病灶以及肝内各管道的立体构象, 并进行量化分析, 模拟实施肝切除术, 根据实时得出的残肝体积计算剩余肝脏的储备功能, 选择最佳方案进行手术. 通过两组手术结果的对比、验证, 探讨、评价三维重建技术在精准肝切除治疗原发性肝癌中的临床应用价值, 以及对二维手术规划的影响.
纳入本研究的原发性肝癌患者共计92例, 其中男69例, 女23例; 肝细胞癌77例, 肝内胆管细胞癌15例; 应用三维重建技术前实施手术的53例, 应用后实施的39例. 92例病患年龄跨度大致是40-60岁, 平均年龄46岁. 本研究排除不同影响因素可能对手术结果产生的影响, 其中肝功能严重受损、病灶过大、切除后剩余肝脏不能良好代偿(剩余肝脏体积不足标准肝脏体积的30%)从而很可能导致急性肝功能衰竭的肝癌患者剔除研究样本[7].
此外, 考虑到多发病灶的出现是疾病晚期的证据, 单个肿瘤的患者5年生存率可达57%, 而3个或更多肿瘤患者仅为26%这一因素, 同时也为突出二维和三维的手术规划效果, 本研究全部选择了单一病灶的患者[8]. 患者术前肝功能均为Child-Pugh A级[9], 无明显门静脉高压征象, 吲哚氰绿染色剂15 min滞留率<10%.
1.2.1 肝脏三维重建: 首先, 对B组39例患者以多层螺旋CT行上腹部平扫和三期增强扫描, 层厚1.25-1.50 mm, 将B组获得的二维图像按顺序导入美国EDDA公司的计算机辅助手术规划系统进行三维重建, 并在此基础上进行虚拟手术的规划. 其次, 系统自动根据肝脏静脉期全部影像轮廓将其从周围脏器中提取出来, 操作者可以适当手工分割, 系统会实时生成肝脏的相关信息, 包括病灶信息、肝内管道的空间分布、管径、长度、变异、肿瘤与肝脏管道结构的毗邻关系、剩余肝脏的血管结构和拟切断的重要血管结构等. 最后, 根据肝区分割功能对肝脏进行分段, 完成B组所有病患的三维重建, 构建清晰的三维立体透视影像.
1.2.2 肝脏体积测算: B组首先基于二维断层影像和患者的身高、体质量等基本信息计算肝脏体积和评估残肝体积. 然后在二维图像的基础上重建三维立体影像, 根据不同的虚拟切割方式, 系统自动得出肿瘤体积、预切除肝脏体积、肝段体积、剩余肝脏中的缺血、淤血体积等数据, 选择最佳的手术方式, 通过比较B组不同手术规划的手术结果, 比较三维和二维手术规划的情况以及三维手术术前规划与三维实际手术结果的相关性.
1.2.3 手术设计: A组为应用三维重建技术前53例符合条件的样本. 查阅、收集历史资料, 包括手术时间、术中出血量[10]以及术后并发症随访记录结果. B组基于三维重建技术的手术规划行肝切除术, 记录术中实际手术时间、出血量等情况, 并术后随访12 mo, 平均随访10 mo, 记录并发症结果并与A组对比研究. B组的二维手术规划只在二维影像资料的基础上, 确定目标病灶的边界, 根据肝区或肝段间隙的标志性结构在二维影像上划定拟切除线, 根据体质量、身高确定必要的切除范围和要保留的体积以及肝实质离断层面.
此外, B组通过三维重建技术, 明确病灶与肝脏内各管道的关系, 参考全肝体积、肿瘤体积等二维数据, 确定需切除的目标病灶累及的病变肝组织及病灶切除后结构和功能可能会遭到损毁的非病变肝组织, 可以模拟多种手术切除方案. 对于正常肝实质, 剩余具有功能的肝脏体积要求大于标准肝脏体积的30%; 对于存在明显纤维化或肝硬化的患者, 其剩余具有功能的肝脏体积要求大于标准肝脏体积的40%. 因此, 在必要切除范围和必需保留范围之间的肝脏可切除范围的基础上, 考虑足够的无肿瘤切边缘, 最大程度地保留功能性肝组织. 并结合各种可选择手术方式的难度、风险和安全性, 选择最佳的虚拟手术切除方案. 利用软件中的空间切割工具, 顺沿缺乏脉管结构的区段间隙, 进行虚拟切割, 并自动得出预切除肝脏体积、剩余肝脏体积、肝段体积、剩余肝脏中的缺血、淤血体积等各项数据. 在此基础上, 将其应用于B组39例患者, 将三维方法切除肝脏体积结果和二维结果相对照, 分析相关性和差异性.
统计学处理 本文应用SPSS12.0统计软件进行分析. 三维方法切除肝脏体积与二维方法切除肝脏体积之间的差异分析采用配对t检验, 两者之间的相关性采用Pearson相关分析, 误差率的比较采用r检验. P<0.05为差异有统计学意义.
B组内, 二维方法计算的预切除肝脏体积与采用三维方法计算的结果比较, 差异无统计学意义(t = 1.985, P>0.05). 三维方法计算切除肝脏体积与术后实际切除肝脏质量统计学中具有相关性(r = 0.999, P<0.05)(表1).
| 测量方式 | 切除部分体积(cm3) | 剩余肝脏体积/全肝体积(%) |
| 二维 | 532±229 | 59.60±12.11 |
| 三维 | 568±245 | 58.34±11.25 |
| 术后实际 | 574±238 | 60.08±12.07 |
A组是我院引进三维重建技术前, 按照二维手术规划的结果实施的53例肝切除样本. 通过查阅历史资料统计术后并发症等情况. B组样本39例, 按照三维重建技术手术规划最佳方案行精准肝切除术. 对B组39例患者术后随访12 mo, 平均随访10 mo. 两组术后并发症统计包括术中死亡率、有无术后肝功能损害、切口感染、胸腔积液等[11], 统计结果如表2.
| 术后并发症 | A组 | B组 | ||
| n | % | n | % | |
| n | 53 | 39.0 | ||
| 胸腔积液 | 8 | 15.1 | 3 | 7.7 |
| 胆漏 | 1 | 1.9 | 0 | 0.0 |
| 肺部感染 | 3 | 5.7 | 1 | 2.6 |
| 切口感染 | 2 | 3.8 | 1 | 2.6 |
| 肝功能衰竭 | 1 | 1.9 | 0 | 0.0 |
| 肿瘤复发率 | 40.5%(15/37) | 8.6%(3/35) | ||
| 1年生存率 | 78.3%(29/37) | 91.4%(32/35) | ||
结果显示, A组出现8例胸腔积液、1例胆漏、3例肺部感染、1例肝功能衰竭. 53例样本中37例获得随访统计结果, 肿瘤复发率40.5%, 1年生存率78.3%. B组3例病患术后出现并发症, 经保守治疗痊愈. 39例样本中35例获得随访结果, 肿瘤复发率8.6%, 1年生存率91.4%. B组术后并发症发生的概率基本小于A组, 但是差异并不明显. 92例样本量的对比结果显示, 利用三维重建技术术前规划, 术后并发症出现的概率低于二维术前规划, 但无明显差异.
此外, B组20例手术患者术中平均出血约330 mL, 平均术后住院天数8 d, 平均手术时间193 min, 未实施肝门阻断. A组手术患者术中平均出血约431 mL, 平均术后住院10 d, 平均手术时间125 min, 实施肝门阻断, 平均阻断时间19 min(表3)两组术中出血量、手术时间以及术后住院天数等参数无明显差异. 实施三维重建技术行精准肝切除术至少不会比二维术前规划结果差.
| 其他术中以及术后基本情况 | A组(应用三维技术前) | B组(应用三维技术后) |
| 平均出血量(mL) | 431 | 330 |
| 平均术后住院天数(d) | 10 | 8 |
| 平均手术时间(min) | 125 | 193 |
| 肝门阻断 | ||
| 是否肝门阻断 | 是 | 否 |
| 平均阻断时间(min) | 19 | 0 |
这里选取了B组中二维和三维评估结果有所不同的两个病例进行研究.
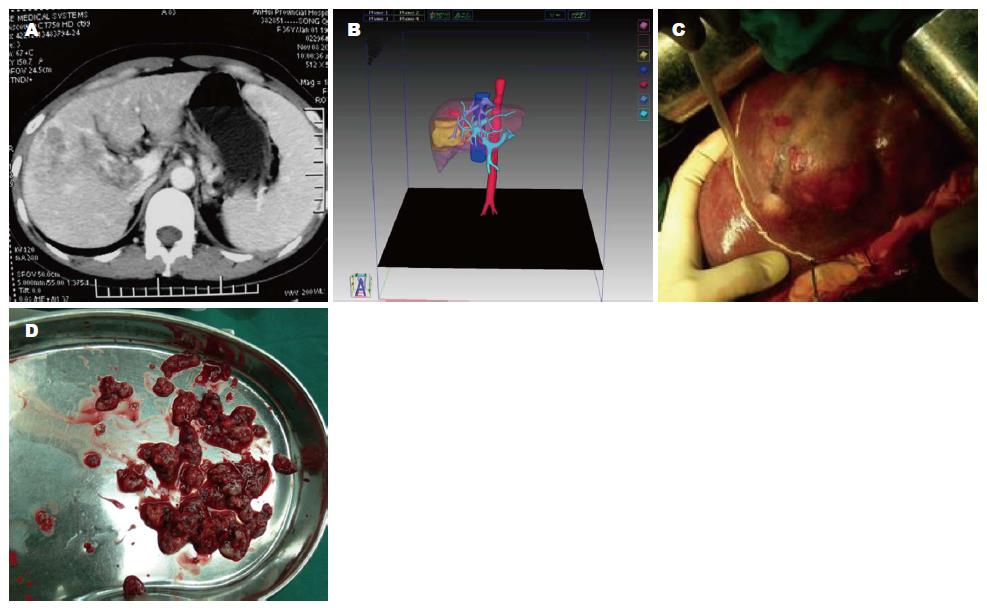
病例1, 男, 年龄51岁, 肝细胞癌. 根据二维影像评估结果显示, 肿瘤为单一病灶, 位于肝中叶, 拟从肿瘤部位进行局部切除手术, 但由于病灶切缘不清, 应用三维重建技术后, 采用虚拟手术模拟多种切除方式, 病灶位于第八段, 由第八段背侧支供血, 为充分切除肿瘤, 拟行解剖性八段切除术并门静脉切开取栓, 并保证剩余肝脏体积能够达到正常肝储备功能, 手术采用该方案并取得了成功(图1).
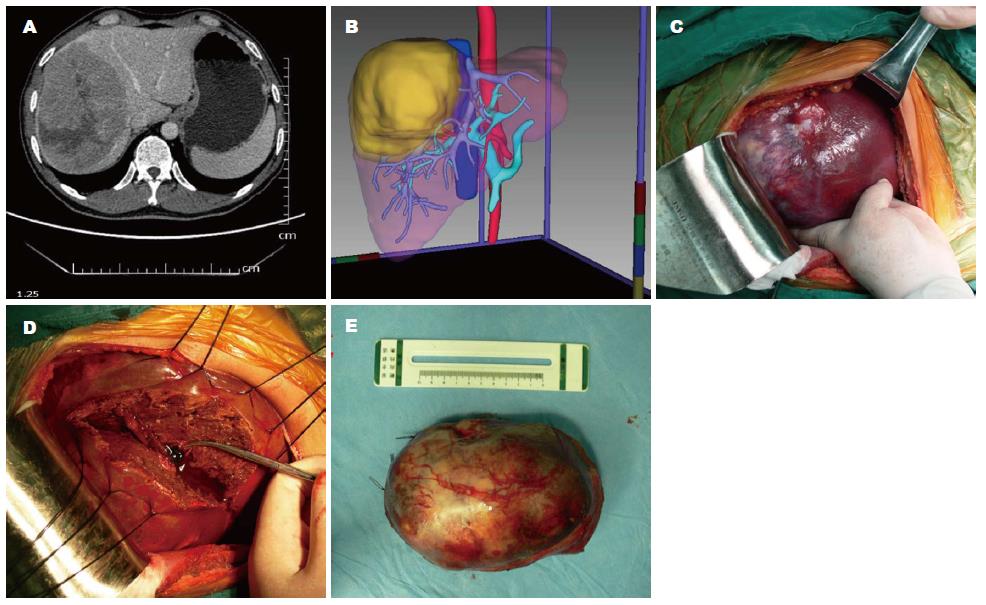
病例2, 男, 年龄48岁, 为巨块型肿瘤, 肿瘤位于右半肝, 拟行右三区切除术, 但计算的剩余肝脏体积仅为498 mL, 功能肝切除率过大, 二维手术设计规划结果是不宜行肝切除术. 而根据二维影像重建的三维模型中显示病灶位于肝脏的Ⅶ、Ⅷ段, 部分Ⅴ、Ⅵ段, 无病灶区的左半肝和剩余Ⅴ、Ⅵ段的总体积占标准肝脏体积的62.5%, 可实现正常代偿. 因此, 在三维手术规划下改行精准Ⅴ、Ⅵ、Ⅶ、Ⅷ段局部切除, 手术取得成功(图2).
本研究结果证实, 利用二维方法计算的预切除肝脏体积与采用三维方法计算的结果比较, 差异无统计学意义(t = 1.985, P>0.05); 三维方法计算切除肝脏体积与术后实际切除肝脏质量统计学中具有相关性(r = 0.999, P<0.05); 在三维术前规划的结果实施手术无论是手术时间、术中出血量还是术后并发症出现的概率都好于在二维规划基础上实施的手术结果, 但是结果没有太大差异. 但是在实际临床应用中, 三维重建技术在治疗原发性肝癌中的优势非常明显. 三维图像视觉立体、直观、形态逼真, 免去了外科医生根据二维CT图像在脑海中进行复杂图像综合和空间想象过程. 通过系统自带的透明化处理, 可以从多角度旋转观察肿瘤的大小、定位、数目, 病灶累及范围和邻近脉管的毗邻关系等[12,13]. 通过对图像的处理, 实时计算模拟切除的肝脏体积、残肝体积, 根据预后风险分析在保证切缘安全的基础上避免过多的肝组织切除[14]. 对不同方案进行比较, 筛选出最佳方案, 应用于临床. 这种基于三维重建技术的术前评估和规划能够最大限度地减少不必要的组织损伤, 控制术中出血, 使患者达到最小创伤侵袭、最大脏器保护和最佳康复效果[15]. 但是由于时间、资源和能力等因素制约, 本研究还存在很多不足, 所选取的样本量也比较有限, 不能完全排除偶然因素的影响, 也不能完全代表所有可能的结果. 本研究仅仅是提供一种见解和想法, 希望对后来的研究有所启示.
利用精准肝切除术治疗原发性肝癌成为当前该领域临床治疗的首选. 随着计算机技术在医学的广泛应用, 三维重建技术应运而生, 它的大力发展和临床应用为减少术后肝功能衰竭、确保肝切除手术安全性和精确性提供了保证. 但是学术界对其实际临床价值是否显著优于传统二维术前规划, 仍然存在争议.
于则利, 教授, 首都医科大学附属北京同仁医院外科
如何利用三维技术在治疗原发性肝癌中行精准肝切除术, 探讨三维重建技术在临床实践中的应用价值, 即三维技术是否明显优于传统二维术前的规划.
首先, 本研究通过查阅、收集利用三维重建技术前即利用传统二维手术规划并行肝切除术的患者手术时间、术中出血量以及术后并发症等随访记录资料. 并与利用三维重建技术术前规划和术中切除的患者资料对比研究. 其次, 选取利用三维重建技术后的病患资料, 术前分别利用二维和三维计算预切除肝脏体积. 分析三维与传统二维技术的优劣.
医学应该充分利用当前科学技术的飞速发展所带来的契机. 在临床实践中, 更多借助三维技术行精准肝切除术, 根据预后风险分析在保证切缘安全的基础上避免过多的肝组织切除. 使患者达到最小创伤侵袭、最大脏器保护和最佳康复效果. 而不必过多依赖医生的经验和主观判断.
本文选题简明而有特色, 研究方法和技术较系统. 文章的科学性、创新性和可读性能较好地反映我国消化系外科临床和基础研究的先进水平.
编辑: 田滢 电编:鲁亚静
| 3. | 樊 嘉, 吴 志全, 汤 钊猷, 马 曾辰, 周 信达, 林 芷英, 叶 胜龙, 周 俭, 邱 双健, 钦 伦秀. 不同治疗模式对不能切除的肝癌二期手术预后的影响. 中华外科杂志. 2001;39:745-748. |
| 4. | Imamura H, Sano K, Sugawara Y, Kokudo N, Makuuchi M. Assessment of hepatic reserve for indication of hepatic resection: decision tree incorporating indocyanine green test. J Hepatobiliary Pancreat Surg. 2005;12:16-22. [PubMed] [DOI] |
| 5. | Garcea G, Ong SL, Maddern GJ. Predicting liver failure following major hepatectomy. Dig Liver Dis. 2009;41:798-806. [PubMed] [DOI] |
| 7. | Clavien PA, Petrowsky H, DeOliveira ML, Graf R. Strategies for safer liver surgery and partial liver transplantation. N Engl J Med. 2007;356:1545-1559. [PubMed] [DOI] |
| 8. | Farges O, Belghiti J, Kianmanesh R, Regimbeau JM, Santoro R, Vilgrain V, Denys A, Sauvanet A. Portal vein embolization before right hepatectomy: prospective clinical trial. Ann Surg. 2003;237:208-217. [PubMed] [DOI] |
| 9. | Belghiti J, Regimbeau JM, Durand F, Kianmanesh AR, Dondero F, Terris B, Sauvanet A, Farges O, Degos F. Resection of hepatocellular carcinoma: a European experience on 328 cases. Hepatogastroenterology. 2002;49:41-46. [PubMed] |
| 10. | Nagino M, Kamiya J, Arai T, Nishio H, Ebata T, Nimura Y. "Anatomic" right hepatic trisectionectomy (extended right hepatectomy) with caudate lobectomy for hilar cholangiocarcinoma. Ann Surg. 2006;243:28-32. [PubMed] [DOI] |
| 11. | 许 戈良, 荚 卫东, 李 建生, 马 金良, 刘 文斌, 葛 勇胜, 余 继海, 王 伟. 应用精细肝脏外科理念治疗原发性肝癌53例. 世界华人消化杂志. 2010;18:1824-1828. |
| 12. | Yamanaka J, Saito S, Fujimoto J. Impact of preoperative planning using virtual segmental volumetry on liver resection for hepatocellular carcinoma. World J Surg. 2007;31:1249-1255. [PubMed] [DOI] |
| 13. | Saito S, Yamanaka J, Miura K, Nakao N, Nagao T, Sugimoto T, Hirano T, Kuroda N, Iimuro Y, Fujimoto J. A novel 3D hepatectomy simulation based on liver circulation: application to liver resection and transplantation. Hepatology. 2005;41:1297-1304. [PubMed] [DOI] |
| 14. | Lang H, Radtke A, Hindennach M, Schroeder T, Frühauf NR, Malagó M, Bourquain H, Peitgen HO, Oldhafer KJ, Broelsch CE. Impact of virtual tumor resection and computer-assisted risk analysis on operation planning and intraoperative strategy in major hepatic resection. Arch Surg. 2005;140:629-38; discussion 638. [PubMed] [DOI] |