修回日期: 2014-03-20
接受日期: 2014-03-28
在线出版日期: 2014-05-18
目的: 观察磷脂酰肌醇-3激酶/蛋白激酶(phosphatidylinositol-3 kinase/Akt, PI3K/Akt)信号通路在CCl4诱导的肝纤维化大鼠肝组织中的变化并探讨中药汉丹肝乐对他的影响.
方法: 选取SD大鼠30只, 随机分为正常对照组、肝纤维化8 wk组及汉丹肝乐治疗组, 每组各10只. 肝纤维化组及汉丹肝乐治疗组大鼠按0.3 mL/100 g体质量的剂量皮下注射40%CCl4花生油溶液, 每隔3 d注射1次, 造模时间为8 wk; 对照组大鼠皮下注射等量花生油溶液. 造模结束后汉丹肝乐治疗组大鼠给予1.0 g/kg的汉丹肝乐灌胃治疗, 1次/d, 治疗时间为8 wk. HE染色观察肝组织病理学改变; 采用免疫组织化学技术及Western blot检测肝组织中PI3K/Akt信号通路中关键分子Akt1、磷酸化Akt1的表达变化, 同时应用TUNEL法检测肝星状细胞(hepatic stellate cells, HSC)凋亡情况.
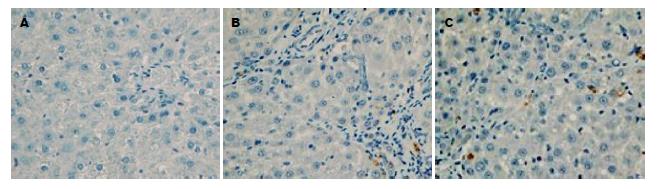
结果: 与正常对照组比较, 肝纤维化8 wk组大鼠肝组织中Akt1(2.73±0.52 vs 9.60±2.28, P<0.01)、磷酸化Akt1(0.92±0.40 vs 6.51±1.39, P<0.01)的表达均显著增加, 差异具有显著性; 经汉丹肝乐治疗后, 肝组织中Akt1(9.60±2.28 vs 5.36±1.59, P<0.01)、磷酸化Akt1(6.51±1.39 vs 2.08±0.85, P<0.01)的表达均显著下降; 同时, TUNEL法检测发现汉丹肝乐组大鼠肝组织中HSC凋亡率显著高于肝纤维化8 wk组(1.07±0.32 vs 4.24±0.86, P<0.01).
结论: PI3K/Akt信号通路在肝纤维化的发生发展过程中发挥重要作用, 而汉丹肝乐可通过抑制该信号通路, 促进HSC的凋亡来发挥抗肝纤维化的作用.
核心提示: 肝星状细胞(hepatic stellate cells, HSC)激活转化为肌成纤维细胞并大量分泌细胞外基质是肝纤维化发生发展的中心环节, 汉丹肝乐可通过抑制PI3K/Akt信号通路的激活, 促进HSC的凋亡来发挥抗肝纤维化的作用.
引文著录: 胡晓霞, 王艳, 王晋星一. 汉丹肝乐对大鼠肝纤维化PI3K/Akt信号通路的影响及意义. 世界华人消化杂志 2014; 22(14): 1915-1920
Revised: March 20, 2014
Accepted: March 28, 2014
Published online: May 18, 2014
AIM: To observe the change of the PI3K/Akt signaling pathway in CCl4 induced liver fibrosis and to explore the effect of Handan Ganle on this signaling pathway in hepatic fibrosis in rats.
METHODS: Thirty SD rats were randomly divided into a normal control group, a liver fibrosis group and a Handan Ganle treated group. The rats of the liver fibrosis group and Handan Ganle treated group were treated by hypodermic injection of 40% CCl4 at 0.3 mL/100 g body weight to induce hepatic fibrosis. Then, the rats in the Handan Ganle group were treated with 1.0 g/kg Handan Ganle once daily for 8 weeks. The expression of Akt1 and phospho-Akt1 was detected by immunohistochemistry and Western blot, and the apoptosis of HSCs was determined by TUNEL assay.
RESULTS: Compared with the normal control group, the expression of Akt1 (2.73 ± 0.52 vs 9.60 ± 2.28, P < 0.01) and phospho-Akt1 (0.92 ± 0.40 vs 6.51 ± 1.39, P < 0.01) in the liver fibrosis group was increased. Handan Ganle treatment decreased the levels of Akt1 (9.60 ± 2.28 vs 5.36 ± 1.59, P < 0.01) and phospho-Akt1 (6.51 ± 1.39 vs 2.08 ± 0.85, P < 0.01) but increased the apoptosis of HSCs (1.07 ± 0.32 vs 4.24 ± 0.86, P < 0.01).
CONCLUSION: The PI3K/Akt signaling pathway may play an important role in CCl4 induced liver fibrosis. Handan Ganle can suppress this signaling pathway and increase the apoptosis of HSCs, which might be related with its anti-hepatic fibrosis activity.
- Citation: Hu XX, Wang Y, Wang JXY. Handan Ganle inhibits PI3K/Akt signaling pathway in liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1915-1920
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1915.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1915
肝纤维化是多种慢性肝脏疾病向肝硬化发展的必经阶段, 其主要的病理特征是以胶原为主的细胞外基质过度增加而在肝脏内沉积[1-3]. 目前研究认为, 肝星状细胞(hepatic stellate cells, HSC)激活并转变为肌成纤维细胞, 同时分泌大量的细胞外基质是肝纤维化发生的中心环节[4]. PI3K/Akt信号通路是体内重要的信号转导通路之一, 他不仅在细胞代谢、增殖、存活等多种生物学过程中发挥关键作用, 同时也能够抑制细胞凋亡过程[5,6]. 汉丹肝乐是根据中医活血化瘀, 通络软坚的理论研制而成的中药复方制剂, 主要由丹参、赤芍、黄芪、银杏叶等组成, 既往研究表明该药可通过抗氧化损伤、促进细胞外基质降解以及促进HSC凋亡等途径对肝纤维化发挥一定的治疗作用[7,8], 但是其具体的药物作用靶点及作用机制尚不十分清楚. 本研究拟用CCl4复制大鼠肝纤维化动物模型, 观察各组大鼠肝组织中PI3K/Akt信号通路的变化, 探讨中药汉丹肝乐对该信号通路的影响及其对HSC凋亡的作用.
健康清洁级SD大鼠由贵阳医学院实验动物中心提供; 兔抗大鼠多克隆Akt1及p-Akt1抗体购自美国Santa Cruz公司; 免疫组织化学SABC试剂盒、DAB显色剂及TUNEL检测试剂盒均购自武汉博士德公司; 丙烯酰胺、三羟甲基氨基甲烷、十二烷基硫酸钠、过硫酸铵、甘氨酸均购自北京鼎国昌盛生物技术有限公司; PVDF膜及ECL化学发光试剂盒购自美国Millipore公司.
1.2.1 动物分组及动物模型复制: ♂SD大鼠30只, 体质量160-200 g, 在恒温(25 ℃)、光照周期12-12 h环境中适应性饲养1 wk后进行实验. 将实验动物随机分为3组: 正常对照组、肝纤维化8 wk组和汉丹肝乐治疗组, 每组各10只. 肝纤维化组及汉丹肝乐治疗组大鼠采用皮下注射40% CCl4花生油溶液诱导肝纤维化模型, 剂量为0.3 mL/100 g体质量, 每隔3 d注射1次, 造模时间为8 wk; 对照组大鼠皮下注射等量花生油溶液. 造模成功后汉丹肝乐治疗组大鼠给予1.0 g/kg的汉丹肝乐灌胃治疗[9], 1次/d, 治疗时间为8 wk. 大鼠处死前称体质量, 3%戊巴比妥钠0.1 mL/100 g腹腔麻醉后, 股动脉放血处死大鼠, 留取血液及全部肝脏, 每只大鼠取相同部位肝叶固定于4%中性甲醛溶液中, 48 h后, 转移到0.1 mol/L PBS溶液中保存, 剩余肝组织保存于-80 ℃低温冰箱保存.
1.2.2 实验指标的检测: (1)肝组织病理学检查: 每只大鼠取相同部位肝叶固定于4%中性甲醛溶液中, 然后肝组织经石蜡包埋, 常规组织切片及HE染色后在光学显微镜下观察肝组织的病理学改变; (2)血清生化指标检测: 血清丙氨酸转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(glutamic-oxalacetic transaminase, AST)采用日立7170A全自动生化分析仪测定; (3)肝组织免疫组织化学检测: 切片常规脱蜡水化, 3%H2O2封闭内源性过氧化物酶, 微波修复抗原, 加封闭液后, 滴加兔抗大鼠Akt1及p-Akt1多克隆抗体(工作浓度为1:100), 4 ℃过夜. 次日加生物素化羊抗兔IgG, 在37 ℃孵育30 min, 加SABC工作液, DAB显色, 苏木素复染. 阴性对照以PBS缓冲液代替一抗. 随机抽取5个高倍镜下视野, 观察阳性表达的定位及Akt1及p-Akt1阳性表达细胞数占细胞总数的百分比; (4)Western blot检测肝组织中Akt1及p-Akt1表达情况: 提取肝组织总蛋白, 经聚丙烯酰胺凝胶电泳分离蛋白质后, 采用半干电转移将蛋白质分子转移到PVDF膜上, 电转移结束后PVDF膜置于封闭缓冲液中室温下封闭1 h. 封闭完成后洗膜缓冲液洗膜3次, 然后将PVDF膜与一抗稀释液(1:500)4 ℃封闭过夜. 次日早上用洗膜缓冲液洗膜3次后, PVDF膜与二抗稀释液(1:1000)在室温下孵育1 h, 洗膜缓冲液洗膜3次后加入增强化学发光试剂A、B液各0.5 mL, 室温反应1 min后暗室中将PVDF膜迅速封入保鲜膜中, Kodak X-ray film压片, 放射自显影1 min. 然后进行显影、定影, 清水冲洗晾干; (5)TUNEL法检测细胞凋亡: 严格按照试剂盒说明书操作.
统计学处理 计量资料以mean±SD表示, 用SPSS13.0统计软件进行组间方差分析, P<0.05为差异有统计学意义.
从表1可知, 肝纤维化8 wk组大鼠血清中AST、ALT浓度较正常对照组大鼠明显增多; 经汉丹肝乐治疗后, 大鼠血清中AST、ALT浓度较肝纤维化组大鼠明显降低, 但仍未恢复到正常水平. 各组大鼠ALT及AST结果如表1.
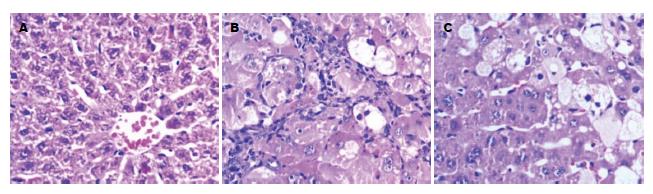
经HE染色后光镜下可见正常对照组大鼠肝细胞以中央静脉为中心呈放射状排列, 肝组织内未见细胞外基质沉积; 肝纤维化8 wk组大鼠肝小叶结构破坏, 肝索排列紊乱, 汇管区纤维结缔组织增生, 胶原纤维向肝实质延伸, 分割正常肝组织, 形成假小叶, 纤维化程度较正常组显著增加; 汉丹肝乐治疗组大鼠肝组织结构改善明显, 结缔组织增生显著减少, 各组大鼠肝脏病理学改变如图1.
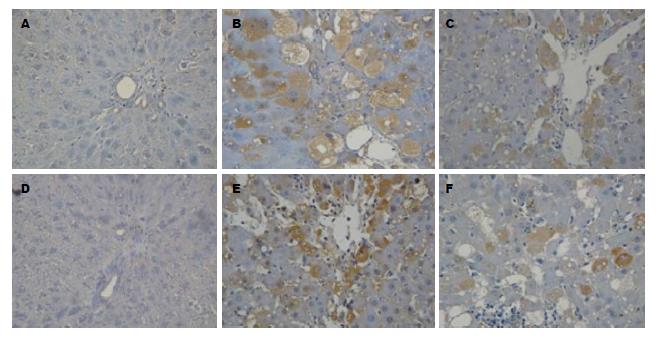
免疫组织化学结果显示: 正常对照组大鼠肝组织中仅有少量Akt1、磷酸化Akt1阳性表达, 肝纤维化8 wk时肝组织中Akt1、磷酸化Akt1阳性表达显著增多; 而汉丹肝乐组Akt1、磷酸化Akt1阳性表达较肝纤维化8 wk组显著减少. Akt1、磷酸化Akt1阳性表达呈棕黄色, 主要表达在肝细胞及间质细胞的胞浆中. 各组大鼠肝组织中Akt1、磷酸化Akt1表达情况如表2, 图2.
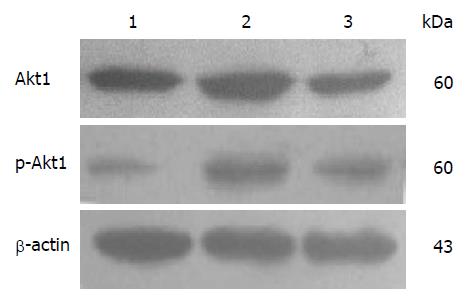
与正常对照组比较, 肝纤维化8 wk时, 大鼠肝组织中Akt1、磷酸化Akt1蛋白表达显著增高; 而经汉丹肝乐治疗后, 大鼠肝组织中Akt1、磷酸化Akt1蛋白表达较肝纤维化8 wk组显著减少. 各组大鼠肝组织中Akt1、磷酸化Akt1蛋白表达情况如图3, 表3.
肝纤维化是肝脏对各种慢性刺激进行损伤修复反应时, 以胶原为主的细胞外基质在肝脏内大量沉积的病理过程[10]. HSC是肝纤维化的主要效应细胞, 当各种慢性肝损伤因素作用于肝脏时, HSC可被激活并大量增殖, 同时合成、分泌细胞外基质等多种物质, 从而导致肝纤维化的发生[11-13]. PI3K/Akt是体内重要的信号转导通路之一, 在维持细胞的正常生理功能, 如生长、分化、代谢等方面起着关键作用[14-16]. 该信号通路中的PI3K是生长因子受体超家族信号转导过程中的重要成员, 在体内可被多种细胞因子激活. Akt为PKA和PKC家族成员, 是PI3K下游的直接靶蛋白, 而p-Akt是Akt的活化状态, 当Akt转变为p-Akt才能发挥生物学功能[17-19]. 近年来的多项研究表明, PI3K/Akt通路在 HSC增殖、凋亡中扮演重要角色[20-24]. Akt激活后能够使GSK-3β磷酸化并失活, 从而丧失诱导细胞凋亡的作用[25-27]; 同时p-Akt还可以抑制促凋亡蛋白Bad、Bax和Caspase的形成, 从而发挥抑制细胞凋亡的作用[28-31].
本次研究发现, 采用CCl4复制肝纤维化模型8 wk后, 大鼠血清中ALT、AST水平较正常对照组大鼠显著增高, 说明肝细胞发生了一定程度的损伤; 此外, 病理检查结果显示肝纤维化8 wk组大鼠肝组织内有大量胶原纤维增生, 肝纤维化程度较正常组大鼠明显增加. 上述结果与杜锡潮等[32]的研究结果一致, 提示我们的肝纤维化大鼠模型复制是成功的. 同时, 免疫组织化学及Western blot结果发现, 肝纤维化8 wk组大鼠肝组织中Akt1及p-Akt1的表达较正常对照组明显增加; 由于Akt是PI3K下游的效应分子, 因此我们推测PI3K/Akt信号通路的活化可能参与了肝纤维化的发生过程. Xiao等[22]在研究胆道闭锁所引起的肝纤维化时发现, miR-200b可通过激活PI3K/Akt信号通路, 促进HSC的增殖, 从而加速肝纤维化的发生和发展. 这说明PI3K/Akt信号通路可能在肝纤维化过程中发挥了重要作用, 而抑制这一信号通路的活化有可能成为抗肝纤维化的有效途径之一. 汉丹肝乐是根据中医活血化瘀, 通络软坚的理论研制而成的中药复方制剂, 以往的研究发现他可通过促进HSC凋亡而发挥抗肝纤维化的作用[33], 但其具体的作用机制尚不清楚. 在本次研究中发现, 经汉丹肝乐治疗8 wk后, 大鼠血清中ALT、AST水平及纤维化程度均较肝纤维化8 wk组明显减少; 同时, 我们还发现, 汉丹肝乐组大鼠肝组织中Akt1及p-Akt1的表达与肝纤维化8 wk组比较明显降低, 而肝组织中HSC的凋亡则较肝纤维化8 wk组显著增加. 由于Akt1激活及p-Akt1增加可抑制细胞凋亡过程, 而相反Akt1及p-Akt1表达下调则可促进细胞凋亡, 因此我们推测, 汉丹肝乐抗肝纤维化的作用可能是通过抑制PI3K/Akt信号通路的激活, 下调肝组织中Akt1及p-Akt1的表达, 从而促进HSC的凋亡来实现的.
肝纤维化是各种慢性肝脏疾病所共有的病理特征, 是肝脏在病因的长期作用下, 经历持续的损伤及抗损伤修复过程, 导致细胞外基质在肝脏内大量沉积所造成的. 肝纤维化的发生、发展涉及到多种肝脏实质、间质细胞及细胞因子之间的复杂作用, 因此关于肝纤维化的发生机制及防治研究一直是肝病研究的热点内容.
王蒙, 副教授, 第二军医大学附属东方肝胆外科医院肝外综合治疗一科
目前临床上应用的治疗肝纤维化的西药大多只能针对其发病机制中某一环节起效, 而很难做到多靶点、多层次覆盖的药效作用; 而中药抗肝纤维化具有药效机制多层次、多靶点, 注重整体调节的特点, 且具有不良反应轻等优点, 因此中药防治肝纤维化疾病受到越来越多的关注.
PI3K/Akt是体内重要的信号转导通路之一, 在维持细胞的正常生理功能, 如生长、分化、代谢等方面起关键作用。有研究人员发现在胆道闭锁所致的肝纤维化过程中,PI3K/Akt信号通路的激活可促进HSC的增殖,从而加速肝纤维化的发生和发展.
前期研究发现汉丹肝乐可通过促进HSC凋亡发挥抗肝纤维化的作用, 但其具体机制尚不清楚. 本次研究发现, 汉丹肝乐可抑制PI3K/Akt信号通路的激活, 减少肝纤维化大鼠肝组织中Akt1及p-Akt1的表达, 从而促进HSC的凋亡, 达到减轻肝纤维化的目的.
肝纤维化是肝硬化、肝癌发展过程中一个关键的中间环节. 汉丹肝乐能够减少血清ALT、AST水平, 对肝功能具有一定的保护作用; 同时他还能促进HSC凋亡, 减少细胞外基质的沉积, 通过本次研究可为汉丹肝乐的临床应用提供理论依据.
本文具有一定指导意义.
编辑 田滢 电编 鲁亚静
| 2. | Arriazu E, Ruiz de Galarreta M, Cubero FJ, Varela-Rey M, Pérez de Obanos MP, Leung TM, Lopategi A, Benedicto A, Abraham-Enachescu I, Nieto N. Extracellular Matrix and Liver Disease. Antioxid Redox Signal. 2014; Jan 8. [Epub ahead of print]. [PubMed] [DOI] |
| 3. | Wirkowska A, Paczek L. [Liver fibrosis and cirrhosis--causes. Part I]. Przegl Lek. 2011;68:222-227. [PubMed] |
| 4. | Mehal W, Imaeda A. Cell death and fibrogenesis. Semin Liver Dis. 2010;30:226-231. [PubMed] [DOI] |
| 6. | Zhou JD, Shen F, Ji JS, Zheng K, Huang M, Wu JC. FAM9C plays an anti-apoptotic role through activation of the PI3K/Akt pathway in human hepatocellular carcinoma. Oncol Rep. 2013;30:1275-1284. [PubMed] [DOI] |
| 7. | Geng XX, Yang Q, Xie RJ, Luo XH, Han B, Ma L, Li CX, Cheng ML. In vivo effects of Chinese herbal recipe, Danshaohuaxian, on apoptosis and proliferation of hepatic stellate cells in hepatic fibrotic rats. World J Gastroenterol. 2005;11:561-566. [PubMed] |
| 9. | Li C, Luo J, Li L, Cheng M, Huang N, Liu J, Waalkes MP. The collagenolytic effects of the traditional Chinese medicine preparation, Han-Dan-Gan-Le, contribute to reversal of chemical-induced liver fibrosis in rats. Life Sci. 2003;72:1563-1571. [PubMed] [DOI] |
| 11. | Jiao J, Friedman SL, Aloman C. Hepatic fibrosis. Curr Opin Gastroenterol. 2009;25:223-229. [PubMed] [DOI] |
| 12. | Ma R, He S, Liang X, Yu H, Liang Y, Cai X. Decorin prevents the development of CCl4-induced liver fibrosis in mice. Chin Med J (Engl). 2014;127:1100-1104. [PubMed] |
| 13. | Dong Y, Qu Y, Xu M, Wang X, Lu L. Catalase ameliorates hepatic fibrosis by inhibition of hepatic stellate cells activation. Front Biosci (Landmark Ed). 2014;19:535-541. [PubMed] [DOI] |
| 16. | Gunda V, Bucur O, Varnau J, Vanden Borre P, Bernasconi MJ, Khosravi-Far R, Parangi S. Blocks to thyroid cancer cell apoptosis can be overcome by inhibition of the MAPK and PI3K/AKT pathways. Cell Death Dis. 2014;5:e1104. [PubMed] [DOI] |
| 18. | Song T, Wang L, Mo Z, Mao L, Ma X, Niu R, Gu K, Yan R, Ma P, Qi Y. Expression of p-Akt in ovarian serous carcinoma and its association with proliferation and apoptosis. Oncol Lett. 2014;7:59-64. [PubMed] |
| 19. | Liu K, Shi Y, Guo XH, Ouyang YB, Wang SS, Liu DJ, Wang AN, Li N, Chen DX. Phosphorylated AKT inhibits the apoptosis induced by DRAM-mediated mitophagy in hepatocellular carcinoma by preventing the translocation of DRAM to mitochondria. Cell Death Dis. 2014;5:e1078. [PubMed] [DOI] |
| 20. | Wang Y, Jiang XY, Liu L, Jiang HQ. Phosphatidylinositol 3-kinase/Akt pathway regulates hepatic stellate cell apoptosis. World J Gastroenterol. 2008;14:5186-5191. [PubMed] [DOI] |
| 21. | Sancho-Bru P, Juez E, Moreno M, Khurdayan V, Morales-Ruiz M, Colmenero J, Arroyo V, Brenner DA, Ginès P, Bataller R. Hepatocarcinoma cells stimulate the growth, migration and expression of pro-angiogenic genes in human hepatic stellate cells. Liver Int. 2010;30:31-41. [PubMed] [DOI] |
| 22. | Xiao Y, Wang J, Chen Y, Zhou K, Wen J, Wang Y, Zhou Y, Pan W, Cai W. Up-regulation of miR-200b in biliary atresia patients accelerates proliferation and migration of hepatic stallate cells by activating PI3K/Akt signaling. Cell Signal. 2014;26:925-932. [PubMed] [DOI] |
| 23. | Zhang F, Zhang Z, Kong D, Zhang X, Chen L, Zhu X, Lu Y, Zheng S. Tetramethylpyrazine reduces glucose and insulin-induced activation of hepatic stellate cells by inhibiting insulin receptor-mediated PI3K/AKT and ERK pathways. Mol Cell Endocrinol. 2014;382:197-204. [PubMed] [DOI] |
| 24. | Bai T, Lian LH, Wu YL, Wan Y, Nan JX. Thymoquinone attenuates liver fibrosis via PI3K and TLR4 signaling pathways in activated hepatic stellate cells. Int Immunopharmacol. 2013;15:275-281. [PubMed] [DOI] |
| 25. | Wang CD, Yuan CF, Bu YQ, Wu XM, Wan JY, Zhang L, Hu N, Liu XJ, Zu Y, Liu GL. Fangchinoline inhibits cell proliferation via Akt/GSK-3beta/ cyclin D1 signaling and induces apoptosis in MDA-MB-231 breast cancer cells. Asian Pac J Cancer Prev. 2014;15:769-773. [PubMed] |
| 26. | Xu G, Li Y, Yoshimoto K, Wu Q, Chen G, Iwata T, Mizusawa N, Wan C, Nie X. 2,3,7,8-Tetrachlorodibenzo-p-dioxin stimulates proliferation of HAPI microglia by affecting the Akt/GSK-3β/cyclin D1 signaling pathway. Toxicol Lett. 2014;224:362-370. [PubMed] [DOI] |
| 27. | Zhang Q, Fu H, Zhang H, Xu F, Zou Z, Liu M, Wang Q, Miao M, Shi X. Hydrogen sulfide preconditioning protects rat liver against ischemia/reperfusion injury by activating Akt-GSK-3β signaling and inhibiting mitochondrial permeability transition. PLoS One. 2013;8:e74422. [PubMed] [DOI] |
| 29. | Jeon HG, Yoon CY, Yu JH, Park MJ, Lee JE, Jeong SJ, Hong SK, Byun SS, Lee SE. Induction of caspase mediated apoptosis and down-regulation of nuclear factor-κB and Akt signaling are involved in the synergistic antitumor effect of gemcitabine and the histone deacetylase inhibitor trichostatin A in human bladder cancer cells. J Urol. 2011;186:2084-2093. [PubMed] [DOI] |
| 30. | Xue X, You Y, Tao J, Ye X, Huang J, Yang S, Lin Z, Hong Z, Peng J, Chen L. Electro-acupuncture at points of Zusanli and Quchi exerts anti-apoptotic effect through the modulation of PI3K/Akt signaling pathway. Neurosci Lett. 2014;558:14-19. [PubMed] [DOI] |
| 31. | Quan JH, Cha GH, Zhou W, Chu JQ, Nishikawa Y, Lee YH. Involvement of PI 3 kinase/Akt-dependent Bad phosphorylation in Toxoplasma gondii-mediated inhibition of host cell apoptosis. Exp Parasitol. 2013;133:462-471. [PubMed] [DOI] |