修回日期: 2014-03-22
接受日期: 2014-03-28
在线出版日期: 2014-04-18
目的: 检测microRNA-130a(miR-130a)在肝癌中的表达水平及其对CYLD基因表达的调控, 并探讨miR-130a对肝癌细胞增殖的影响.
方法: 采用qRT-PCR检测miR-130a在原发性肝癌组织及对应的癌旁组织、肝癌细胞系和正常肝细胞中的表达差异, 利用靶基因预测分析软件预测miR-130a潜在靶基因CYLD后, 构建携带靶基因CYLD野生型及突变型3'UTR序列的双荧光素酶报告基因质粒, 应用双荧光素酶报告基因实验体系进行验证; 采用miR-130a抑制剂下调肝癌细胞系HepG2中miR-130a的表达, Western blot检测CYLD蛋白的表达变化; MTT法检测肝癌细胞增殖的改变.
结果: MiR-130a在原发性肝癌组织中的表达明显高于对应的癌旁组织(P<0.05), 在肝癌细胞系中的表达也显著高于正常肝细胞(P<=0.05); 双荧光素酶报告基因系统验证CYLD是miR-130a的直接靶基因; HepG2细胞中转染miR-130a抑制剂下调miR-130a表达后. Western blot检测结果显示CYLD蛋白表达水平显著上调; miR-130a抑制剂转染的HepG2细胞其增殖受到明显抑制.
结论: MiR-130a在肝癌中表达上调, 下调miR-130a后可以促进靶基因CYLD的表达, 并可以抑制肝癌细胞的增殖活性, miR-130a有可能成为原发性肝癌治疗的新靶点.
核心提示: MiR-130a在肝癌中表达上调, 下调miR-130a后可以促进靶基因CYLD的表达, 并可以抑制肝癌细胞的增殖活性, miR-130a有可能成为原发性肝癌治疗的新靶点.
引文著录: 倪芳, 赵华, 汪心怡, 陈卓, 汪思应. MiR-130a靶向调控CYLD基因及其对肝癌细胞增殖的影响. 世界华人消化杂志 2014; 22(11): 1504-1509
Revised: March 22, 2014
Accepted: March 28, 2014
Published online: April 18, 2014
AIM: To detect the expression level of miR-130a in hepatocellular carcinoma and to analyze the effect of miR-130a on hepatocellular carcinoma cell proliferation.
METHODS: MiR-130a expression levels in hepatocellular carcinoma and non-tumor pericarcinous tissues, as well as normal liver and hepatocellular carcinoma cell lines were determined by qRT-PCR. The CYLD 3'-UTR as the target of miR-130a was predicted by bioinformatics analysis. The reporter activity was evaluated by the dual luciferase reporter assay. After HepG2 cells were transfected with a synthetic miR-130a inhibitor (anti-miR-3666) or a synthetic control miRNA (anti-miR-C), the expression of CYLD protein in the transfected HepG2 cells was determined by Western blot, and cell proliferation was determined by MTT assay.
RESULTS: MiR-130a expression was up-regulated in hepatocellular carcinoma compared to non-tumor pericarcinous tissues. The results of dual luciferase assays validate CYLD as a specific target gene of miR-130a. Inhibition of miR-130a resulted in the upregulation of CYLD protein expression in HepG2 cell line. MiR-130a knockdown significantly inhibited the cell proliferation of HepG2 cells.
CONCLUSION: MiR-130a is overexpressed in hepatocellular carcinoma. Inhibition of miR-130a promotes the proliferation of hepatocellular carcinoma cells. MiR-130a may become a new potential therapeutic target for hepatocellular carcinoma.
- Citation: Ni F, Zhao H, Wang XY, Chen Z, Wang SY. MicroRNA-130a targets CYLD to regulate cell proliferation in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1504-1509
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1504.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1504
肝细胞癌(hepatocellular carcinoma, HCC)作为危害性很强的恶性肿瘤之一, 具有高增殖活性, 高转移等恶性生物学特性, 其在导致死亡的恶性肿瘤中居世界第3位[1-3]. 近年来, 尽管不同的治疗方案应用于肝癌的临床治疗, 但由于其恶性生物学行为的分子机制不清, 导致其存活率依然没有明显升高. MicroRNA(miRNA)是近年来发现的一种存在于真核生物中的内源性单链非编码RNA, 通常在转录后水平调节靶基因的表达, 进而参与细胞的增殖、分化和凋亡等多种生命过程[4,5]. 越来越多的研究表明, miRNA在肝癌的发生发展中发挥重要作用[6-12], 但仍有大量miRNA的功能是未知的. 本研究中的miR-130a在肝癌中的表达及其在肝癌发生发展中的作用鲜有研究报道. 我们利用生物信息学方法预测到miR-130a与抑癌基因CYLD mRNA 3'UTR存在相互作用位点, 提示miR-130a可能通过靶向抑癌基因CYLD参与肿瘤的发生发展. 本研究拟检测miR-130a在肝癌中的表达情况, 并验证miR-130a对CYLD的靶向调控作用, 同时观察miR-130a对肝癌细胞增殖的影响, 为肝癌防治提供线索.
收集2011-03/2013-03安徽医科大学第一附属医院31例原发性肝癌组织标本及对应的癌旁组织, 患者年龄38-67岁. 所有标本均经病理学检查确诊, 取出后迅速放入液氮保存备用. DMEM培养基、胎牛血清均购自Gibco公司; 人正常肝脏细胞株HL-02以及肝癌细胞系Hep3B、HepG2和Huh7均由本实验室长期保存. 脂质体Lipofectamine 2000购自Invitrogen TRIzol购自Invitrogen公司; MicroRNA逆转录检测试剂盒(miScript Reverse Transcription kit)、hsa-miR-130a及内参RNU6B引物、microRNA荧光定量PCR检测试剂盒(miScript SYBR Green PCR kit)均购自Qiagen公司; 双荧光素酶报告基因检测试剂盒(Dual-Luciferase Reporter Assay System) 购自Promega公司; miR-130a模拟体(mimics)及阴性对照(miR-C)、miR-130a抑制体(inhibitor)及阴性对照(anti-miR-C)均购自上海吉玛生物公司; CYLD兔抗人单克隆抗体购自Cell Signaling公司; HRP标记的山羊抗兔二抗购自北京中杉金桥生物公司.
1.2.1 qRT-PCR检测miR-130a的表达: TRIzol提取细胞或组织总RNA(含miRNA), 采用miScript Reverse Transcription Kit(含通用反向引物)(Qiagen)合成cDNA; 依据miScript SYBR Green PCR kit说明书配置PCR反应液(20 μL体系), 按下列条件扩增: 95 ℃预变性10 s, 95 ℃ 5 s, 60 ℃ 34 s, 40个循环. 反应结束后, 以RNU6B为内参, 进行相对定量分析.
1.2.2 双荧光素酶报告基因质粒的构建: 首先通过生物信息学在线软件Targetscan预测miR-130a的靶基因, GenBank中查找miR-130a靶基因CYLD 3'UTR序列, 由上海生工合成CYLD-WT 3'UTR(含有预测的miR-130a与CYLD 3'UTR结合序列上下游各150 bp左右的片段)、CYLD-mutant 3'UTR基因(删除整段预测的miR-130a与CYLD 3'UTR结合序列), 两端带有NotⅠ和XhoⅠ酶切位点; 之后重组入双荧光素酶报告基因质粒psi-CHECK2多克隆位点, 分别获得野生型及突变型克隆并测序鉴定正确性.
1.2.3 双荧光素酶报告基因活性检测: 将HEK293A细胞接种到24孔板中, 每孔8×104细胞, 待细胞会和度达到80%左右时进行转染, 按照Lipofectamine 2000说明书配制转染试剂, 将0.2 μg的双荧光素酶报告质粒及20 nmol/L终浓度的miR-130a mimics或阴性对照共转染HEK293A细胞, 5 h后更换DMEM完全培养基, 48 h后用Dual-Luciferase Reporter Assay System (Promega)检测荧光素酶的活性.
1.2.4 Western blot检测CYLD蛋白表达水平: 在肝癌细胞株HepG2细胞中分别转染miR-130a抑制体(anti-miR-130a)和阴性对照(anti-miR-C), 48 h后, 收集上述不同转染组的HepG2细胞, 加入RIPA蛋白裂解液, BCA法测定蛋白浓度. 每孔40 μg上样进行SDS-PAGE凝胶电泳后, 用水浴式电转仪转至PVDF膜上. 5%脱脂牛奶室温封闭1 h, 加入1:1000稀释的兔抗人CYLD单克隆抗体, 4 ℃孵育过夜, TBST洗膜后, 然后加入HRP标记的羊抗兔二抗(1:8000), 室温孵育l h, 取出, TBST洗膜, 化学发光法检测后分析结果.
1.2.5 MTT法检测细胞增殖活性: 转染anti-miR-130a组和anti-miR-C组HepG2细胞株, 在转染后24 h消化细胞, 以2000个/孔的细胞密度接种于96孔板中, 每孔加入100 μL培养液, 各组设6个复孔, 37 ℃ 5%CO2培养箱培养; 分别于培养12、24、36、48 h的时间点, 每孔加入5 g/L的MTT 溶液50 μL, 在 37 ℃, 5%CO2培养箱内继续孵育4 h后, 弃上清, 加入150 μL DMSO溶解; 490 nm测定吸光度(A)值.
统计学处理 采用SPSS17.0统计软件对数据进行统计分析, 数据以mean±SD表示, 均数间的比较采用t检验. P<0.05为差异有统计学意义.
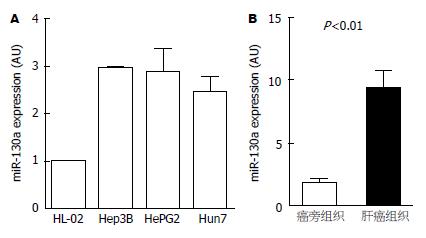
qRT-PCR结果表明, miR-130a在肝癌组织中的表达显著高于对应的癌旁组织(P<0.01); 同时, miR-130a在肝癌细胞系中的表达也明显高于正常肝细胞(P<0.01), 差异有统计学意义(图1).
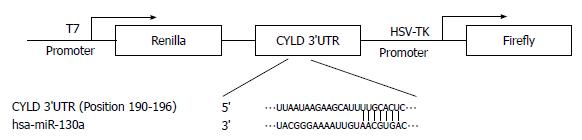
我们通过Targetscan在线分析软件(http://www.targetscan.org)分析, hsa-miR-130a可特异结合CYLD基因3'UTR区域的190-196位碱基, 结合位点见图2.
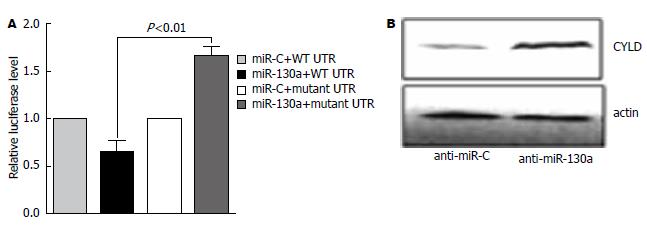
为了进一步证明miR-130a对CYLD基因具有直接调控作用, 将CYLD基因WT3'UTR序列(包含软件预测的整段miR-130a结合位点)及CYLD基因mutant 3'UTR序列(删除了整段预测的miR-130a结合位点)克隆入双荧光素酶报告基因质粒psi-CHECK2(图2), 并通过测序鉴定正确. 双荧光素酶报告基因实验结果表明: miR-130a能通过CYLD-WT 3'UTR抑制荧光素酶的活性, 当miR-130a与psi-CHECK2 mutant 3'UTR共转染后, 则不能对报告基因的活性产生抑制效应(图3A). Western blot实验结果发现: 转染miR-130a inhibitor能显著上调肝癌细胞中CYLD蛋白表达(图3B). 以上结果表明miR-130a对CYLD的表达具有直接调控作用.
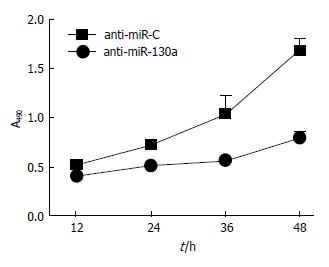
MTT检测结果显示, 转染anti-miR-130a后的HepG2细胞生长速度较anti-miR-C对照组明显减慢(P<0.05, 图4).
原发性肝癌是世界范围内高发的恶性肿瘤之一, 肝癌细胞具有易侵袭转移、高增殖性等恶性生物学行为, 这也是导致肝癌预后不良的主要原因. 近年来的研究表明: 癌基因的激活或抑癌基因的失活或突变参与肝癌等恶性肿瘤的发生发展, 如p53、Her2、PTEN及CYLD等基因表达异常或突变与多种肿瘤的发生发展密切相关[13-16]. CYLD是2003年Nature杂志报道的一个新的肿瘤抑制基因[17], 众多研究提示CYLD作为一种去泛素化酶, 其去泛素化活性可以抑制核因子(nuclear factor kappa B, NF-κB)、JNK、WNT/b-catenin等信号途径的激活, 在细胞周期的调控、介导细胞凋亡、抑制肿瘤发生等分子事件中有着重要的调控作用[18-23]. 已有的研究结果表明很多实体瘤或血液肿瘤细胞中存在CYLD基因的低表达或突变, 进而参与肿瘤的发生发展. 最新的研究显示, CYLD在肝癌的发生发展中也发挥着重要作用[24-29]. 然而, CYLD基因表达调控的机制还很不清楚.
近年来发现的microRNA, 是调控基因表达的重要分子, 某些表达失调的miRNA与恶性肿瘤的发生发展密切相关, 本研究报道的miR-130a, 其在肝癌中的作用知之甚少, 有研究报道miR-130a能够提高肝癌细胞对化疗药物顺铂的耐药性[30], 而我们的研究发现miR-130a在人肝癌细胞系以及原代的肝癌组织中高表达, 并首次通过双荧光素酶报告基因实验证实了CYLD是miR-130a的潜在靶基因, 也进一步证明了在肝癌细胞中下调miR-130a后, 可以促进抑癌基因CYLD蛋白的表达, 并且可以抑制肝癌细胞的增殖, 表明在肝癌细胞中, 可能由于miR-130a的高表达, 抑制了抑癌基因CYLD的表达, 低表达的肝癌细胞NF-κB等信号途径可能会异常活化, 而这些信号转导途径的异常活化与肝癌等肿瘤的增殖等恶性生物学行为呈正相关关系. 因此, miR-130a上调可能是肝癌恶性发展的机制之一, 这可能为肝癌的治疗提供新的靶点.
肝细胞癌在导致死亡的恶性肿瘤中居世界第3位. 由于其恶性生物学行为的分子机制不清, 导致肝癌患者存活率很低. 近年来的研究表明microRNA在肝癌的发生发展中发挥重要作用, 但仍有大量microRNA的功能是未知的.
张志坚, 教授, 福州总医院消化内科
MiRNA与恶性肿瘤的发生发展密切相关, 本研究中的miR-130a在肝癌中的表达及其在肝癌发生发展中的作用鲜有研究报道. 我们利用生物信息学方法预测到miR-130a与抑癌基因CYLD mRNA 3'UTR存在相互作用位点, 并验证miR-130a对CYLD的靶向调控作用, 同时观察miR-130a对肝癌细胞增殖的影响.
CYLD作为肿瘤抑制基因, 在多种肿瘤的发生发展中发挥重要作用, 最新研究报道CYLD在肝癌的发生发展也起重要作用. 然而, CYLD基因表达调控的机制还很不清楚. 很多研究表明microRNA在肝癌的发生发展中起重要调控作用, 然而miR-130a在肝癌中的作用却知之甚少.
本研究报道的miR-130a, 其在肝癌中的作用鲜有研究报道, 我们首次通过双荧光素酶报告基因实验证实了CYLD是miR-130a的潜在靶基因, 并且证明在肝癌细胞中下调miR-130a后, 可以促进抑癌基因CYLD蛋白的表达, 并且可以抑制肝癌细胞的增殖, 表明在肝癌细胞中, 可能由于miR-130a的高表达, 抑制了抑癌基因CYLD的表达, 进而促进肝癌细胞的增殖等恶性生物学行为.
MiR-130a上调可能是肝癌恶性发展的机制之一, 这可能为肝癌的治疗提供新的靶点.
本文的科学性、创新性和可读性较好地反映了该领域基础研究的先进水平.
编辑 田滢 电编 鲁亚静
| 1. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] |
| 2. | Perz JF, Armstrong GL, Farrington LA, Hutin YJ, Bell BP. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol. 2006;45:529-538. [PubMed] |
| 3. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 4. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 5. | Cheng AM, Byrom MW, Shelton J, Ford LP. Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis. Nucleic Acids Res. 2005;33:1290-1297. [PubMed] |
| 6. | Chen Y, Verfaillie CM. MicroRNAs: the fine modulators of liver development and function. Liver Int. 2014; Feb 11. [Epub ahead of print]. [PubMed] [DOI] |
| 7. | Turato C, Simonato D, Quarta S, Gatta A, Pontisso P. MicroRNAs and SerpinB3 in hepatocellular carcinoma. Life Sci. 2014;100:9-17. [PubMed] [DOI] |
| 8. | Hou W, Bonkovsky HL. Non-coding RNAs in hepatitis C-induced hepatocellular carcinoma: dysregulation and implications for early detection, diagnosis and therapy. World J Gastroenterol. 2013;19:7836-7845. [PubMed] [DOI] |
| 9. | Wang Z, Wu J, Zhang G, Cao Y, Jiang C, Ding Y. Associations of miR-499 and miR-34b/c Polymorphisms with Susceptibility to Hepatocellular Carcinoma: An Evidence-Based Evaluation. Gastroenterol Res Pract. 2013;2013:719202. [PubMed] |
| 10. | Callegari E, Elamin BK, Sabbioni S, Gramantieri L, Negrini M. Role of microRNAs in hepatocellular carcinoma: a clinical perspective. Onco Targets Ther. 2013;6:1167-1178. [PubMed] |
| 11. | Wong CM, Kai AK, Tsang FH, Ng IO. Regulation of hepatocarcinogenesis by microRNAs. Front Biosci (Elite Ed). 2013;5:49-60. [PubMed] |
| 12. | Giordano S, Columbano A. MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma? Hepatology. 2013;57:840-847. [PubMed] [DOI] |
| 13. | Sanefuji K, Taketomi A, Iguchi T, Sugimachi K, Ikegami T, Yamashita Y, Gion T, Soejima Y, Shirabe K, Maehara Y. Significance of DNA polymerase delta catalytic subunit p125 induced by mutant p53 in the invasive potential of human hepatocellular carcinoma. Oncology. 2010;79:229-237. [PubMed] [DOI] |
| 14. | Scaltriti M, Eichhorn PJ, Cortés J, Prudkin L, Aura C, Jiménez J, Chandarlapaty S, Serra V, Prat A, Ibrahim YH. Cyclin E amplification/overexpression is a mechanism of trastuzumab resistance in HER2+ breast cancer patients. Proc Natl Acad Sci U S A. 2011;108:3761-3766. [PubMed] [DOI] |
| 15. | Wrighton KH. Cancer biology: Role of nuclear PTEN revealed. Nat Rev Mol Cell Biol. 2011;12:134. [PubMed] [DOI] |
| 16. | Massoumi R. CYLD: a deubiquitination enzyme with multiple roles in cancer. Future Oncol. 2011;7:285-297. [PubMed] [DOI] |
| 17. | Trompouki E, Hatzivassiliou E, Tsichritzis T, Farmer H, Ashworth A, Mosialos G. CYLD is a deubiquitinating enzyme that negatively regulates NF-kappaB activation by TNFR family members. Nature. 2003;424:793-796. [PubMed] |
| 18. | Brummelkamp TR, Nijman SM, Dirac AM, Bernards R. Loss of the cylindromatosis tumour suppressor inhibits apoptosis by activating NF-kappaB. Nature. 2003;424:797-801. [PubMed] |
| 19. | Zhang J, Stirling B, Temmerman ST, Ma CA, Fuss IJ, Derry JM, Jain A. Impaired regulation of NF-kappaB and increased susceptibility to colitis-associated tumorigenesis in CYLD-deficient mice. J Clin Invest. 2006;116:3042-3049. [PubMed] |
| 20. | Xue L, Igaki T, Kuranaga E, Kanda H, Miura M, Xu T. Tumor suppressor CYLD regulates JNK-induced cell death in Drosophila. Dev Cell. 2007;13:446-454. [PubMed] |
| 21. | Tauriello DV, Haegebarth A, Kuper I, Edelmann MJ, Henraat M, Canninga-van Dijk MR, Kessler BM, Clevers H, Maurice MM. Loss of the tumor suppressor CYLD enhances Wnt/beta-catenin signaling through K63-linked ubiquitination of Dvl. Mol Cell. 2010;37:607-619. [PubMed] [DOI] |
| 22. | Sun SC. CYLD: a tumor suppressor deubiquitinase regulating NF-kappaB activation and diverse biological processes. Cell Death Differ. 2010;17:25-34. [PubMed] [DOI] |
| 23. | Ye H, Liu X, Lv M, Wu Y, Kuang S, Gong J, Yuan P, Zhong Z, Li Q, Jia H. MicroRNA and transcription factor co-regulatory network analysis reveals miR-19 inhibits CYLD in T-cell acute lymphoblastic leukemia. Nucleic Acids Res. 2012;40:5201-5214. [PubMed] [DOI] |
| 24. | Pannem RR, Dorn C, Ahlqvist K, Bosserhoff AK, Hellerbrand C, Massoumi R. CYLD controls c-MYC expression through the JNK-dependent signaling pathway in hepatocellular carcinoma. Carcinogenesis. 2014;35:461-468. [PubMed] [DOI] |
| 25. | Gautheron J, Luedde T. A novel player in inflammation and cancer: the deubiquitinase CYLD controls HCC development. J Hepatol. 2012;57:937-939. [PubMed] [DOI] |
| 26. | Font-Burgada J, Seki E, Karin M. CYLD and HCC: when being too sensitive to your dirty neighbors results in self-destruction. Cancer Cell. 2012;21:711-712. [PubMed] [DOI] |
| 27. | Urbanik T, Köhler BC, Boger RJ, Wörns MA, Heeger S, Otto G, Hövelmeyer N, Galle PR, Schuchmann M, Waisman A. Down-regulation of CYLD as a trigger for NF-κB activation and a mechanism of apoptotic resistance in hepatocellular carcinoma cells. Int J Oncol. 2011;38:121-131. [PubMed] |
| 28. | Chu L, Gu J, He Z, Xiao T, Liu X. Adenoviral vector expressing CYLD augments antitumor activity of TRAIL by suppression of NF-kappaB survival signaling in hepatocellular carcinoma. Cancer Biol Ther. 2006;5:615-622. [PubMed] |
| 29. | Hashimoto K, Mori N, Tamesa T, Okada T, Kawauchi S, Oga A, Furuya T, Tangoku A, Oka M, Sasaki K. Analysis of DNA copy number aberrations in hepatitis C virus-associated hepatocellular carcinomas by conventional CGH and array CGH. Mod Pathol. 2004;17:617-622. [PubMed] |
| 30. | Xu N, Shen C, Luo Y, Xia L, Xue F, Xia Q, Zhang J. Upregulated miR-130a increases drug resistance by regulating RUNX3 and Wnt signaling in cisplatin-treated HCC cell. Biochem Biophys Res Commun. 2012;425:468-472. [PubMed] [DOI] |