修回日期: 2013-11-05
接受日期: 2013-11-19
在线出版日期: 2014-01-08
目的: 探讨缬沙坦对门静脉高压性胃病大鼠胃黏膜病变的疗效和作用机制.
方法: 48只♂SD大鼠随机分为假手术组、门静脉高压性胃病模型组、缬沙坦预防组、缬沙坦常规剂量组和缬沙坦加倍剂量组. 采用部分门静脉主干缩窄法制备门静脉高压性胃病模型. 免疫组织化学染色法检测各组大鼠胃黏膜组织转化生长因子-β1(transforming growth factor-β1, TGF-β1)表达、微血管密度(microvessel density, MVD), Western blot分析胃黏膜组织Smad2、Smad7蛋白表达. ELISA法检测各组血清肾素(plasma renin activity, PRA)、血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)、谷氨酸转氨酶(alanine aminotransferase, ALT)、白蛋白(albumin, ALB)水平.
结果: 缬沙坦预防组、常规剂量组和加倍剂量组胃黏膜组织中TGF-β1(11.58±2.27, 13.29±2.82, 13.15±3.36)明显低于造模组(24.25±3.48)(P<0.05); 缬沙坦预防组、常规剂量组和加倍剂量组胃黏膜微血管密度值(12.08±2.34; 13.13±1.42; 12.04±1.02)亦明显低于造模组(17.09±5.52)(P<0.05); 缬沙坦预防组、常规剂量组和加倍剂量组胃黏膜组织中Smad2蛋白表达(0.86±0.59, 0.82±0.36, 0.83±0.49)较造模组(1.60±0.77)明显下降(P<0.05), 但高于假手术组; Smad7蛋白表达(1.59±0.72, 1.65±0.80, 1.69±0.85)较模型组(0.58±0.35)明显升高(P<0.05), 但低于假手术组. 缬沙坦预防组、常规剂量组和加倍剂量组血PRA(16.49 ng/mL±2.77 ng/mL; 15.92 ng/mL±4.30 ng/mL; 16.72 ng/mL±5.48 ng/mL)、AngⅡ(1664.44 pg/mL±285.47 pg/mL, 1686.82 pg/mL±499.16 pg/mL, 1734.07 pg/mL±326.66 pg/mL)水平较模型组(11.49 ng/mL±2.12 ng/mL, 1110.38 pg/mL±193.85 pg/mL)比较明显升高(P<0.05, P<0.01).
结论: 缬沙坦能够改善门静脉高压性胃病大鼠胃黏膜微血管病变,可能是通过下调TGF-β1、Smad2表达, 上调Smad7表达发挥作用.
核心提示: 门脉高压性胃病时胃黏膜微血管内膜受损、管腔扩张、扭曲, 微血管密度增加, 转化生长因子-β1(transforming growth factor-β1, TGF-β1)和Smad2表达明显升高, Smad7表达明显降低, 提示胃黏膜血管病变形成. 缬沙坦能够通过抑制胃黏膜TGF-β1和Smad2表达, 增加Smad7蛋白表达, 对胃黏膜血管病变具有一定治疗作用.
引文著录: 黄蔚, 钱静蓉, 陈岳祥. 缬沙坦对门静脉高压性胃病大鼠胃黏膜组织TGF-β1/Smad信号传导通路的影响. 世界华人消化杂志 2014; 22(1): 9-16
Revised: November 5, 2013
Accepted: November 19, 2013
Published online: January 8, 2014
AIM: To investigate the efficacy and mechanisms of action of valsartan on portal hypertensive gastropathy in rats with gastric mucosa lesions.
METHODS: Forty-eight SD rats were randomly divided into a sham-operated group, a portal hypertension gastropathy group, a valsartan prevention group, a normal dose valsartan group and a high dose valsartan group. Portal hypertensive gastropathy was induced by the partial portal vein ligation method. Gastric mucosa TGF-beta1 expression and microvessel density (MVD) were detected by immunohistochemical staining method. Gastric mucosa Smad2 and Smad7 protein expression was detected by Western blot. Plasma levels of rennin activity (PRA), angiotensin II (Ang II), alanine aminotransferase (ALT), and albumin (ALB) were determined by ELISA.
RESULTS: Compared with the model group, gastric mucosa TGF-β1 (11.58 ± 2.27, 13.29 ± 2.82, 13.15 ± 3.36 vs 24.25 ± 3.48, all P <0.05) and Smad2 (0.86 ± 0.59, 0.82±0.36, 0.83 ± 0.49 vs 1.60 ± 0.77, P < 0.05) protein expression was significantly decreased in the valsartan prevention group, normal dose valsartan group and high dose valsartan group. Smad7 protein expression in the valsartan prevention group, normal dose valsartan group and high dose valsartan group was significantly higher than that in the model group (1.59 ± 0.72, 1.65 ± 0.80, 1.69 ± 0.85 vs 0.58 ± 0.35, all P < 0.05). Plasma PRA (16.49 ng/mL ± 2.77 ng/mL, 15.92 ng/mL ± 4.30 ng/mL, 16.72 ng/mL ± 5.48 ng/mL vs 11.49 ng/mL ± 2.12 ng/mL, all P <0.05) and Ang II (1664.44 pg/mL ± 285.47 pg/mL, 1686.82 pg/mL ± 499.16 pg/mL, 1734.07 pg/mL ± 326.66 pg/mL vs 1110.38 pg/mL ± 193.85 pg/mL, all P <0.01) were also significantly higher in the valsartan prevention group, normal dose valsartan group and high dose valsartan group than in the model group.
CONCLUSION: Valsartan can improve portal hypertensive gastropathy probably by down-regulating TGF-β1 and Smad2 expression and up-regulating Smad7 expression.
- Citation: Huang W, Qian JR, Chen YX. Valsartan improves portal hypertensive gastropathy in rats possibly via TGF-β1/Smad signaling pathway. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 9-16
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/9.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.9
门静脉高压性胃病(portal hypertension gastropathy, PHG)主要见于肝硬化门脉高压症(portal hypertention, PHT)患者. 其主要病理机制[1]是一种累及胃黏膜的血管性病变, 组织学特征为黏膜和黏膜下水肿, 小血管扩张, 而炎症细胞浸润不明显. 胃镜下表现为胃底和胃体黏膜充血水肿、糜烂甚至溃疡, 是上消化道出血的常见原因之一. PHT是PHG发生的始动因素, 任何能够降低门静脉压力的因素都能改善PHG[2]. 近年来研究发现缬沙坦作为一种血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)1型受体拮抗剂有降低门静脉压力、抗肝纤维化和改善胃黏膜血供的作用, 其作用机制可能与抑制转化生长因子β1(transforming growth factor beta 1, TGF-β1)的合成和激活有关[3,4]. 大量研究证实TGF-β1在肝脏纤维化的发生和发展过程中发挥重要作用, 缬沙坦直接或间接抑制TGF-β1与TGF-β1Ⅱ型受体的合成和表达减轻肝纤维化程度[4-6]. 本课题组前期研究发现缬沙坦通过抑制门静脉TGF-β1的表达, 降低胶原纤维的合成, 改善门静脉血管病变的程度, 提示缬沙坦对PHG大鼠门静脉血管病变具有一定治疗作用[7], 但关于其对胃黏膜血管病变的影响, 国内报道甚少. 本实验拟观察缬沙坦对门静脉高压性胃病大鼠胃黏膜微血管构型的影响及其作用机制.
实验动物为成年健康♂Sprague-Dawley (SD)大鼠48只, 体质量200-220 g, 由上海第二军医大学实验动物中心提供[许可证号scxk(沪)2008-0016]. 缬沙坦(商品名代文, 北京诺华制药有限公司馈赠, 批号X0830); TGF-β1抗体(Santa Cruz公司, 货号为sc-146); Smad抗体(Santa Cruz公司, Smad2货号sc-135644; Smad7货号sc-11392); CD34抗体(福州迈新生物技术开发有限公司); SABC试剂盒(武汉博士德生物工程有限公司); 蛋白提取试剂盒(碧云天生物技术研究所提供).
1.2.1 动物分组和模型建立: 大鼠随机分成5组, 假手术组即对照组(n = 6)、模型组(n = 6)、缬沙坦预防组(n = 12)、缬沙坦常规剂量组(n = 12)、缬沙坦加倍剂量组(n = 12). 各组大鼠体质量、年龄相比无显著性差异. 本实验参照国内段进东等[8]的造模方法, 该方法可造成大鼠门静脉横截面积缩窄90%, 2 wk就能形成PHG模型. 具体方法如下: 模型组大鼠实验前24 h禁食, 自由饮水, 3%戊巴比妥钠溶液0.11-0.13 mL/100 g体质量腹腔内注射麻醉; 开腹后暴露并游离门静脉, 沿其纵轴外置一20 G钝性针头, 于近肝门处用3-0丝线结扎门静脉主干及外置针头后拔针, 形成肝前性门静脉狭窄. 假手术组仅游离门静脉主干而不结扎, 4 wk后与药物干预组一起进行指标检测. 缬沙坦预防组于造模开始每天清晨缬沙坦20 mg/kg体质量灌胃, 1次/d, 连续4 wk. 缬沙坦常规剂量组和加倍剂量组在造模术后第3周给药, 前者每天清晨20 mg/kg体质量灌胃, 1次/d; 后者40 mg/kg体质量灌胃, 1次/d, 连续2 wk. 造模组和假手术组于术后第3周予等量0.9%NaCl溶液灌胃, 连续2 wk.
1.2.2 胃黏膜大体标本制备: 造模4 wk后大鼠禁食12 h, 饮水, 3%戊巴比妥0.1 mL/100 g腹腔内麻醉后暴露腹腔取出全胃, 以0.9%NaCl溶液冲洗胃内容物, 剪取胃底部2 mm×4 mm大小的组织2块, 1块放入4%多聚甲醛固定石蜡包埋, 4 μm厚连续切片, 行HE染色. 另一块胃底组织-80 ℃保存.
1.2.3 血清肾素(plasma renin activity, PRA)、血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)、谷氨酸转氨酶(alanine aminotransferase, ALT)、白蛋白(albumin, ALB)检测: 处死大鼠后腹腔静脉采血3 mL, 按照ELISA方法测定PRA、Ang Ⅱ、ALT、ALB浓度, 具体步骤按照试剂盒说明书操作.
1.2.4 免疫组织化学染色检测胃黏膜组织TGF-β1表达: 采用SABC法. 试剂盒购自武汉博士德生物工程有限公司, 严格按说明书操作. 免疫组织化学染色后先在光镜下做定性观察, 200倍高倍镜下每张切片测定3个视野, 通过显微摄像系统摄取图像, 在图像分析仪上应用免疫组织化学计算面积软件做定量分析代表阳性面积率, 取其平均值.
1.2.5 免疫组织化学染色检测胃黏膜微血管密度: 采用SABC法, 试剂盒购自福州迈新生物技术开发有限公司产品, 严格按说明书进行操作. MVD检测方法如下: (1)CD34阳性以血管内皮细胞呈棕色或棕褐色染色为标准. 微血管计数以被染棕色或棕褐色的单个内皮细胞或内皮细胞簇作为一个血管计数. 只要结构不相连, 其分支结构也计作一个血管计数; (2)切片先在光镜下挑选微血管分布最高密度区域, 再在200倍光镜下计数3个不重复热点区域中被CD34染成棕色或棕褐色的微血管数, 取其平均值.
1.2.6 Western印迹分析胃黏膜Smad2、Smad7蛋白表达: 将胃底组织粉碎后加入裂解液, 蛋白提取过程按说明书操作进行. 在提取的蛋白中加入5%SDS煮沸10 min, 离心10 min, 提取上清液, BCA法测定蛋白含量. 取等量蛋白样本加入10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶中, 电转至硝酸纤维素膜, 室温下5%脱脂奶粉封闭2 h, 以封闭非特异性蛋白结合位点. 将膜放入用5%脱脂奶粉稀释的一抗稀释液中, 4 ℃摇床过夜, TBST洗3次, 每次20 min, 之后将膜放入用5%脱脂奶粉稀释的二抗稀释液中, 4 ℃摇床摇4 h, 然后用TBST洗3次, 每次20 min. 采用ECL化学发光法检测蛋白含量, 于暗室中用胶片显影、定影, 并用扫描仪进行扫描. 使用GENE公司图像处理软件分析, 计算目的基因与β-actin的吸光度比值.
统计学处理 采用SPSS13.0统计软件, 所得数据以mean±SD表示. 多组间比较采用单因素方差分析; 若方差齐性, 两两比较采用LSD法, 若方差不齐, 采用Dunnett T3检验. P<0.05为差异有统计学意义.
缬沙坦加倍剂量组大鼠死亡3只, 其中2只由于灌胃后呛咳、窒息死亡, 1只为腹水伴腹腔感染, 缬沙坦预防组和常规剂量组分别有2只大鼠死亡, 死因为灌胃后呛咳、窒息. 造模组和假手术组无大鼠死亡.
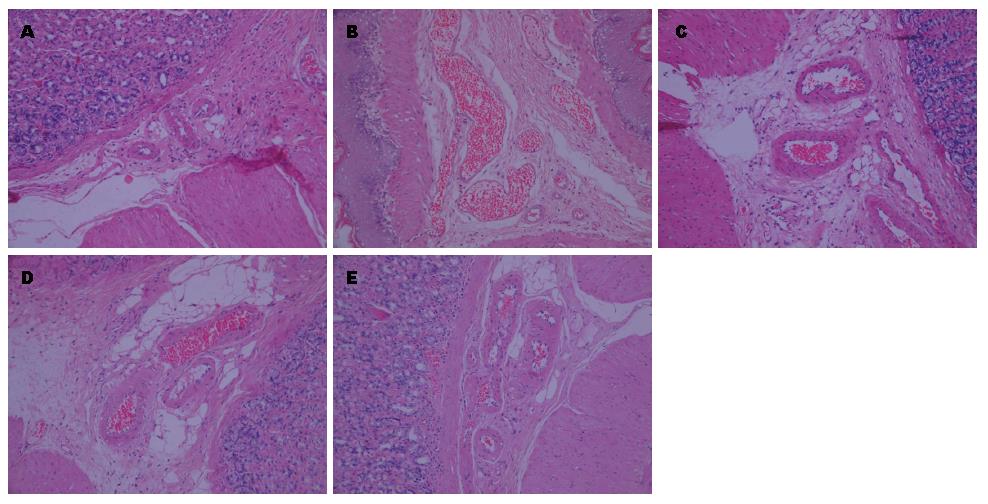
造模后1 wk大鼠开始厌食、懒动, 2 wk后腹腔增大, 厌食加剧. HE染色结果显示, 假手术组大鼠胃黏膜和黏膜下层微动静脉结构完整, 腺体排列规整, 管壁光滑; 造模组大鼠胃黏膜腺体排列不整齐, 黏膜下层间隙增宽, 黏膜下微动静脉明显充血, 管壁变薄, 管腔内可见大量血细胞黏附, 胃黏膜毛细血管重度扩张、膨胀. 缬沙坦预防组、常规剂量组和加倍剂量组大鼠胃黏膜腺体排列较整齐, 黏膜下层稍增宽, 微动静脉轻度充血, 毛细血管轻度扩张(图1).
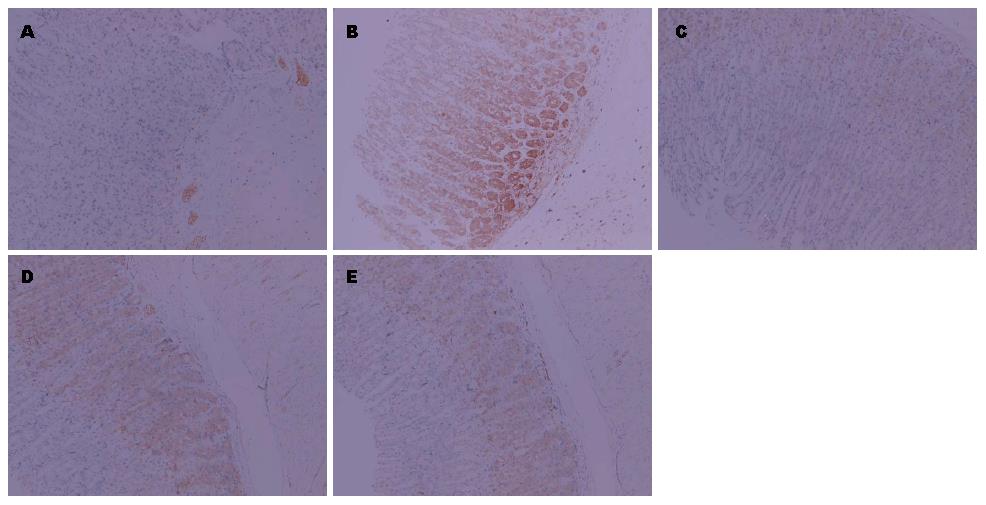
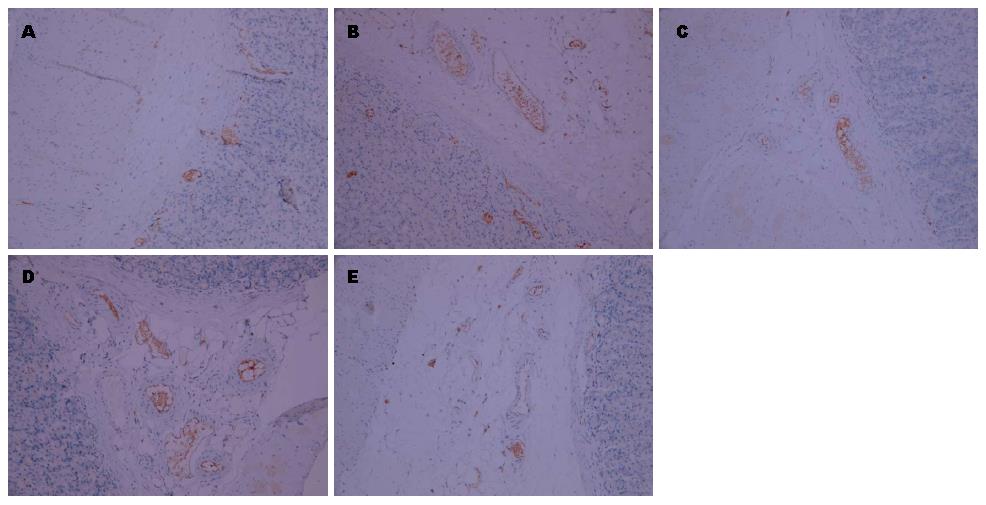
免疫组织化学结果显示, TGF-β1表达主要在胃黏膜上皮细胞的细胞浆和细胞膜, 阳性结果为细胞质染成棕黄色, 细胞核染成淡蓝色. 造模组大鼠胃黏膜组织TGF-β1表达量明显增加, 与假手术组大鼠比较差异有统计学意义(P<0.01), 缬沙坦预防组、常规剂量组和加倍剂量组大鼠胃黏膜组织TGF-β1阳性表达率较造模组降低, 差异均有统计学意义(P<0.01, P<0.05)(图2, 表1). CD34阳性表达主要见于血管内皮细胞胞浆中, 呈棕色或棕褐色染色. 微血管一般呈管腔样结构, 有些只见血管内皮细胞呈点状或线状不均匀分布. 造模组大鼠胃黏膜组织微血管密度值明显增加, 与假手术组大鼠比较差异有统计学意义(P<0.01), 缬沙坦预防组、正常剂量组和加倍剂量组大鼠胃黏膜组织微血管密度值与造模组相比较, 差异均有统计学意义(P<0.05)(图3).
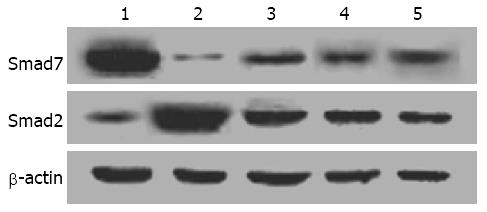
Western blot结果显示, 与假手术组相比, 造模组大鼠胃黏膜组织Smad2蛋白表达明显升高(P<0.01), 而Smad7蛋白表达明显降低(P<0.01). 缬沙坦预防组、常规剂量组和加倍剂量组胃黏膜组织Smad2蛋白表达均低于造模组(P<0.05), Smad7蛋白表达均高于造模组(P<0.05)(表1, 图4).
缬沙坦预防组、常规剂量组和加倍剂量组大鼠血清PRA水平明显高于造模组(P<0.05); Ang-Ⅱ含量均高于造模组(P<0.01); 缬沙坦预防组、常规剂量组和加倍剂量组血清ALT水平低于造模组、ALB含量高于造模组, 但与造模组比较差异无统计学意义(表2).
| 分组 | n | PRA(ng/mL) | AngⅡ(pg/mL) | ALT(U/L) | ALB(g/L) |
| 假手术组 | 6 | 12.06±1.93 | 955.99±112.91 | 65.50±16.80 | 27.37±0.95 |
| 造模组 | 6 | 11.49±2.12 | 1110.38±193.85 | 79.00±42.69 | 24.00±1.89 |
| 缬沙坦预防组 | 10 | 16.49±2.77a | 1664.44±285.47b | 57.00±10.00 | 25.48±1.89 |
| 缬沙坦常规剂量组 | 10 | 15.92±4.30a | 1686.82±499.16b | 68.90±29.48 | 27.86±0.75 |
| 缬沙坦加倍剂量组 | 9 | 16.72±5.48a | 1734.07±326.66b | 67.22±22.61 | 26.24±0.92 |
目前多数学者认为, PHG是一种独立的血管性疾病[1,9]. 门静脉高压导致胃的静脉回流受阻, 使胃壁静脉淤血, 加上胃的动脉血供增多, 更加剧胃壁淤血. 在长期的高压力血流作用下, 胃壁的血管发生适应性代偿反应, 胃黏膜毛细血管和小静脉形态和结构异常, 表现为血管扩张, 管壁增厚. 血管内皮的增厚扩大了损伤因子作用的靶点, 使得胃黏膜对损伤因子的易感性增强, 导致黏膜下水肿, 影响营养物质的弥散[1]. 此外, 门脉高压时胃黏膜血管再生能力减弱, 直接影响胃黏膜损伤后修复, 可能是引发胃黏膜出血的重要因素之一[10,11].
本研究发现, 假手术组大鼠4 wk后胃黏膜微血管结构完整, 管壁光滑. 造模组胃黏膜下微血管显著扩张, 管壁变薄; 毛细血管数量增加, 管腔扩张、淤血, 与文献报道一致[1,12]. 缬沙坦预防组、常规剂量组和加倍剂量组大鼠胃黏膜下微血管扩张扭曲减轻, 毛细血管数量减少, 管腔扩张减轻. 由CD34标记的微血管密度值在造模组和缬沙坦预防组、常规剂量组和加倍剂量组均明显高于假手术组, 缬沙坦预防组、常规剂量组和加倍剂量组微血管密度值与造模组比较有显著性差异(P<0.05), 提示缬沙坦干预后胃黏膜水肿减轻, 血管结构改变好转, 扩张淤血减轻, 胃黏膜的微循环得到改善, 起到了一定治疗作用[12].
降低门静脉压力是治疗PHG的关键, 目前已有多种药物通过减少门静脉血流量或降低肝内血管阻力来降低门静脉压力[13-15], 但尚无一种药物即能降低门静脉压力, 又能抗肝纤维化并无明显副作用. 缬沙坦是一种口服有活性的强力特异性血管紧张素(AngⅡ)Ⅰ型受体拮抗剂, 他选择性作用于AngⅡ1型受体发挥降低血压作用, 具有平稳降压和保护心、脑、肾等靶器官作用. 研究证实, 缬沙坦能够较好地降低肝硬化患者门静脉压力, 并具有一定的抗肝纤维化作用[16-18]; 其抗纤维化作用可能是通过消除AngⅡ对TGF-β1自分泌的正调控作用, 抑制TGF-β1及其受体(TRⅡ mRNA)的合成和表达, 抑制肝星状细胞活化、增殖和转化, 减少细胞外基质的合成, 从而发挥抗肝纤维化的作用, 间接促进门静脉压力的降低[19-21].
TGF-β1在调节细胞增殖、分化、血管形成和组织纤维化等方面起重要作用[22,23]. TGF-β1通过Smad信号转导通路发挥其生物学效应[24-27], 当TGF-β1与TGF-β1Ⅱ型受体(TGF-β1RⅡ)结合后, 继而活化TGF-β1Ⅰ型受体(TGF-β1RⅠ),活性TGF-β1RⅠ的激酶区直接使Smad2、3自动磷酸化, 与共同介质型Smad4形成异源寡聚体复合物, 该复合物随即转移到细胞核, 介导TGF-β1的生物学效应. 而抑制型Smad6、7是细胞中TGF-β1RⅠ拮抗蛋白, 能牢固的与TGF-β1RⅠ结合, 使之无法将Smad2、3磷酸化而阻断信号转导过程. 已有研究证实, 肝脏纤维化发生发展中, 肝星状细胞(hepatic stellate cells, HSC)大量表达TGF-β1和Smad2、4, 而Smad7表达被抑制[28,29]. 本实验发现造模组大鼠胃黏膜组织TGF-β1和Smad2蛋白表达明显增强, 而Smad7蛋白表达明显降低, 与假手术组比较差异有统计学意义(P<0.01). 实验结果表明, 正常胃黏膜组织内有大量Smad7表达而TGF-β1、Smad2较少, PHG大鼠胃黏膜组织内Smad7表达明显减少而TGF-β1、Smad2显著增多. 应用缬沙坦干预后各组大鼠胃黏膜TGF-β1、Smad2和Smad7蛋白水平出现相应变化, 缬沙坦预防组、常规剂量组和加倍剂量组大鼠胃黏膜组织中TGF-β1和Smad2蛋白表达均低于模型组; Smad7蛋白表达高于模型组, 提示缬沙坦能够作用于TGF-β1下游信号通道蛋白Smad, 提升PHG大鼠胃黏膜组织内Smad7, 同时抑制Smad2蛋白表达, 作用于TGF-β1的正负反馈环路, 在各阶段阻断TGF-β1发挥病理作用.
本实验结果还显示, 缬沙坦干预后大鼠血清PRA、AngⅡ水平明显升高(P<0.05), 与缬沙坦拮抗AngⅡ受体, 减少AngⅡ的消耗, 并且减少对肾上腺皮质球状带的刺激, 从而减少醛固酮的分泌, 减轻水钠潴留有关. 此外, 缬沙坦干预各组大鼠血清白蛋白水平与造模组比较有所升高, 丙氨酸转氨酶水平有所降低, 虽然差异无统计学意义(P>0.05), 可能与样本数量较少有关, 但提示其具有一定的保护肝脏功能作用[13,30].
总之, 缬沙坦具有降低门脉压力作用, 并可能通过抑制TGF-β1/Smad信号通路来改善门静脉高压性胃黏膜血管病变, 但长期疗效和药物的不良反应仍有待进一步研究证实.
肝硬化门脉高压性胃病是肝功能失代偿期的表现, 其所致的上消化道出血仅次于食管胃底静脉曲张破裂出血. 加之此类患者凝血功能差, 常导致肝脏功能进一步恶化, 加速肝性脑病、肝肾综合征等并发症出现, 影响患者预后. 选择既能平稳降低门脉压力, 又能改善肝脏功能药物已经成为人们关注的热点.
陈光, 教授, 吉林大学第一医院消化器官外科
肝硬化门脉高压症是导致门脉高压性胃病的重要发病机制之一, 有效降低门脉高压理论上可以阻止和改善胃黏膜病变. 目前治疗方法包括手术、介入和药物. 肝移植手术费用高, 肝源少; TIPS短期内能够降低门脉高压, 但远期并发症较多; 药物治疗是目前研究热点.
研究报道肝硬化门脉高压性胃病是一种血管性疾病, 血管紧张素Ⅱ与肝硬化门脉高压症的形成密切相关. 血管紧张素Ⅱ1型受体拮抗剂沙坦类药物能够降低门静脉压力, 改善胃黏膜微循环, 且不良反应少, 不引起明显的血压、心率的改变.
缬沙坦改善肝硬化门脉高压性胃黏膜病变的作用机制目前不十分清楚. 本课题发现缬沙坦能够抑制胃黏膜组织TGF-β1的合成和分泌, 通过上调Smad2表达、下调Smad7表达来调控TGF-β1发挥作用, 从而减少胃黏膜血管损伤, 减轻血管病变程度.
肝硬化门脉高压性胃病及其并发症是肝硬化患者的主要威胁. 缬沙坦能够减少PHG大鼠胃黏膜血管损伤, 减轻血管病变程度; 并有降低血清丙氨酸转氨酶、升高白蛋白趋势, 对肝脏功能具有一定保护作用, 为临床使用缬沙坦提供了理论依据.
本文具有较好的学术价值, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Khomeriki SG, Zhukov AG. [Morphological features of the gastric mucosa capillary network in patients with portal hypertension]. Arkh Patol. 2011;73:43-47. [PubMed] |
| 2. | Al-Busafi SA, McNabb-Baltar J, Farag A, Hilzenrat N. Clinical manifestations of portal hypertension. Int J Hepatol. 2012;2012:203794. [PubMed] |
| 3. | Hidaka H, Nakazawa T, Shibuya A, Minamino T, Takada J, Tanaka Y, Okuwaki Y, Watanabe M, Koizumi W. Effects of 1-year administration of olmesartan on portal pressure and TGF-beta1 in selected patients with cirrhosis: a randomized controlled trial. J Gastroenterol. 2011;46:1316-1323. [PubMed] [DOI] |
| 5. | Jia D, Duan F, Peng P, Sun L, Liu X, Wang L, Wu W, Ruan Y, Gu J. Up-regulation of RACK1 by TGF-β1 promotes hepatic fibrosis in mice. PLoS One. 2013;8:e60115. [PubMed] [DOI] |
| 6. | Sun YC, Liang Q, Qian KL, Xiao L, Liu Q, Shi XF. [Effect of TGF-b1 siRNA-mediated silencing on Smad proteins in hepatic fibrosis rats]. Zhonghua Ganzangbing Zazhi. 2012;20:289-293. [PubMed] |
| 9. | Perini RF, Camara PR, Ferraz JG. Pathogenesis of portal hypertensive gastropathy: translating basic research into clinical practice. Nat Clin Pract Gastroenterol Hepatol. 2009;6:150-158. [PubMed] [DOI] |
| 10. | Pan WD, Liu Y, Lin N, Xu R. The expression of PEDF and VEGF in the gastric wall of prehepatic portal hypertensive rats. Hepatogastroenterology. 2011;58:2152-2155. [PubMed] [DOI] |
| 11. | Kalafateli M, Triantos CK, Nikolopoulou V, Burroughs A. Non-variceal gastrointestinal bleeding in patients with liver cirrhosis: a review. Dig Dis Sci. 2012;57:2743-2754. [PubMed] [DOI] |
| 13. | Biecker E. Portal hypertension and gastrointestinal bleeding: diagnosis, prevention and management. World J Gastroenterol. 2013;19:5035-5050. [PubMed] [DOI] |
| 14. | Agasti AK, Mahajan AU, Phadke AY, Nathani PJ, Sawant P. Comparative randomized study on efficacy of losartan versus propranolol in lowering portal pressure in decompensated chronic liver disease. J Dig Dis. 2013;14:266-271. [PubMed] [DOI] |
| 15. | Tang SH, Zhang MM, Wu XJ, Wang KJ. [A meta-analysis of the effect and safety of angiotensin II receptor blockers in treatment of portal hypertension in cirrhotic patients]. Zhonghua Neike Zazhi. 2011;50:1013-1018. [PubMed] |
| 16. | Huo LJ, Zhang SJ, Liu Y. [Clinical evaluation of valsartan on portal hypertension in patients with hepatic cirrhosis]. Zhonghua Ganzangbing Zazhi. 2010;18:622-623. [PubMed] [DOI] |
| 17. | Fierbinteanu-Braticevici C, Dragomir P, Tribus L, Negreanu L, Bengus A, Usvat R, Andronescu D. The effect of valsartan, an angiotensin II receptor antagonist, on portal and systemic hemodynamics and on renal function in liver cirrhosis. J Gastrointestin Liver Dis. 2006;15:337-342. [PubMed] |
| 18. | Moreno M, Gonzalo T, Kok RJ, Sancho-Bru P, van Beuge M, Swart J, Prakash J, Temming K, Fondevila C, Beljaars L. Reduction of advanced liver fibrosis by short-term targeted delivery of an angiotensin receptor blocker to hepatic stellate cells in rats. Hepatology. 2010;51:942-952. [PubMed] [DOI] |
| 19. | Subeq YM, Ke CY, Lin NT, Lee CJ, Chiu YH, Hsu BG. Valsartan decreases TGF-β1 production and protects against chlorhexidine digluconate-induced liver peritoneal fibrosis in rats. Cytokine. 2011;53:223-230. [PubMed] [DOI] |
| 20. | Qiang G, Zhang L, Yang X, Xuan Q, Shi L, Zhang H, Chen B, Li X, Zu M, Zhou D. Effect of valsartan on the pathological progression of hepatic fibrosis in rats with type 2 diabetes. Eur J Pharmacol. 2012;685:156-164. [PubMed] [DOI] |
| 21. | Peng J, Li X, Feng Q, Chen L, Xu L, Hu Y. Anti-fibrotic effect of Cordyceps sinensis polysaccharide: Inhibiting HSC activation, TGF-β1/Smad signalling, MMPs and TIMPs. Exp Biol Med (Maywood). 2013;238:668-677. [PubMed] [DOI] |
| 22. | Huo LJ, Huang HF, Yang BY. [The effect of angiotensin II type 1 receptor blocker valsartan in rats with portal hypertensive gastropathy]. Zhonghua Ganzangbing Zazhi. 2006;14:611-613. [PubMed] |
| 23. | Samarakoon R, Overstreet JM, Higgins PJ. TGF-β signaling in tissue fibrosis: redox controls, target genes and therapeutic opportunities. Cell Signal. 2013;25:264-268. [PubMed] [DOI] |
| 24. | Zhang L, Li Y, Chen M, Su X, Yi D, Lu P, Zhu D. 15-LO/15-HETE Mediated Vascular Adventitia Fibrosis via p38 MAPK-Dependent TGF-β. J Cell Physiol. 2014;229:245-257. [PubMed] [DOI] |
| 25. | Kitao A, Sato Y, Sawada-Kitamura S, Harada K, Sasaki M, Morikawa H, Shiomi S, Honda M, Matsui O, Nakanuma Y. Endothelial to mesenchymal transition via transforming growth factor-beta1/Smad activation is associated with portal venous stenosis in idiopathic portal hypertension. Am J Pathol. 2009;175:616-626. [PubMed] [DOI] |
| 27. | Deng YL, Xiong XZ, Cheng NS. Organ fibrosis inhibited by blocking transforming growth factor-β signaling via peroxisome proliferator-activated receptor γ agonists. Hepatobiliary Pancreat Dis Int. 2012;11:467-478. [PubMed] |
| 28. | Xu W, Song S, Huang Y, Gong Z. Effects of perindopril and valsartan on expression of transforming growth factor-beta-Smads in experimental hepatic fibrosis in rats. J Gastroenterol Hepatol. 2006;21:1250-1256. [PubMed] |
| 29. | Bi WR, Yang CQ, Shi Q. Transforming growth factor-β1 induced epithelial-mesenchymal transition in hepatic fibrosis. Hepatogastroenterology. 2012;59:1960-1963. [PubMed] [DOI] |
| 30. | Sipal S, Halici Z, Kiki I, Polat B, Albayrak A, Albayrak F, Karakus E, Aksak S, Ozturk B, Gundogdu C. Comparative study of three angiotensin II type 1 receptor antagonists in preventing liver fibrosis in diabetic rats: stereology, histopathology, and electron microscopy. J Mol Histol. 2012;43:723-735. [PubMed] [DOI] |