修回日期: 2013-10-28
接受日期: 2013-11-19
在线出版日期: 2014-01-08
目的: 研究乙型肝炎病毒x基因(hepatitis B virus x gene, HBx)蛋白调节细胞内钙离子可能分子机制, 揭示乙型肝炎病毒(hepatitis B virus, HBV)诱导肝癌的可能途径.
方法: 培养HEK293细胞, 取第2代HEK293细胞转染pcDNA-HBx质粒, 培养12、24和48 h后, 细胞活力细胞毒性检测(cell counting kit-8, CCK-8)观察转染后细胞生长情况, Western blot检测HBx蛋白的表达情况, 当共同转染HBx基因、Orai1基因或STIM1基因后co-IP实验、免疫荧光检测观察细胞内蛋白结合情况.
结果: 转染pcDNA-HBx质粒后HBx蛋白可以在HEK293细胞高表达, 转染后的24 h后细胞增殖加快(P<0.05), co-IP实验及免疫荧光检测结果均显示, HBx蛋白在细胞内可以与Orai1蛋白结合.
结论: HBx蛋白通过与细胞膜钙离子通道Orai1结合, 来升高细胞内钙离子浓度, 从而影响细胞增殖等活性.
核心提示: 本研究首次发现在细胞内乙肝病毒x基因(hepatitis B virus x gene, HBx)蛋白可以与SOCs在细胞膜上的孔蛋白Orai1蛋白相互作用, 这可能是HBx蛋白通过内质网途径调节细胞内钙离子平衡的重要途径, 从而影响细胞生物活性, 加速肝细胞恶性转变.
引文著录: 王君, 何生松, 刘亚男, 张盼, 姚景宏. HBx蛋白与细胞膜钙离子通道蛋白Orai1的关系. 世界华人消化杂志 2014; 22(1): 80-85
Revised: October 28, 2013
Accepted: November 19, 2013
Published online: January 8, 2014
AIM: To determine whether HBx protein elevates the intracellular calcium through interacting with SOC components (STIM1 and Orai1).
METHODS: The pcDNA-Flag-HBx plasmid was transfected into HEK293 cells, and viability of transfected cells was determined by cell counting Kit-8 (CCK8). The interaction between SOC components and HBx protein was confirmed in co-immunoprecipitation (Co-IP) and immunofluorescence assays. Subsequent confocal microscopic analysis revealed that HBx protein also co-localizes with full-length STIM1 and Orai1 complexes in HEK293 cells following Ca2+ store depletion.
RESULTS: The results indicated that HBx protein interacts with the Orai1 in binding assays and this interaction may be modulated by the intracellular Ca2+ concentration.
CONCLUSION: HBx protein binds to STIM1-Orai1 complexes to positively regulate the activity of SOCs.
- Citation: Wang J, He SS, Liu YN, Zhang P, Yao JH. Hepatitis B virus X protein disturbs intracellular calcium signaling by binding to Orai1 protein. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 80-85
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/80.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.80
在我国乙型肝炎病毒(hepatitis B virus, HBV)感染是肝细胞癌(hepatocellular carcinoma, HCC)的最主要致病原因, 绝大部分HCC患者合并有HBV感染[1]. HBV促进肝细胞恶变及侵袭、转移, HBV可以通过内质网应激, 增加细胞对缺氧耐受从而促进肿瘤细胞生长, 还可以通过干预细胞内钙离子平衡从而影响细胞生长, 参与肝癌的形成, 但是其具体作用机制尚不明确[2-4]. 乙肝病毒x基因(hepatitis B virus x gene, HBx)编码的HBx蛋白具有强大的恶性转化能力, 与肝细胞肝癌发生关系密切[5]. HBx蛋白是一种多功能蛋白, 可以调节细胞转录、蛋白降解、细胞胞浆钙离子信号、细胞周期及细胞的凋亡途径[4,6]. 钙离子是重要的细胞内第二信使, 参与细胞的多种生理病理过程[7]. 已有研究表明, 经通透性钙池调节离子通道SOCs进入细胞的钙离子对肝细胞系Huh-7和HepG2细胞的增殖发挥重要作用[8]. 我们发现, HBx在促进HBV复制及肝细胞增殖恶性转化过程中, 常首先激活钙离子信号, 引起细胞内钙离子浓度失稳, 但是HBx蛋白是如何调节细胞内钙离子机制目前还不清楚, 本研究从内质网途径入手研究HBx蛋白调节细胞内钙离子可能分子机制.
HEK293(ATCC, Manassas, USA); BL21(DE3)菌株、携带HBx全长基因的pcDNA-Flag-HBx质粒及pcDNA-GFP-HBx质粒、携带Orai1全长基因的pcDNA-HA-Orai1质粒、携带 基质交互作用蛋白1(stromal interaction molecule-1, STIM1)全长基因的pcDNA-HA-STIM1质粒(从NIH神经实验室Prof. Lutz Birnbaumer处获得); 细胞培养基DMEM、6孔培养板、胎牛血清(Gibco公司); PBS(武汉博士德公司); 蛋白质marker(晶美生物有限公司); 胰蛋白酶、鼠单克隆HA抗体、羊抗鼠多克隆抗体、flag-beeds、HA-beeds、CY3标记的HA IgG(Sigma公司); ECL显色试剂盒(默克公司); 细胞活力细胞毒性检测(cell counting kit-8, CCK-8)试剂盒(碧云天生物技术研究所); Lipofectamine 2000(Invitrogen); 倒置相差显微镜(日本OLYMPUS); 激光共聚焦显微镜(日本OLYMPUS).
1.2.1 细胞培养: HEK293细胞使用10%胎牛血清的DMEM培养基培养, 待细胞贴壁生长达80%-90%融合度时, 细胞生长状态良好, 预热的PBS洗细胞, 弃去PBS; 用预热的胰蛋白酶消化细胞, 细胞脱落后, 加入含10%FBS培养液终止消化反应, 并将细胞悬液转入离心管中; 1000 r/min, 离心5 min, 去除上清; 加入10 mL DMEM培养液(含10%FBS), 重新悬浮细胞, 进行细胞计数, 将适当数量的细胞悬液转至6孔培养板中(细胞密度6×104个/mL); 置于37 ℃ 5%CO2的培养箱中培养.
1.2.2 细胞转染: 在Lipofectamine 2000介导下, 将pcDNA-Flag-HBx、pcDNA-HA-Orai1、pcDNA-HA-STIM1及空载质粒转染或共转染HEK293细胞. 分别将需要共转染质粒各2.5 g装入250 L不含血清的DMEM培养基的1.5 mL Ep管中混匀. 将10 L Lipofectamine 2000装入500 L不含血清的DMEM培养基的1.5 mL Ep管中混匀, 将含2.5 g质粒的无血清培养基分别和含有5 L Lipofectamine 2000的无血清培养基250 L混合, 轻轻混匀, 室温静置30 min. 将含有DNA和脂质体的液体小心加入换液后的每个培养孔中, 分散均匀, 置于37 ℃ 5%CO2的培养箱孵育5 h后去除含脂质体复合物的培养基, 加入2 mL含10%血清的DMEM培养基, 置于37 ℃ 5%CO2的培养箱中培养48 h.
1.2.3 细胞活性检测: CCK8检测转染后细胞增殖情况: 将转染后的第2代细胞接种到96孔板, 密度为2.5×103个/孔, 每孔设置4个复孔. 每孔加入100 L细胞悬液, 后加入含胎牛血清10%培养液150 L. 置于37.0 ℃、5%CO2浓度和饱和湿度的培养箱中培养, 每24 h换液1次, 实验组为转染细胞组, 对照组(control)未转染细胞组. 分别在0、12、24、48 h, 每个时间点取出96孔板, 实验组对照组每次取6个孔, 加入细胞毒性/增殖检测试剂CCK-8 10 L, 避光放入37.0 ℃培养箱中培养2 h, 取出用酶标仪测吸光度值, 激发光波长为450 nm. 每个时间点取出96孔板, 加入20 L的CCK8试剂, 避光, 37 ℃孵育2 h, 后使用分光光度计450 nm检测吸光光度值, 根据吸光光度值确定存活的细胞个数, 并与对照组细胞增殖情况进行
对比.
1.2.4 Western blot检测HBx蛋白的表达: 转染48 h后, 吸走培养孔中培养基, 用PBS洗涤2次, 加入预冷的细胞裂解液(含cocktail蛋白酶抑制剂)1 mL, 细胞刮收集细胞; 超声裂解细胞; 4 ℃, 8000 r/min, 离心15 min, 取上清, 水浴65 ℃ 5 min, 蛋白变性. 取适量表达蛋白样品上样后, 用12% SDS-PAGE电泳分离, 然后转印于PVDF膜上, 用含5%的脱脂奶粉TBST室温封闭蛋白印迹膜l h, 加入一抗即鼠单克隆myc抗体, 4 ℃孵育过夜, 用TBST振摇洗涤3次, 10 min/次, 加入二抗即羊抗鼠IgG, 室温孵育2 h, 接着用TBST振摇洗涤3次, 10 min/次, 用ECL显色, 暗室胶片曝光显影.
1.2.5 免疫共沉淀: 转染48 h后收集细胞, 提取目的蛋白(具体操作同上). 取30 L含有flag蛋白的琼脂糖珠(flag-beeds)或HA蛋白的琼脂糖珠(HA-beeds), 用预冷的RIPA buffer洗3遍, 12000 r/min,离心1 min, 并用RIPA buffer配制成1:1琼脂糖珠悬浮液. 将琼脂糖珠悬浮液加入到已收集的细胞裂解液中, 4 ℃层析柜旋转孵育4 h. 在4 ℃, 以12000 r/min, 离心3 min; 将上清小心吸去, 琼脂糖珠悬浮液用预冷的RIPA buffer洗3遍, 800 L/遍; 最后加入35 L 2×SDS上样缓冲液, 将上样样品水浴95 ℃ 5 min, 蛋白变性. 取适量表达蛋白样品上样后, 用10%的SDS-PAGE电泳分离, 然后转印于PVDF膜上, 用含5%的脱脂奶粉TBST室温封闭蛋白印迹膜l h, 加入一抗即鼠单克隆HA抗体或flag抗体, 4 ℃孵育过夜. 用TBST振摇洗涤3次, 10 min/次, 加入二抗即羊抗鼠IgG, 室温孵育2 h, 接着用TBST振摇洗涤3次, 10 min/次, 用ECL显色, 暗室胶片曝光显影.
1.2.6 免疫荧光检测HBx蛋白在细胞内与Orai1蛋白结合: 取6孔板, 将其分为3组, 每组2孔. 每孔先放入细胞爬片, 用0.1 mg/mL多聚赖氨酸包被各孔. 3组每孔均接种HEK293细胞悬液2 mL(细胞密度6×104个/mL), 置于37 ℃、5%CO2细胞培养箱培养, 待细胞贴壁生长达80%时, 分别用pcDNA-GFP-HBx、pcDNA-HA-Orai、pcDNA-GFP-EV质粒共转染HepG2细胞. 转染48 h后, 吸走培养基, 用PBS轻柔的洗涤1次, 将细胞爬片用4%多聚甲醛固定15 min; 室温下, 用PBS洗涤3次, 10 min/次; 加入0.1%Triton X-100破膜3 min; 再次用PBS洗涤3次, 10 min/次; 用10%牛血清(BSA)封闭30 min, 300 L/孔; 吸出多余封闭血清, 用PBS轻柔的洗涤1遍, 加入由PBS稀释的CY3标记的HA IgG(1:100), 100 L/孔, 室温避光孵育12 h; 用PBS洗涤3次, 10 min/次; 取出细胞爬片甘油封片后于激光共聚焦显微镜下观察, 并拍照保存, 红色荧光为Orai1蛋白表达, 绿色荧光为HBx蛋白表达, 黄色荧光为细胞内HBx蛋白与Orai1蛋白的结合.
统计学处理 采用SPSS12统计软件处理数据, 测定结果均以mean±SD表示, 两组数据间使用配对t检验, P<0.05为差异有统计学意义.
培养HEK293细胞, 采用脂质体Lipofectamine 2000方法转染细胞, 24 h用显微镜观察细胞生长情况, 观察结果显示转染后的细胞生长良好(图1).
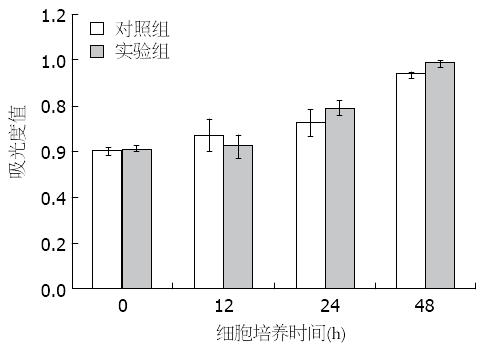
使用pcDNA-HBx质粒转染HEK293细胞后, 使用CCK8试剂观察细胞的活性, 结果显示24、48 h, 实验组与对照组相比吸光度值均明显增高(P<0.05), 显示转染pcDNA-HBx质粒后HEK293细胞增殖明显加快(图2).
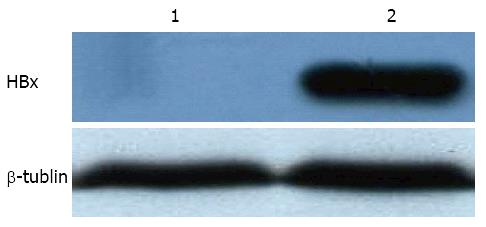
pcDNA-HBx或者pcDNA质粒转染HEK293细胞24 h后, 并且HBx蛋白使用myc标记, 收集HEK293细胞通过Western blot检测结果显示细胞内可以表达HBx蛋白, 对照组无表达(图3).
为检测HBx蛋白如何通过内质网调节细胞内钙离子, 收集HEK293细胞蛋白, 进行co-IP实验, 验证Orai1或者STIM1蛋白是否可以HBx蛋白结合, co-IP实验结果示, 共转染HA标记的Orai1基因, HA标记的STIM1基因及Flag标记的HBx基因到HEK293细胞, 使用co-IP技术HA标记的Orai1蛋白可以与Flag标记的HBx蛋白免疫共沉淀(图4), 表明Orai1-HBx在HEK293细胞内可以发生聚合, Orai1蛋白可以直接与HBx蛋白结合. 而对照组HA标记的STIM蛋白不与HBx蛋白发生免疫共沉淀, 因此结果显示在细胞内HBx蛋白可以与Orai1蛋白形成异二聚体, 从而影响细胞内钙离子的平衡.
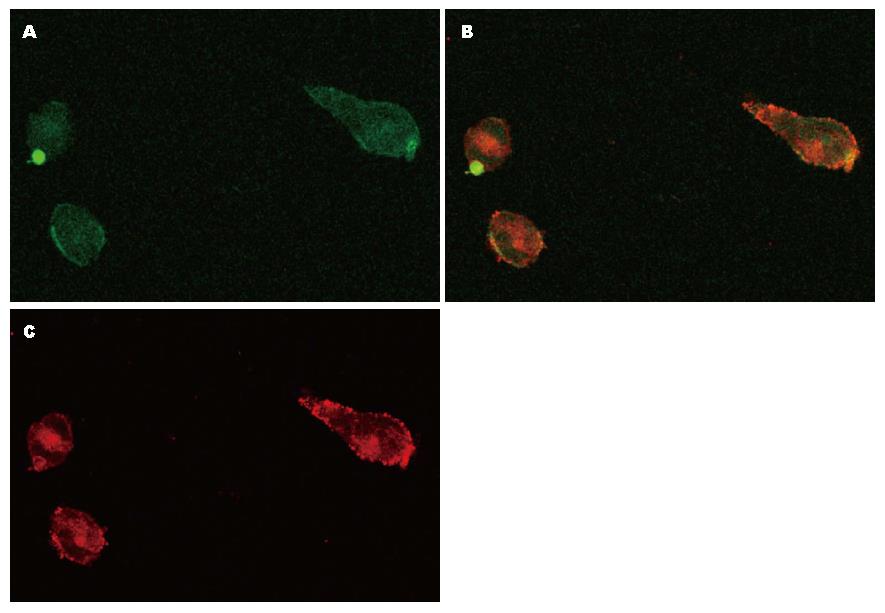
pcDNA-GFP-HBx或者pcDNA-HA-Orai1质粒转染HEK293细胞后, 48 h后收集细胞进行免疫荧光染色, 后通过激光共聚焦显微镜观察细胞(图5), 结果显示: GFP标记的HBx蛋白主要在细胞浆表达, 细胞核也有少量表达, 为绿色, HA-Orai1蛋白使用cy3标记的二抗, 主要在细胞膜表达, 为红色, 阳性细胞即细胞内HBx基因表达蛋白与细胞内的Orai1蛋白结合的细胞细胞内为黄色, 阴性细胞为红色或绿色(即二者蛋白无结合). 用过激光共聚焦软件分析显示阳性细胞数为46个, 对照组细胞内无相关蛋白表达.
HBV复制与肝癌的发生密切相关, Hbx蛋白是HBV的核心蛋白, 他是一种多功能蛋白, 可以调节细胞转录、蛋白降解、细胞浆钙离子信号、细胞周期及细胞的凋亡途径, 其中调节细胞浆钙离子信号、蛋白酶体的活性等与HBV复制及肝细胞增殖密切相关, 但是HBx蛋白是如何干预细胞内钙离子平衡来调节细胞增殖从而影响HBV复制, 具体机制不清.
目前研究显示HBx蛋白可以增加细胞内钙离子及促进细胞增殖[9,10], 而且HBx蛋白通过线粒体途径干扰细胞内钙离子平衡已有报道[11], 但是内质网做为细胞钙离子储存库, 可以调节及维持细胞内钙离子平衡[12]. 为明确HBx蛋白经如何通过内质网相关途径调节细胞内钙离子平衡的, 本课题组从内质网钙离子调节关键蛋白Orai1及STIM1入手, 探讨HBx蛋白调节细胞内钙离子平衡机制. Orail蛋白是钙离子释放激活的钙离子通道(CRAC通道)重要的亚单位, 对存储调控性钙离子内流(store-operated calcium entry, SOCE)起着关键性作用[13]. STIM1为内质网Ca2+浓度感受器, Orail是SOCs在细胞膜上的孔蛋白, 同时发现Orail与STIM1的联合作用可以大大提高SOCE和CRAC通道的活性[14,15]. Oh等[16]研究表明, HBx能升高细胞内钙离子浓度, 激活细胞信号通道, 促进细胞增殖. 我们研究发现, Western blot检测转染后细胞内HBx蛋白的表达情况, 结果显示转染后的HEK293细胞可以表达HBx蛋白. co-IP实验证实在细胞内HBx蛋白可以与Orai1蛋白形成异二聚体, 该结果显示在细胞内HBx蛋白可以与SOCs在细胞膜上的孔蛋白Orai1蛋白相互作用. 因此HBx蛋白与Orai1蛋白结合可能是HBx蛋白通过内质网途径调节细胞内钙离子平衡的重要途径, 从而影响细胞生物活性. 免疫荧光检测再次证明在细胞内HBx蛋白可以与Orai1蛋白结合, 从而影响细胞内钙离子平衡. 此实验结果与之前研究HBx蛋白通过线粒体途径调节细胞内钙离子平衡有所不同, Gearhart等[11]研究发现HBx蛋白可以通过线粒体途径调节细胞内钙离子平衡, 影响细胞的生理活性. CCK8检测显示HEK293细胞转染HBx质粒后, 细胞增殖加速, 此结果可能与HBx蛋白与Orai1蛋白相互作用, 升高细胞内钙离子, 加快细胞增殖有关. 其中转染后12 h, 细胞数较对照组减少, 可能与转染时加入Lipofectamine 2000有关. 此结果与Yang等[17]研究相似, 与HBV感染后可能导致癌症形成有关.
本研究从内质网着手研究HBx蛋白调节细胞内钙离子的具体分子途径, 首次提出HBx蛋白可以与Orai1蛋白结合干预细胞内钙离子平衡, 从而调节细胞增殖等生物活性, 可能与癌症形成有关, 但是HBx蛋白与Orai1蛋白结合的具体部位, 及二者结合后对细胞内钙离子平衡的影响等目前还不清楚, 还需继续研究.
在我国乙型肝炎病毒(hepatitis B virus, HBV)感染是肝细胞癌的最主要致病原因, 近年来发现HBV的x基因编码蛋白即乙型肝炎病毒x基因(hepatitis B virus x gene, HBx)在肝细胞癌(hepatocellular carcinoma, HCC)的发生和发展过程中发挥重要的作用. 钙离子是重要的细胞内第二信使, 参与细胞的多种生理病理过程. 本研究从内质网途径入手研究HBx蛋白调节细胞内钙离子可能分子机制.
傅晓辉, 副教授, 副主任医师, 东方肝胆外科医院
已有实验研究发现HBx在促进HBV复制及肝细胞增殖恶性转化过程中, 常首先激活钙离子信号, 引起细胞内钙离子浓度失稳, 但是HBx蛋白是如何调节细胞内钙离子机制目前还不清楚, 需进一步研究.
目前研究表明HBx蛋白可以增加细胞内钙离子内流及促进细胞增殖, 而且HBx蛋白通过线粒体途径干扰细胞内钙离子平衡已经有报道.
做为细胞钙离子储存库的内质网, 在调节及维持细胞内钙离子平衡方面起着重要作用. 但HBx蛋白如何通过内质网相关途径调节细胞内钙离子平衡却鲜有报道, 本课题组从内质网钙离子调节关键蛋白Orai1及STIM1入手, 探讨HBx蛋白调节细胞内钙离子平衡机制.
本研究从内质网着手研究HBx蛋白调节细胞内钙离子的具体分子途径, 揭示HBV诱导HCC的可能途径, 为肝癌研究提供新的研究方向.
本文首次提出HBx蛋白可以与Orai1蛋白结合干预细胞内钙离子平衡, 从而影响细胞增殖等生物活性, 提示了乙型肝炎病毒与肝癌发生之间新的关系.
编辑: 田滢 电编:鲁亚静
| 1. | Kew MC. Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma. J Gastroenterol Hepatol. 2011;26 Suppl 1:144-152. [PubMed] [DOI] |
| 2. | Samal J, Kandpal M, Vivekanandan P. Molecular mechanisms underlying occult hepatitis B virus infection. Clin Microbiol Rev. 2012;25:142-163. [PubMed] [DOI] |
| 3. | Azam F, Koulaouzidis A. Hepatitis B virus and hepatocarcinogenesis. Ann Hepatol. 2008;7:125-129. [PubMed] |
| 4. | Matsuda Y, Ichida T. Impact of hepatitis B virus X protein on the DNA damage response during hepatocarcinogenesis. Med Mol Morphol. 2009;42:138-142. [PubMed] [DOI] |
| 5. | Ng SA, Lee C. Hepatitis B virus X gene and hepatocarcinogenesis. J Gastroenterol. 2011;46:974-990. [PubMed] [DOI] |
| 6. | Rawat S, Clippinger AJ, Bouchard MJ. Modulation of apoptotic signaling by the hepatitis B virus X protein. Viruses. 2012;4:2945-2972. [PubMed] [DOI] |
| 8. | El Boustany C, Bidaux G, Enfissi A, Delcourt P, Prevarskaya N, Capiod T. Capacitative calcium entry and transient receptor potential canonical 6 expression control human hepatoma cell proliferation. Hepatology. 2008;47:2068-2077. [PubMed] [DOI] |
| 9. | Feitelson MA, Lee J. Hepatitis B virus integration, fragile sites, and hepatocarcinogenesis. Cancer Lett. 2007;252:157-170. [PubMed] |
| 10. | Gearhart TL, Bouchard MJ. The hepatitis B virus X protein modulates hepatocyte proliferation pathways to stimulate viral replication. J Virol. 2010;84:2675-2686. [PubMed] [DOI] |
| 11. | Gearhart TL, Bouchard MJ. Replication of the hepatitis B virus requires a calcium-dependent HBx-induced G1 phase arrest of hepatocytes. Virology. 2010;407:14-25. [PubMed] [DOI] |
| 13. | Hoover PJ, Lewis RS. Stoichiometric requirements for trapping and gating of Ca2+ release-activated Ca2+ (CRAC) channels by stromal interaction molecule 1 (STIM1). Proc Natl Acad Sci U S A. 2011;108:13299-13304. [PubMed] [DOI] |
| 14. | Numaga-Tomita T, Putney JW. Role of STIM1- and Orai1-mediated Ca2+ entry in Ca2+-induced epidermal keratinocyte differentiation. J Cell Sci. 2013;126:605-612. [PubMed] [DOI] |
| 15. | Wu MM, Buchanan J, Luik RM, Lewis RS. Ca2+ store depletion causes STIM1 to accumulate in ER regions closely associated with the plasma membrane. J Cell Biol. 2006;174:803-813. [PubMed] |
| 16. | Oh JC, Jeong DL, Kim IK, Oh SH. Activation of calcium signaling by hepatitis B virus-X protein in liver cells. Exp Mol Med. 2003;35:301-309. [PubMed] |
| 17. | Yang N, Tang Y, Wang F, Zhang H, Xu D, Shen Y, Sun S, Yang G. Blockade of store-operated Ca(2+) entry inhibits hepatocarcinoma cell migration and invasion by regulating focal adhesion turnover. Cancer Lett. 2013;330:163-169. [PubMed] [DOI] |