修回日期: 2013-11-12
接受日期: 2013-11-27
在线出版日期: 2014-01-08
目的: 研究血清和胆汁中中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin, NGAL)对于区分良恶性胆道狭窄的临床价值.
方法: 所研究患者是经内镜下逆行胰胆管造影进行胆道减压的患者. 共44例胆总管扩张患者, 恶性胆道狭窄患者共21例, 其中胆管癌12例, 胰腺癌8例, 壶腹癌1例, 良性胆道狭窄患者23例. 收集患者血清和胆汁并采用酶联免疫吸附试验方法检测其中NGAL的含量, 常规检测其他生化指标如血常规、肝功能等.
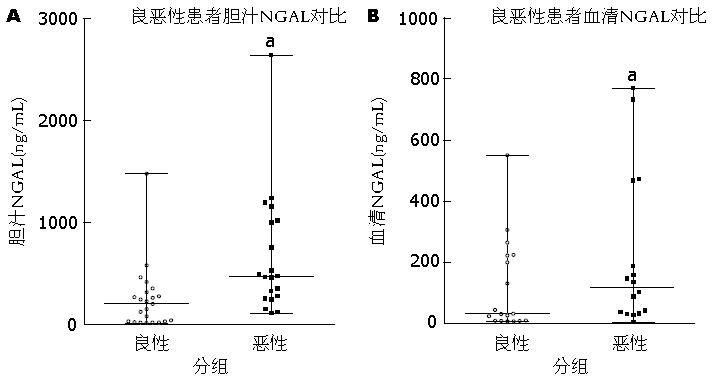
结果: 血清NGAL在区分良恶性胆道狭窄患者中没有明显区别, 差异无统计学意义(平均值31.10 ng/mL vs 118.35 ng/mL, P = 0.0825). 比起良性胆道狭窄疾病患者, 胆汁NGAL含量在恶性胆道狭窄患者中明显升高, 差异有统计学意义(平均值199.0 ng/mL vs 466.7 ng/mL, P = 0.0215) .
结论: 胆汁而非血清中NGAL含量对于鉴别良恶性胆道狭窄患者有临床意义.
核心提示: 胆汁而非血清中中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin, NGAL)含量对于鉴别良恶性胆道狭窄患者有临床意义. 相比较血清而言, 测定胆汁中NGAL的含量所受到外界的影响要小, 一定程度上使其特异性和敏感性高一些.
引文著录: 韩美玲, 吕志武. 血清及胆汁中NGAL对于区分良恶性胆道狭窄的临床意义. 世界华人消化杂志 2014; 22(1): 133-139
Revised: November 12, 2013
Accepted: November 27, 2013
Published online: January 8, 2014
AIM: To investigate the value of serum and bile neutrophil gelatinase associated lipocalin (NGAL) for distinguishing malignant strictures caused by cholangiocarcinoma (CCA) or pancreatic cancer from benign biliary strictures.
METHODS: The study was performed prospectively on patients admitted for endoscopic retrograde cholangiopancreatography biliary decompression. Forty-four patients with dilated biliary ducts, including 12 cases of CCA, 8 cases of pancreatic cancer, 1 case of carcinoma of the ampulla, and 23 cases of benign biliary strictures, were enrolled. Their sera and bile were collected to measure NGAL. Routine biochemistry including liver function test and routine blood examination was also performed. Enzyme-linked immunosorbent assay was performed to measure the contents of NGAL in serum and bile samples.
RESULTS: Serum NGAL had no significant value for discriminating malignant and benign biliary strictures (mean, 31.10 ng/mL vs 118.35 ng/mL, P = 0.0825). Biliary NGAL levels were significantly raised in the malignant disease group compared with the benign disease group (mean, 199.0 ng/mL vs 466.7 ng/mL, P = 0.0215).
CONCLUSION: Measurement of biliary NGAL, not serum NGAL, may differentiate malignant biliary strictures from benign biliary strictures.
- Citation: Han ML, Lv ZW. Serum and bile NGAL for clinically distinguishing malignant biliary strictures from benign biliary strictures. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 133-139
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/133.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.133
胰胆管恶性肿瘤是常见的癌症相关死亡原因之一, 死亡率高, 5年总体存活<5%[1,2]. 当患者诊断时多已经出现远处转移或局部浸润[3]. 胆管癌在过去的十几年中发病率在逐年增加[4,5]. 胰胆管肿瘤在早期往往缺乏特异性临床表现, 可仅出现中上腹腹胀、不适、隐痛、纳差、乏力、消瘦等症状, 因此对于该疾病的早诊较为困难, 在后期患者多表现为梗阻性黄疸.
对于胆管癌患者确定诊断是很困难的, 胆道狭窄的原因有很多, 除了恶性胆道狭窄外, 许多良性胆道疾病也有相似的临床表现, 如炎性(自身免疫性、感染性)、基因性的、血管性的等. 延迟的确定诊断和治疗多是因为诊断的不确定性. 外科手术仅仅针对于那些可能治愈的患者, 所以只能应用于一小部分人群[6,7]. 诊断的不确定往往导致处理方面的偏差, 目前对于恶性胆道梗阻的诊断多依赖于影像学(CT、MRI、超声内镜、胰胆管水成像)、胆道的细胞采集、胆道活检、血清肿瘤标志物等[8-10]. 典型的胆管癌常沿着胆管长轴生长[11], 且很少局部聚集, 然而影像学对于观察这一区域的病变往往可准定位, 但在确定良恶性方面帮助较少. 通过细胞刷和活检在胆道狭窄的部位可获得组织学样本, 但是细胞学和组织学检查敏感性一般小于<60%[12]. 蛋白质图谱在发现新的肿瘤标志物方面很有前景[13,14],但是在人类胆汁中很难成功。虽然人类的胆汁成分十分复杂,最近有研究证实在人类胆汁中蛋白可以定量,并且可以提取出蛋白质生物标记物[15-17]. 目前最常用的血清肿瘤标志物为糖原抗体(carbohydrate antigen 19-9, CA19-9)和癌胚抗原, 因其较低的敏感性和特异性对于胰胆管肿瘤的诊断仍需进一步研究. 因此, 临床中需要更多的可协助准确诊断并鉴别良恶性胆道梗阻的可靠的肿瘤标志物.
中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase associated lipocalin, NGAL)是一24 kDa分泌型糖蛋白, 从激活的中性粒细胞中释放出来, 在人类NGAL基因定位于9q34. 多种证据表明NGAL诱导了多种人类的癌症, 并且在这些癌症患者中存在NGAL高表达的现象, 比如皮肤癌[18]、甲状腺癌、乳腺癌[19,20]、卵巢癌[21,22]、子宫内膜癌[23]、结肠癌[24]、肺癌[25]、肝癌、胆管癌、食道癌[26]、胃癌[27,28]和胰腺癌[29,30]等. 有报道称在胃癌、胰腺癌和肝细胞癌的患者血清中有NGAL水平增高的现象[31-33]. 之前有研究报道了在胆管癌患者中血清NGAL有较正常患者明显升高的现象, 差异有统计学意义[34,35]. 很少有研究恶性胆道狭窄患者胆汁中NGAL含量的文献报道, 本文就NGAL在良恶性胆道狭窄患者中的含量区别进行研究.
选择于2013-02/2013-06就诊于哈医大二院的梗阻性黄疸的患者. 收集该病患者的逆行性胰胆管造影(endoscopic retrograde cholangiopancteatography, ERCP)术前周围静脉血, 以及行ERCP检查时收集患者胆汁. 将不符合实验要求的患者予以排除. 排除标准: 因NGAL在急性肾功能衰竭、肾功能不全或慢性胰腺炎的患者中明显增高[30,36,37], 因此以上疾病的患者予以排除. 同时将除胰胆管癌症以外的其他部位的恶性肿瘤、ERCP胆总管插管未成功者排除.
在患者行ERCP检查之前对患者进行采血至少4 mL, 置于4 ℃的冰箱中约2 h. 待血液凝结后在室温条件下1000 r/min的速度离心10 min, 取上清并置于EP管中密封后置于-80 ℃中保存, 待测量时备用. 在受试者行ERCP检查时, 向胆总管中注入造影剂之前抽出胆汁约5-10 mL, 置于试管中, 随后将试管避光并置于4 ℃冰箱中. 此后用离心机12000 r/min, 离心10 min. 取上清并置于EP管中密封后置于-80 ℃中保存, 待测量时备用. 待样本数达到预计值后将血清以及胆汁样本取出后做ELISA分析. ELISA试剂盒购自美国Cloud-Clone Corp.公司, 货品编号为SEB388Hu, 各项操作均严格按照说明进行. 同时患者的丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰氨转移酶等运用速率法进行检测, 血清总胆红素以及直接胆红素运用比色法进行检测.
统计学处理 使用Excel进行数据处理, 分析方法: 计量数据采用mean±SD进行描述, 计数数据采用计数和百分比进行描述; 主要分析指标与疾病是否具有相关性, 采用线性回归, 调整年龄与性别两个因素. 分析过程采用SAS9.3进行分析.
所选取符合实验入组标准的胆道狭窄的患者一共44例, 良性胆道狭窄患者23例, 恶性胆道狭窄患者21例. 良性胆道狭窄的病因包括: 胆总管结石18例、Oddi括约肌功能失调1例、胆道炎性狭窄2例、胆囊管管状腺瘤1例、十二指肠憩室1例等, 恶性胆道狭窄包括胆管癌12例、胰腺癌8例、壶腹癌1例. 在21例恶性胆道狭窄患者中有7例经病理证实, 其余患者均有经影像学诊断为恶性胆道狭窄, 包括彩超、超声内镜、肝胆胰CT/MRI、ERCP检查等. 所有肿瘤患者术前均未做放疗、化疗或免疫治疗. 按照α = 0.05检验水准, 良恶性胆道狭窄患者中血清NGAL含量在两组患者中分别为31.1 ng/mL(9.1 ng/mL±215.325 ng/mL) vs 118.35 ng/mL(36.65 ng/mL±256.2 ng/mL), P = 0.0825, 胆汁中NGAL含量在两组患者中分别为199.0 ng/mL(27.9 ng/mL±292.1 ng/mL) vs 466.7 ng/mL(270.05 ng/mL±102.5 ng/mL), P = 0.0215. 比起良性组, 恶性组患者血清总胆红素、γ-谷氨酰氨转移酶水平均较高, 血红蛋白水平较低, 差异有统计学意义(P值分别为0.0208、0.0324、0.0416). 年龄、性别、ALT、AST、ALP等生化指标在两组之间无明显差异. 患者良恶性胆道狭窄的基本特征比较如表1, 患者胆汁和血清中NGAL比较情况, 如图1.
| 指标 | 分组 | P值 | |
| 良性组 | 恶性组 | ||
| n | 23 | 21 | |
| 年龄(岁) | 59.13±10.58 | 65±10.50 | |
| 性别 | |||
| 男 | 15 | 12 | |
| 女 | 8 | 8 | |
| 血红蛋白(g/L) | 131.0(125.0±140.5) | 129.5(107.5±139.25) | <0.05 |
| ALT(U/L) | 46.0(16.0±103.0) | 57(35.5±103.25) | |
| AST(U/L) | 26.0(16.0±83.5) | 70.5(44±80.25) | |
| GGT(U/L) | 156.0(47.5±568.0) | 542.5(232.5±748.75) | <0.05 |
| ALP(U/L) | 105.5(78.5±188.25) | 189.5(156±358.5) | |
| 总胆红素(μmol/L) | 20.7(15.2±44.4) | 75.2(39.05±233.075) | <0.05 |
| 直接胆红(μmol/L) | 16.2(6.65±43.3) | 70.25(33.02±218.37) | |
| 血清NGAL(ng/mL) | 31.1(9.1±215.325) | 118.35(36.65±256.2) | |
| 胆汁NGAL(ng/mL) | 199.0(27.9±292.1) | 466.7(270.05±102.5) | <0.05 |
胰胆管恶性肿瘤发病隐匿, 早期发现以及诊断困难, 手术切除率低, 术后死亡率高, 预后差. 至今, 常用于临床检测胆管癌的血清学肿瘤标志物有癌胚抗原和CA19-9. 然而CEA因许在多其他的消化系统肿瘤、妇产科恶性肿瘤或其他的胆道病理性改变(如胆管炎或肝炎等)也增高, 因此CEA在诊断胆管癌中特异性较差[38]. Leelawat等[39]曾报道了CEA在诊断胆管癌方面的敏感性和特异性分别仅为58.54%和62.50%. 血清CA19-9值的显著升高对胆管良恶性病变有一定的鉴别诊断价值, 但在胆道感染或其他胆管良性病变中CA19-9值亦可显著升高[40], 因此在本研究中并未将CEA、CA19-9列为测量指标, 本研究旨在发现对鉴别良恶性胆道狭窄敏感性和特异性均高的新的肿瘤标志物.
NGAL又称人脂质运载蛋白2[41], NGAL的表达在一些良性和恶性疾病中会出现表达失调的现象. NGAL在肿瘤中的功能从阻止凋亡(在甲状腺癌细胞), 阻止肿瘤浸润和血管再生(在胰腺癌)到增加肿瘤的增殖和转移(在乳腺和结肠癌)[42], 因此近年来NGAL与人类恶性肿瘤的这种多样性的关系越来越受到了人们的重视. 此外, NGAL与基质金属蛋白酶-9(matrix metalloprotease-9, MMP-9)以二硫键形成复合物, 促进MMP-9对细胞基底膜的降解, 从而浸润周围基质, 介导癌细胞转移[43]. 尽管NGAL在肿瘤发生中的准确的机制尚不完全清楚, 但是他确定与人类的一些常见的恶性肿瘤相关, 包括胃癌、食道癌、胰腺癌和胆管癌等. 有报道称比起非肿瘤组织NGAL与MMP-9复合物在胃癌和食道鳞状细胞癌的组织中表达增高[44,45], 同时在乳腺癌组织中, NGAL过表达是患者预后不良的标志, 包括癌组织分化程度低和存在淋巴结转移[20].
胰腺癌是致死率最高的恶性肿瘤之一, 5年存活率低于3.5%[3]. 目前越来越多的证据表明NGAL与胰胆管恶性肿瘤相关[26,46,47], 有报道称[37]在胰腺癌中存在NGAL mRNA过度表达的现象, 在组织学和血清学研究中, 胰腺恶性肿瘤和胰腺炎症患者中NGAL表达明显上调, 但正常胰腺组织中却很少表达(P<0.001).
NGAL在胆管癌患者中存在表达增高的现象已经有一些研究报道. Nuntagowat等[48]报道在胆管癌患者中通过siRNA可以抑制70%-80%的NGAL mRNA和蛋白的表达.
在胰胆管恶性肿瘤中, 胆汁是一潜在的有着丰富的肿瘤生物标志物的资源. 胆汁从胆道中缓缓流出, 理论上其含有丰富的肿瘤细胞代谢产物. 此外, 胆汁相对容易获得, 多数胆道狭窄的患者都需经逆行性胰胆管造影检查以及相关内镜下治疗, 通过此操作可获取胆汁. 然而在正常胆管组织中无此蛋白的表达, 因此, 推测测量良恶性胆道狭窄患者的胆汁中NGAL的含量可能有区别. 但目前国内外对胆汁中NGAL检测的文献报道少之又少.
本研究采用酶联免疫吸附法检测了良恶性胆道狭窄患者胆汁中NGAL蛋白表达水平, 结果提示与胆道良性狭窄患者相比, 胆道恶性狭窄患者胆汁中NGAL蛋白有较高的表达水平(平均值466.7 ng/mL vs 199.0 ng/mL), 差异有统计学意义(P = 0.0215), 说明检测胆汁中NGAL蛋白对胆道系统肿瘤的诊断具有临床意义. 因此, 根据本研究可推测出, 胆汁中NGAL蛋白含量的检测对肿瘤性质的鉴别诊断具有一定意义. 但是相对于患者血清来说, 患者胆汁的收集更为复杂. 因此本实验同时检测了两组患者血清中NGAL的含量, 检测结果示恶性胆道梗阻患者较良性组高(平均值118.35 ng/mL vs 31.10 ng/mL), 但差异没有统计学意义(P = 0.0825), 从另一方面证明了血清中NGAL蛋白含量在鉴别良恶性胆道狭窄的诊断方面临床价值较小. 最近有两项研究报道了血清或者胆汁中NGAL含量在胰胆管恶性肿瘤患者中的临床应用价值. 其中, Leelawat[35]报道了血清中NGAL和CA19-9含量在鉴别良性胆道狭窄和胆管癌方面有临床意义, 差异有统计学意义(P<0.001), 与本研究结果不一致. 然而在其实验中并未将患者胆汁中NGAL的含量进行检测. 另一项研究[34]显示胆汁中NGAL含量在区分良恶性胆道梗阻方面的敏感性为94%, 但在本研究中胆管癌患者数量较少, 众所周知比起胆管癌, 血清CA19-9和胰腺CT对胰腺癌的诊断更为有效.
在本研究中胆汁NGAL多元线性回归分析表明, 胆汁中NGAL含量与总胆红素与直接胆红素呈负相关, 而与其他因素如年龄、性别、血红蛋白、肝功能酶学指标等无明显相关性, 表明NGAL在区分良恶性胆道狭窄方面是一独立的预测指标. 本实验虽然证实检测胆汁中的NGAL蛋白在鉴别诊断胆道良恶性肿瘤等方面有一定的临床应用价值, 但因样本例数较少, 尚需更大样本量的研究结果进一步证实. 此外, 本实验无正常健康人的胆汁中NGAL的检测, 且有个别良性胆道狭窄患者胆汁中NGAL蛋白含量表达较高, 但可能与胆石等刺激胆管局部组织增生相关, 仍需进一步研究.
胰胆管恶性肿瘤是常见的癌症相关死亡原因之一, 死亡率高, 5年总体存活<5%. 由于胰胆管肿瘤在早期缺乏特异性临床表现, 当患者被确诊时多已经出现远处转移, 因此对于该疾病的早诊较为困难.
薛东波, 教授, 哈尔滨医科大学附属第一医院
目前对于恶性胆道梗阻的诊断多依赖于影像学、胆道的细胞采集、胆道活检、血清肿瘤标志物等. 通过细胞刷和活检在胆道狭窄的部位可获得组织学样本, 但是细胞学和组织学检查敏感性一般<60%. 目前最常用的血清肿瘤标志物为糖原-199和癌胚抗原, 因其较低的敏感性和特异性对于胰胆管肿瘤的诊断仍需进一步研究. 因此, 临床中需要更多的可协助准确诊断并鉴别良恶性胆道梗阻的可靠的肿瘤标志物.
多种证据表明NGAL诱导多种人类的癌症, 并且在这些癌症患者中存在NGAL高表达的现象, 比如皮肤癌、甲状腺癌、乳腺癌、卵巢癌、子宫内膜癌、结肠癌、肺癌、肝癌、胆管癌、食道癌、胃癌和胰腺癌.
已经有许多国内外文献报道了NGAL在消化系恶性肿瘤方面的研究, 如胃癌、肝癌、胰腺癌患者血清中NGAL的含量, 但是关于胆汁中的含量目前还比较少.
本研究表明NGAL在区分良恶性胆道狭窄方面是一独立的预测指标. 在鉴别诊断胆道良恶性肿瘤等方面有一定的临床应用价值.
本文立题新颖, 病例充分, 结果准确, 统计方法科学有意义, 本文有学术价值, 具有临床实践意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Raimondi S, Maisonneuve P, Lowenfels AB. Epidemiology of pancreatic cancer: an overview. Nat Rev Gastroenterol Hepatol. 2009;6:699-708. [PubMed] [DOI] |
| 2. | Khan SA, Toledano MB, Taylor-Robinson SD. Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma. HPB (Oxford). 2008;10:77-82. [PubMed] [DOI] |
| 3. | Chakraborty S, Baine MJ, Sasson AR, Batra SK. Current status of molecular markers for early detection of sporadic pancreatic cancer. Biochim Biophys Acta. 2011;1815:44-64. [PubMed] [DOI] |
| 4. | Welzel TM, McGlynn KA, Hsing AW, O'Brien TR, Pfeiffer RM. Impact of classification of hilar cholangiocarcinomas (Klatskin tumors) on the incidence of intra- and extrahepatic cholangiocarcinoma in the United States. J Natl Cancer Inst. 2006;98:873-875. [PubMed] |
| 5. | Khan SA, Emadossadaty S, Ladep NG, Thomas HC, Elliott P, Taylor-Robinson SD, Toledano MB. Rising trends in cholangiocarcinoma: is the ICD classification system misleading us? J Hepatol. 2012;56:848-854. [PubMed] [DOI] |
| 6. | Seehofer D, Kamphues C, Neuhaus P. Management of bile duct tumors. Expert Opin Pharmacother. 2008;9:2843-2856. [PubMed] [DOI] |
| 7. | Khan SA, Davidson BR, Goldin RD, Heaton N, Karani J, Pereira SP, Rosenberg WM, Tait P, Taylor-Robinson SD, Thillainayagam AV. Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update. Gut. 2012;61:1657-1669. [PubMed] [DOI] |
| 8. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 9. | Khan SA, Thomas HC, Davidson BR, Taylor-Robinson SD. Cholangiocarcinoma. Lancet. 2005;366:1303-1314. [PubMed] |
| 10. | Greenhalf W, Grocock C, Harcus M, Neoptolemos J. Screening of high-risk families for pancreatic cancer. Pancreatology. 2009;9:215-222. [PubMed] [DOI] |
| 11. | Weber A, Schmid RM, Prinz C. Diagnostic approaches for cholangiocarcinoma. World J Gastroenterol. 2008;14:4131-4136. [PubMed] |
| 12. | Weber A, von Weyhern C, Fend F, Schneider J, Neu B, Meining A, Weidenbach H, Schmid RM, Prinz C. Endoscopic transpapillary brush cytology and forceps biopsy in patients with hilar cholangiocarcinoma. World J Gastroenterol. 2008;14:1097-1101. [PubMed] |
| 13. | Farina A, Dumonceau JM, Lescuyer P. Proteomic analysis of human bile and potential applications for cancer diagnosis. Expert Rev Proteomics. 2009;6:285-301. [PubMed] [DOI] |
| 14. | Hanash SM, Pitteri SJ, Faca VM. Mining the plasma proteome for cancer biomarkers. Nature. 2008;452:571-579. [PubMed] [DOI] |
| 15. | Farina A, Dumonceau JM, Frossard JL, Hadengue A, Hochstrasser DF, Lescuyer P. Proteomic analysis of human bile from malignant biliary stenosis induced by pancreatic cancer. J Proteome Res. 2009;8:159-169. [PubMed] |
| 16. | Alvaro D. Serum and bile biomarkers for cholangiocarcinoma. Curr Opin Gastroenterol. 2009;25:279-284. [PubMed] |
| 17. | Bonney GK, Craven RA, Prasad R, Melcher AF, Selby PJ, Banks RE. Circulating markers of biliary malignancy: opportunities in proteomics? Lancet Oncol. 2008;9:149-158. [PubMed] |
| 18. | Mallbris L, O'Brien KP, Hulthén A, Sandstedt B, Cowland JB, Borregaard N, Ståhle-Bäckdahl M. Neutrophil gelatinase-associated lipocalin is a marker for dysregulated keratinocyte differentiation in human skin. Exp Dermatol. 2002;11:584-591. [PubMed] |
| 19. | Nacht M, Ferguson AT, Zhang W, Petroziello JM, Cook BP, Gao YH, Maguire S, Riley D, Coppola G, Landes GM. Combining serial analysis of gene expression and array technologies to identify genes differentially expressed in breast cancer. Cancer Res. 1999;59:5464-5470. [PubMed] |
| 20. | Bauer M, Eickhoff JC, Gould MN, Mundhenke C, Maass N, Friedl A. Neutrophil gelatinase-associated lipocalin (NGAL) is a predictor of poor prognosis in human primary breast cancer. Breast Cancer Res Treat. 2008;108:389-397. [PubMed] |
| 21. | Santin AD, Zhan F, Bellone S, Palmieri M, Cane S, Bignotti E, Anfossi S, Gokden M, Dunn D, Roman JJ. Gene expression profiles in primary ovarian serous papillary tumors and normal ovarian epithelium: identification of candidate molecular markers for ovarian cancer diagnosis and therapy. Int J Cancer. 2004;112:14-25. [PubMed] |
| 22. | Cho H, Kim JH. Lipocalin2 expressions correlate significantly with tumor differentiation in epithelial ovarian cancer. J Histochem Cytochem. 2009;57:513-521. [PubMed] [DOI] |
| 23. | Miyamoto T, Kashima H, Suzuki A, Kikuchi N, Konishi I, Seki N, Shiozawa T. Laser-captured microdissection-microarray analysis of the genes involved in endometrial carcinogenesis: stepwise up-regulation of lipocalin2 expression in normal and neoplastic endometria and its functional relevance. Hum Pathol. 2011;42:1265-1274. [PubMed] [DOI] |
| 24. | Bousserouel S, Kauntz H, Gossé F, Bouhadjar M, Soler L, Marescaux J, Raul F. Identification of gene expression profiles correlated to tumor progression in a preclinical model of colon carcinogenesis. Int J Oncol. 2010;36:1485-1490. [PubMed] |
| 25. | Linnerth NM, Sirbovan K, Moorehead RA. Use of a transgenic mouse model to identify markers of human lung tumors. Int J Cancer. 2005;114:977-982. [PubMed] |
| 26. | Furutani M, Arii S, Mizumoto M, Kato M, Imamura M. Identification of a neutrophil gelatinase-associated lipocalin mRNA in human pancreatic cancers using a modified signal sequence trap method. Cancer Lett. 1998;122:209-214. [PubMed] |
| 27. | Wang HJ, He XJ, Ma YY, Jiang XT, Xia YJ, Ye ZY, Zhao ZS, Tao HQ. Expressions of neutrophil gelatinase-associated lipocalin in gastric cancer: a potential biomarker for prognosis and an ancillary diagnostic test. Anat Rec (Hoboken). 2010;293:1855-1863. [PubMed] [DOI] |
| 28. | Alpízar YA, Ramírez BS, Fernández DR, Capote AR, Hidalgo GG, Rodríguez RP, Molina LE. HER1-ECD vaccination dispenses with emulsification to elicit HER1-specific anti-proliferative effects. Hum Vaccin. 2009;5:158-165. [PubMed] |
| 29. | Laurell H, Bouisson M, Berthelemy P, Rochaix P, Dejean S, Besse P, Susini C, Pradayrol L, Vaysse N, Buscail L. Identification of biomarkers of human pancreatic adenocarcinomas by expression profiling and validation with gene expression analysis in endoscopic ultrasound-guided fine needle aspiration samples. World J Gastroenterol. 2006;12:3344-3351. [PubMed] |
| 30. | Moniaux N, Chakraborty S, Yalniz M, Gonzalez J, Shostrom VK, Standop J, Lele SM, Ouellette M, Pour PM, Sasson AR. Early diagnosis of pancreatic cancer: neutrophil gelatinase-associated lipocalin as a marker of pancreatic intraepithelial neoplasia. Br J Cancer. 2008;98:1540-1547. [PubMed] [DOI] |
| 31. | Chan AO, Chu KM, Lam SK, Cheung KL, Law S, Kwok KF, Wong WM, Yuen MF, Wong BC. Early prediction of tumor recurrence after curative resection of gastric carcinoma by measuring soluble E-cadherin. Cancer. 2005;104:740-746. [PubMed] |
| 32. | Reckamp KL, Gardner BK, Figlin RA, Elashoff D, Krysan K, Dohadwala M, Mao J, Sharma S, Inge L, Rajasekaran A. Tumor response to combination celecoxib and erlotinib therapy in non-small cell lung cancer is associated with a low baseline matrix metalloproteinase-9 and a decline in serum-soluble E-cadherin. J Thorac Oncol. 2008;3:117-124. [PubMed] [DOI] |
| 33. | Soyama A, Eguchi S, Takatsuki M, Kawashita Y, Hidaka M, Tokai H, Nagayoshi S, Mochizuki S, Matsumoto S, Hamasaki K. Significance of the serum level of soluble E-cadherin in patients with HCC. Hepatogastroenterology. 2008;55:1390-1393. [PubMed] |
| 34. | Zabron AA, Horneffer-van der Sluis VM, Wadsworth CA, Laird F, Gierula M, Thillainayagam AV, Vlavianos P, Westaby D, Taylor-Robinson SD, Edwards RJ. Elevated levels of neutrophil gelatinase-associated lipocalin in bile from patients with malignant pancreatobiliary disease. Am J Gastroenterol. 2011;106:1711-1717. [PubMed] [DOI] |
| 35. | Leelawat K, Narong S, Wannaprasert J, Leelawat S. Serum NGAL to Clinically Distinguish Cholangiocarcinoma from Benign Biliary Tract Diseases. Int J Hepatol. 2011;2011:873548. [PubMed] [DOI] |
| 36. | Bolignano D, Lacquaniti A, Coppolino G, Donato V, Campo S, Fazio MR, Nicocia G, Buemi M. Neutrophil gelatinase-associated lipocalin (NGAL) and progression of chronic kidney disease. Clin J Am Soc Nephrol. 2009;4:337-344. [PubMed] [DOI] |
| 37. | Tong Z, Kunnumakkara AB, Wang H, Matsuo Y, Diagaradjane P, Harikumar KB, Ramachandran V, Sung B, Chakraborty A, Bresalier RS. Neutrophil gelatinase-associated lipocalin: a novel suppressor of invasion and angiogenesis in pancreatic cancer. Cancer Res. 2008;68:6100-6108. [PubMed] [DOI] |
| 38. | Hultcrantz R, Olsson R, Danielsson A, Järnerot G, Lööf L, Ryden BO, Wahren B, Broomé U. A 3-year prospective study on serum tumor markers used for detecting cholangiocarcinoma in patients with primary sclerosing cholangitis. J Hepatol. 1999;30:669-673. [PubMed] |
| 39. | Leelawat K, Sakchinabut S, Narong S, Wannaprasert J. Detection of serum MMP-7 and MMP-9 in cholangiocarcinoma patients: evaluation of diagnostic accuracy. BMC Gastroenterol. 2009;9:30. [PubMed] [DOI] |
| 40. | Ker CG, Chen JS, Lee KT, Sheen PC, Wu CC. Assessment of serum and bile levels of CA19-9 and CA125 in cholangitis and bile duct carcinoma. J Gastroenterol Hepatol. 1991;6:505-508. [PubMed] |
| 41. | Chakraborty S, Kaur S, Guha S, Batra SK. The multifaceted roles of neutrophil gelatinase associated lipocalin (NGAL) in inflammation and cancer. Biochim Biophys Acta. 2012;1826:129-169. [PubMed] [DOI] |
| 42. | Roudkenar MH, Halabian R, Ghasemipour Z, Roushandeh AM, Rouhbakhsh M, Nekogoftar M, Kuwahara Y, Fukumoto M, Shokrgozar MA. Neutrophil gelatinase-associated lipocalin acts as a protective factor against H(2)O(2) toxicity. Arch Med Res. 2008;39:560-566. [PubMed] [DOI] |
| 44. | Kubben FJ, Sier CF, Hawinkels LJ, Tschesche H, van Duijn W, Zuidwijk K, van der Reijden JJ, Hanemaaijer R, Griffioen G, Lamers CB. Clinical evidence for a protective role of lipocalin-2 against MMP-9 autodegradation and the impact for gastric cancer. Eur J Cancer. 2007;43:1869-1876. [PubMed] |
| 45. | Zhang H, Xu L, Xiao D, Xie J, Zeng H, Wang Z, Zhang X, Niu Y, Shen Z, Shen J. Upregulation of neutrophil gelatinase-associated lipocalin in oesophageal squamous cell carcinoma: significant correlation with cell differentiation and tumour invasion. J Clin Pathol. 2007;60:555-561. [PubMed] |
| 46. | Han H, Bearss DJ, Browne LW, Calaluce R, Nagle RB, Von Hoff DD. Identification of differentially expressed genes in pancreatic cancer cells using cDNA microarray. Cancer Res. 2002;62:2890-2896. [PubMed] |
| 47. | Iacobuzio-Donahue CA, Maitra A, Olsen M, Lowe AW, van Heek NT, Rosty C, Walter K, Sato N, Parker A, Ashfaq R. Exploration of global gene expression patterns in pancreatic adenocarcinoma using cDNA microarrays. Am J Pathol. 2003;162:1151-1162. [PubMed] |
| 48. | Nuntagowat C, Leelawat K, Tohtong R. NGAL knockdown by siRNA in human cholangiocarcinoma cells suppressed invasion by reducing NGAL/MMP-9 complex formation. Clin Exp Metastasis. 2010;27:295-305. [PubMed] [DOI] |