修回日期: 2013-01-11
接受日期: 2013-02-20
在线出版日期: 2013-03-18
目的: 研究USP22和Nanog在结肠癌组织中的表达及其与临床病理因素的关系.
方法: 采用免疫组织化学法检测USP22和Nanog在80例结肠癌组织, 35例结肠腺瘤组织及40例癌旁正常结肠组织中的表达.
结果: USP22在结肠癌中的阳性表达率明显高于结肠腺瘤和正常结直肠黏膜组织(P<0.05), 但结肠腺瘤和癌旁正常组织的阳性表达率差异无统计学意义(P>0.05), Nanog在癌旁正常组织, 结肠腺瘤和结肠腺癌中的阳性表达率差异均有统计学意义(P<0.05). USP22和Nanog的表达与Dukes分期, 组织学分级, 淋巴结转移以及浸润深度均有关(P<0.05); USP22和Nanog在结肠癌组织中的表达呈正相关(r = 0.509, P<0.01).
结论: USP22和Nanog的表达与结肠癌的发生发展有关, 二者在结肠癌的细胞增殖、浸润和转移中有协同作用. 他们有望成为结肠癌的早期诊断指标和治疗靶点.
引文著录: 贾莹莹, 王进, 杨丽敏. USP22和Nanog在结肠癌组织中的表达及临床意义. 世界华人消化杂志 2013; 21(8): 719-723
Revised: January 11, 2013
Accepted: February 20, 2013
Published online: March 18, 2013
AIM: To investigate the expression of USP22 and Nanog in colon cancer and to explore their relationship with clinicopathological factors of this malignancy.
METHODS: The expression of USP22 and Nanog was detected by immunohistochemistry in 80 cases of colonic adenocarcinoma, 35 cases of colonic adenoma and 40 cases of normal colonic tissue.
RESULTS: The positive rate of USP22 expression in colonic adenocarcinoma was significantly higher than those in colonic adenoma and normal tissues (both P < 0.05), but there was no significant difference between colonic adenoma and adenocarcinoma (P > 0.05). The positive rate of Nanog expression differed significantly in normal colonic tissue, colonic adenoma and colonic adenocarcinoma (all P < 0.05). The expression of USP22 and Nanog was correlated with Duke's stage, histopathological grade, lymph node metastasis and depth of invasion (all P < 0.05). There was a positive correlation between the expressions of USP22 and that of Nanog in colonic adenocarcinoma (r = 0.509, P < 0.01).
CONCLUSION: The expression of USP22 and Nanog is closely related to the occurrence and development of colonic adenocarcinoma, and they have synergistic effect on infiltration, invasion and metastasis of colonic adenocarcinoma. USP22 and Nanog may be used as early diagnostic markers and therapeutic targets for colorectal adenocarcinoma.
- Citation: Jia YY, Wang J, Yang LM. Clinical significance of expression of USP22 and Nanog in colon cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 719-723
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/719.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.719
结肠癌为临床常见恶性肿瘤之一, 他的发生遵循"正常黏膜-腺瘤-腺癌"的组织发生顺序, 被称为大肠腺瘤-癌序列. 在我国常见的恶性肿瘤中, 结肠癌的发病率位于第5位[1], 并有逐年增高的趋势. 近年来提出的肿瘤干细胞理论认为肿瘤干细胞具有自我更新、无限增殖以及多向分化的潜能, 是肿瘤的启动细胞, 可能是恶性肿瘤的种子和源泉, 只有针对肿瘤干细胞的靶向治疗才能最终治愈肿瘤[2]. 这个理论为肿瘤的预防和治疗提供了新的方向. 去泛素酶基因(USP22)是肿瘤干细胞标志家族中一个新鉴定的成员, 目前已经发现USP22在DNA转录、细胞恶变以及细胞周期进程中发挥了重要作用, 已成为干细胞领域研究的一个热点. Nanog是近些年在胚胎干细胞(embryonic stem cells, ESCs)中发现的最重要的转录因子, 对于维持胚胎干细胞自我更新和多向分化潜能起着关键作用, 并且发现在多种肿瘤中高表达. 目前, 国内对USP22、Nanog在结肠癌方面的联合报道甚少. 本研究通过联合检测二者在结肠腺瘤和腺癌组织中的表达, 探讨二者在结肠癌发生发展过程中的作用, 为临床的诊断治疗及判断预后提供理论依据.
选取郑州大学第一附属医院2010-11/2011-12外科手术或内镜下切除后的存档石蜡标本155例, 所有标本均经病理明确诊断. 其中结肠腺癌80例, 男46例, 女34例, 年龄32-84岁, 中位年龄55.4岁. 按Duke分期分为A期19例、B期29例、C期26例、D期6例. 按分化程度分为高分化26例、中分化32例、低分化22例. 有淋巴结转移者31例, 无淋巴结转移49例. 浸润深度侵及浆膜者57例, 未侵及浆膜者23例. 结肠腺瘤伴不典型增生35例. 癌旁正常组织40例(取自上述40例结肠癌患者癌旁>5 cm组织). 所有患者术前均未接受过放射、化学和免疫治疗. 兔抗人USP22多克隆抗体购自美国Abgent公司(Cat.AP2148b);兔抗人多克隆抗体Nanog购自河北博海生物技术有限公司(Cat.yp-0829R); 即用型S-P试剂盒及DAB显色剂均购自北京中杉金桥生物技术有限公司.
所有标本均经10%甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, 常规脱蜡, 高温高压修复, 具体操作步骤严格按照试剂盒说明书进行. USP22一抗工作浓度为1:50, Nanog一抗工作浓度为1:100. 用PBS代替一抗作空白对照, 用已知阳性切片作阳性对照.
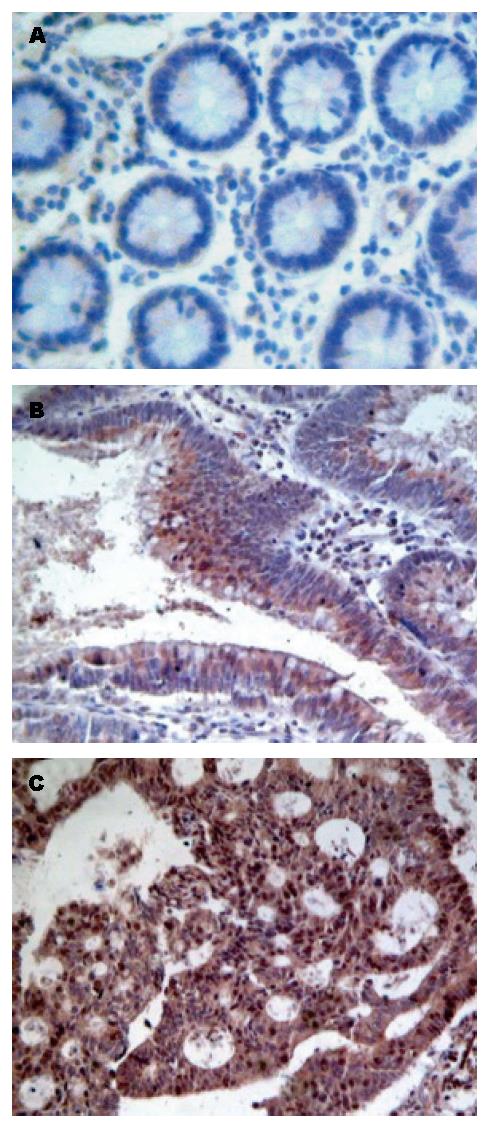
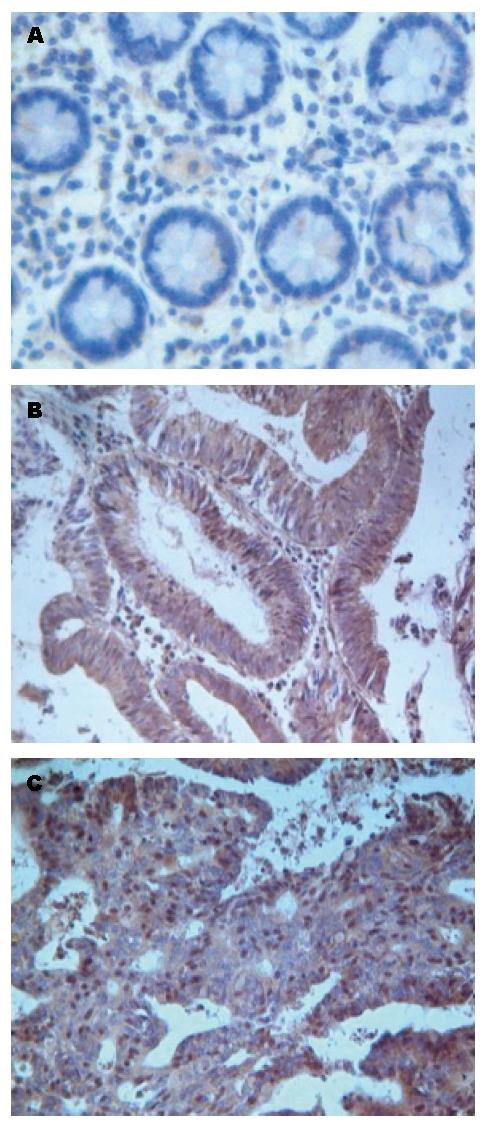
USP22为胞浆与胞核着色, 以胞核着色判断为阳性, 随即选择5个高倍镜视野, 每个视野取200个细胞观察其中阳性细胞的个数, 将结果分为强阳性(+++), 阳性细胞≥76%; 阳性(++)51%-75%; 弱阳性(+)11%-50%; 阴性(-)<10%. Nanog蛋白阳性反应为位于细胞核或胞浆内的棕黄色均匀细颗粒. Nanog蛋白阳性为高倍光学显微镜下观察, #每张切片随机选取5个视野, 每个视野计数100个细胞, 阳性细胞数<5%为(-)、5%-25%为(+)、26%-75%为(++)、≥76%为(+++). 免疫组织化学染色由两位高年资病理科医师在双盲条件下进行评定.
统计学处理 采用SPSS17.0软件包进行分析处理. 计数资料采用χ2检验, 两等级变量的相关分析采用Spearman等级相关分析. 以α = 0.05作为检验水准.
USP22和Nanog蛋白在癌旁正常、结肠腺瘤及腺癌组织中的表达见图1, 图2和表1. USP22和Nanog蛋白表达与结肠癌临床病理因素的关系见表2. 结肠癌组织中, USP22和Nanog表达均为阳性的有44例, 均为阴性的有14例. 两者表达呈显著正相关(r = 0.509, P<0.01).
| 临床病理因素 | n | USP阳性n(%) | χ2值 | P值 | Nanog阳性n(%) | χ2值 | P值 |
| 年龄(岁) | 0.425 | 0.514 | 0.011 | 0.918 | |||
| ≤55 | 39 | 20(51.3) | 32(82.1) | ||||
| >55 | 41 | 24(58.5) | 34(82.9) | ||||
| 性别 | 0.101 | 0.750 | 1.489 | 0.222 | |||
| 男 | 46 | 26(56.5) | 40(87.0) | ||||
| 女 | 34 | 18(52.9) | 26(76.5) | ||||
| Dukes分期 | 6.136 | 0.013 | 4.675 | 0.031 | |||
| A + B | 48 | 21(43.8) | 36(75.0) | ||||
| C + D | 32 | 23(71.9) | 30(93.8) | ||||
| 分化程度 | 4.257 | 0.039 | 9.670 | 0.002 | |||
| 高 | 26 | 10(38.5) | 16(61.5) | ||||
| 中低 | 54 | 34(63.0) | 50(92.6) | ||||
| 淋巴结转移 | 5.214 | 0.022 | 4.279 | 0.039 | |||
| 无 | 49 | 22(44.9) | 37(75.5) | ||||
| 有 | 31 | 22(71.0) | 29(93.5) | ||||
| 浸润深度 | 7.871 | 0.005 | 23.617 | 0.000 | |||
| 未及浆膜 | 23 | 7(30.4) | 11(47.8) | ||||
| 侵及浆膜 | 57 | 37(64.9) | 55(96.5) |
近年来, 肿瘤干细胞的研究已经成为热点. 几年前, 可以预测具有耐药性和侵袭性肿瘤的11号基因簇被发现, 他有利于肿瘤患者的诊断和病情级别的划分. 11号基因组肿瘤干细胞标志家族是编码正常干细胞和肿瘤干细胞的关键调节因子的, 而USP22则是家族中一个新鉴定的成员, 他在DNA转录、Myc介导的细胞恶变以及细胞周期进程中发挥着重要作用. 现已证实, USP22是激活子驱动的转录所必需的. 他与人转录辅助因子复合体(hSAGA)相互作用可以调节多种关键基因的转录[3], 比如USP22调控Myc靶基因的转录激活是Myc介导的细胞恶变所必需的. 因此认为USP22是通过调控多种基因的转录而影响基因的功能, 从而发挥生物学功能的. 目前已经发现USP22在胃癌[4]、乳腺癌[5]等多种肿瘤细胞中呈现高表达, 并且其表达程度与肿瘤转移潜能、耐药性及患者预后密切相关, 所以, USP22被认为是肿瘤干细胞的标志基因, 其异常表达是细胞恶性转化、浸润的重要环节[6,7]. 目前多数学者认为约80%的结直肠癌来自于腺瘤[8]. 已有研究表明, USP22对直肠癌的发生、发展起重要作用[9]. 本研究通过检测发现USP22蛋白在正常组织和结肠腺癌以及腺瘤和腺癌中的阳性表达率差异具有统计学意义, USP22在结肠癌中的表达随着Dukes分期的进展, 分化程度的降低, 淋巴结的转移以及浸润深度的加深逐渐增高. 由此可以看出USP22可能在结肠腺瘤癌变过程, 腺癌的浸润转移中起着重要作用, 很可能成为诊断早期结肠癌的新指标. 但是目前USP22许多作用机制尚不完全清楚, 比如是否存在转录因子相关的其他作用底物等, 因此仍需要更进一步的研究.
Nanog是维持ESCs自我更新和多向分化潜能的核心转录因子之一, 可诱导多能干细胞, 是全能性或多能性干细胞标志物[10,11]. 多个研究报道已证明, Nanog在胃癌[12]、结肠癌[13]、乳腺癌和前列腺癌[14]等多种肿瘤细胞中表达, 并且他的表达与结肠癌的复发转移相关[15]. Nanog作为干细胞标志物在肿瘤中的表达不仅为肿瘤干细胞理论提供了依据, 而且很多人认为Nanog可作为肿瘤的一个特异性、敏感性的标志物和治疗靶点. 在本研究中发现, Nanog在正常黏膜, 腺瘤到腺癌中阳性表达率依次增高, 且各组比较差异均有统计学意义, 并且Nanog在结肠癌中的表达随着临床分期的进展, 分化程度的降低, 浸润深度的加深以及淋巴结的转移逐渐增高. 这些结果提示, Nanog可能在结肠癌的增殖、转移、浸润中扮演着重要角色.
作为hSAGA亚单位和ESCs转录因子, USP22和 Nanog在转录过程中都发挥着重要作用, 因此, 我们推断他们在结肠癌的发生、发展、浸润和转移过程中可能具有协同作用. 而我们的研究实验得出USP22和Nanog在结肠癌组织中的表达呈正相关, 恰好也证明了上述推论. 作为肿瘤干细胞标志物, USP22和 Nanog在结肠癌中的高表达也进一步验证了肿瘤干细胞理论.
今后希望通过对USP22和Nanog更进一步的研究, 使他们有望成为诊断结肠癌的早期指标. 并且USP22编码的是一种酶, 极易受到药物影响, 因此USP22有可能成为抗肿瘤药物的一个新靶点. 找到针对肿瘤干细胞的药物新靶点, 肿瘤才有治愈的可能. 目前, 对于USP22和Nanog的生物学功能及其作用机制还尚未完全了解, 因此, 我们还需要更为深入的研究, 以便于更多地了解干细胞和肿瘤细胞的生物学特性以及肿瘤发生、发展、浸润和转移的分子机制, 进而为肿瘤的早期诊断和基因治疗提供新的切入点.
肿瘤干细胞是肿瘤中一小部分具有干细胞性质的细胞群, 具有自我更新能力, 是肿瘤发生发展的源泉. 由于肿瘤干细胞理论打破了以往的肿瘤研究模式, 近年来越来越受到重视. 而通过对肿瘤干细胞标志物的研究, 可以为肿瘤的早期诊断提供依据, 并且为靶向治疗寻求新的靶点.
刘丽江, 教授, 江汉大学医学院病理学
肿瘤干细胞标志物的研究不仅有助于阐明肿瘤的发生机制, 而且还可以针对肿瘤干细胞的特异性抗原制备相应的抗体, 研制出特定的靶向药物, 为抗肿瘤药物的研究开辟一个全新的领域.
Glinsky等利用mRNA微集阵列技术, 发现USP22 在多数恶性肿瘤细胞中表达普遍升高, 并且其表达程度与实体肿瘤转移潜能、耐药性及患者预后密切相关, 因此, USP22与BMI-1、cyclin B1等一同被归纳为肿瘤干细胞的标志基因.
USP22和Nanog有望成为结肠癌的早期诊断指标和抗肿瘤药物的新靶点.
人转录辅助因子复合体(hSAGA): 是由多个亚单位组成的复合物, 通过乙酰化染色体上的组蛋白, 调节多种关键基因的转录.
本文选题有较高的科学性以及新颖性, 实验结果可靠, 其结果对于进一步理解结肠癌及结肠癌干细胞的生物学特性和判断预后有一定的价值.
编辑: 李军亮 电编: 闫晋利
| 1. | Zhao P, Dai M, Chen W, Li N. Cancer trends in China. Jpn J Clin Oncol. 2010;40:281-285. [PubMed] [DOI] |
| 3. | Zhang XY, Varthi M, Sykes SM, Phillips C, Warzecha C, Zhu W, Wyce A, Thorne AW, Berger SL, McMahon SB. The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for activated transcription and cell-cycle progression. Mol Cell. 2008;29:102-111. [PubMed] [DOI] |
| 4. | Yang DD, Cui BB, Sun LY, Zheng HQ, Huang Q, Tong JX, Zhang QF. The co-expression of USP22 and BMI-1 may promote cancer progression and predict therapy failure in gastric carcinoma. Cell Biochem Biophys. 2011;61:703-710. [PubMed] [DOI] |
| 5. | Zhang Y, Yao L, Zhang X, Ji H, Wang L, Sun S, Pang D. Elevated expression of USP22 in correlation with poor prognosis in patients with invasive breast cancer. J Cancer Res Clin Oncol. 2011;137:1245-1253. [PubMed] [DOI] |
| 6. | Glinsky GV. Death-from-cancer signatures and stem cell contribution to metastatic cancer. Cell Cycle. 2005;4:1171-1175. [PubMed] [DOI] |
| 7. | Glinsky GV. Genomic models of metastatic cancer: functional analysis of death-from-cancer signature genes reveals aneuploid, anoikis-resistant, metastasis-enabling phenotype with altered cell cycle control and activated Polycomb Group (PcG) protein chromatin silencing pathway. Cell Cycle. 2006;5:1208-1216. [PubMed] [DOI] |
| 11. | Mitsui K, Tokuzawa Y, Itoh H, Segawa K, Murakami M, Takahashi K, Maruyama M, Maeda M, Yamanaka S. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell. 2003;113:631-642. [PubMed] [DOI] |
| 14. | Gu G, Yuan J, Wills M, Kasper S. Prostate cancer cells with stem cell characteristics reconstitute the original human tumor in vivo. Cancer Res. 2007;67:4807-4815. [PubMed] [DOI] |