修回日期: 2013-01-06
接受日期: 2013-01-11
在线出版日期: 2013-02-08
目的: 检测RASAL1(ras GTPase-activating-like protein 1)基因甲基化率及RAS活性在人结肠癌组织中的表达, 探讨其与临床病理资料间的关系.
方法: 以40例结肠癌标本为研究对象, 相应的正常组织标本为对照. 甲基化特异性PCR(methylation-specific PCR, MSP)检测RASAL1启动子CpG岛甲基化状态, 免疫共沉淀法检测RAS活性, 分析肿瘤组织中RASAL1基因甲基化率及RAS活性与临床病理参数间的关系.
结果: 40例肿瘤组织中有26例检测出RASAL1基因甲基化(26/40, 67.5%), 对照组40例中有12例出现甲基化(12/40, 30%), 肿瘤组织甲基化率明显高于正常组织(P = 0.0017). 肿瘤组织中RAS活性的中位数为1.07, 正常组织中RAS活性的中位数为0.52, P<0.001, 差异有统计学意义. 结肠癌组织中RASAL1基因的甲基化率、RAS活性与患者肿瘤分化程度、侵袭深度、淋巴结转移、TNM分期有统计学差异(均P<0.05).
结论: RASAL1甲基化状态与RAS活性增加有关, 可能在结肠癌的发生发展中起重要作用. 抑制RASAL1甲基化及RAS活性, 可能成为治疗结肠癌的新靶点.
引文著录: 袁纯, 陆枫林, 陈洪. RASAL1基因启动子甲基化及RAS活性与结肠癌临床病理的关系. 世界华人消化杂志 2013; 21(4): 341-345
Revised: January 6, 2013
Accepted: January 11, 2013
Published online: February 8, 2013
AIM: To detect RASAL1 (ras GTPase-activating-like protein 1) promoter methylation and ras activity in colorectal carcinoma (CRC) and to analyze their correlation with clinical and pathological parameters.
METHODS: Methylation-specific PCR (MSP) was used to detect RASAL1 promoter methylation in forty CRC specimens and matched normal colorectal tissue specimens. Co-immunoprecipitation was used to detected ras activity in tumor and normal tissues. The correlation of RASAL1 promoter methylation and ras activity with clinical and pathological parameters was analyzed.
RESULTS: RASAL1 promoter methylation was detected in 67.5% (26/40) of colorectal cancer tissues and in 30% (12/40) of normal tissues, and the positive rate of RASAL1 promoter methylation in tumor tissues was significantly higher than that in normal tissues (P = 0.0017). The median ras activity was significantly higher in colorectal cancer tissues than in normal tissues (1.07 vs 0.52, P < 0.001). RASAL1 promoter methylation and ras activity were both positively correlated with degree of tumor differentiation, invasion depth, lymph node metastasis, and TNM stage (all P < 0.05).
CONCLUSION: High ras activity is related to RASAL1 promoter methylation, which may play an important role in the oncogenesis of CRC. RASAL1 methylation and ras activity may be novel therapeutic targets for CRC.
- Citation: Yuan C, Lu FL, Chen H. Clinical significance of RASAL1 promoter methylation and ras activity in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 341-345
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/341.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.341
恶性肿瘤是当前除心血管疾病外主要死亡原因之一. 在美国, 结直肠癌在各种癌症中发病率和死亡率均居第3位[1], 在我国, 结肠癌发病率逐年上升, 其病因与饮食、环境密切相关, 死亡率居高不下. 现代肿瘤学认为肿瘤是由基因点突变、小片段缺失或插入引起的遗传性改变和DNA甲基化等表观遗传学改变而导致的. RASAL1基因是近年发现的参与结肠癌发生发展的新基因[2], 目前国外已有研究表明, 结肠癌组织中存在RASAL1基因甲基化改变, 国内研究只针对RASAL1基因mRNA及RASAL1蛋白进行检测, 尚未对导致RASAL1基因表达变化的机制进行研究. 本实验拟采用甲基化特异性PCR、免疫共沉淀检测结肠癌组织及正常组织中RASAL1甲基化状态及RAS活性改变, 并探讨与结肠癌临床病理指标间的关系, 为结肠癌的临床诊断治疗、预后判断提供科学依据.
收集2009-05/2010-05于东南大学附属中大医院接受外科手术切除的结肠癌患者的结肠癌组织标本40例作为研究组, 术前未接受放、化疗或其他针对肿瘤的治疗, 肿瘤组织取自肿瘤中心非坏死部位, 正常组织为据肿瘤边缘5 cm以上的组织. 诊断经术后病理检查证实, 并确定病理类型和分化程度. 其中男24例, 女16例; 年龄为40-83岁, 平均65.1岁±12.7岁. 癌组织和正常组织标本经4%中性缓冲甲醇固定、石蜡包埋. Taq Mix酶为美国ABI公司产品; DNA提取试剂盒为北京碧云天生物公司产品; Wizard DNA Clean-Up System试剂盒为美国Promega公司产品; PCR引物为上海生工生物技术有限公司合成; RIPA细胞裂解液和聚乙烯二氟(PVDF)膜为英国Whatman公司产品; 蛋白提取试剂盒为南京凯基生物公司产品; K-RAS活性检测试剂盒(包含磁珠)为英国Abcam公司; K-RAS一抗(鼠抗人单克隆抗体)为英国Abcam公司; 二抗[山羊抗鼠Ig(H+L)-HRP]为晶美生物公司产品.
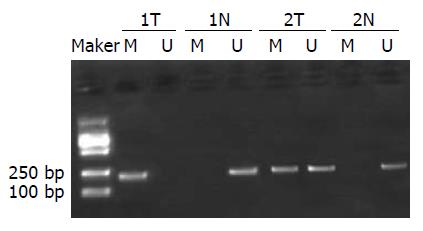
1.2.1 MSP方法: 石蜡切片, 用二甲苯脱蜡, 从石蜡包埋组织中提取DNA充分去除二甲苯, 按Zymo DNA CpG岛甲基化修饰盒进行亚硫酸氢盐修饰. PCR反应体系: 50 µL反应体系: 5×扩增缓冲液10 µL, 25 mmol/L MgCl2 2 µL, 4种dNTP各1 µL, Taq酶0.25 µL, 上下游引物各0.5 µL, cDNA 10 µL, 余体积以无菌蒸馏水补齐. 反应条件: 94 ℃预变性2 min, 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃ 1 min, 40个循环后, 72 ℃延伸7 min. 根据文献, MSP甲基化引物序列为5'-GTGTATTTTTGTTTTCGTCGTTC-3'和5'-CAACGAACTCTTACCGAAACG-3', 非甲基化引物为5'-AATTTATTAGGAGTTAGTGGTTAT-3'和5'-CACAACAAACTCTTACCAAAACA-3', 长度均为221 bp.
PCR判断标准: 甲基化阳性为能扩增出甲基化产物, 包括同时扩增出非甲基化产物; 甲基化阴性为只出现非甲基化条带[3].
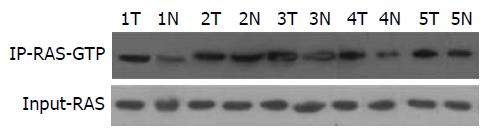
1.2.2 免疫共沉淀方法: 磷酸盐缓冲液冲洗后, 按照组织蛋白提取试剂盒的要求提取蛋白, 用Western免疫印记法检测目的蛋白. 各条带灰度值结果以有活性的RAS和总RAS灰度值之比表示.
统计学处理 应用SPSS18.0统计软件, 定量数据满足正态性的采用mean±SD描述, 不满足正态性的采用中位数来描述. 两组相关样本采用配对t检验或者配对秩和检验分析. 分类资料采用频数描述原始资料, 采用χ2或者Fisher's精确概率检验进行组间比较, 所有检验均以显著水平P<0.05为具有统计学意义.
根据MSP结果(图1), 40例肿瘤组织中有26例(67.5%)发生RASAL1基因甲基化, 对照组40例正常组织中有12例(30%)正常组织中出现甲基化, 肿瘤组织、正常组织间RASAL1基因甲基化差异有统计学意义(P = 0.0017, 表1).
| 分组 | 甲基化 | 非甲基化 | P值 |
| 肿瘤组织 | 27 | 13 | 0.0017 |
| 正常组织 | 12 | 28 |
根据各标本灰度值(图2), 检测得出肿瘤组织中RAS活性的中位数为1.07, 正常组织中RAS活性的中位数为0.52, P<0.001, 差异有统计学意义.
本组40例结肠癌组织中RASAL1基因的甲基化率、RAS活性与患者肿瘤分化程度、侵袭深度、淋巴结转移、TNM分期有统计学差异(均P<0.05), 与患者性别、年龄、肿瘤大小间差异无显著性(均P>0.05, 表2).
| 临床病理参数 | n | 甲基化例数(n) | χ2值 | P值 | RAS活性 | χ2值 | P值 |
| 性别 | |||||||
| 男 | 24 | 14 | 2.2982 | 0.1295 | 0.97(0.7, 1.65) | -0.4003 | 0.6889 |
| 女 | 16 | 13 | 1.07(0.87, 1.19) | ||||
| 年龄(岁) | |||||||
| <70 | 20 | 11 | 2.8490 | 0.0914 | 0.88(0.65, 1.15) | 1.6365 | 0.1017 |
| ≥70 | 20 | 16 | 1.16(0.8, 1.35) | ||||
| 大小(cm) | |||||||
| <4 | 26 | 18 | 0.1014 | 0.7501 | 1.09(0.74, 1.21) | -0.3545 | 0.7230 |
| ≥4 | 14 | 9 | 0.98(0.77, 1.41) | ||||
| 分化程度 | |||||||
| 低 | 21 | 18 | 19.5513 | <0.001 | 1.20(1.12, 1.46) | -4.2522 | <.0001 |
| 高、中 | 19 | 9 | 0.77(0.46, 0.81) | ||||
| 侵袭程度 | |||||||
| T1, T2 | 25 | 11 | 6.8249 | 0.0090 | 0.98(0.66, 1.19) | 1.7321 | 0.0433 |
| T3, T4 | 15 | 11 | 1.17(0.8, 2.02) | ||||
| 淋巴结转移 | |||||||
| 无转移 | 20 | 8 | 13.7892 | 0.0002 | 0.80(0.66, 1.04) | 3.2325 | 0.0012 |
| 有转移 | 20 | 19 | 1.20(1.08, 2.01) | ||||
| TNM分期 | |||||||
| Ⅰ、Ⅱ | 16 | 7 | 12.2121 | 0.0005 | 0.80(0.66, 1.04) | -2.3881 | 0.0169 |
| Ⅲ、Ⅳ | 24 | 20 | 1.15(0.88, 1.73) |
Ras基因是存在于人体多种细胞中的原癌基因, 其编码的Ras蛋白参与细胞的增殖、分化、细胞骨架的构建. Ras蛋白可与GTP、GDP结合, 前者为活化状态, 后者为非活化状态, 调控GTP/GDP间转化的因素主要有Ras GTP酶活化蛋白(GTPase activating protein, Ras GAP)及Ras鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor, Ras GEF)[4]. 在正常细胞中, RAS蛋白几乎全部和GDP结合, 处于非活化状态, 故细胞呈现正常生长增殖. 当RAS蛋白与GTP结合, 处于活化状态时, 能激活下游信号分子, 从而导致增殖信号过度传入, 细胞增殖失控导致肿瘤发生发展[5].
RASAL1是近年新发现的一种抑癌基因, 位于人类第12号染色体(12q24.13), 其编码的RASAL1蛋白是Ras GAP家族一员, 即具有GTP酶活性, 可以水解GTP为GDP, 从而RAS活性降低[6]. 研究表明, 肿瘤组织中RASAL1基因表达下降, 主要机制有以下方面: RASAL1基因启动子CpG岛高甲基化、细胞内钙离子调节异常、上游基因PITX1(pituitary homeobox 1)功能缺失, 而RASAL1基因启动子甲基化是该基因表达下调的主要机制[7]. RASAL1基因的甲基化与RAS活性的关系即是本课题研究的主要内容.
本课题前期实验[8]已证明RASAL1蛋白在结肠癌组织中的表达较正常组织明显下降, RASAL1 mRNA在结肠癌组织中表达较正常组织下降, 与RASAL1蛋白表达正相关, 说明了RASAL1基因对于RASAL1蛋白的调控作用, 验证了文献报道的结肠癌中都存在RASAL1表达下调的情况. 有关研究表明, 肿瘤组织中, RASAL1基因表达下降的主要原因与基因启动子CpG岛甲基化有关[9,10].
本实验采用MSP方法检测组织中基因的甲基化情况, 结果显示肿瘤组织中有27例(67.55%)发生RASAL1基因甲基化, 12例(30%)正常组织中出现甲基化, 肿瘤组织、正常组织间RASAL1基因甲基化差异有统计学意义(P = 0.0017). 国外文献中, Jin等[11]发现在结肠癌细胞中RASAL1基因外显子中存在CpG岛, 并证明肿瘤细胞株存在甲基化现象. Ohta等[12]也在结肠癌细胞株RASAL1的CpG岛发现了甲基化位点, 并发生甲基化. 本实验和国外研究相符合, 验证了RASAL1基因甲基化是结肠癌组织中的高频事件. 本研究中有12例正常组织中出现甲基化, 标本经病理证实未发生病理学改变, 考虑原因为基因甲基化是早期分子事件, 早于病理改变分子水平已有表观遗传学的改变. 同时, MSP只需少量的DNA, 对CpG岛等位基因甲基化有高敏感性. 因此, 可通过检测甲基化水平为评价术后复发提供相对早期的分子生物学参考依据.
同时本实验也出现半甲基化情况[13], 即肿瘤组织中既有甲基化特异性引物的扩增, 又有非甲基化引物的扩增, 也称为杂合甲基化. 考虑原因有以下几点: (1)Bai等[14]认为可能是两个等位基因的异质性有关, 即两个等位基因一个甲基化一个非甲基化; (2)可能肿瘤细胞的异质性有关, 一部分细胞甲基化, 而另一部分非甲基化; (3)肿瘤组织中可能混有炎性细胞或纤维组织. 半甲基化也提示这甲基化过程可能是一个量的积累的过程. 综上所述, 结肠癌组织中RASAL1基因甲基化是一高频事件, 是抑癌基因RASAL1表达下调的重要因素, 进而激活下游信号通路, 引起肿瘤发生发展. 因此, 检测RASAL1基因甲基化水平对结肠癌的诊断有积极的意义.
免疫共沉淀利用抗原和抗体之间专一作用, 研究蛋白质之间相互作用, 确定两种蛋白质在生物组织中相互作用[15], 可以检测与GTP结合的RAS蛋白的量, 根据其占总RAS蛋白的比例, 测出RAS活性. 本实验中, 肿瘤组RAS活性中位数为1.07, 正常组RAS活性中位数0.52, 差异有统计学意义. 表明肿瘤组织中与GTP结合的RAS蛋白的量占总RAS蛋白的比例高, RAS活性高. 与既有的研究表明的肿瘤组织中RASAL1表达下降, 即RAS GTP酶活性降低, 导致RAS-GTP灭活减少, RAS活性增加的观点符合[6].
Ohta等[12]曾收集不同组织学分期的结直肠肿瘤标本, 发现RASAL1在结肠早期腺瘤(直径<1 cm)中表达正常, 结肠腺癌组织中表达较后期腺瘤(直径>1 cm)降低. 这一结果表明, RASAL1表达下降在结直肠癌中早期即发生, 并与进展有关系, 在结肠癌的发展过程中, RASAL1表达下调频率越高, 表明RASAL1的低表达与结肠癌的发展有着密切关系. 本实验研究显示, 随着患者肿瘤分化程度减低、侵袭程度增加、淋巴转移数增加、TNM分期增大, 结肠癌组织中RASAL1甲基化率越高(均P<0.05), RAS活性越高(均P<0.05). 由此可见, RASAL1甲基化及RAS活性与患者疾病进展、TNM分期呈正相关, 与患者性别、年龄及肿瘤大小间差异无统计学意义. 也验证了RASAL1基因甲基化是引起RASAL1表达下降的重要机制的理论, 同时证实了RASAL1表达下降会导致RAS-GTP灭活减少, 即RAS活性升高, 故RASAL1可作为结肠癌早期诊断的指标, 亦可联合其他临床分子生物学指标, 行多基因联合检测, 以提高灵敏度与特异性. 同时, 由于肿瘤分化程度、侵袭程度、淋巴转移、TNM分期是结肠癌预后的评估参数, RASAL1也可作为结肠癌预后评估的重要指标, 指导临床治疗方案. 综上所述, RASAL1通过活化GTP酶,使有活性的RAS-GTP转化为无活性的RAS-GDP, 调控着细胞正常的生长、分化、增殖, 发挥抑癌基因的作用. RASAL1基因发生甲基化后, 功能静默, RASAL1蛋白表达下降, 即RAS-GTP酶活性降低, 导致RAS-GTP灭活减少, 即有活性的RAS增加[14], 因此能激活下游信号通路, 导致肿瘤发生. 甲基化在肿瘤的发展过程中持续存在, 但甲基化的过程也是可逆的, 可通过5-氮杂-2'-脱氧胞苷将其逆转, 称为去甲基化. 甲基化是目前肿瘤研究的重要方向, 抑制甲基化及RAS活性可成为结肠癌诊断治疗的新靶点, 进一步研究去甲基化, 可为肿瘤的治疗提供新的思路.
我国恶性肿瘤的发生率及死亡率逐年上升, 结肠癌即为3大恶性肿瘤之一, 已严重威胁我国居民健康. 对结肠癌的分子水平的研究成为热点, 有关研究发现与结肠癌相关的抑癌基因RASAL1, 在结肠癌组织中表达下降, 导致RAS蛋白活性增高, 从而激活相应的下游信号通路, 细胞过度增殖分化, 引起肿瘤发生发展.
崔莲花, 副教授, 266021, 山东省青岛市, 青岛大学医学院公共卫生系
RASAL1基因是近期新发现的抑癌基因, 可致多种肿瘤的发生, 与结肠癌密切相关. 引起RASAL1基因表达下调的分子生物学机制成为结肠癌研究的重点及热点, 如何干预RASAL1基因功能沉默可能为结肠癌治疗提供新的思路.
国内研究只针对RASAL1基因mRNA及RASAL1蛋白进行检测, 尚未对导致RASAL1基因表达变化的机制进行研究. 本文深入研究了结肠癌组织中RAS活性及甲基化状态与临床病理资料的关系, 不仅发现RASAL1基因可导致结肠癌发生, 还研究在结肠癌发展过程中基因甲基化状态和RAS活性变化的规律, 有助于临床病情的评估及预后判断.
本文检测了RASAL1基因甲基化状态及RAS活性在正常结肠组织及结肠癌组织中的表达情况, 并分析其与结肠癌组织的临床病理资料间的关系, 为研究结肠癌的分子机制提供理论依据, 抑制甲基化及RAS活性可成为结肠癌治疗的新靶点.
本文应用甲基化特异性PCR、免疫共沉淀检测结肠癌组织及正常组织中RASAL1甲基化状态及RAS活性改变, 探讨了其临床意义. 可读性较好, 有助于读者了解RASAL1甲基化在结肠癌中的表达以及RASAL1甲基化与RAS活性的关系.
编辑: 田滢 电编: 闫晋利
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 2. | Westbrook TF, Martin ES, Schlabach MR, Leng Y, Liang AC, Feng B, Zhao JJ, Roberts TM, Mandel G, Hannon GJ. A genetic screen for candidate tumor suppressors identifies REST. Cell. 2005;121:837-848. [PubMed] [DOI] |
| 3. | Herman JG, Latif F, Weng Y, Lerman MI, Zbar B, Liu S, Samid D, Duan DS, Gnarra JR, Linehan WM. Silencing of the VHL tumor-suppressor gene by DNA methylation in renal carcinoma. Proc Natl Acad Sci USA. 1994;91:9700-9704. [PubMed] [DOI] |
| 4. | Vigil D, Cherfils J, Rossman KL, Der CJ. Ras superfamily GEFs and GAPs: validated and tractable targets for cancer therapy? Nat Rev Cancer. 2010;10:842-857. [PubMed] [DOI] |
| 5. | Walker SA, Kupzig S, Bouyoucef D, Davies LC, Tsuboi T, Bivona TG, Cozier GE, Lockyer PJ, Buckler A, Rutter GA. Identification of a Ras GTPase-activating protein regulated by receptor-mediated Ca2+ oscillations. EMBO J. 2004;23:1749-1760. [PubMed] [DOI] |
| 6. | Györffy B, Schäfer R. Biomarkers downstream of RAS: a search for robust transcriptional targets. Curr Cancer Drug Targets. 2010;10:858-868. [PubMed] [DOI] |
| 7. | Yashiro M, Nishioka N, Hirakawa K. K-ras mutation influences macroscopic features of gastric carcinoma. J Surg Res. 2005;124:74-78. [PubMed] [DOI] |
| 8. | Bernards A, Settleman J. Loss of the Ras regulator RASAL1: another route to Ras activation in colorectal cancer. Gastroenterology. 2009;136:46-48. [PubMed] [DOI] |
| 10. | Aytekin T, Ozaslan M, Cengiz B. Deletion mapping of chromosome region 12q13-24 in colorectal cancer. Cancer Genet Cytogenet. 2010;201:32-38. [PubMed] [DOI] |
| 11. | Jin H, Wang X, Ying J, Wong AH, Cui Y, Srivastava G, Shen ZY, Li EM, Zhang Q, Jin J. Epigenetic silencing of a Ca(2+)-regulated Ras GTPase-activating protein RASAL defines a new mechanism of Ras activation in human cancers. Proc Natl Acad Sci USA. 2007;104:12353-12358. [PubMed] [DOI] |
| 12. | Ohta M, Seto M, Ijichi H, Miyabayashi K, Kudo Y, Mohri D, Asaoka Y, Tada M, Tanaka Y, Ikenoue T. Decreased expression of the RAS-GTPase activating protein RASAL1 is associated with colorectal tumor progression. Gastroenterology. 2009;136:206-216. [PubMed] [DOI] |
| 13. | Glickman JF, Flynn J, Reich NO. Purification and characterization of recombinant baculovirus-expressed mouse DNA methyltransferase. Biochem Biophys Res Commun. 1997;230:280-284. [PubMed] [DOI] |
| 14. | Bai T, Tanaka T, Yukawa K, Maeda M, Umesaki N. Reduced expression of death-associated protein kinase in human uterine and ovarian carcinoma cells. Oncol Rep. 2004;11:661-665. [PubMed] |
| 15. | Lee C. Coimmunoprecipitation assay. Methods Mol Biol. 2007;362:401-406. [PubMed] [DOI] |