修回日期: 2012-01-13
接受日期: 2013-01-18
在线出版日期: 2013-02-08
目的: 探讨1,25-二羟维生素D3[1,25(OH)2D3]在葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠溃疡性结肠炎(ulcerative colitis, UC)中的作用机制.
方法: 将30只Balb/c小鼠按随机数字表分为A-E组: 对照组、UC组及低、中、高剂量1,25(OH)2D3干预组. A组小鼠饮用蒸馏水7 d; B-E组小鼠自由饮用5%DSS溶液7 d以制成UC模型. 于造模第1、3、5及7天分别给C-E组小鼠以低、中、高剂量1,25(OH)2D3(50、100、200 ng/只)腹腔内注射, A-B组予腹腔注射溶药载体无菌大豆油作为对照. 观察指标包括疾病活动指数(disease activity index, DAI)和结肠组织病理学评分(histopathological score, HPS). 于造模第8天, 处死所有小鼠. 应用免疫组织化学方法测定小鼠结肠干扰素-γ(interferon-γ, IFN-γ)、白介素(interleukin, IL)-17和IL-4蛋白水平的表达.
结果: (1)与对照组DAI和HPS相比, 模型组小鼠DAI和HPS明显增高(7.33±1.03 vs 0.33±0.52, 12.00±0.63 vs 0.17±0.41, P<0.01); 与模型组相比, 经1,25(OH)2D3干预后C-E组DAI(2.83±0.40、2.83±0.75、2.33±0.52)和HPS(10.83±0.98、7.50±0.84、6.67±0.52)均有不同程度的下降(P<0.01); (2)模型组小鼠结肠IFN-γ(548.00±36.25)和IL-17(121.48±12.34)的表达显著高于对照组IFN-γ(76.68±14.19)和IL-17(31.89±4.19)(P<0.01), 干预组IFN-γ(252.82±32.06、141.72±21.07、171.70±17.12)和IL-17(76.86±4.48、47.00±6.64、37.54±5.36)的表达明显低于模型组(P<0.01); 模型组IL-4(49.72±11.08)的表达则显著低于对照组(89.83±6.97)(P<0.01), 干预组IL-4(127.23±11.04、303.82±78.14、185.31±19.01)的表达明显高于模型组(P<0.01).
结论: 1,25(OH)2D3有助于维持结肠黏膜的局部免疫平衡机制, 减轻溃疡性结肠炎的炎症.
引文著录: 李月芹, 叶建新, 邹玲婷, 张光波, 高楠, 陈卫昌. 1,25(OH)2D3在实验性溃疡性结肠炎中的作用机制. 世界华人消化杂志 2013; 21(4): 313-319
Revised: January 13, 2012
Accepted: January 18, 2013
Published online: February 8, 2013
AIM: To explore the mechanisms underlying the therapeutic effects of 1,25-dihydroxyvitamin D3 [1,25(OH)2D3] against experimental ulcerative colitis (UC).
METHODS: Thirty Balb/c mice were randomly assigned to groups A to E: control group, model group, low-, medium-, and high-dose intervention groups. Groups B-E were given 5% DSS solution for seven days to induce UC, while group A was given equal volume of distilled water. On days 1, 3, 5, and 7, groups C-E were intraperitoneally injected with 50, 100 and 200 ng of 1,25(OH)2D3, respectively. Disease activity index (DAI) and histopathological score (HPS) were calculated. The protein expression of interferon-γ (IFN-γ), interleukin (IL)-17 and IL-4 in colonic tissues was measured by immunohistochemistry.
RESULTS: Compared to the control group, the DAI and HPS were significantly higher in the model group (7.33 ± 1.03 vs 0.33 ± 0.52, 12.00 ± 0.63 vs 0.17 ± 0.41, both P < 0.01). Compared to the model group, the DAI (2.83 ± 0.40, 2.83 ± 0.75, 2.33 ± 0.52) and HPS (10.83 ± 0.98, 7.50 ± 0.84, 6.67 ± 0.52) significantly decreased in the three intervention groups (all P < 0.01). The expression of IFN-γ and IL-17 was significantly higher in the model group than in the control group (both P < 0.01), and was significantly lower in the intervention groups than in the model group (all P < 0.01). IL-4 expression was significantly lower in the model group than in the control group (P < 0.01), and was significantly higher in the intervention group than in the model group (P < 0.01).
CONCLUSION: 1,25(OH)2D3 can maintain local immune balance in the colonic mucosa and reduce inflammation in ulcerative colitis.
- Citation: Li YQ, Ye JX, Zou LT, Zhang GB, Gao N, Chen WC. Mechanisms underlying therapeutic effects of 1,25(OH)2D3 against experimental ulcerative colitis in mice. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 313-319
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/313.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.313
溃疡性结肠炎(ulcerative colitis, UC)的发病机制尚未完全阐明[1], 目前认为, 可能与一系列的易感基因、环境因素、感染及免疫系统异常的相互作用有关, 换句话说, 即环境因素作用于遗传易感者, 在肠道菌丛(或者目前尚未明确的特异性微生物)的参与下, 启动肠道免疫及非免疫系统, 而且导致的免疫炎症反应表现为过度亢进和难于自限[2]. 而同时, 溃疡性结肠炎的发病率正在上升[3]. 近年来研究发现, 当1,25-二羟维生素D3[1,25(OH)2D3]缺乏时, Th1细胞活动会增强, 而Th2细胞和调节性T细胞活动减弱, 由此可诱导出Th1优势免疫应答[4], 从而引起自身免疫性疾病的发生. 已有研究证实1,25(OH)2D3具有调节免疫系统的作用, 认为其可作为一种新型的免疫调节剂, 运用到类风湿关节炎、多发性硬化症、2型糖尿病等多种免疫相关性疾病的治疗中[5-12]. 目前, 1,25(OH)2D3在UC中的研究报道较少, 因此本研究探讨1,25(OH)2D3在UC模型中可能的免疫作用机制.
30只10-12周龄Balb/c清洁级♂小鼠, 体质量25 g±3 g, 购自上海斯莱克实验动物有限责任公司[SCXK(沪)2007-0005]. DSS(MW = 36000-50000)购自MP Bio medicals, LLC, 1,25(OH)2D3(罗盖全胶囊)为瑞士上海罗氏制药有限公司生产, 0.25 μg/粒, 将1,25(OH)2D3液体稀释于无菌大豆油中, 配成浓度为1 μg/mL(0.1 mL大豆油中含1,25(OH)2D3 0.1 μg)成品. Rabbit Anti-IFN gamma(mouse, rat)、Rabbit Anti-IL-17(mouse, rat)和Rabbit Anti-IL-4(mouse, rat)均购自北京博奥森生物技术有限公司; GTVisionTM抗鼠/兔通用型免疫组织化学检测试剂盒[A: HRP标记聚合物(抗兔/鼠); B: DAB缓冲稀释液; C: DAB原液]由Gene Tech (Shanghai) Company limited提供.
1.2.1 造模: 按照Cooper的经典方法, 将30只Balb/c小鼠按随机数字表分为A-E组: 对照组、UC组及低、中、高剂量1,25(OH)2D3干预组. 除外对照组, 其余组小鼠自由饮用5%DSS溶液连续7 d, 建立小鼠溃疡性结肠炎模型[13,14]. 相关研究采用1,25(OH)2D3隔天应用一次, 剂量为5 µg/kg[15,16]. 且已有研究证明, 经腹腔注射或者口服给药方式对疾病指标或相关因子的影响程度相似, 无显著性差异[17,18]. 因此, 参照Gysemans CA, Foumier C提出的用药剂量和时间, 设定3个剂量组, 于造模第1、3、5及7天分别给3个干预组小鼠以低、中、高剂量1,25(OH)2D3(50、100、200 ng/只)腹腔内注射[15,16], 对照组与模型组予腹腔注射溶药载体无菌大豆油作为对照. 于造模第8天, 处死所有小鼠, 采集小鼠结肠标本备检.
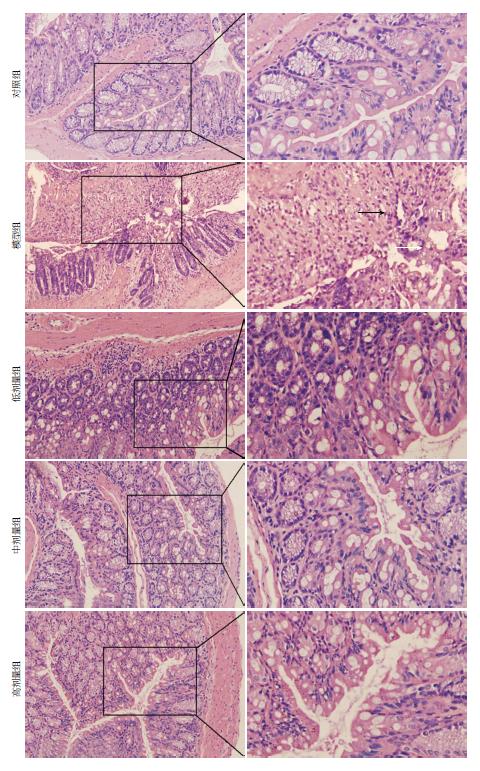
1.2.2 DAI与HPS: 造模过程每日观察小鼠的体质量、大便性状和隐血情况, 计算疾病活动指数(disease activity index, DAI)评分[14]. 每只小鼠在远端结肠、中端结肠和近端结肠各取1块组织标本(2 mm×10 mm), 常规石蜡包埋、连续4 μm病理切片(HE染色), 光镜下按结肠组织病理学评分(histopathological score, HPS)评分评估UC小鼠的结肠黏膜损伤情况[14].
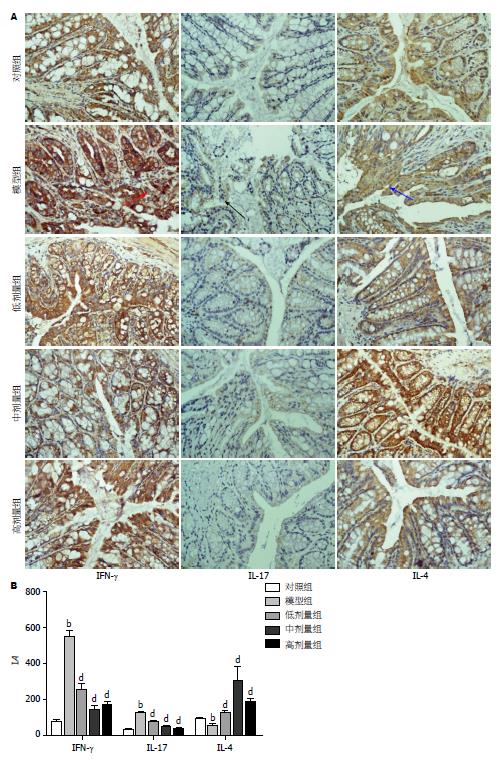
1.2.3 免疫组织化学检测小鼠结肠IFN-γ、IL-17和IL-4蛋白表达: 采集的小鼠结肠组织经包埋、切片、烤片、脱蜡、水化、高温高压抗原修复后, 按试剂说明书步骤进行染色. 用PBS代替一抗作为阴性对照, 用已知阳性组织作为阳性对照. 加一抗工作液50-100 μL于组织上, 37 ℃孵育60 min. 孵育完毕, 用PBS洗3次, 3 min/次. 加A液50-100 μL, 37 ℃孵育30 min. 孵育完毕, 用PBS洗3次, 3 min/次. 滴加DAB显色, 用蒸馏水冲洗终止显色. 复染后, 乙醇由低至高浓度逐级脱水, 再入二甲苯, 封片. 镜检, 干扰素-γ(interferon-γ, IFN-γ)、白介素(interleukin, IL)-17和IL-4为胞浆阳性, 应用Image-pro plus 6.0图像分析软件, IFN-γ、IL-17和IL-4蛋白表达量用累计吸光度(IA)表示.
统计学处理 使用统计软件SPSS17.0, Levene法进行方差齐性检验, 应用方差分析, 组间比较用LSD-t(方差齐)或Tamhane(方差不齐), 各组数据以mean±SD表示, 以P<0.05为差异有统计学意义.
模型组于第5-7天均出现肉眼黏液血便, 体质量下降明显, 而对照组小鼠大便正常, 体质量增加. 不同剂量的1,25(OH)2D3干预后, 黏液血便、消瘦等症状有不同程度的缓解. 对各组小鼠进行DAI定量评分, 模型组较对照组明显升高(P<0.01); 各干预组跟模型组相比差异均有统计学意义(P<0.01, 表1). 模型组4只小鼠结肠黏膜可见点状出血灶, 但均未见明显糜烂、溃疡, 2只小鼠黏膜未见明显异常. 其余组小鼠结肠黏膜无明显异常. 与对照组相比, 模型组小鼠光镜下全结肠黏膜出现多灶浅溃疡, 大部分隐窝被完全破坏, 少数残留腺体排列紊乱, 杯状细胞明显减少; 黏膜和黏膜下层广泛存在炎性细胞浸润. 各干预组小鼠结肠黏膜较完整, 隐窝结构基本正常, 炎性细胞少量浸润. HPS评分显示模型组明显高于对照组(P<0.01); 各干预组较模型组均有显著下降(P<0.01, 表1, 图1).
对照组小鼠结肠结构完整; 上皮及肠腺中可观察到IFN-γ棕黄色阳性颗粒, 免疫反应物均匀分布于胞浆中, 检测IFN-γ在小鼠结肠中的表达为76.68±14.19; 上皮及肠腺中可观察到IL-17少量棕色阳性颗粒, 免疫反应物散在分布于胞浆中, 表达量为31.89±4.19; 上皮及肠腺中可观察到IL-4棕黄色阳性颗粒, 免疫反应物均匀分布于胞浆中, 表达量为89.83±6.97. 模型组小鼠结肠大部分隐窝被破坏; IFN-γ、IL-17的表达量明显升高(548.33±36.25、121.48±12.34); IL-4的表达量下降(49.72±11.08). 经1,25(OH)2D3治疗后, 干预组小鼠结肠黏膜基本完整; IFN-γ的表达量显著下降(252.82±32.06、141.72±21.07、171.70±17.12); IL-17的表达量亦下降(76.86±4.48、47.00±6.64、37.54±5.36); IL-4的表达量则显著升高(127.23±11.04、303.82±78.14、185.31±19.01). 这提示UC结肠黏膜中IFN-γ、IL-17的含量增加, IL-4的含量下降; 1,25(OH)2D3干预后, IFN-γ、IL-17的含量下降, IL-4的含量升高. 各组IFN-γ、IL-17和IL-4的IA值不满足方差齐性, 故采用Tamhane检验(图2).
在我国, UC是较常见的消化系疾病和慢性腹泻的主要病因, 并且正逐渐引起消化界的高度关注[1]. 继1997年Sartor提出免疫调节异常在炎症性肠病(inflammatory bowel disease, IBD)的发病中占有中心地位的假说发表并被广泛接受后, 越来越多的学者认为IBD是一种自身免疫性疾病. UC患者体内存在免疫功能紊乱, 经1,25(OH)2D3治疗后T淋巴细胞在植物凝集素的刺激下, 增殖明显低于正常对照组, 并呈剂量依赖性特点[19]. IBD的发病过程中, 1,25(OH)2D3的缺乏较为常见[20,21]. Cantorna等[22]亦报道了维生素D可能的治疗和预防IBD的作用, 敲除IL-10小鼠, 维生素D缺乏会加剧IBD的症状和病情.
由于多种细胞内均存在特异性维生素D受体(specific vitamin D receptor, SVDR), 因此1,25(OH)2D3对免疫系统的影响是多方面的. 大多数实验表明, 1,25(OH)2D3可以抑制T细胞向Th1及Th17分化, 促进及调节调节性T细胞(Treg)向Th2分化[9]. 1,25(OH)2D3可抑制白介素(interleukin)-12(IL-12)及Th1分泌的IFN-γ、IL-5等相关细胞因子, 而IL-12在Th1的分化过程中起重要作用, 因此1,25(OH)2D3可以抑制Th1细胞的分化, 但也有研究者认为, 1,25(OH)2D3并不能抑制Th1的分化[23,24], 相关研究表明, 1,25(OH)2D3可直接作用于T细胞亚型如Th1细胞、Th17细胞等, 下调促炎因子IFN-γ、IL-17等, 同时亦能上调Th2型细胞因子IL-4等[6,25]. 本实验用1,25(OH)2D3干预UC模型可以缓解UC小鼠的黏液血便、消瘦等症状, 亦能减轻UC小鼠肠黏膜病理学上的炎症改变, 这也提示一定剂量的1,25(OH)2D3可能对UC小鼠有治疗效应.
研究证实, IFN-γ主要由Th1淋巴细胞产生, 他的免疫调节活性强, 是典型的促炎因子. 研究表明, Th17细胞产生的IL-17在炎症性疾病和自身免疫性疾病中起着关键的作用[26-29]. 而IL-4主要由活化T细胞合成, 可以抑制细胞因子包括IL-1、IL-6等的产生, UC患者的IL-4 mRNA表达及蛋白分泌明显减少, 提示IL-4与UC的发病有关[17]. 本实验应用免疫组织化学方法测定小鼠病变结肠组织中IFN-γ、IL-17和IL-4蛋白水平的表达, 研究结果提示, UC小鼠结肠组织IFN-γ和IL-17蛋白表达量高于对照组, IL-4的蛋白表达量明显下降, 这与王婷等学者的观点是相符的[2]; 经1,25(OH)2D3干预后IFN-γ和IL-17的表达则有不同程度的下降, 而IL-4的表达明显升高. 这提示, 1,25(OH)2D3抑制肠道炎症因子IFN-γ和IL-17的表达, 上调抑炎因子IL-4是成立的.
本实验着手UC小鼠模型的免疫机制方面进行了探讨, 发现UC小鼠IFN-γ、IL-17的蛋白表达量均显著升高, 而IL-4的蛋白表达量明显下降, 这提示Th1细胞、Th17细胞在UC中可能是活跃的, Th2反应则被抑制. 1,25(OH)2D3干预后IFN-γ和IL-17的表达水平明显下降, IL-4的表达水平显著上升, 这表明1,25(OH)2D3可以抑制过度的免疫反应, 减少促炎因子的过度表达, 上调抑炎因子, 促进促炎、抑炎因子的平衡, 从而缓解肠道炎症. 后续我们将进一步探索1,25(OH)2D3对免疫系统的具体作用机制.
1,25-二羟维生素D3[1,25(OH)2D3], 是维生素D的活性形式, 相关研究证实1,25(OH)2D3具有调节免疫系统的作用, 认为其可作为一种新型的免疫调节剂, 运用到多种免疫相关性疾病的治疗中. 1,25(OH)2D3作为维生素D受体(VDR)的配体发挥生物效应, VDR属于核受体超家族, 免疫系统的大多数细胞类型中都有VDR存在, 尤其是抗原呈递细胞(APC)和T细胞. 本文针对1,25(OH)2D3在溃疡性结肠炎中的应用进行了研究.
杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院
由于多种细胞内均存在特异性维生素D受体(SVDR), 因此1,25(OH)2D3对免疫系统的影响是多方面的.
大多数实验表明, 1,25(OH)2D3可以抑制T细胞向Th1及Th17分化, 促进及调节调节性T细胞(Treg)向Th2分化.
对1,25(OH)2D3与自身免疫性疾病的相关性进深入研究, 将为从基因水平认识自身免疫性疾病的发病机制提供重要的线索, 并且可为疾病的治疗和预防提供新的途径.
系统性红斑狼疮(SLE): 是一种具有广泛临床和免疫学异常的自身免疫性疾病, 其病因学尚不明确. 遗传对SLE的重要影响已在大量的流行病学研究中得到验证. 除了遗传易感因素以外, 环境因素也与自身免疫性疾病的发生发展密切关系, 维生素D可能就是一个重要的环境因素. 在光照少的地区, 如北美、北欧地区, 自身免疫性疾病的患病率较高. 另外, 维生素D摄入较少也可能是患病原因. SLE患者体内DCs数量及功能的异常改变在其发病及病情进展中具有很重要的作用.
本文创新性较强, 结果可靠, 有较高的学术价值.
编辑: 李军亮 电编: 闫晋利
| 3. | Bernstein CN, Fried M, Krabshuis JH, Cohen H, Eliakim R, Fedail S, Gearry R, Goh KL, Hamid S, Khan AG. 2010年世界胃肠病学组织关于炎症性肠病诊断和治疗的实践指南. 胃肠病学. 2010;15:548-558. |
| 4. | Cantorna MT, Mahon BD. Mounting evidence for vitamin D as an environmental factor affecting autoimmune disease prevalence. Exp Biol Med (Maywood). 2004;229:1136-1142. [PubMed] |
| 5. | Baroni E, Biffi M, Benigni F, Monno A, Carlucci D, Carmeliet G, Bouillon R, D'Ambrosio D. VDR-dependent regulation of mast cell maturation mediated by 1,25-dihydroxyvitamin D3. J Leukoc Biol. 2007;81:250-262. [PubMed] [DOI] |
| 6. | Jeffery LE, Burke F, Mura M, Zheng Y, Qureshi OS, Hewison M, Walker LS, Lammas DA, Raza K, Sansom DM. 1,25-Dihydroxyvitamin D3 and IL-2 combine to inhibit T cell production of inflammatory cytokines and promote development of regulatory T cells expressing CTLA-4 and FoxP3. J Immunol. 2009;183:5458-5467. [PubMed] |
| 7. | Yan X, Zhao Y, Pan J, Fang K, Wang Y, Li Z, Chang X. Vitamin D-binding protein (group-specific component) has decreased expression in rheumatoid arthritis. Clin Exp Rheumatol. 2012;30:525-533. [PubMed] |
| 8. | Cantorna MT, Zhao J, Yang L. Vitamin D, invariant natural killer T-cells and experimental autoimmune disease. Proc Nutr Soc. 2012;71:62-66. [PubMed] [DOI] |
| 9. | Correale J, Ysrraelit MC, Gaitán MI. Immunomodulatory effects of Vitamin D in multiple sclerosis. Brain. 2009;132:1146-1160. [PubMed] [DOI] |
| 10. | Mathieu C, Adorini L. The coming of age of 1,25-dihydroxyvitamin D(3) analogs as immunomodulatory agents. Trends Mol Med. 2002;8:174-179. [PubMed] |
| 11. | Xuan Y, Zhao HY, Liu JM. Vitamin D and Type 2 Diabetes. J Diabetes. 2013; Jan 10. [Epub ahead of print]. [PubMed] [DOI] |
| 12. | Cantorna MT. Vitamin D and its role in immunology: multiple sclerosis, and inflammatory bowel disease. Prog Biophys Mol Biol. 2006;92:60-64. [PubMed] |
| 13. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 15. | Fournier C, Gepner P, Sadouk M, Charreire J. In vivo beneficial effects of cyclosporin A and 1,25-dihydroxyvitamin D3 on the induction of experimental autoimmune thyroiditis. Clin Immunol Immunopathol. 1990;54:53-63. [PubMed] |
| 16. | Gysemans CA, Cardozo AK, Callewaert H, Giulietti A, Hulshagen L, Bouillon R, Eizirik DL, Mathieu C. 1,25-Dihydroxyvitamin D3 modulates expression of chemokines and cytokines in pancreatic islets: implications for prevention of diabetes in nonobese diabetic mice. Endocrinology. 2005;146:1956-1964. [PubMed] [DOI] |
| 17. | Lemire JM, Archer DC. 1,25-dihydroxyvitamin D3 prevents the in vivo induction of murine experimental autoimmune encephalomyelitis. J Clin Invest. 1991;87:1103-1107. [PubMed] [DOI] |
| 19. | Stio M, Bonanomi AG, d'Albasio G, Treves C. Suppressive effect of 1,25(OH)2D3 and its analogues EB 1089 and KH 1060 on T lymphocyte proliferation in active ulcerative colitis. Biochem Pharmacol. 2001;61:365-371. |
| 20. | Ulitsky A, Ananthakrishnan AN, Naik A, Skaros S, Zadvornova Y, Binion DG, Issa M. Vitamin D deficiency in patients with inflammatory bowel disease: association with disease activity and quality of life. JPEN J Parenter Enteral Nutr. 2011;35:308-316. [PubMed] [DOI] |
| 21. | Chatu S, Chhaya V, Holmes R, Neild P, Kang JY, Pollok RC, Poullis A. Factors associated with vitamin D deficiency in a multicultural inflammatory bowel disease cohort. Frontline Gastroenterol. 2013;4:51-56. [DOI] |
| 22. | Cantorna MT, Zhu Y, Froicu M, Wittke A. Vitamin D status, 1,25-dihydroxyvitamin D3, and the immune system. Am J Clin Nutr. 2004;80:1717S-1720S. [PubMed] |
| 23. | Chang JH, Cha HR, Lee DS, Seo KY, Kweon MN. 1,25-Dihydroxyvitamin D3 inhibits the differentiation and migration of T(H)17 cells to protect against experimental autoimmune encephalomyelitis. PLoS One. 2010;5:e12925. [PubMed] [DOI] |
| 24. | Palmer MT, Lee YK, Maynard CL, Oliver JR, Bikle DD, Jetten AM, Weaver CT. Lineage-specific effects of 1,25-dihydroxyvitamin D(3) on the development of effector CD4 T cells. J Biol Chem. 2011;286:997-1004. [PubMed] [DOI] |
| 25. | Colin EM, Asmawidjaja PS, van Hamburg JP, Mus AM, van Driel M, Hazes JM, van Leeuwen JP, Lubberts E. 1,25-dihydroxyvitamin D3 modulates Th17 polarization and interleukin-22 expression by memory T cells from patients with early rheumatoid arthritis. Arthritis Rheum. 2010;62:132-142. [PubMed] [DOI] |
| 26. | Seguin P, Béziat JL, Achard R, Momège B. [Clinical and therapeutic aspects of maxillofacial lesions of Paget's disease]. Rev Stomatol Chir Maxillofac. 1988;89:80-86. [PubMed] [DOI] |
| 27. | Daniel C, Sartory NA, Zahn N, Radeke HH, Stein JM. Immune modulatory treatment of trinitrobenzene sulfonic acid colitis with calcitriol is associated with a change of a T helper (Th) 1/Th17 to a Th2 and regulatory T cell profile. J Pharmacol Exp Ther. 2008;324:23-33. [PubMed] [DOI] |
| 28. | Bettelli E, Oukka M, Kuchroo VK. T(H)-17 cells in the circle of immunity and autoimmunity. Nat Immunol. 2007;8:345-350. [PubMed] [DOI] |
| 29. | Lubberts E. Th17 cytokines and arthritis. Semin Immunopathol. 2010;32:43-53. [PubMed] [DOI] |