修回日期: 2013-11-17
接受日期: 2013-11-19
在线出版日期: 2013-11-28
目的: 了解卡马西平对肝脏缺血再灌注的保护作用.
方法: 动脉夹阻断肝脏血流1 h释放形成再灌建立小鼠肝脏缺血再灌注模型. 6-8周龄♂Balb/c随机分为缺血再灌组(对照组)、卡马西平组、卡马西平+氯喹组, 每组6只. 生化检测各组缺血再灌不同时间点血清丙氨酸转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate transaminase, AST)水平. HE染色观察肝脏形态学变化, 免疫组织化学分析肝脏高迁移率族蛋白B1(high mobility group box 1, HMGB1)表达, 免疫印迹检测Caspase3、Atg7、Beclin-1和微管相关蛋白1轻链3Ⅱ(light chain 3 Ⅱ, LC3Ⅱ)表达.
结果: 卡马西平阻止缺血再灌注小鼠肝脏LC3Ⅱ和自噬相关基因Atg7与Beclin-1的表达下降. 卡马西平组缺血再灌后2、6和12 h血清ALT/AST水平显著低于缺血再灌组(P<0.01). 卡马西平降低缺血再灌6 h肝细胞Caspase3表达和HMGB1胞浆移位. 抑制自噬的药物氯喹具有对抗卡马西平降低Caspase3表达、HMGB1胞浆移位和血清ALT/AST水平的效应.
结论: 卡马西平通过促进肝细胞自噬保护肝脏缺血后再灌注损伤.
核心提示: 本研究发现卡马西平增加缺血再灌小鼠肝脏细胞自噬, 降低血清丙氨酸转氨酶(alanine aminotransferase)/谷草转氨酶(aspartate transaminase)水平、Caspase3表达和高迁移率族蛋白B1(high mobility group box B1)胞浆移位. 氯喹抑制自噬对抗卡马西平的上述效应. 表明卡马西平促进肝细胞自噬保护缺血再灌损伤, 具有重要临床应用价值.
引文著录: 雷延昌, 罗盼, 李雯. 卡马西平保护小鼠肝脏缺血再灌注损伤. 世界华人消化杂志 2013; 21(33): 3617-3622
Revised: November 17, 2013
Accepted: November 19, 2013
Published online: November 28, 2013
AIM: To explore the effects of carbamazepine (CBZ) on hepatic ischemia/reperfusion (I/R) injury in mice.
METHODS: Hepatic ischemia in male Balb/c mice was induced by occluding the portal triad for 1 h, and reperfusion was initiated by removing a microvascular clamp. Mice were randomly assigned to three groups (n = 6 for each group): I/R group as control, CBZ treatment group, and CBZ plus chloroquine (CQ) group. Serum ALT/AST levels at different time points were measured using biochemical methods. Hepatic morphological changes at 6 h after I/R were assessed by HE staining, and hepatocyte high mobility group box 1 (HMGB1) cytoplasmic translocation was detected by immunohistochemistry. Expression of Caspase3, Atg7, Beclin-1 and light chain 3 Ⅱ (LC3Ⅱ) in liver tissue was analyzed by Western blot.
RESULTS: CBZ blocked the depletion of Atg7 and Beclin-1 and LC3II expression after reperfusion. CBZ treatment decreased ALT/AST levels significantly 2, 6 and 12 h after I/R compared with the I/R group (all P < 0.01). Expression of Caspase3 in liver tissue and hepatocyte HMGB1 cytoplasmic translocation at 6 h after I/R were also decreased significantly in the CBZ group (both P < 0.01). CQ antagonized the effect of CBZ in decreasing ALT/AST levels, Caspase3 expression and hepatocyte HMGB1 cytoplasmic translocation.
CONCLUSION: CBZ protects the liver against I/R injury in mice.
- Citation: Lei YC, Luo P, Li W. Carbamazepine protects the liver against ischemia/reperfusion injury in mice. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3617-3622
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3617.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3617
自噬是细胞依赖溶酶体及时清除或处理过剩的或失去功能的胞浆蛋白或细胞器的过程. 自噬是主要的肝脏蛋白分解代谢方式, 对肝脏缺血再灌损伤具有保护作用. 研究显示, 上调自噬相关基因表达降低缺血再灌损伤线粒体通透性增加, 从而减轻其功能障碍[1,2]. 因此, 促进自噬对肝脏缺血再灌损伤具有潜在的治疗价值. 然而, 目前通过基因和药物增加自噬面临一些问题. 基因治疗存在安全性、治疗效率、免疫反应、致突变和伦理方面问题[3]. 在药物方面, 雷帕霉素及其类似物有效促进自噬, 但存在免疫抑制和高脂血症等严重不良反应[4,5]. 最近发现, 抗惊厥药物卡马西平降低细胞内肌醇水平促进自噬[6]. 并且发现, 卡马西平用于治疗α1-抗胰蛋白酶(α1-antitrypsin, α1-AT)缺乏肝纤维化, 其作用机制是通过自噬降解突变的Z蛋白[7,8]. 为了解卡马西平对肝脏缺血再灌损伤的作用, 进行本研究.
6-8周龄♂Balb/c小鼠, 体质量20 g±0.5 g, 由南昌大学医学院动物实验中心提供(动物质量合格证编号: 2013091206), 动物饲养和处理严格按照美国国立卫生研究院实验动物饲养和使用指南. 主要试剂: 卡马西平(Carbamazepine, CBZ)和氯喹(Chloroquine, CQ)标准品购自中国生物制品检定所; 兔抗鼠高迁移率族蛋白B1(high mobility group box 1, HMGB1)(ABGENT公司, 美国); 兔抗鼠Caspase3(Scant Cruz公司, 美国); 兔抗鼠Atg7、Beclin-1和LC3Ⅱ(Cell signaling公司, 美国).
1.2.1 动物模型及分组: Balb/c小鼠♂实验前12 h禁食, 不禁水. 将体质量和周龄相同的动物随机分为3组: 缺血再灌组(对照组)、卡马西平组、卡马西平+氯喹组, 每组6只. 肝脏缺血再灌注模型参照文献[1]进行, 采用动脉夹阻断肝脏血流1 h后释放形成再灌. 小鼠乙醚麻醉下打开胸腔, 动脉夹住肝门1 h, 释放动脉夹血流再灌, 无菌手术缝合腹部切口, 敷料包扎. 卡马西平组肝脏缺血再灌注前12 h给予卡马西平25 mg/kg腹腔注射, 卡马西平+氯喹组, 分别于缺血再灌前12 h和6 h给予卡马西平(25 mg/kg)和磷酸氯喹(60 mg/kg)腹腔注射, 肝脏缺血再灌注组给予等量PBS腹腔注射[9,10].
1.2.2 标本收集: 肝脏缺血前、缺血1 h, 再灌后2、6、12、24、48 h动物乙醚麻醉眼眶采血50 µL, 分离血清置于-80 ℃保存. 分别在肝脏缺血1 h和再灌后6 h处死部分动物, 肝组织-80 ℃冻存用于免疫印迹检测, 40 g/L的中性甲醛固定肝组织, 进行HE染色和免疫组织化学检测HMGB1表达.
1.2.3 血清生化检测: 全自动生化分析仪检测丙氨酸转氨酶(alanine aminotransferase, ALT)和谷草转氨酶(aspartate transaminase, AST)按照生产厂家说明书进行, 根据标准曲线计算结果.
1.2.4 免疫印迹及其分析: 取0.5 g肝组织研磨后加入1 mL含蛋白酶抑制剂混合物的双蒸水混匀-80 ℃保存, 取10 µL样品加入90 µL RIPA高效裂解液(碧云天, 中国)充分裂解, 6000 g离心30 s, 加入50 µL上样缓冲液, 聚丙烯酰胺凝胶电泳后转移至硝酸纤维素膜上, 10%的BSA在4 ℃封闭过夜, 一抗37 ℃孵育2 h, 1:10000辣根过氧化物酶标记的羊抗兔IgG抗体37 ℃孵育0.5 h, 化学发光法检测结果.
统计学处理 所有数据用SPSS18.0软件作统计学分析, 数据资料以mean±SD表示, 两组均数之间的比较应用t检验, 两组样本率的比较采用χ2检验, P<0.05为差异有统计学意义.
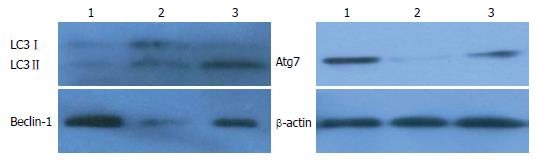
免疫印迹检测自噬特异性LC3Ⅱ表达显示, LC3Ⅱ在缺血期无明显表达, 而在再灌6 h时LC3Ⅱ表达增加, 卡马西平促进肝脏缺血再灌注肝细胞LC3Ⅱ表达水平, 促进自噬(图1). 为进一步了解卡马西平对肝脏缺血再灌注肝细胞自噬的作用, 免疫印迹检测自噬相关蛋白Atg7和Beclin-1表达显示, 卡马西平同样可以增加肝脏缺血再灌注肝细胞自噬相关蛋白的表达(图1). 表明卡马西平增加肝脏缺血再灌注肝细胞自噬.
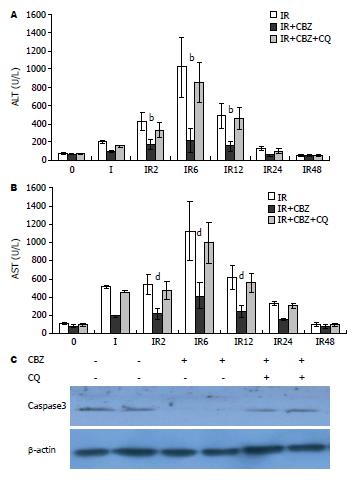
生化检测血清ALT水平可了解患者和小鼠肝细胞损伤的程度. 肝脏缺血再灌注小鼠血清ALT水平在缺血1 h开始升高, 再灌后6 h达到峰值, 在12和24 h逐渐降低, 48 h恢复至正常水平. 卡马西平治疗降低血清ALT/AST水平, 其中再灌2、6和12 h的ALT/AST水平与对照组差异有显著性(P<0.01, 图2A, B). 表明, 卡马西平对肝脏缺血再灌注损伤具有被保护作用. 在本实验条件下, 肝脏缺血再灌注6 h肝组织HE染色未发现肝细胞坏死. 为进一步了解卡马西平对肝脏缺血再灌肝细胞保护作用, 免疫印迹检测肝脏凋亡相关蛋白Caspase3的表达显示, 肝脏缺血再灌6 h肝脏Caspase3的表达升高, 而卡马西平治疗组肝脏Caspase3的表达显著降低(图2C). 表明, 卡马西平具有保护缺血再灌肝脏细胞凋亡的作用. 为了解卡马西平肝损伤保护作用与自噬的关系, 缺血再灌注前给予氯喹抑制自噬, 发现卡马西平降低小鼠血清ALT、AST水平和肝脏缺血再灌6 h肝脏Caspase3表达的作用消失(图2), 肝细胞损伤和凋亡有所增加. 提示卡马西平对肝脏缺血再灌损伤的保护作用依赖于促进肝细胞自噬效应.
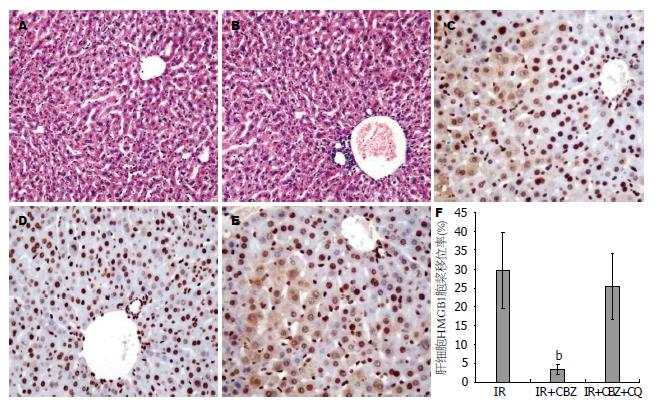
肝脏缺血再灌注6 h肝组织HE染色未发现肝细胞坏死(图3A, B), 但已经出现肝细胞凋亡. 免疫组织化学检测肝细胞HMGB1表达发现, 缺血再灌注6 h后接近三分之一肝细胞胞浆表达HMGB1, 发生HMGB1肝细胞胞浆移位, 而卡马西平治疗组HMGB1在肝细胞胞浆几乎无表达(图3C, D). 氯喹预处理抑制自噬抵消卡马西平抑制肝细胞HMGB1胞浆移位(图3E). 图像分析显示, 卡马西平组肝细胞HMGB1胞浆移位率显著低于对照组和卡马西平+氯喹组, 差异有显著性(P<0.01, 图3F).
肝脏移植、手术、休克和心力衰竭等因素均可导致肝脏缺氧, 有氧代谢障碍、ATP减少和酸中毒, 再灌恢复正常氧和营养物质浓度, 肝脏损伤加重, 发生缺血后再灌注损伤. 肝脏和其他一些组织在血流再灌时线粒体通透性增加, 导致氧化磷酸化解偶联, 线粒体功能障碍和细胞死亡[1]. 然而, 目前对缺血再灌的线粒体功能障碍缺乏有效的治疗方法.
研究显示, 自噬在生理病理情况下都具有重要作用. 在生理情况下, 自噬主要为细胞提供营养. 在应激情况下, 如缺血再灌、酒精和对乙酰氨基酚肝损伤和脂多糖(lipopolysaccharide, LPS)刺激等, 自噬成为适应这些应激的一种反应[1,2,9,11,12]. 本研究显示, 卡马西平提高缺血再灌肝脏自噬水平, 降低ALT/AST水平和肝细胞凋亡, 并减轻肝细胞HMGB1胞浆移位, 从而保护缺血再灌肝损伤, 具有潜在的治疗应用价值.
最近在研究α1-AT肝纤维化的研究中发现, 抗惊厥药物卡马西平促进肝细胞自噬, 其机制是通过降低细胞内肌醇水平[6-8]. 本研究显示, 卡马西平25 mg/kg腹腔注射, 增加缺血再灌6 h小鼠肝脏LC3Ⅱ表达水平, 促进肝细胞自噬. 与之相一致, 卡马西平增加自噬相关蛋白Atg7和Beclin-1表达. 研究显示, 自噬相关蛋白Atg7和Beclin-1在肝损伤保护中具有重要作用, Atg7基因敲除小鼠肝脏出现异常线粒体聚集, 而Beclin-1缺失加重肝脏缺血再灌损伤[13-15]. 卡马西平增加Atg7和Beclin-1表达进一步显示其自噬依赖的肝脏保护作用.
在本研究实验条件下, 小鼠肝脏缺血再灌注2 h后ALT/AST水平明显升高, 再灌后6 h达到峰值, 12 h仍维持在较高水平, 与国内外的研究一致[16-19]. 卡马西平治疗降低再灌2、6和12 h的ALT/AST水平. 然而, 缺血再灌6 h肝组织HE染色并未发现肝细胞坏死, 但免疫印迹检测发现, 卡马西平降低缺血再灌6 h肝脏Caspase3表达, 提示卡马西平通过抑制肝细胞凋亡保护缺血再灌肝损伤.
近年来发现, HMGBl在肝脏缺血后再灌注损伤发挥重要作用[20]. 正常情况下, HMGB1主要存在于胞核, 肝细胞坏死被动释放HMGB1, 炎症如LPS, 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和缺氧等刺激肝细胞主动释放HMGB1, 从胞核至胞浆后释放, 放大炎症反应及其损伤[20-23]. 因此, 检测HMGB1肝细胞胞浆移位可以间接早期了解肝脏受损情况. 研究显示, 急性肝衰竭患者和小鼠模型早期出现血清HMGB1升高和大量肝细胞HMGB1胞浆移位[11,24-26]. 因此, 检测肝细胞HMGB1胞浆移位可以间接早期了解肝脏受损情况. 然而HMGB1胞浆移位在肝脏缺血再灌中的作用尚不清楚. 本研究发现, 肝脏缺血再灌6 h后虽然肝组织未出现肝细胞坏死, 但已出现Caspase3表达提示肝细胞凋亡, 同时出现大量肝细胞HMGB1胞浆移位, 而卡马西平治疗可显著减少HMGB1胞浆移位肝细胞数量. 进一步表明卡马西平对肝脏缺血再灌保护作用.
已知, 氯喹是目前公认的已知自噬药物[27,28], 为了解卡马西平肝损伤保护作用与自噬的关系, 缺血再灌注前给予氯喹阻断自噬, 发现卡马西平降低小鼠血清ALT/AST水平、Caspase3表达和肝细胞HMGB1胞浆移位的作用消失, 肝细胞损伤增加. 提示卡马西平对肝脏缺血再灌损伤的保护作用依赖于促进肝细胞自噬效应. 最近研究发现, 促进肝细胞自噬可以保护对乙酰氨基酚、D-氨基半乳糖(D-galactosamine, D-GaIN)/LPS以及酒精对小鼠的肝细胞毒性, 抑制肝细胞自噬增加TNF-α和D-GalN诱导的肝细胞凋亡及损伤[9,29-31]. 本研究发现卡马西平增加肝细胞自噬是保护缺血再灌肝损伤脏的机制之一.
本研究发现, 卡马西平降低肝脏缺血再灌小鼠血清ALT/AST水平、Caspase3表达和肝细胞HMGB1胞浆移位, 自噬抑制剂氯喹使卡马西平的上述作用消失. 表明, 卡马西平具有依赖自噬保护缺血再灌肝损伤作用. 该结果为卡马西平保护肝脏缺血再灌损伤提供了新的理论基础, 具有重要的理论和应用价值, 应用卡马西平治疗缺血再灌肝损伤值得进一步实验和临床研究.
自噬是细胞依赖溶酶体清除处理过剩或失去功能胞浆蛋白和细胞器的过程, 对肝脏缺血再灌损伤具有保护作用. 最近发现, 卡马西平促进肝细胞自噬治疗α1-抗胰蛋白酶缺乏肝纤维化, 对肝脏缺血再灌的保护作用不清楚.
李胜, 研究员, 山东省肿瘤防治研究院肝胆外科
相关研究表明, 自噬保护肝脏缺血再灌损伤, 基因治疗和雷帕霉素促进自噬面临安全性、免疫抑制和高脂血症等不良反应. 寻找临床不良反应较小的促自噬药物对治疗缺血再灌具有重要意义.
自噬保护肝脏缺血再灌损伤, 促进自噬减轻脂肪性肝炎和肝癌发生, HBC和HCV促进肝细胞自噬利于其生存. 最近发现, 卡马西平促进肝细胞自噬治疗α1-抗胰蛋白酶缺乏肝纤维化.
本研究发现, 临床不良反应较小的卡马西平增加缺血再灌小鼠肝脏自噬, 降低血清ALT/AST、抑制肝细胞凋亡和HMGB1胞浆移位.
本实验研究发现卡马西平通过促进自噬保护肝脏缺血再灌损伤, 值得进一步临床研究了解应用价值.
本文具有一定的基础和临床应用价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Kim JS, Nitta T, Mohuczy D, O'Malley KA, Moldawer LL, Dunn WA, Behrns KE. Impaired autophagy: A mechanism of mitochondrial dysfunction in anoxic rat hepatocytes. Hepatology. 2008;47:1725-1736. [PubMed] [DOI] |
| 2. | Wang JH, Ahn IS, Fischer TD, Byeon JI, Dunn WA, Behrns KE, Leeuwenburgh C, Kim JS. Autophagy suppresses age-dependent ischemia and reperfusion injury in livers of mice. Gastroenterology. 2011;141:2188-2199. e6. [PubMed] [DOI] |
| 3. | Verma IM, Somia N. Gene therapy -- promises, problems and prospects. Nature. 1997;389:239-242. [PubMed] [DOI] |
| 4. | Brattström C, Wilczek H, Tydén G, Böttiger Y, Säwe J, Groth CG. Hyperlipidemia in renal transplant recipients treated with sirolimus (rapamycin). Transplantation. 1998;65:1272-1274. [PubMed] [DOI] |
| 5. | Hartford CM, Ratain MJ. Rapamycin: something old, something new, sometimes borrowed and now renewed. Clin Pharmacol Ther. 2007;82:381-388. [PubMed] [DOI] |
| 6. | Williams A, Sarkar S, Cuddon P, Ttofi EK, Saiki S, Siddiqi FH, Jahreiss L, Fleming A, Pask D, Goldsmith P. Novel targets for Huntington's disease in an mTOR-independent autophagy pathway. Nat Chem Biol. 2008;4:295-305. [PubMed] [DOI] |
| 7. | Hidvegi T, Ewing M, Hale P, Dippold C, Beckett C, Kemp C, Maurice N, Mukherjee A, Goldbach C, Watkins S. An autophagy-enhancing drug promotes degradation of mutant alpha1-antitrypsin Z and reduces hepatic fibrosis. Science. 2010;329:229-232. [PubMed] [DOI] |
| 8. | Puls F, Goldschmidt I, Bantel H, Agne C, Bröcker V, Dämmrich M, Lehmann U, Berrang J, Pfister ED, Kreipe HH. Autophagy-enhancing drug carbamazepine diminishes hepatocellular death in fibrinogen storage disease. J Hepatol. 2013;59:626-630. [PubMed] [DOI] |
| 9. | Ni HM, Bockus A, Boggess N, Jaeschke H, Ding WX. Activation of autophagy protects against acetaminophen-induced hepatotoxicity. Hepatology. 2012;55:222-232. [PubMed] [DOI] |
| 10. | Kawaguchi T, Kodama T, Hikita H, Tanaka S, Shigekawa M, Nawa T, Shimizu S, Li W, Miyagi T, Hiramatsu N. Carbamazepine promotes liver regeneration and survival in mice. J Hepatol. 2013; Jul 18. [Epub ahead of print]. [PubMed] [DOI] |
| 11. | Ding WX, Li M, Chen X, Ni HM, Lin CW, Gao W, Lu B, Stolz DB, Clemens DL, Yin XM. Autophagy reduces acute ethanol-induced hepatotoxicity and steatosis in mice. Gastroenterology. 2010;139:1740-1752. [PubMed] [DOI] |
| 12. | Czaja MJ, Ding WX, Donohue TM, Friedman SL, Kim JS, Komatsu M, Lemasters JJ, Lemoine A, Lin JD, Ou JH. Functions of autophagy in normal and diseased liver. Autophagy. 2013;9:1131-1158. [PubMed] [DOI] |
| 13. | Komatsu M, Waguri S, Ueno T, Iwata J, Murata S, Tanida I, Ezaki J, Mizushima N, Ohsumi Y, Uchiyama Y. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 2005;169:425-434. [PubMed] [DOI] |
| 14. | Pickford F, Masliah E, Britschgi M, Lucin K, Narasimhan R, Jaeger PA, Small S, Spencer B, Rockenstein E, Levine B. The autophagy-related protein beclin 1 shows reduced expression in early Alzheimer disease and regulates amyloid beta accumulation in mice. J Clin Invest. 2008;118:2190-2199. [PubMed] [DOI] |
| 15. | Liang XH, Jackson S, Seaman M, Brown K, Kempkes B, Hibshoosh H, Levine B. Induction of autophagy and inhibition of tumorigenesis by beclin 1. Nature. 1999;402:672-676. [PubMed] [DOI] |
| 17. | 黄 汉飞, 宋 飞, 张 玉君, 喻 智勇, 段 键, 徐 王刚, 陈 明清, 曾 仲. 缺血后处理在大鼠肝移植缺血再灌注损伤中的作用. 世界华人消化杂志. 2010;18:3627-3631. [DOI] |
| 18. | Stewart RK, Dangi A, Huang C, Murase N, Kimura S, Stolz DB, Wilson GC, Lentsch AB, Gandhi CR. A novel mouse model of depletion of stellate cells clarifies their role in ischemia/reperfusion- and endotoxin-induced acute liver injury. J Hepatol. 2013; Sep 20. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Hou J, Xia Y, Jiang R, Chen D, Xu J, Deng L, Huang X, Wang X, Sun B. PTPRO plays a dual role in hepatic ischemia reperfusion injury through feedback activation of NF-κB. J Hepatol. 2013; Oct 12. [Epub ahead of print]. [PubMed] [DOI] |
| 20. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] [DOI] |
| 21. | Zhou RR, Zhao SS, Zou MX, Zhang P, Zhang BX, Dai XH, Li N, Liu HB, Wang H, Fan XG. HMGB1 cytoplasmic translocation in patients with acute liver failure. BMC Gastroenterol. 2011;11:21. [PubMed] [DOI] |
| 22. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] [DOI] |
| 23. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] |
| 24. | Li X, Wang LK, Wang LW, Han XQ, Yang F, Gong ZJ. Cisplatin Protects against Acute Liver Failure by Inhibiting Nuclear HMGB1 Release. Int J Mol Sci. 2013;14:11224-11237. [PubMed] [DOI] |
| 27. | Ni HM, Jaeschke H, Ding WX. Targeting autophagy for drug-induced hepatotoxicity. Autophagy. 2012;8:709-710. [PubMed] [DOI] |
| 28. | Fang H, Liu A, Dahmen U, Dirsch O. Dual role of chloroquine in liver ischemia reperfusion injury: reduction of liver damage in early phase, but aggravation in late phase. Cell Death Dis. 2013;4:e694. [PubMed] [DOI] |
| 29. | Lin CW, Zhang H, Li M, Xiong X, Chen X, Chen X, Dong XC, Yin XM. Pharmacological promotion of autophagy alleviates steatosis and injury in alcoholic and non-alcoholic fatty liver conditions in mice. J Hepatol. 2013;58:993-999. [PubMed] [DOI] |
| 30. | Amir M, Zhao E, Fontana L, Rosenberg H, Tanaka K, Gao G, Czaja MJ. Inhibition of hepatocyte autophagy increases tumor necrosis factor-dependent liver injury by promoting caspase-8 activation. Cell Death Differ. 2013;20:878-887. [PubMed] [DOI] |
| 31. | Ding WX. Induction of autophagy, a promising approach for treating liver injury. Hepatology. 2013; Jun 14. [Epub ahead of print]. [PubMed] [DOI] |