修回日期: 2013-07-31
接受日期: 2013-10-20
在线出版日期: 2013-11-18
目的: 探讨miR-320与结直肠癌临床病理因素间的关系, 寻找其下游调控蛋白, 及对结直肠癌细胞化疗敏感性的影响.
方法: 采用RT-PCR检测83例结直肠癌组织及癌旁组织中miR-320的表达, 结合结直肠癌临床病理指标分析其相关性, 用miR-320病毒转染HCT-116及ClonA1两株结直肠癌细胞系, Western blot检测其调控蛋白C-Jun氨基端激酶(c-Jun N-terminal kinase, JNK)的表达, 采用四甲基偶氮唑蓝显色法(methyl thiazolyl tetrazolium, MTT)检测LV-miR-320细胞株与阴性对照组间对5-氟尿嘧啶(5-fluorouracil, 5-Fu)化疗的敏感性.
结果: 83例结直肠癌标本中miR-320的表达明显低于癌旁组织表达(P = 0.012). miR-320表达与肿瘤分化程度相关, 高分化组织中表达较中低分化组织高, 与局部浸润深度及TNM分期相关(P = 0.012, P = 0.004), 但不受患者性别、年龄、肿瘤的大小及位置的影响; 获得LV-miR-320稳定转染细胞株及阴性对照株(negative control, NC), Western blot结果显示LV-miR-320组JNK表达明显降低; LV-miR-320组HCT-116及ClonA1半数抑制浓度(IC50值)分别为11.34 μg/mL和12.56 μg/mL, NC组IC50值分别为24.73 μg/mL和25.34 μg/mL(P = 0.023, P = 0.018).
结论: miR-320在结直肠癌组织中呈低表达, 其在结直肠癌细胞中过表达后, 可明显抑制JNK蛋白翻译, 而显著增加细胞对5-Fu化疗的敏感性. 提示miR-320在结直肠癌的发生发展及治疗中起重要作用.
核心提示: miR-320是新近发现的miRNA, 其在结直肠癌中的表达及其调控靶基因罕见研究报道, 本实验发现miR-320与结直肠癌的发生发展相关, 可部分降低下游c-Jun氨基末端激酶的表达, 在细胞水平, miR-320过表达可显著提高结直肠癌细胞对5-氟尿嘧啶(5-fluorouracil)化疗的敏感性, 使其有可能成为结直肠治疗的重点. 但他在结直肠癌及其他肿瘤发生发展中的具体作用机制尚不明确, 有待于我们进一步的实验研究.
引文著录: 张丹华, 董明, 周建平. miR-320在结直肠癌中的表达及意义. 世界华人消化杂志 2013; 21(32): 3592-3597
Revised: July 31, 2013
Accepted: October 20, 2013
Published online: November 18, 2013
AIM: To detect the expression of miR-320 in colorectal cancer to reveal its relationship with clinical and pathological characteristics of colorectal cancer, and to investigate the effect of miR-320 overexpression on chemosensitivity of colorectal cancer cell lines.
METHODS: The expression of miR-34a was detected by real-time PCR in CRC tissues and tumor-adjacent non-tumorous tissues. HCT-116 and ClonA1 cell lines were transfected with either a LV-miR-320 or a negative control (NC). C-Jun N-terminal kinase (JNK) expression was measured by Western blot after up-regulation of miR-320. The chemosensitivity of cell lines was tested by MTT assay.
RESULTS: MiR-320 expression was significantly down-regulated in CRC cancer tissues compared with tumor-adjacent tissues (P = 0.012). The expression of miR-320 was correlated with degree of differentiation, local invasion and TNM stage (P = 0.045, 0.012, 0.04). Overexpression of miR-320 significantly suppressed the expression of JNK, and the IC50 values for the LV-miR-320 group were significantly lower than those for the negative control group (11.34 vs 24.73, 12.56 vs 25.34, P = 0.023, 0.018).
CONCLUSION: MiR-320 is frequently down-regulated in CRC, which can repress the expression of JNK and modulate chemosensitivity of colorectal cancer cell lines. MiR-320 may play an important role in carcinogenesis and therapy of colorectal cancer.
- Citation: Zhang DH, Dong M, Zhou JP. Dysregulation of microRNA-320 expression in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(32): 3592-3597
- URL: https://www.wjgnet.com/1009-3079/full/v21/i32/3592.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i32.3592
结直肠癌在世界范围内占女性癌症病死率的第3位, 男性病死率的第4位, 每年有一百多万的新发病例, 对人类的健康和生命有着严重危害[1,2]. 尽管过去30年来, 结直肠癌患者的5年生存率有所提高[3], 但是结直肠的发病机制尚不明确, 找到新的肿瘤标志物, 提高化疗敏感性依然是目前研究的重点和热点[4-7].
近来研究发现多种miRNA在大肠癌组织及大肠癌细胞系中异常表达, 参与调节细胞的增殖、分化和凋亡等基本活动[6,8-15], 进一步明确miRNAs在结直肠癌(colorectal cancer, CRC)发病机制中的作用有助于提高CRC的诊治水平. miR-320是新近发现的miRNA, 其在结直肠癌中的表达及其调控靶基因罕见研究报道. 本实验旨在观察结直肠癌与癌旁组织中miR-320的表达情况, 其表达与临床病理因素间的关系, 研究其过表达对下游靶基因蛋白表达的影响, 及对结直肠癌细胞系化疗敏感性的影响.
收集2007/2009在中国医科大学附属第一医院普通外科已告知患者并获得患者同意的, 行外科手术切除的结直肠癌及癌旁组织标本83例, 男35例, 女48例; 年龄25-89岁(平均60.02岁). 所有病例术前未作放化疗, 所有组织均经病理学证实为结直肠腺癌. 标本采集后放入液氮冷冻, -80 ℃保存. 人结肠癌细胞株HCT-116和ClonA1源于中国医科大学细胞生物学实验室, 37 ℃、50 mL/L CO2孵箱, 含10%FBS Hyclone1640培养基培养. 由miRBase数据库(http://microrna.sanger.ac.uk/)查找基因序列, 用软件Primer-Express2.0进行引物设计. miR-320上游引物为5'-ACA CTC CAG CTG GGA AAA GCT GGG TTG AGA-3', 下游引物为5'-ACA CTC CAG CTG GGT CGC CCT C-3', 内参U6上游引物为5'-CTC GCT TCG GCA GCA CA-3', 下游引物5'-AAC GCT TCA CGA ATT TGC GT-3', 上述引物均由金斯瑞公司合成. TRIzol试剂购自Invitrogen公司; LV-miR-320及其阴性对照(negative control, NC)购自上海吉凯基因有限公司; 四甲基偶氮唑蓝显色法(methyl thiazolyl terazolium, MTT)试剂盒购自Sigma公司; 蛋白抽提试剂盒(上海卓康生物科技有限公司); C-Jun氨基端激酶(c-Jun N-terminal kinase, JNK)抗体(Bio-World, 美国); GAPDH抗体(碧云天), 逆转录试剂盒(Takara, 日本); 荧光定量real-time PCR试剂盒(Takara, 日本).
1.2.1 RT-PCR检测标本中miR-320表达: 常规TRIzol试剂抽提总RNA, DEPC水溶解沉淀, 核酸蛋白分析仪(Beckman Coulter)测定RNA浓度, 根据RNA在A260/280≥1.8鉴定RNA纯度及完整性. 用茎环法行miR-320定量检测: 取总RNA 1 μg加入无菌蒸馏水12 μL, 混匀后72 ℃培养5 min以打开RNA二级结构, 随后立即置于冰上, 以防止RNA复性再次恢复二级结构. 在另一去RNase的PCR管中配置以下反应液: dNTP mixture 2.0 μL、RNase inhibitor 0.5 μL、miR-320反转录引物0.5 μL、RNU6B反转录引物0.5 μL、5×buffer 4.0 μL、M-MLV反转录酶0.5 μL, 配好后加入到刚才含总RNA的溶液中混匀, 42 ℃培养60 min, 所得cDNA置于-20 ℃保存. 构建miR-320和RNU6B的RT-PCR反应体系: cDNA 5.0 μL、Primers 1.0 μL、SYBR Green荧光染料10 μL、无菌蒸馏水8.0 μL; 反应条件: 95 ℃变性10 min; 95 ℃ 15 s、65 ℃ 30 s、72 ℃ 30 s, 共40个循环; 循环结束后72 ℃延伸10 min, 每个标本均作复管PCR反应, 采用RNU6B作为内参, 以RNU6B拷贝数作为校正基数, 通过Light Cycler软件直接获得各样本中miR-320的Ct值, 与同样本中RNU6B的Ct值相减, 即获得该样本中miR-320的△Ct值; 由于以RT-PCR定量RNA时, 受到不同RNA样本存在不同反转录效率的限制, 遂再以癌旁组织△Ct值作为校正, 得出-△△Ct值, 按目的基因表达量 = 2-△△Ct公式计算各样本中miR-320确切含量. 以上实验均重复3次.
1.2.2 Western blot检测miRNA病毒转染后靶基因蛋白表达: 分别提取各组细胞总蛋白, 按试剂盒说明书进行. 测定蛋白质浓度(考马斯亮蓝G-250染料法). 行SDS-PAGE电泳, 转膜, 封闭. 加入一抗(JNK和GAPDH抗体稀释度分别为1:1000和1:5000)4 ℃孵育12 h, 加二抗(均为1:5000)室温孵育2 h, 后行化学发光显色.
1.2.3 MTT法检测miRNA病毒转染后HCT-116及ClonA1细胞对者术后需5-氟尿嘧啶(5-fluorouracil, 5-Fu)化疗敏感性的影响: 取HCT-116和ClonA1转染LV-miR-549c及NC组对数生长期的细胞, 分别加入96孔板中, 每孔100 μL, 含1.0×104个细胞. 每组加入5-Fu使终浓度分别为1.25、2.5、5、10、20、40、80、160 μg/mL, 每组细胞每个浓度设3复孔. 50 mL/L CO2孵箱中培养48 h后, 每孔中加入MTT(5 mg/mL)20 μL, 继续培养4 h弃去培养液, 再加入二甲基亚砜150 μL, 微量震荡约10 min, 于自动酶标仪450 nm处测定各孔吸光度值. 根据公式: 抑制率 = (1-实验组平均A值/对照组平均A值)×100%, 根据抑制率计算得到半数抑制浓度(IC50值).
统计学处理 采用SPSS13.0行统计分析, 配对设计两两比较采用t检验; 肿瘤临床病理因素与miR-320表达水平之间的关系分析采用Mann-Whitney检验和Kruskal-Wallis检验, P<0.05为差异有统计学意义.
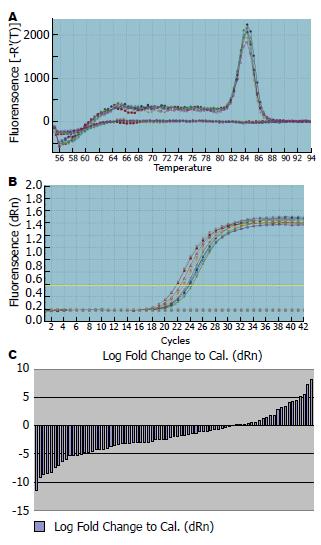
69例样本中miR-320 cDNA显示呈指数增长, 并扩增达平台期, 其扩增曲线为一组典型的S型曲线(图1A), 扩增效率理想. PCR完成后于溶解程序中收集荧光信号, 得到溶解曲线(图1B), 溶解温度均一, 峰形单一锐利, 证明反应特异性良好, 无非特异扩增、引物二聚体及发夹结构的出现.
RT-PCR检测结果显示miR-320在癌组织中较癌旁组织明显降低, 差异有统计意义(P<0.05)(图1C), miR-320表达水平与肿瘤分化(高中分化P = 0.045, 中低分化间P = 0.013)、TNM分期(P = 0.04)相关, 而与患者的性别、年龄、肿瘤部位、大小、淋巴结转移及远处转移无关(表1).
| 临床病理因素 | n | miR-320(mean±SD) | P值 |
| 性别 | |||
| 男 | 35 | 0.121±0.949 | 0.787 |
| 女 | 48 | 0.109±0.100 | |
| 年龄(岁) | |||
| ≤60 | 40 | 0.145±0.999 | 0.453 |
| >60 | 43 | 0.121±0.997 | |
| 肿瘤位置 | |||
| 结肠 | 32 | 0.101±0.081 | 0.677 |
| 直肠 | 51 | 0.154±0.120 | |
| TNM分期 | |||
| Ⅰ+Ⅱ | 34 | 0.187±0.129 | 0.04 |
| Ⅲ+Ⅳ | 49 | 0.076±0.052 | |
| 局部浸润 | |||
| T1-T3 | 50 | 0.153±0.112 | 0.012 |
| T4 | 33 | 0.074±0.071 | |
| 分化类型 | |||
| 高 | 13 | 0.205±0.102 | |
| 中 | 50 | 0.143±0.064 | 0.045 |
| 低 | 20 | 0.054±0.032 | 0.013 |
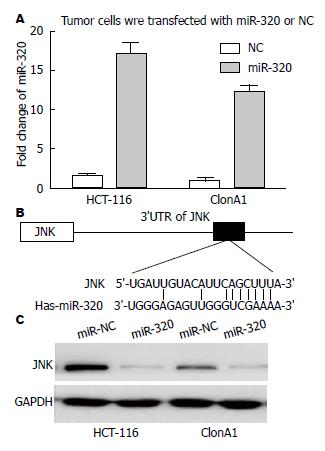
用LV-miR-320病毒及其对照病毒NC转染HCT-116和ClonA两株细胞, 嘌呤霉素筛选转染后细胞, RT-PCR检测其转染效率(图2A), 转染组miR-320表达量明显高于NC组, 形成稳转细胞系.
为了进一步阐述其在结直肠癌细胞中的作用机制, 我们用PicTar、TargetScan和miRanda等生物信息学软件预测, 发现JNK的3'-UTR区可与miR-320不完全结合(图2B). Western blot结果显示JNK在LV-miR-320组细胞中表达明显低于LV-NC组(图2C).
miR-320能否通过降低细胞对5-Fu的耐药性, 增加化疗敏感性, 通过MTT验证. MTT检测LV-miR-320及LV-NC两组四株细胞5-Fu细胞毒性(IC50的变化(表2), HCT-116 LV-miR-320组与LV-NC组IC50值分别为24.73 μg/mL±4.58 μg/mL、11.34 μg/mL±2.74 μg/mL、P = 0.023, ClonA1 LV-miR-320组(25.34 μg/mL±4.49 μg/mL)与LV-NC组(12.56 μg/mL±3.28 μg/mL)相比, IC50值下降(P = 0.018), 化疗敏感性明显提高.
| 分组 | IC50(μg/mL) | P值 | |
| LV-NC | LV-miR-320 | ||
| HCT-116 | 24.73±4.58 | 11.34±2.74 | 0.023 |
| ClonA1 | 25.34±4.49 | 12.56±3.28 | 0.018 |
结直肠癌的发生是多因素、多步骤的发展过程, 同样也是多基因发生异常变化的过程, 随着研究的发展, 越来越多的分子生物学标志表达变化被确认与结直肠癌的发生有关[7,16-19]. miRNA是存在于生物体内的一类长度约为19-22个核苷酸的非编码小分子RNA, 广泛存在于从线虫、植物、动物到人类的多种生物中, 参与基因转录后水平的调控, 其在个体生长发育、细胞增殖凋亡、炎症和肿瘤等多种生理病理过程中起着十分重要的作用, 而其失衡表达亦可促进多种人类疾病尤其是肿瘤的发生、发展, miRNA与肿瘤调控关系逐渐成为研究热点[20-24]. 多种miRNA在结直肠癌中的研究及作用机制已被确认, 而miR-320在结直肠癌中的表达及与结直肠癌发生发展的关系鲜有报道.
本研究发现, miR-320在结直肠癌中表达水平较癌旁组织显著下降, 一方面提示miR-320下调可能作为"抑癌基因"的表达缺失而参与了肿瘤始发及演进, miR-320过表达后, 可明显降低JNK的表达, 同时提高结直肠癌细胞对5-Fu的敏感性. 另一方面提示miR-320与结直肠癌的发生有关: 结直肠癌的临床病理特征是判断肿瘤恶性程度及预后的主要依据, 本研究结果显示, TNM分期Ⅲ+Ⅳ期的结直肠癌组织中miR-320表达水平显著低于Ⅰ+Ⅱ期结直肠癌组织; 分化程度低的结直肠癌组织miR-320表达水平显著低于高、中分化的结直肠癌组织. 因此miR-320的低表达不仅与结直肠癌的发生有关, 也与肿瘤的侵袭、浸润及分化程度相关.
JNK是丝裂素活化蛋白激酶(mitogen activated protein kinases, MAPK)家族的一员, JNK信号通路可被细胞因子、生长因子、应激等多种因素激活, 在Ras诱导的转化实验中, Ras介导c-Jun的磷酸化是由JNK完成的, 提示JNK在细胞增殖、细胞凋亡、应激反应及肿瘤的发生发展中发挥重要作用[25-28]. 通过生物信息学软件预测发现, JNK的3'-UTR区可与miR-320不完全结合, 提示miR-320可作用于JNK, 抑制JNK mRNA的翻译而调控JNK蛋白的表达, 本研究中, 通过Western blot证实miR-320过表达后, JNK的表达明显降低. miR-320在结直肠癌中可能通过抑制JNK的表达从而发挥其抑癌作用.
目前, 临床上结直肠癌患者术后需5-Fu为主的化疗以降低术后局部复发率, 延长生存时间, 提高5年生存率. 而结直肠癌耐药日益增多, 影响化疗效果及患者的远期疗效, 如何降低化疗耐药性, 是结直肠癌研究的一大热点[4,29]. 本实验中, miR-320形成稳转细胞系过表达后, 与LV-NC组相比, IC50值下降, 化疗敏感性明显提高. 证实miR-320可提高化疗敏感性, 但其具体作用机制, 化疗敏感性的提高是否与JNK相关, 尚需进一步实验研究.
总之, 本实验发现miR-320与结直肠癌的发生发展相关, 可部分降低下游JNK的表达, 有可能是抑制结直肠癌侵袭转移的因子, 为结直肠癌发病机制和诊断治疗的研究提供了新的思路和实验基础; 在细胞水平, 发现其过表达可显著提高结直肠癌细胞对5-Fu化疗的敏感性, 使其有可能成为结直肠治疗的重点. 但他在结直肠癌发生发展中的具体作用机制尚不明确, 有待于我们进一步的实验研究.
近来发现多种miRNA在大肠癌组织及大肠癌细胞系中异常表达, 参与调节细胞的增殖、分化和凋亡等基本活动, 进一步明确miRNAs在结直肠癌(colorectal cancer, CRC)发病机制中的作用有助于提高CRC的诊治水平.
李淑德, 教授, 中国人民解放军第二军医大学长海医院消化内科
目前, 临床上结直肠癌患者术后需5-Fu为主的化疗以降低术后局部复发率, 延长生存时间, 提高5年生存率. 而结直肠癌耐药日益增多, 影响化疗效果及患者的远期疗效, 如何降低化疗耐药性, 是结直肠癌研究的一大热点.
林钊宇等发现在唾液腺腺样囊性癌中, miR-320通过调控integrinβ3表达, 有效降低腺样囊性哎的侵袭和迁移能力; 段慧菡等发现在苯丙芘暴露的小鼠支气管上皮细胞中, miR-320可调控细胞周期, 将细胞停滞于G1期.
miR-320是新近发现的miRNA, 其在结直肠癌中的表达及其调控靶基因罕见研究报道. 本实验旨在观察结直肠癌与癌旁组织中miR-320的表达情况及对结直肠癌细胞系化疗敏感性的影响.
本实验发现miR-320与结直肠癌的发生发展相关, 有可能是抑制结直肠癌侵袭转移的因子, 为结直肠癌发病机制和诊断治疗的研究提供了新的思路和实验基础; 在细胞水平, 发现其过表达可显著提高结直肠癌细胞对5-Fu化疗的敏感性, 使其有可能成为结直肠治疗的重点.
本文具有较高的学术价值, 为临床研究结直肠癌提供了一定的方向.
编辑: 田滢 电编:闫晋利
| 1. | Yang Z, Kang L, Wang L, Xiang J, Cai G, Cui J, Peng J, Lan P, Wang J. Characteristics and long-term survival of colorectal cancer patients aged 44 years and younger. Clin Transl Oncol. 2012;14:896-904. [PubMed] [DOI] |
| 2. | Bolino MC, Canseco S, Díaz D, Krayeski M, Sylvester G, Pedace M, Caro L, Cerisoli C. [Adherence of physicians to colorectal cancer screening: which is their compliance to this strategy?]. Acta Gastroenterol Latinoam. 2012;42:33-39. [PubMed] |
| 3. | Agüero F, Murta-Nascimento C, Gallén M, Andreu-García M, Pera M, Hernández C, Burón A, Macià F. Colorectal cancer survival: results from a hospital-based cancer registry. Rev Esp Enferm Dig. 2012;104:572-577. [PubMed] |
| 4. | Andreou A, Kopetz S, Maru DM, Chen SS, Zimmitti G, Brouquet A, Shindoh J, Curley SA, Garrett C, Overman MJ. Adjuvant chemotherapy with FOLFOX for primary colorectal cancer is associated with increased somatic gene mutations and inferior survival in patients undergoing hepatectomy for metachronous liver metastases. Ann Surg. 2012;256:642-650. [PubMed] [DOI] |
| 5. | Turan N, Benekli M, Koca D, Ustaalioglu BO, Dane F, Ozdemir N, Ulas A, Oztop I, Gumus M, Ozturk MA. Adjuvant systemic chemotherapy with or without bevacizumab in patients with resected liver metastases from colorectal cancer. Oncology. 2013;84:14-21. [PubMed] [DOI] |
| 6. | Pagliuca A, Valvo C, Fabrizi E, di Martino S, Biffoni M, Runci D, Forte S, De Maria R, Ricci-Vitiani L. Analysis of the combined action of miR-143 and miR-145 on oncogenic pathways in colorectal cancer cells reveals a coordinate program of gene repression. Oncogene. 2013;32:4806-4813. [PubMed] [DOI] |
| 7. | Peeters M, Price T. Biologic therapies in the metastatic colorectal cancer treatment continuum--applying current evidence to clinical practice. Cancer Treat Rev. 2012;38:397-406. [PubMed] [DOI] |
| 8. | Dong Y, Wu WK, Wu CW, Sung JJ, Yu J, Ng SS. MicroRNA dysregulation in colorectal cancer: a clinical perspective. Br J Cancer. 2011;104:893-898. [PubMed] [DOI] |
| 9. | Aslam MI, Patel M, Singh B, Jameson JS, Pringle JH. MicroRNA manipulation in colorectal cancer cells: from laboratory to clinical application. J Transl Med. 2012;10:128. [PubMed] [DOI] |
| 10. | Tang JT, Fang JY. MicroRNA regulatory network in human colorectal cancer. Mini Rev Med Chem. 2009;9:921-926. [PubMed] |
| 11. | Azimzadeh P, Romani S, Mohebbi SR, Mahmoudi T, Vahedi M, Fatemi SR, Zali N, Zali MR. Association of polymorphisms in microRNA-binding sites and colorectal cancer in an Iranian population. Cancer Genet. 2012;205:501-507. [PubMed] [DOI] |
| 12. | Slaby O, Svoboda M, Fabian P, Smerdova T, Knoflickova D, Bednarikova M, Nenutil R, Vyzula R. Altered expression of miR-21, miR-31, miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer. Oncology. 2007;72:397-402. [PubMed] [DOI] |
| 13. | Balaguer F, Moreira L, Lozano JJ, Link A, Ramirez G, Shen Y, Cuatrecasas M, Arnold M, Meltzer SJ, Syngal S. Colorectal cancers with microsatellite instability display unique miRNA profiles. Clin Cancer Res. 2011;17:6239-6249. [PubMed] [DOI] |
| 14. | Beauchemin N. The colorectal tumor microenvironment: the next decade. Cancer Microenviron. 2011;4:181-185. [PubMed] [DOI] |
| 15. | Link A, Balaguer F, Shen Y, Nagasaka T, Lozano JJ, Boland CR, Goel A. Fecal MicroRNAs as novel biomarkers for colon cancer screening. Cancer Epidemiol Biomarkers Prev. 2010;19:1766-1774. [PubMed] [DOI] |
| 16. | Morillas JD, Castells A, Oriol I, Pastor A, Pérez-Segura P, Echevarría JM, Caballero B, González-Navarro A, Bandrés F, Brullet E. [The Alliance for the Prevention of Colorectal Cancer in Spain. A civil commitment to society]. Gastroenterol Hepatol. 2012;35:109-128. [PubMed] [DOI] |
| 17. | He K, Jin K, Wang H, Teng L. Anti-angiogenic therapy for colorectal cancer: on the way to getting better! Hepatogastroenterology. 2012;59:1113-1117. [PubMed] [DOI] |
| 18. | Ng F, Ganeshan B, Kozarski R, Miles KA, Goh V. Assessment of primary colorectal cancer heterogeneity by using whole-tumor texture analysis: contrast-enhanced CT texture as a biomarker of 5-year survival. Radiology. 2013;266:177-184. [PubMed] [DOI] |
| 19. | Troiani T, Martinelli E, Orditura M, De Vita F, Ciardiello F, Morgillo F. Beyond bevacizumab: new anti-VEGF strategies in colorectal cancer. Expert Opin Investig Drugs. 2012;21:949-959. [PubMed] [DOI] |
| 20. | Pellegrino L, Jacob J, Roca-Alonso L, Krell J, Castellano L, Frampton AE. Altered expression of the miRNA processing endoribonuclease Dicer has prognostic significance in human cancers. Expert Rev Anticancer Ther. 2013;13:21-27. [PubMed] [DOI] |
| 21. | Pereira DM, Rodrigues PM, Borralho PM, Rodrigues CM. Delivering the promise of miRNA cancer therapeutics. Drug Discov Today. 2013;18:282-289. [PubMed] [DOI] |
| 22. | Asrih M, Steffens S. Emerging role of epigenetics and miRNA in diabetic cardiomyopathy. Cardiovasc Pathol. 2013;22:117-125. [PubMed] [DOI] |
| 23. | Akbari Moqadam F, Pieters R, den Boer ML. The hunting of targets: challenge in miRNA research. Leukemia. 2013;27:16-23. [PubMed] [DOI] |
| 24. | Ishida M, Selaru FM. miRNA-Based Therapeutic Strategies. Curr Anesthesiol Rep. 2013;1:63-70. [PubMed] |
| 25. | Davies C, Tournier C. Exploring the function of the JNK (c-Jun N-terminal kinase) signalling pathway in physiological and pathological processes to design novel therapeutic strategies. Biochem Soc Trans. 2012;40:85-89. [PubMed] [DOI] |
| 26. | Chen F. JNK-induced apoptosis, compensatory growth, and cancer stem cells. Cancer Res. 2012;72:379-386. [PubMed] [DOI] |
| 27. | Seki E, Brenner DA, Karin M. A liver full of JNK: signaling in regulation of cell function and disease pathogenesis, and clinical approaches. Gastroenterology. 2012;143:307-320. [PubMed] [DOI] |
| 28. | Sabapathy K. Role of the JNK pathway in human diseases. Prog Mol Biol Transl Sci. 2012;106:145-169. [PubMed] [DOI] |
| 29. | Hong X, Chen G, Wang M, Lou C, Mao Y, Li Z, Zhang Y. STAT5a-targeting miRNA enhances chemosensitivity to cisplatin and 5-fluorouracil in human colorectal cancer cells. Mol Med Rep. 2012;5:1215-1219. [PubMed] [DOI] |