修回日期: 2013-09-27
接受日期: 2013-10-15
在线出版日期: 2013-11-08
目的: 建立干扰素-γ(interferon-γ, IFN-γ)基因敲除小鼠慢性乙型肝炎病毒(hepatitis B virus, HBV)复制模型.
方法: IFN-γ基因敲除(IFN-γ-/-)小鼠繁育并抽提组织DNA进行聚合酶链反应(PCR)及凝胶电泳鉴定基因型. IFN-γ-/-小鼠纯合子9只与野生型C57BL/6小鼠9只同时高压水注射pAAV/HBV1.2质粒, 按既定时间点采血检测乙型肝炎表面抗原(hepatitis B virus surface antigen, HBsAg)、乙型肝炎e抗原(hepatitis B virus e antigen, HBeAg)和HBV DNA. 血清HBsAg和HBeAg表达水平由电化学发光法进行定量检测. 经抽提血清总DNA后, 血清HBV DNA由定量PCR进行检测.
结果: 本实验室繁殖的IFN-γ-/-小鼠均为纯合子基因型. IFN-γ-/-小鼠和野生型C57BL/6小鼠血清中HBsAg、HBeAg和HBV DNA持续存在, 转染后第40天仍阳性. 但是, IFN-γ-/-小鼠血清HBsAg表达水平高于C57BL/6野生小鼠(40天时, P = 0.042); IFN-γ-/-小鼠血清HBV DNA持续高水平复制, 明显高于C57BL/6野生小鼠(第25天时, P = 0.012; 第40天时, P = 0.039). 两组小鼠血清HBeAg表达水平无差异.
结论: IFN-γ-/-小鼠慢性HBV复制模型成功建立, 并揭示了IFN-γ在慢性HBV感染中可抑制HBV复制.
核心提示: 本研究成功建立了干扰素-γ(interferon-γ, IFN-γ)基因敲除小鼠乙型肝炎病毒(hepatitis B virus, HBV)持续复制模型, 该模型小鼠血清病毒血症持续时间长, 而IFN-γ基因缺陷. 因此, 本研究揭示了IFN-γ是机体内一个非常重要的免疫调节和效应因子, 在HBV持续感染过程中都发挥着重要的抗HBV作用.
引文著录: 陈明发, 夏幼辰, 林永, 孙潺, 杨东亮, 吴珺. 干扰素-γ基因敲除小鼠慢性乙型肝炎病毒复制模型的建立. 世界华人消化杂志 2013; 21(31): 3394-3399
Revised: September 27, 2013
Accepted: October 15, 2013
Published online: November 8, 2013
AIM: To develop an interferon-γ (IFN-γ) knockout mouse model of HBV persistence.
METHODS: Nine IFN-γ knock-out (IFN-γ-/-) mice were injected hydrodynamically with 10 micrograms of pAAV/HBV1.2 DNA via the tail vein. Nine wild-type C57BL/6 mice were used as controls. After injection, blood samples were regularly taken to monitor serum levels of HBsAg, HBeAg and HBV DNA. HBsAg and HBeAg were determined by electrochemiluminescence immunoassay (ECLIA) on an E170 analyzer. Total DNA was extracted from serum samples and used for detection of HBV DNA by real-time PCR.
RESULTS: Serum HBsAg, HBeAg and HBV DNA in IFN-γ-/- mice were continuously positive until 40 days after the injection of the pAAV/HBV1.2 DNA. The levels and duration of serum HBsAg, HBeAg and HBV DNA in IFN-γ-/- mice were similar to those in control mice. Serum HBsAg levels in IFN-γ-/- mice were higher than those in wild-type C57BL/6 mice on day 40 post injection (P = 0.042). Serum HBV DNA levels in IFN-γ-/- mice were persistently higher than those in wild-type C57BL/6 mice (P = 0.012, on day 25; P = 0.039, on day 40). No significant difference was observed in serum HBeAg levels between IFN-γ-/- mice and control mice.
CONCLUSION: We have successfully developed an IFN-γ-/- mouse model of HBV persistence. Our data suggest that IFN-γ could suppress HBV replication during chronic HBV infection.
- Citation: Chen MF, Xia YC, Lin Y, Sun C, Yang DL, Wu J. An IFN-γ knockout mouse model of HBV persistence. Shijie Huaren Xiaohua Zazhi 2013; 21(31): 3394-3399
- URL: https://www.wjgnet.com/1009-3079/full/v21/i31/3394.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i31.3394
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是全球范围内最常见的病毒感染性疾病之一, 全球范围内大约4亿人为慢性HBV感染者[1]. 人体免疫系统对HBV初始感染的免疫应答决定了HBV感染的转归. 导致HBV慢性感染取决于多重因素相互作用, 其包括宿主遗传背景、病毒与环境等因素[2]. 干扰素-γ(interferon-γ, IFN-γ)是由免疫细胞(Th1和NK细胞)在免疫应答过程中产生的具有高度生物活性的细胞因子, 能抑制Th2细胞增殖分化, 具有抗病毒、抗肿瘤和免疫调节等功能. 有关研究显示, IFN-γ对细胞内病毒感染起着重要防御作用, 而且促进了免疫介导的炎症应答[3], 参与了抑制HBV DNA复制或HBV的清除. 为了进一步研究IFN-γ在慢性HBV感染中作用, 以及其在抑制HBV DNA复制或清除HBV中的作用机制, 我们利用IFN-γ基因敲除(IFN-γ-/-)小鼠建立慢性HBV感染复制模型, 来探讨HBV感染与IFN-γ之间的关系.
IFN-γ-/-小鼠(C57BL/6背景), 3 ♂ 3 ♀, 6-8周龄, 体质量22 g, 由南京青紫兰科技有限公司提供; C57BL/6 ♂小鼠, 9只, 6-8周龄, 体质量20-22 g, 由北京华阜康生物科技有限公司提供; 小鼠均按照无特定病原体(SPF)级动物饲养标准进行饲养, 屏障环境内控制12-12 h光暗循环, 温度在20 ℃-25 ℃, 湿度控制在40%-70%, 用钴60辐照饲料灭菌, 垫料和饮水均经过高温高压灭菌处理后使用, 实行自由采食和饮水; pAAV/HBV1.2质粒由国立台湾大学医学院Peijer Chen教授惠赠; 其他的使用试剂包括: E.Z.N.ATM Tissue DNA Kit(OMEGA, USA); SYBR Green Real-time PCR Master Mix(TOYOBO, Japan); E.Z.N.ATM Endo-Free Plasmid Maxi kit and E.Z.N.ATMEndo-Free Plasmid Mini kit(OMEGA, USA); QIAamp MinElute virus spin kit(Qiagen, German); Elecsys HBsAg Ⅱ reagent kit and Elecsys HBeAg reagent kit(Roche, USA).
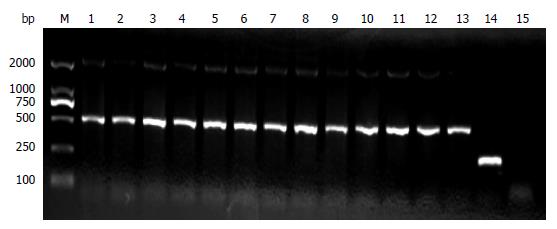
1.2.1 IFN-γ-/-小鼠繁殖与鉴定: IFN-γ-/-小鼠按1只雄鼠和1只雌鼠合笼的方式进行繁殖, 共繁殖出13只♂小鼠, 周龄6-8 wk(体质量20-22 g)时进行基因型鉴定. 取小许小鼠尾组织, 使用OMEGA tissue DNA试剂盒抽提组织DNA. 然后, 用PCR及琼脂糖凝胶电泳法鉴定IFN-γ基因缺陷小鼠IFN-γ基因型. 引物序列由上述公司提供, 并由上海英潍捷基贸易有限公司合成. 引物序列如下: 引物1: IFN-γ knockdown primer 1: CCT TCT ATC GCC TTC TTG ACG; 引物2: IFN-γ knockdown primer 2: AGA AGT AAG TGG AAG GGC CCA GAA G; 引物3: IFN-γ knockdown primer 3: AGG GAA ACT GGG AGA GGA GAA ATA T. 25 μL PCR反应体系如下: 10×PCR buffer 2.5 μL, 15 mmol/L MgCl2 2.5 μL, 10 mmol/L dNTPs 0.5 μL, 5 mol/L betain 2.5 μL, 5 U/μL Taq DNA polymerase 0.5 μL, 引物1、2及3 20 μmol/L各0.625 μL, 加H2O 13.625 μL至24 μL, 再加DNA模板1 μL. PCR反应过程: (1)94 ℃预变性3 min; (2)94 ℃变性30 s, 63 ℃退火45 s, 72 ℃延伸1 min, 共35循环; 最后再72 ℃延伸3 min, 10 ℃保存. 电泳鉴定: 取PCR反应终产物10 μL在1%琼脂糖凝胶电泳. 小鼠组织琼脂糖凝胶电泳基因型片段为: 突变型为500 bp, 野生型为210 bp, 杂合子为210 bp与500 bp两条带, 按条带鉴别出各个基因型小鼠.
1.2.2 IFN-γ-/-小鼠慢性乙型肝炎病毒复制模型建立: (1)质粒制备: pAAV/HBV1.2质粒按标准的质粒DNA大量提取方案, 获得大量的pAAV/HBV1.2质粒; (2)高压水注射法转染小鼠: 取上述繁殖的IFN-γ-/-♂小鼠13只中9只与♂C57BL/6野生小鼠9只, 用于建立慢性乙型肝炎病毒复制模型. 10 μg pAAV/HBV1.2质粒DNA溶于小鼠体质量10%的体积生理盐水, 通过高压水注射方式从小鼠尾静脉注入, 5-10 s内注射完全部剂量; (3)采取血样本: 1%戊巴比妥钠麻醉动物, 眼眶采血, 分离血清.
1.2.3 定量ELISA检测小鼠血清中乙肝表面抗原(hepatitis B virus surface antigen, HBsAg)和乙肝e抗原(hepatitis B virus e antigen, HBeAg)表达: 高压水注射pAAV/HBV1.2后, 按既定时间点收集血清样本. 用于检测HBsAg和HBeAg的血清样本用通用稀释液10倍稀释. E170 analyzer仪上电化学发光法自动定量检测HBsAg和HBeAg.
1.2.4 定量PCR检测小鼠血清中HBV DNA复制水平: 应用Qiagen公司试剂盒抽提上述血清样本总DNA, 用Real-time PCR检测血清HBV DNA水平.
统计学处理 数据用mean±SD表示. 使用统计学软件SPSS18.0进行数据分析, 组间均数比较用t检验. P<0.05为差异有统计学意义.
我们所购进的IFN-γ-/-小鼠均为纯合子突变株, 其13只♂子代均应为纯合子. 结果如图1. 所示用于实验的小鼠鉴定结果, 1-13号小鼠均为纯合子, 出现500 bp条带. 14号小鼠为野生型对照, 目的条带为210 bp.
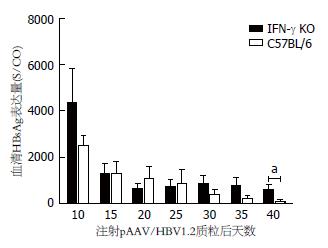
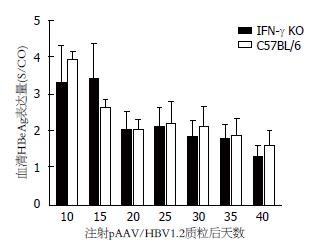
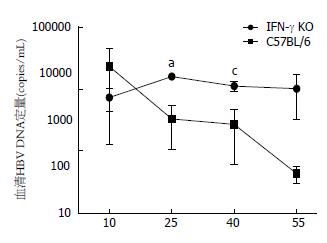
IFN-γ-/-小鼠在高压水注射pAAV/HBV1.2质粒后第10、15、20、25、30、35和40天采血, 分离血清. C57BL6小鼠作为对照, 也进行如上处理. 结果与C57BL6小鼠相似, IFN-γ-/-小鼠血清HBsAg、HBeAg及其HBV DNA持续阳性(图2-4). 在第40天时, IFN-γ-/-小鼠血清HBsAg、HBeAg及其HBV DNA仍全部阳性. 据此, 我们已成功建立了IFN-γ-/-小鼠慢性乙型肝炎病毒复制模型.
然而, IFN-γ-/-小鼠血清HBsAg表达水平高于C57BL6野生小鼠, 在第40天时血清HBsAg表达水平(图2)与C57BL6野生小鼠相比具有明显差异(P = 0.042). 两组小鼠血清HBeAg表达水平及持续时间(图3)无明显差别. IFN-γ-/-小鼠血清HBV DNA(图4)持续高水平复制, 明显高于C57BL6野生小鼠(第25天时, P = 0.012; 第40天时, P = 0.039).
我们的结果显示已成功建立了IFN-γ-/-小鼠慢性HBV持续复制模型. Huang等[4]通过尾静脉高压水注射pAAV/HBV1.2质粒建立了C57BL/6小鼠慢性HBV持续复制模型. 40%小鼠血清HBsAg阳性持续6 mo以上, 肝脏病毒复制中间体、转录物、蛋白持续存在1年以上. 我们前期研究[5]已成功建立C57BL/6小鼠和I型干扰素受体敲除小鼠慢性HBV持续复制模型. 本实验建立的IFN-γ-/-小鼠HBV复制模型血清中HBsAg、HBeAg和HBV DNA第40天时呈100%阳性, 与对照组C57BL/6野生小鼠相同. 因此, 我们成功建立了IFN-γ-/-小鼠慢性HBV持续复制模型, 可利用此小鼠模型进一步研究IFN-γ与HBV感染之间的关系.
IFN-γ是人体感染HBV后重要的免疫应答细胞因子, 在慢性HBV感染的临床转归中起着重要作用. IFN-γ在HBV清除中作用近年不断有报道, 如在急性自限性HBV感染患者中, 由T淋巴细胞分泌的IFN-γ高水平表达, 在HBV清除中起着相当重要的作用[6]. IFN-γ能抑制HBV的复制, 从而直接降低病毒的复制水平[7-10]. Khanizadeh等[11]通过分析200例慢性HBV感染者和200例健康对照者外周血样本中IFN-γ受体1基因单个核苷酸多态性, 发现IFN-γ受体1基因中第611位为G等位基因者对HBV感染是低风险的, 而第56位为T等位基因者发生慢性HBV感染的风险明显增高. 通过IFN-γ-/-小鼠和IFN-α/β受体敲除小鼠研究发现细胞因子IFN-γ与IFN-α/β均在控制HBV及其他嗜肝病毒感染中发挥抗病毒效应[12]. 最近研究[13]显示, 激活的细胞毒性T淋巴细胞增加, 以及肝组织中IFN-γ、CXCL9和CXCL10表达水平上调有助于持续感染的HBV清除. 本研究以IFN-γ-/-小鼠与C57BL/6野生小鼠同时建立慢性HBV持续复制模型, 结果发现IFN-γ-/-小鼠血清中HBsAg表达水平从30 d后就高于C57BL/6野生小鼠, 至40 d时明显高表达, 而且血清HBV DNA复制水平亦明显高于C57BL/6野生小鼠, 然而血清中HBeAg表达水平两组无明显差别, 这可能与此动物模型的局限性有关, 血清中HBeAg表达水平并不与血清HBV DNA复制水平相一致. 我们的结果更加直接地证实了IFN-γ参与了慢性HBV感染过程, 明显抑制HBV复制. IFN-γ抑制HBV复制或清除HBV的可能机制: 由病毒激活的细胞毒性T淋巴细胞(cytotoxicity T lymphocyte, CTL)表达IFN-γ, 通过非细胞裂解机制清除HBV以及诱导趋化因子CXCL9和CXCL10的表达, 后者通过募集抗原非特异性的单个核细胞, 导致肝脏炎性病变而清除病毒[14,15]. 干扰素刺激人体基因表达产生大量的抗病毒活性的蛋白或酶, 如黏病毒抗性A(myxovirus resistance A, MxA)和干扰素可诱导双链核糖核酸依赖蛋白激酶(double-stranded RNA-dependent protein kinase, PKR), 具有抑制HBV复制作用[16]. 一旦接合到他的受体时, 干扰素就激活了下游Janus激酶-信号转导和转录激活因子(the Janus kinase/signal transducers and activators of transcription, JAK/STAT)信号通路, 生成两个转录因子, 即干扰素-α激活因子(IFN-alpha-activated factor, AAF)和干扰素刺激基因因子3(IFN-stimulated gene factor 3, ISGF3), 最终导致了干扰素诱导的抗病毒基因表达和各类型的抗病毒蛋白产生, 包括蛋白激酶、2'-5'寡腺苷酸合成酶(2',5'-oligoadenylate synthetase, OAS)和MxA[17-19]. 因此, IFN-γ是机体内一个非常重要的免疫调节和效应因子, 通过调节机体免疫反应和非细胞损伤机制在病毒复制和转录水平直接抑制肝细胞内HBV的复制, 在机体抗HBV过程中发挥着重要作用.
总之, 我们通过尾静脉高压水注射pAAV/HBV1.2质粒方式成功建立IFN-γ-/-小鼠HBV持续复制模型, 并初步阐明了IFN-γ在HBV感染过程中起着相当重要的作用, 具有抗HBV效应. 该动物模型可用于进一步探索IFN-γ与HBV感染之间的关系及其在抗HBV作用中的机制, 亦为IFN-γ用于临床上抗HBV治疗提供了理论依据.
慢性乙型肝炎病毒感染仍是最常见的病毒感染性疾病之一, 严重危害人类健康. HBV感染的转归取决于宿主免疫与病毒等多方面因素, 其中, IFN-γ为高度生物活性的细胞免疫因子, 在HBV感染中起着重要的作用, 直接影响HBV感染的结局.
刘正稳, 教授, 西安交通大学医学院第一附属医院
在临床上, IFN-γ基因多态性与HBV感染的临床结局之间关系, 以及自限性HBV感染中IFN-γ对临床转归的作用, 均是当前研究的热点问题. 在基础研究方面, 主要是探讨IFN-γ在HBV感染过程中抑制病毒复制或清除病毒的细胞免疫机制.
IFN-γ在急性HBV自限性感染中高水平表达, 具有清除HBV的作用; IFN-γ受体基因单个核苷酸多态性与HBV感染的风险高低密切相关; 细胞毒性T淋巴细胞被HBV激活后表达IFN-γ, 通过非细胞裂解和诱导趋化因子等机制清除HBV.
本研究通过IFN-γ基因敲除小鼠成功建立HBV持续复制小鼠模型, 运用定量酶联免疫法检测血清HBsAg和HBeAg表达, 以及运用定量PCR法检测血清HBV DNA, 更加直接阐明了IFN-γ在慢性HBV感染中抑制HBV作用, 为IFN-γ用于临床上抗HBV治疗提供了理论依据.
本研究建立的动物模型, 证实了IFN-γ在HBV感染中发着重要作用, 但是IFN-γ在HBV感染中清除或抑制病毒的作用机制不是很清楚. 因此, 本研究建立的IFN-γ基因敲除小鼠HBV持续复制模型, 为研究IFN-γ与慢性HBV感染之间的关系提供了便利和实用的动物模型.
本研究利用IFN-γ基因敲除C57BL/6小鼠建立了慢性乙型肝炎病毒复制模型, 结果显示IFN-γ对HBV的复制有一定干扰作用. 该模型为研究HBV感染及其慢性化与免疫应答特别是IFN-γ相关的免疫应答的关系以及设计HBV感染的免疫干预方案具有较大意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Deng G, Zhou G, Zhai Y, Li S, Li X, Li Y, Zhang R, Yao Z, Shen Y, Qiang B. Association of estrogen receptor alpha polymorphisms with susceptibility to chronic hepatitis B virus infection. Hepatology. 2004;40:318-326. [PubMed] [DOI] |
| 2. | Guidotti LG, Rochford R, Chung J, Shapiro M, Purcell R, Chisari FV. Viral clearance without destruction of infected cells during acute HBV infection. Science. 1999;284:825-829. [PubMed] [DOI] |
| 3. | Billiau A. Interferon-gamma: biology and role in pathogenesis. Adv Immunol. 1996;62:61-130. [PubMed] |
| 4. | Huang LR, Wu HL, Chen PJ, Chen DS. An immunocompetent mouse model for the tolerance of human chronic hepatitis B virus infection. Proc Natl Acad Sci U S A. 2006;103:17862-17867. [PubMed] [DOI] |
| 5. | Chen MF, Lin Y, Xia YC, Sun C, Feng XM, Lu MJ, Yang DL, Wu J. Establishment and application of hepatitis B virus persistent replication model in IFNAR(-/-) mouse. J Huazhong Univ Sci Technolog Med Sci. 2013;33:392-397. [PubMed] [DOI] |
| 6. | Penna A, Del Prete G, Cavalli A, Bertoletti A, D'Elios MM, Sorrentino R, D'Amato M, Boni C, Pilli M, Fiaccadori F. Predominant T-helper 1 cytokine profile of hepatitis B virus nucleocapsid-specific T cells in acute self-limited hepatitis B. Hepatology. 1997;25:1022-1027. [PubMed] |
| 7. | Romero R, Lavine JE. Cytokine inhibition of the hepatitis B virus core promoter. Hepatology. 1996;23:17-23. [PubMed] |
| 8. | Bulat-Kardum L, Etokebe GE, Knezevic J, Balen S, Matakovic-Mileusnic N, Zaputovic L, Pavelic J, Beg-Zec Z, Dembic Z. Interferon-gamma receptor-1 gene promoter polymorphisms (G-611A; T-56C) and susceptibility to tuberculosis. Scand J Immunol. 2006;63:142-150. [PubMed] [DOI] |
| 9. | Matsuda A, Ebihara N, Kumagai N, Fukuda K, Ebe K, Hirano K, Sotozono C, Tei M, Hasegawa K, Shimizu M. Genetic polymorphisms in the promoter of the interferon gamma receptor 1 gene are associated with atopic cataracts. Invest Ophthalmol Vis Sci. 2007;48:583-589. [PubMed] [DOI] |
| 10. | Ben-Ari Z, Mor E, Papo O, Kfir B, Sulkes J, Tambur AR, Tur-Kaspa R, Klein T. Cytokine gene polymorphisms in patients infected with hepatitis B virus. Am J Gastroenterol. 2003;98:144-150. [PubMed] [DOI] |
| 11. | Khanizadeh S, Ravanshad M, Mohebbi SR, Naghoosi H, Abrahim Tahaei M, Mousavi Nasab SD, Romani S, Azimzadeh P, Sanati A, Zali MR. Polymorphisms within the promoter region of the gamma interferon (IFN-γ) receptor1 gene are associated with the susceptibility to chronic HBV infection in an iranian population. Hepat Mon. 2012;12:e7283. [PubMed] [DOI] |
| 12. | McClary H, Koch R, Chisari FV, Guidotti LG. Relative sensitivity of hepatitis B virus and other hepatotropic viruses to the antiviral effects of cytokines. J Virol. 2000;74:2255-2264. [PubMed] [DOI] |
| 13. | Chen SH, Wu HL, Kao JH, Hwang LH. Persistent hepatitis B viral replication in a FVB/N mouse model: impact of host and viral factors. PLoS One. 2012;7:e36984. [PubMed] [DOI] |
| 14. | Guidotti LG, Chisari FV. Immunobiology and pathogenesis of viral hepatitis. Annu Rev Pathol. 2006;1:23-61. [PubMed] [DOI] |
| 15. | Iannacone M, Sitia G, Ruggeri ZM, Guidotti LG. HBV pathogenesis in animal models: recent advances on the role of platelets. J Hepatol. 2007;46:719-726. [PubMed] [DOI] |
| 16. | Wei X S, Zhang PA, Ye FL, Li Y, Deng B. The influence of polymorphisms in the MxA promoter and the elF-2α regulatory region 2 on the natural outcome of HBV infection. Hereditary Genet. 2012;1:106. [DOI] |
| 17. | Knapp S, Yee LJ, Frodsham AJ, Hennig BJ, Hellier S, Zhang L, Wright M, Chiaramonte M, Graves M, Thomas HC. Polymorphisms in interferon-induced genes and the outcome of hepatitis C virus infection: roles of MxA, OAS-1 and PKR. Genes Immun. 2003;4:411-419. [PubMed] [DOI] |
| 18. | García MA, Gil J, Ventoso I, Guerra S, Domingo E, Rivas C, Esteban M. Impact of protein kinase PKR in cell biology: from antiviral to antiproliferative action. Microbiol Mol Biol Rev. 2006;70:1032-1060. [PubMed] [DOI] |
| 19. | Pletneva LM, Haller O, Porter DD, Prince GA, Blanco JC. Interferon-inducible Mx gene expression in cotton rats: cloning, characterization, and expression during influenza viral infection. J Interferon Cytokine Res. 2006;26:914-921. [PubMed] [DOI] |