修回日期: 2012-11-23
接受日期: 2012-12-28
在线出版日期: 2013-01-28
目的: 分析海尔曼螺杆菌(Helicobacter heilmannii, H. heilmannii)相关性胃炎与幽门螺杆菌(Helicobacter pylori,H. pylori)相关性胃炎的胃镜及组织病理学差异.
方法: 回顾性分析2003-01/2010-01于北京大学第三医院行胃镜及病理检查的53559例病例的相关资料. 对H. heilmannii相关性胃炎与H. pylori相关性胃炎在内镜所见、炎症浸润、癌前病变的等方面进行对比分析.
结果: H. heilmannii感染病例的检出率为0.1%(46/53559); 与H. pylori相关性胃炎相比, H. heilmannii相关性胃炎病例中螺旋杆菌定植量较少(P<0.001), 胃黏膜急、慢性炎症程度轻(P<0.001), 内镜下溃疡性病变更为少见(P = 0.021). 此外, 两组病例中胃黏膜萎缩、肠上皮化生及上皮内瘤变的检出率及病变程度均无显著性差异. 相关分析显示H. heilmannii相关性胃炎病例中细菌定植量仅与胃黏膜急性炎症细胞浸润程度相关(P = 0.02). 报道1例伴发H. heilmannii感染的胃印戒细胞癌病例.
结论: H. heilmannii相关性胃炎非常少见且其炎症反应较轻, 但是其癌前病变的检出率及病变程度与H. pylori相关性胃炎相比未见显著性差异, 表明H. heilmannii在胃恶性相关性病变的发生过程中可能发挥与H. pylori相似的作用.
引文著录: 张贺军, 崔荣丽, 韩亚京, 尚慧茹, 张颖, 金珠. 海尔曼螺杆菌与幽门螺杆菌相关性胃炎的临床病理特征. 世界华人消化杂志 2013; 21(3): 244-249
Revised: November 23, 2012
Accepted: December 28, 2012
Published online: January 28, 2013
AIM: To compare the endoscopic and histopathological characteristics of Helicobacter heilmannii (H. heilmannii)- versusHelicobacter pylori (H. pylori)-associated gastritis in Chinese patients.
METHODS: Gastric biopsy specimens from 53559 consecutive patients treated at Peking University Third Hospital from January 2003 to January 2010 were reviewed retrospectively. All cases of chronic gastritis were evaluated based on the Updated Sydney System. Endoscopic and histopathological characteristics of cases with H. heilmannii infection were compared with those with H. pylori infection.
RESULTS: There were 46 cases with H. heilmannii infection (0.1%) and 18326 cases with H. pylori infection (34.2%). Compared to H. pylori-associated gastritis, H. heilmannii-associated gastritis showed a lower bacterial density (P < 0.001), less severe mononuclear cell infiltration (P < 0.001) and neutrophil activity (P < 0.001), and endoscopic findings of H. heilmannii-associated gastritis were devoid of ulcer (P = 0.021). H. heilmannii density showed a significant correlation with neutrophil activity (P = 0.02), but not with chronic inflammation (P = 0.159). The percentages of patients with mucosal atrophy, intestinal metaplasia and intraepthelial neoplasia in the H. heilmannii-associated gastritis group were 23.9%, 21.7% and 4.3%, respectively, and there was no significant difference in the prevalence and degree of these precancerous lesions between the two groups. A case of signet-ring cell carcinoma concomitant with H. heilmannii infection was detected.
CONCLUSION: H. heilmannii-associated gastritis is uncommon and milder than H. pylori-associated gastritis. The observation that there were no significant differences between two groups in the prevalence and degree of mucosal atrophy, intestinal metaplasia and intraepthelial neoplasia suggests that H. heilmannii may be partly responsible for malignant-associated lesions just as H. pylori does. In addition, one case of signet-ring cell carcinoma concomitant with H. heilmannii infection was noted.
- Citation: Zhang HJ, Cui RL, Han YJ, Shang HR, Zhang Y, Jin Z. Clinical characteristics of Helicobacter heilmannii- versus Helicobacter pylori-associated gastritis in Chinese patients. Shijie Huaren Xiaohua Zazhi 2013; 21(3): 244-249
- URL: https://www.wjgnet.com/1009-3079/full/v21/i3/244.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i3.244
目前已发现至少35种螺旋杆菌, 但仅有小部分被证实与人类胃炎的发生相关[1]. 海尔曼螺杆菌(Helicobacter heilmannii, H. heilmannii)是除幽门螺杆菌(Helicobacter pylori, H. pylori)外最常见的定植于人类胃黏膜的螺旋杆菌, 国内外文献报道H. heilmannii的感染率约为0.1%-6.2%[2-6]. 目前已有文献报道海尔曼螺杆菌的感染与胃炎[7-9]、消化性溃疡[10]、消化不良[11]、胃癌及胃黏膜相关恶性淋巴瘤[12-16]等疾病的发生存在相关性. 本研究通过回顾性分析总结H. heilmannii相关性胃炎的临床病理特点, 并与H. pylori相关性胃炎对比在内镜及组织病理学等方面的差异.
分析2003-01/2010-01于我院行上消化道内镜及活检组织病理检查的病例53559例.
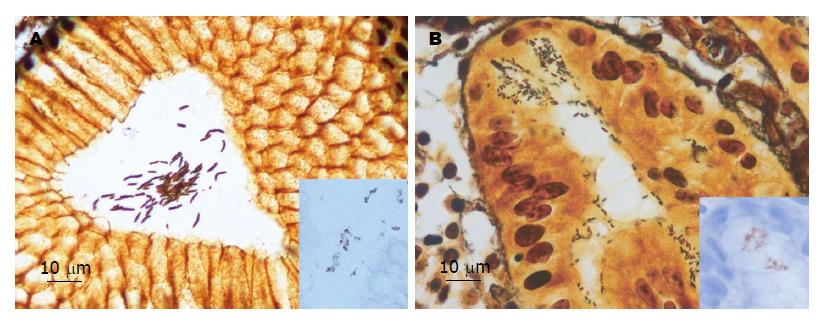
常规行上消化道内镜检查, 将内镜下所见分为慢性胃炎(包括慢性胃炎伴糜烂、慢性胃炎伴息肉等)、消化性溃疡(包括胃溃疡、十二指肠溃疡和复合溃疡). 于内镜表现异常部位进行活检, 活检组织固定于4%甲醛溶液, 常规石蜡包埋, 4 μm连续切片, 分别行HE和Warthin-Starry(WS)染色, 进行组织学评价及判定螺旋杆菌感染状况. 活检组织的炎症细胞浸润、腺体萎缩、肠上皮化生、螺旋杆菌感染等组织学评价及分级依据悉尼胃炎分类标准[17]; 胃黏膜上皮细胞的异型增生评价依据WHO标准[18]分为低级别上皮内瘤变和高级别上皮内瘤变两级. WS染色切片中H. heilmannii形态判定依据Heilmann等[19]文献报道, 即菌体较直且明显大于H. pylori, 约4-10 μm, 有多个盘绕较紧的螺旋(呈螺丝锥样形态, 图1A).
统计学处理 利用SPSS13.0统计分析软件, 分别采用t检验、χ2检验及秩和检验进行统计学分析, 以α = 0.05作为检验水准.
7年间我院共检出46例H. heilmannii感染患者, H. heilmannii检出率为0.1%, 其中男26例, 女20例, 男女比为1.0:0.8; 年龄18-84(48.2±17.2)岁; 同期我院共检出18326例H. pylori感染患者, H. pylori检出率为34.2%. 仅发现1例患者同时感染H. heilmannii和H. pylori. 以1:3的比例, 利用SPSS软件随机选取138例H. pylori相关性胃炎患者(除外合并H. pylori感染的恶性肿瘤及接受过胃部手术的患者), 其中男75例, 女63例, 男女比为1.0:0.8; 年龄19-79(49.0±15.8)岁. 两组病例在年龄和性别构成上差异无统计学意义(t = 0.295, P = 0.768; χ2 = 0.066, P = 0.797).
内镜下91.3%(42例)的H. heilmannii相关性胃炎患者表现为慢性胃炎, 仅4例发现存在溃疡性病变; H. pylori相关性胃炎患者中表现为慢性胃炎占75.4%, 溃疡性病变占24.6%. 两组病例之间病变构成比差异有统计学意义(P = 0.021, 表1), 溃疡性病变更常见于H. pylori相关性胃炎患者. 进一步分析发现两组病例溃疡性病变均以十二指肠溃疡最为常见, 分别为75.0%、70.6%; 两组病例在慢性胃炎构成类型上差异无统计学意义.
| H. heilmannii相关性胃炎 | H. pylori相关性胃炎 | χ2 | P值 | |
| n | 46 | 138 | ||
| 内镜所见 | 5.351 | 0.021 | ||
| 慢性胃炎(CG) | 42(91.3) | 104(75.4) | 0.176 | 0.916 |
| CG | 27(64.3) | 65(62.5) | ||
| CG伴糜烂 | 10(23.8) | 28(26.9) | ||
| CG伴其他1 | 5(11.9) | 11(10.6) | ||
| 溃疡性病变 | 4(8.7) | 34(24.6) | - | - |
| 胃溃疡 | 1(25.0) | 6(17.6) | ||
| 十二指肠溃疡 | 3(75.0) | 24(70.6) | ||
| 复合溃疡 | 0(0.0) | 4(11.8) | ||
| 组织病理学所见 | ||||
| 慢性炎症 | 46(100.0) | 138(100.0) | - | - |
| 中性粒细胞 | 24(52.2) | 133(96.4) | 53.838 | 0.000 |
| 腺体萎缩 | 11(23.9) | 43(31.2) | 0.874 | 0.350 |
| 肠上皮化生 | 10(21.7) | 47(34.1) | 2.449 | 0.118 |
| 上皮内瘤变 | 2(4.3) | 11(8.0) | 0.248 | 0.618 |
| 淋巴滤泡形成/淋巴组织增生 | 29(63.0) | 85(61.6) | 0.310 | 0.861 |
H. heilmannii引起的患者胃黏膜组织病理学改变与H. pylori相关性胃炎患者相似, 均表现为慢性炎细胞(淋巴浆细胞)浸润, 但是H. heilmannii相关性胃炎胃黏膜活动性炎症(中性粒细胞)的检出率显著低于H. pylori相关性胃炎患者(52.2% vs 96.4%, P<0.001). H. heilmannii相关性胃炎患者胃黏膜腺体萎缩、肠上皮化生、上皮内瘤变及灶性淋巴组织增生的检出率分别为23.9%、21.7%、4.3%和63.0%, 与H. pylori相关性胃炎(31.2%、34.1%、8.0%和61.6%)相比均无统计学差异; 本研究184例患者中共发现13例上皮内瘤变(其中H. heilmannii感染组2例, H. pylori感染组11例), 均为低级别上皮内瘤变(表1). 依据悉尼胃炎分类标准, 将两组病例胃黏膜的螺旋杆菌定植量、慢性炎细胞浸润、活动性、腺体萎缩、肠上皮化生等病变进行程度分级并比较. 由表2可知, H. heilmannii相关性胃炎患者胃黏膜H. heilmannii定植量显著少于H. pylori相关性胃炎患者H. pylori定植量(P<0.001), 胃黏膜急、慢性炎症浸润程度明显轻于H.pylori相关性胃炎患者(均P<0.001); 但两组病例之间胃黏膜发生肠上皮化生、腺体萎缩的程度无显著性差异.
| H. heilmannii相关性胃炎 | H. pylori相关性胃炎 | χ2 | P值 | |
| n | 46 | 138 | ||
| 螺旋杆菌定植量 | -5.109 | 0.000 | ||
| 轻度 | 42(91.3) | 67(48.5) | ||
| 中度 | 4(8.7) | 51(37.0) | ||
| 重度 | 0(0.0) | 20(14.5) | ||
| 慢性炎症程度 | -7.179 | 0.000 | ||
| 无 | 0(0.0) | 0(0.0) | ||
| 轻度 | 27(58.7) | 10(7.3) | ||
| 中度 | 19(41.3) | 111(80.4) | ||
| 重度 | 0(0.0) | 17(12.3) | ||
| 急性炎症程度 | -7.419 | 0.000 | ||
| 无 | 22(47.8) | 5(3.6) | ||
| 轻度 | 21(45.7) | 54(39.1) | ||
| 中度 | 3(6.5) | 67(48.6) | ||
| 重度 | 0(0.0) | 12(8.7) | ||
| 肠上皮化生 | -1.675 | 0.094 | ||
| 无 | 36(78.3) | 91(66.0) | ||
| 轻度 | 7(15.2) | 28(20.3) | ||
| 中度 | 2(4.3) | 5(3.6) | ||
| 重度 | 1(2.2) | 14(10.1) | ||
| 腺体萎缩 | -1.086 | 0.278 | ||
| 无 | 35(76.1) | 95(68.9) | ||
| 轻度 | 8(17.4) | 24(17.4) | ||
| 中度 | 1(2.2) | 5(3.6) | ||
| 重度 | 2(4.3) | 14(10.1) |
利用Spearman等级相关分析分析螺旋杆菌定植量与胃黏膜炎症反应之间的相关关系, 结果显示H. pylori相关性胃炎组胃黏膜H. pylori定植量与胃黏膜急、慢性炎细胞浸润呈显著相关(r = 0.183, P = 0.032 vs 急性炎症; r = 0.199, P = 0.019 vs 慢性炎症); 而H. heilmannii相关性胃炎组H. heilmannii定植量仅与胃黏膜急性炎症反应显著相关(r = 0.342,P = 0.02), 与慢性炎症反应未见显著相关性(r = 0.211, P = 0.159).
在本研究H. heilmannii感染组病例中发现一例胃印戒细胞癌(2.2%, 1/46), 而同期本院18326例H. pylori感染病例中发现304例胃腺癌(1.7%), 其中55例为胃印戒细胞癌. 该患者, 女, 24岁, 上腹部不适2年. 实验室检查显示血清CA125轻度升高; 胃镜显示胃窦部前壁及大弯可见一深大溃疡, 累及窦腔近1/2, 被覆污秽苔, 底不平坦, 周边呈堤样隆起, 活检质脆. 溃疡周边活检组织病理检查为印戒细胞癌, 非溃疡区域活检组织为慢性非萎缩性胃炎(轻度活动)伴H. heilmannii感染. 术后病理证实为印戒细胞癌, 癌细胞侵及浆膜层. 患者否认有胃癌家族史.
Warren和Marshall[21]从人类胃黏膜组织中成功分离并培养出H. pylori以来, H. pylori一直被认为是引起多种上消化道疾病的主要致病因素. H. heilmannii与H. pylori同属于螺旋杆菌属, 可定植于人类胃黏膜, 并引起胃黏膜的损伤. 本研究在53559例行胃镜及病理检查的病例中检出46例患者存在H. heilmannii感染, 检出率为0.1%, 远低于同期H. pylori的检出率(34.2%), 与国外多数报道[3-5]的H. heilmannii检出率相近, 但低于中国南方[2]及泰国[6]报道的检出率, 可能与地区[2]及经济、卫生条件等差异[20]有关.
H. heilmannii引起的胃黏膜炎症反应与H. pylori相关性胃炎相似, 但是炎症程度, 尤其是活动性炎症, 明显轻于H. pylori相关性胃炎, 相关性分析显示这与胃黏膜螺旋杆菌的定植量有关. 此外推测还与H. heilmannii在胃黏膜的定植方式有关, 与H. pylori黏附于胃上皮表面不同, H. heilmannii与上皮细胞无粘着, 不会深入到细胞间紧密连接处(图1). 由于中性粒细胞的浸润可以破坏上皮细胞[22], 这可能是H. heilmannii相关性胃炎组内镜下溃疡性病变较H. pylori组少见的原因. 但有报道指出H. heilmannii相关性胃炎病例中糜烂和溃疡病变与患者服用NSAIDs药物有关[15].
胃癌可能是H. pylori长期感染与其他因素共同作用的结果[23], 胃黏膜经历慢性胃炎-胃黏膜萎缩-肠上皮化生-异型增生-胃癌这一癌变模式[24,25]. H. pylori已被世界卫生组织国际癌症研究机构(IARC)列为Ⅰ类致癌原[26], H. pylori相关性胃炎是最为常见的胃癌癌前病变[19]. H. heilmannii与胃癌发生发展的关系尚未明确, 但是已有文献报道[12-15]合并H. heilmannii感染的胃癌病例. 本研究H. heilmannii相关性胃炎病例中, 胃黏膜萎缩、肠上皮化生及上皮内瘤变的检出率分别为23.9%、21.7%和4.3%, 与H. pylori相关性胃炎组相比, 上述癌前病变的检出率及病变程度上均无显著性差异, 提示H. heilmannii在胃癌发生发展过程中可能具有与H. pylori相似的作用. 本研究H. heilmannii相关性胃炎组病例中检出一例印戒细胞癌, 癌检出率为2.2%, 而同期本院H. pylori感染病例中胃腺癌检出率为1.7%(304/18326). 虽然H. heilmannii感染的检出率显著低于H. pylori, 但本研究及文献报道[12,13]中H. heilmannii感染病例的胃癌检出率却并不低于H. pylori感染病例, 进一步提示H. heilmannii可能在胃癌发生中的病原学作用.
Stolte等[15]的研究认为H. heilmannii与胃黏膜相关淋巴组织(mucosa associated lymphoid tissue lymphoma, MALT)淋巴瘤的流行病学相关性较H. pylori更为紧密, Morgner等[16]和Okiyama等[5]的研究结果显示根除H. heilmannii感染可使胃MALT淋巴瘤达到完全缓解, 进一步证明了H. heilmannii是导致人类MALT淋巴瘤的重要病原. 本研究H. heilmannii相关性胃炎病例组中虽然未发现恶性淋巴瘤病例, 但是胃黏膜组织中淋巴滤泡形成/淋巴组织增生病变的检出率与H. pylori相关性胃炎组相比无显著性差异.
综上所述, H. heilmannii相关性胃炎非常少见且其炎症反应较轻, 但是其癌前病变的检出率及病变程度与H. pylori相关性胃炎相比未见显著性差异, 表明H. heilmannii在胃恶性相关性病变的发生过程中可能发挥与H. pylori相似的作用.
幽门螺杆菌(H. pylori)感染在消化科日常工作中比较常见, 但是海尔曼螺杆菌(H. heilmannii)感染较少见, 本文旨在总结H. heilmannii感染患者的内镜、病理特征, 使读者能意识到H. heilmannii感染可以引起与H. pylori感染相似的组织病理学改变, 从而重视对其的诊断.
任建林, 教授, 厦门大学附属中山医院消化内科
由于H. heilmannii感染比较罕见, 对于其大宗病例分析比较少, 国内外文献报道胃癌患者中可有H. heilmannii感染, 仅局限于个例报道, H. heilmannii感染与胃癌是一种伴随现象还是因果原因, 目前还不清楚, 这也是目前研究的热点.
国内外多篇文献报道H. heilmannii感染相关的研究, 但是病例数较少, 有文献报道H. heilmannii感染与胃黏膜淋巴瘤存在显著相关性, 但是本文未发现H. heilmannii感染的淋巴瘤病例.
本文通过总结46例H. heilmannii感染病例的组织病理学特征, 并与H.pylori感染病例的组织病理学特征进行了对比, 发现其癌前病变发生率与H.pylori感染病例没有显著性差异, 此外还报道了一例胃癌伴H. heilmannii感染的病例, 从而提示H. heilmannii感染在胃癌发生发展过程中可能具有与H.pylori感染相似的作用.
本文旨在引起消化科医生对于H. heilmannii感染的重视, 加强对于H. heilmannii感染的研究.
本文先进性, 科学性均好, 具有一定的临床指导意义.
编辑: 翟欢欢 电编: 鲁亚静
| 1. | Genta RM. Inflammatory Disorders of the Stomach. Surgiacal pathology of the GI tract, liver, biliary tract, and pancreas. Saunders: Philadelphia 2004; 155. |
| 3. | Ierardi E, Monno RA, Gentile A, Francavilla R, Burattini O, Marangi S, Pollice L, Francavilla A. Helicobacter heilmannii gastritis: a histological and immunohistochemical trait. J Clin Pathol. 2001;54:774-777. [PubMed] [DOI] |
| 4. | Joo M, Kwak JE, Chang SH, Kim H, Chi JG, Kim KA, Yang JH, Lee JS, Moon YS, Kim KM. Helicobacter heilmannii-associated gastritis: clinicopathologic findings and comparison with Helicobacter pylori-associated gastritis. J Korean Med Sci. 2007;22:63-69. [PubMed] [DOI] |
| 5. | Okiyama Y, Matsuzawa K, Hidaka E, Sano K, Akamatsu T, Ota H. Helicobacter heilmannii infection: clinical, endoscopic and histopathological features in Japanese patients. Pathol Int. 2005;55:398-404. [PubMed] [DOI] |
| 6. | Yali Z, Yamada N, Wen M, Matsuhisa T, Miki M. Gastrospirillum hominis and Helicobacter pylori infection in Thai individuals: comparison of histopathological changes of gastric mucosa. Pathol Int. 1998;48:507-511. [PubMed] [DOI] |
| 7. | Yang H, Dixon MF, Li X, Xu Z, Zhou D, Blum AL. Acute gastritis associated with infection of large spiral-shaped bacteria. Am J Gastroenterol. 1995;90:307-309. [PubMed] |
| 8. | Yamamoto T, Matsumoto J, Shiota K, Kitajima S, Goto M, Imaizumi M, Arima T. Helicobacter heilmannii associated erosive gastritis. Intern Med. 1999;38:240-243. [PubMed] [DOI] |
| 9. | Boyanova L, Lazarova E, Jelev C, Gergova G, Mitov I. Helicobacter pylori and Helicobacter heilmannii in untreated Bulgarian children over a period of 10 years. J Med Microbiol. 2007;56:1081-1085. [PubMed] [DOI] |
| 10. | Sykora J, Hejda V, Varvarovská J, Stozicky F, Gottrand F, Siala K. Helicobacter heilmannii related gastric ulcer in childhood. J Pediatr Gastroenterol Nutr. 2003;36:410-413. [PubMed] [DOI] |
| 11. | Sýkora J, Hejda V, Varvarovská J, Stozický F, Siala K, Schwarz J. Helicobacter heilmannii gastroduodenal disease and clinical aspects in children with dyspeptic symptoms. Acta Paediatr. 2004;93:707-709. [PubMed] [DOI] |
| 12. | Yang H, Li X, Xu Z, Zhou D. "Helicobacter heilmannii" infection in a patient with gastric cancer. Dig Dis Sci. 1995;40:1013-1014. [PubMed] [DOI] |
| 13. | Morgner A, Bayerdörffer E, Meining A, Stolte M, Kroher G. Helicobacter heilmannii and gastric cancer. Lancet. 1995;346:511-512. [PubMed] [DOI] |
| 14. | Duttala SV, Majumdar AP, Parikh RK, Levi E, Patel BB. H. heilmannii infection and gastric carcinogenesis. Indian J Gastroenterol. 2008;27:131-132. [PubMed] |
| 15. | Stolte M, Kroher G, Meining A, Morgner A, Bayerdörffer E, Bethke B. A comparison of Helicobacter pylori and H. heilmannii gastritis. A matched control study involving 404 patients. Scand J Gastroenterol. 1997;32:28-33. [PubMed] [DOI] |
| 16. | Morgner A, Lehn N, Andersen LP, Thiede C, Bennedsen M, Trebesius K, Neubauer B, Neubauer A, Stolte M, Bayerdörffer E. Helicobacter heilmannii-associated primary gastric low-grade MALT lymphoma: complete remission after curing the infection. Gastroenterology. 2000;118:821-828. [PubMed] [DOI] |
| 17. | Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol. 1996;20:1161-1181. [PubMed] [DOI] |
| 18. | Fenoglio-Preiser C, Carneiro F, Correa P, Guilford P, Lambert R, Megraud F. Gastric carcinoma. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Digestive System. IARC Press: Lyon 2000; 46, 47. |
| 19. | Heilmann KL, Borchard F. Gastritis due to spiral shaped bacteria other than Helicobacter pylori: clinical, histological, and ultrastructural findings. Gut. 1991;32:137-140. [PubMed] [DOI] |
| 21. | Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet. 1983;1:1273-1275. [PubMed] |
| 22. | Sobala GM, Crabtree JE, Dixon MF, Schorah CJ, Taylor JD, Rathbone BJ, Heatley RV, Axon AT. Acute Helicobacter pylori infection: clinical features, local and systemic immune response, gastric mucosal histology, and gastric juice ascorbic acid concentrations. Gut. 1991;32:1415-1418. [PubMed] [DOI] |
| 23. | Konturek PC, Konturek SJ, Brzozowski T. Helicobacter pylori infection in gastric cancerogenesis. J Physiol Pharmacol. 2009;60:3-21. [PubMed] |
| 24. | Correa P. A human model of gastric carcinogenesis. Cancer Res. 1988;48:3554-3560. [PubMed] |
| 25. | Konturek PC, Konturek SJ, Brzozowski T. Gastric cancer and Helicobacter pylori infection. J Physiol Pharmacol. 2006;57 Suppl 3:51-65. [PubMed] |
| 26. | Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [PubMed] |