修回日期: 2013-08-07
接受日期: 2013-08-15
在线出版日期: 2013-10-18
目的: 分析术前同步放化疗联合全直肠系膜切除术(total mesorectal excision, TME)手术治疗Ⅱ/Ⅲ期直肠癌的安全性、有效性.
方法: 收集郑州大学第一附属医院胃肠外科2006-01/2011-12收治的112例TME治疗的Ⅱ/Ⅲ期直肠癌患者的临床病例资料, 其中接受术前同步放化疗联合TME手术治疗方案的为A组(n = 56), 单纯行TME手术者为B组(n = 56), 比较分析两组的术后并发症、R0切除率、保肛率、局部复发率和远期生存率.
结果: 两组患者R0切除率(91.7% vs 75%)和保肛率(64.7% vs 26.3%)存在显著差异(P<0.05); 两组患者术后吻合口瘘(6.0% vs 4.8%)和切口愈合不良(12.5% vs 8.9%)发生率无显著差异(P<0.05); 两组患者3年局部复发率分别为8.9%和26.8%, A组明显低于B组(P<0.05), 两组患者3年生存率(80.4% vs 71.4%)和5年生存率(57.1% vs 53.6%)均无显著性差异(P>0.05).
结论: 术前放同步放化疗可以提高手术R0切除率和保肛率而不增加患者术后并发症的发生率. 术前同步放化疗联合TME治疗Ⅱ/Ⅲ期直肠癌可以明显降低3年局部复发率, 但是并不能明显改善患者远期生存预后.
核心提示: 局部进展期直肠癌术前放化疗可提高R0切除率和保肛率, 降低局部复发率, 全直肠系膜切除术理论上可以使直肠癌手术达到根治效果与传统手术相比, 术前同步放化疗联合TME能更好地提高R0切除率, 降低直肠癌局部复发率及泌尿系统功能的损伤.
引文著录: 董新华, 张谢夫, 杨振, 刘光辉. 术前同步放化疗联合TME治疗Ⅱ/Ⅲ期直肠癌的临床疗效. 世界华人消化杂志 2013; 21(29): 3163-3167
Revised: August 7, 2013
Accepted: August 15, 2013
Published online: October 18, 2013
AIM: To assess the efficacy and safety of preoperative radiochemotherapy combined with total mesorectal excision (TME) in the treatment of stage Ⅱ/Ⅲ rectal cancer.
METHODS: One hundred and twelve patients with stage Ⅱ/Ⅲ rectal cancer, who were hospitalized in Department of Gastrointestinal Surgery of the First Affiliated Hospital of Zhengzhou University from January 2006 to December 2011 were collected and equally divided into two groups to receive either preoperative radiochemotherapy combined with TME (group A) or TME alone (group B). The R0 resection rate, anal preservation rate, local recurrence rate and long-term survival rate were compared between the two groups.
RESULTS: There were significant differences in R0 radical resection rate (91.1% vs 75%, P < 0.05) and anal preservation rate (64.7% vs 26.3%, P < 0.05) between the two groups, although no significant difference was observed in the rates of anastomotic leakage (6.0% vs 4.8%, P > 0.05) and poor healing of incision (12.5% vs 8.9%, P > 0.05). The 3-year local recurrence rate was significantly lower in group A than in group B (8.9% vs 26.8%, P < 0.05), but there were no significant differences in the 3-year survival rate (80.4% vs 71.4%, P > 0.05) or 5-year survival rate (57.1% vs 53.6%, P > 0.05) between the two groups.
CONCLUSION: Preoperative chemoradiotherapy can increase the rates of R0 radical resection and anal preservation but can not increase the rate of complications. Preoperative chemoradiotherapy combined with TME can significantly reduce the 3-year local recurrence rate but can not improve the long-term survival rate.
- Citation: Dong XH, Zhang XF, Yang Z, Liu GH. Efficacy and safety of preoperative radiochemotherapy combined with total mesorectal excision in treatment of stage Ⅱ/Ⅲ rectal cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3163-3167
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3163.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3163
近年来随着对直肠癌生物学行为的深入研究、新辅助治疗理念的提出、外科手术方式的改进、吻合器械的应用以及术后辅助治疗的进展, 直肠癌预后得到了明显的改善, 但是局部复发和远处转移是直肠癌治疗失败的两大主要原因[1,2]. 随着全直肠系膜切除术(total mesorectal excision, TME)[3]和新辅助治疗的提出, 直肠癌的治疗效果有了很大改观. 本文旨在通过回顾性分析既往接受术前放化疗联合TME治疗方案的Ⅱ/Ⅲ期直肠癌患者的病例资料, 总结临床经验, 探讨此治疗方案的安全性和有效性, 为其推广应用提供更多有利的临床证据, 以期更好地指导临床治疗决策, 进一步改善直肠癌患者的生活质量和预后.
收集郑州大学第一附属医院胃肠外科2006-01/2011-12收治的112例TME治疗的Ⅱ/Ⅲ期直肠癌患者的临床病例资料, 其中接受术前同步放化疗联合TME手术治疗方案的为A组(n = 56), 单纯行TME手术者为B组(n = 56). 两组患者基本情况及肿瘤距肛缘的距离详见表1. 所有病例均经肠镜病理证实为直肠腺癌. 患者纳入标准: (1)术前肠镜病理确诊为直肠腺癌, 硬质直肠镜检查肿瘤下缘距肛缘距离≤10 cm; (2)术前CT分期为II期(淋巴结阴性, 肿瘤穿透肠壁肌层)和III期(淋巴结阳性, 无远处转移)的直肠癌患者; (3)接受术前放化疗联合TME手术治疗方案或按TME原则单纯行手术治疗的直肠癌患者; (4)所有患者均知情同意, 遵循自愿原则, 该临床研究报我院伦理委员会批准同意后进行.
| 分组 | 性别(n) | 年龄(岁) | 肿瘤位置(下缘距肛缘) | |||||
| 男 | 女 | 分布 | 平均 | 距离(cm) | 患者分布(n) | |||
| 平均 | 中位 | 距离≤6 cm | 距离>6 cm | |||||
| A组 | 30 | 26 | 36-75 | 51 | 2.5-8.0 | 5.5 | 38 | 18 |
| B组 | 35 | 21 | 40-78 | 55 | 2-9 | 5 | 36 | 20 |
1.2.1 术前同步放化疗: 术前化疗方案采用FOLFOX6方案, 即奥沙利铂85 mg/m2静脉滴注2 h, 第1天亚叶酸钙400 mg/m2静脉滴注2 h, 然后氟尿嘧啶(fluorouracil, 5-FU)400 mg/m2静脉推注不小于10 min, 之后5-FU 1200 mg/(m2•d)×2静脉滴注持续46-48 h为一疗程, 每2 wk重复, 术前进行2疗程化疗. 于化疗开始第1天同步进行放疗, 放疗方案采用常规分割放疗, 总剂量36-40 Gy, 每次1.8-2.0 Gy, 每周5次, 共4 wk.
1.2.2 手术方式: 术前放化疗结束后间隔4 wk在我科进行手术, A组与B组直肠癌患者的手术均由同等资质、同等技术水平的医生完成. A组患者实施手术前复查血常规、肝肾功等生化检查以及盆腔CT, 了解有无手术禁忌症, 对直肠癌病变重新进行术前评估分期. 手术方式有腹会阴联合直肠癌切除术(Miles手术)、经腹直肠癌切除术(Dixon手术)和经腹直肠癌切除、近端造口、远端封闭手术(Hartmann手术), 无一例患者行预防性造瘘术, 术中均遵循TME手术原则, 肠管吻合均采用同一厂家同类型吻合器械.
1.2.3 术后辅助治疗: A组患者无论术后病理结果如何, 均接受FOLFOX6化疗方案进行术后辅助治疗[4]. B组患者根据术后病理情况, 如果术后病理提示恶性程度高、淋巴结转移比例高(N2)或者有血管、神经侵犯等情况, 且病人条件允许, 给予FOLFOX6方案进行术后辅助治疗. 否则均参照NCCN结直肠癌指南(2012中国版)[5]给予对症处理.
1.2.4 术后治疗监测及随访: 术后每次辅助化疗之前复查血常规、肝肾功能和肿瘤标志物, 在最初的2年应每3 mo一次病史询问和系统的体格检查, 然后每6 mo 检查1次, 总共5年. 对于Ⅱ/Ⅲ期直肠癌患者, 在最初的3-5年内每年至少进行一次胸、腹和盆腔CT扫描检查. 随访采用住院复查、门诊随访和电话随访. 随访终止日期为2012-12-31.
统计学处理 应用SPSS17.0统计软件进行统计学分析, 计数资料采用χ2检验和Fisher确切概率法进行统计学分析, 生存分析采用Kaplan-Meier法和Log-rank检验进行统计学处理, 本研究中P<0.05为差异有统计学意义.
2.1.1 两组患者手术R0切除率和保肛率的比较: A组与B组所有患者肿瘤两端切缘术中快速病理活检均为阴性, A组56例患者均获得手术切除, 有5例患者术后系统病理检查CRM阳性, R0切除率为91.1%(51/56). 新辅助治疗前有17例患者肿瘤拟行Miles手术, 而最终只有6例实施了Miles手术, 保肛率为64.7%(11/17), 其余病例均行Dixon手术. B组56例患者也均获得手术切除, 有14例患者术后病理证实CRM阳性, R0切除率为75%(42/56). 手术前有19例患者拟行Miles手术, 而最终根据术中探查情况仅有5例实施了保肛手术, 有1例患者因为年龄较大, 身体一般状况较差实施了Hartmann手术, 保肛率为26.3%(5/19). 两组患者R0切除率和保肛率的统计学差异如表2.
| 分组 | A组 | B组 | χ2 | P值 |
| R0切除率 | 91.1 | 75.0 | 5.134 | 0.023 |
| 保肛率 | 64.7 | 26.3 | 5.355 | 0.021 |
2.1.2 术后短期并发症的比较: 手术后A组患者出现7例切口愈合不良(12.5%), 3例超低位吻合口瘘(6.0%). B组患者出现5例切口愈合不良(8.9%), 包括3例会阴部积液, 2例低位吻合口瘘(4.8%), 发生吻合口瘘的患者经积极给予营养支持、局部通畅冲洗引流及给予抗生素等保守治疗后均于1 mo内闭瘘. 两组患者术后切口愈合不良和吻合口瘘的发生率无显著差异(表3). 术后短期内出现排尿功能障碍者9例, 均于术后7-10 d天恢复正常. 65例男性患者中, 有3例患者出现性功能障碍, 其中2例表现为勃起障碍, 1例失访.
| 分组 | A组 | B组 | χ2 | P值 |
| 切口愈合不良 | 12.5 | 8.9 | 0.373 | 0.541 |
| 吻合口瘘 | 6.0 | 4.8 | 0.061 | 0.805 |
两组患者术后3年局部复发率的比较: A组与B组者均获随访, A组随访时间16-80 mo, 中位随访时间为55 mo, 6位患者失访, 失访率为10.7%(6/56); B组患者随访时间为12-80 mo, 中位随访时间为50 mo, 5位患者失访, 失访率为8.9%(5/56). 随访于2012-12-31或患者死亡时间或失访时间终止. A组患者术后随访3年有5例出现局部复发, 1例发生远处转移至肝脏, 局部复发率为8.9%(5/56); B组患者后随访3年有15例出现局部复发, 有3例因转移至肝脏而死亡, 局部复发率为26.8%(15/56). 两组患者3年复发率比较有显著差异(χ2 = 6.087, P = 0.014), A组治疗组3年局部复发率明显低于B治疗组(8.9% vs 26.8%).
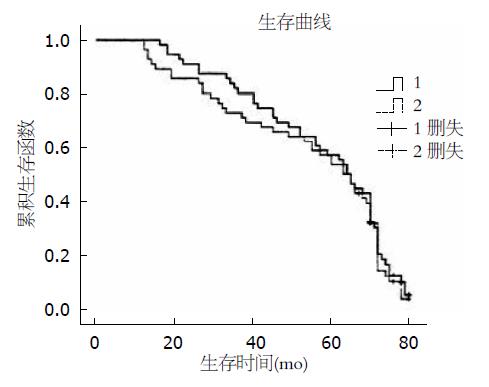
两组患者术后的生存率估计和生存曲线比较, 对两组患者的随访资料应用Kaplan-Meier法和Log-rank检验进行生存分析估计和生存曲线比较. 两组患者3年生存率(χ2 = 1.220, P = 0.269)和5年生存率(χ2 = 0.145, P = 0.704)均无显著性差异(表4, 图1).
| 分组 | 累计生存率(%) | 期内死亡人数(n) | ||||
| 1年 | 3年 | 5年 | 1年 | 3年 | 5年 | |
| A组 | 100 | 80.4 | 57.1 | 0 | 11 | 24 |
| B组 | 100 | 71.4 | 53.6 | 0 | 16 | 26 |
直肠癌是我国常见的消化系恶性肿瘤之一, 近年来其发病率呈上升趋势, 严重危害了人类的身心健康. 近年来随着对直肠癌生物学行为的深入研究、新辅助治疗理念的提出、外科手术方式的改进、吻合器械的应用以及术后辅助治疗的进展, 直肠癌预后得到了明显的改善, 但是局部复发和远处转移是直肠癌治疗失败的两大主要原因. 随着TME和新辅助治疗的提出, 直肠癌的治疗效果有了很大改观[6].
局部进展期直肠癌术前放化疗可降低肿瘤分期, 提高R0切除率和保肛率, 降低局部复发率, 可以说已经成为综合治疗的标准模式[7,8]. 术前由于肿瘤血供较好切肿瘤组织含氧量较高, 可以提高放疗效果和局部化疗药物浓度; 且可以同时控制和消灭临床或亚临床的微小病灶[9], 所以术前放化疗可以提高R0切除率. TME并不是一种手术方式, 而是直肠癌手术中坚持的一种原则. TME理论上可以使直肠癌手术达到根治效果, 大量的临床研究也证实了TME在降低直肠癌局部复发率中的价值, TME的另一优势在于直视下锐性分离可以更好地保护盆腔自主神经, 减少直肠癌术后的泌尿生殖功能障碍. TME强调的是环绕直肠锐性剥离直肠系膜, 切除直肠远端系膜不少于5 cm或全部系膜, 癌肿肛侧肠管切线距癌肿远端不少于2 cm. 故与传统手术相比, 术前同步放化疗联合TME能更好地提高R0切除率, 降低直肠癌局部复发率及泌尿系统功能的损伤[10-12].
术前同步放化疗联合手术根治切除的多学科综合治疗可以降低肿瘤分期[13], 提高保肛率、降低局部复发率, 但是均未改善总体生存[14,15]. 两组患者的生存曲线如图1, 3年、5年生存率分别为80.4%、57.1%和71.4%、53.6%, 远期生存无显著差异, 与Glynne-Jones等[15]的研究结果相符. 虽没有统计学差异, 但是从生存曲线上可以看出, 术后5年内, A组生存曲线位于B组上方. 可见术前同步放化疗联合TME治疗Ⅱ/Ⅲ期直肠癌其优势明显高于单纯手术者, 但是术前同步放化疗联合TME治疗Ⅱ/Ⅲ期直肠癌最终能否改善5年生存率尚需进一步临床研究.
直肠癌是我国常见的消化系恶性肿瘤之一, 对于直肠癌的治疗目前多数多采用单纯手术治疗, 术后生存率依然不太令人满意, 且术后并发症较高, 故何种方式更好的解决直肠癌, 各科医师都在持续关注.
李革, 副教授, 吉林省延吉市延边大学附属医院
本文采用术前放化疗结合TME手术方式研究直肠癌的生存预后及术后并发症, 以期能找到更好地应对直肠癌办法.
现很多文章单一从放化疗或者单一手术去治疗直肠癌, 进而去评估其生存率、并发症, 结论都比较单一; 而本文采取术前同步放化疗联合TME手术方式去论证直肠癌的生存率及其并发症, 为以后寻找直肠癌更合理的方式提供了借鉴.
术前放化疗已成为直肠癌的标准治疗模式, 全直肠系膜切除术(total mesorectal excision, TME)理论上可以使直肠癌手术达到根治效果, 所以术前放化疗结合TME势必会成为直肠癌治疗的主流趋势.
本论文采用新辅助治疗方法对直肠癌患者治疗, 取得明显效果, 有一定的临床价值, 试验设计合理, 结论可信, 有一定的科学性和可读性.
| 1. | Bonadeo FA, Vaccaro CA, Benati ML, Quintana GM, Garione XE, Telenta MT. Rectal cancer: local recurrence after surgery without radiotherapy. Dis Colon Rectum. 2001;44:374-379. [PubMed] [DOI] |
| 2. | Roh MS, Colangelo LH, O'Connell MJ, Yothers G, Deutsch M, Allegra CJ, Kahlenberg MS, Baez-Diaz L, Ursiny CS, Petrelli NJ. Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol. 2009;27:5124-5130. [PubMed] [DOI] |
| 3. | Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery--the clue to pelvic recurrence? Br J Surg. 1982;69:613-616. [PubMed] [DOI] |
| 4. | Hofheinz RD, Wenz F, Post S, Matzdorff A, Laechelt S, Hartmann JT, Müller L, Link H, Moehler M, Kettner E. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol. 2012;13:579-588. [PubMed] [DOI] |
| 5. | National Comprehensive Cancer Network(NCCN). NCCN Clinical Practice Guidelines in Oncology-Rectal Cancer. Available from: http: //www.nccn.org/professional/physician-gl -s/pdf/rectal.pdf. |
| 6. | Braendengen M, Tveit KM, Berglund A, Birkemeyer E, Frykholm G, Påhlman L, Wiig JN, Byström P, Bujko K, Glimelius B. Randomized phase III study comparing preoperative radiotherapy with chemoradiotherapy in nonresectable rectal cancer. J Clin Oncol. 2008;26:3687-3694. [PubMed] [DOI] |
| 7. | Pucciarelli S, Del Bianco P, Efficace F, Serpentini S, Capirci C, De Paoli A, Amato A, Cuicchi D, Nitti D. Patient-reported outcomes after neoadjuvant chemoradiotherapy for rectal cancer: a multicenter prospective observational study. Ann Surg. 2011;253:71-77. [PubMed] [DOI] |
| 9. | Gérard JP, Conroy T, Bonnetain F, Bouché O, Chapet O, Closon-Dejardin MT, Untereiner M, Leduc B, Francois E, Maurel J. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203. J Clin Oncol. 2006;24:4620-4625. [PubMed] [DOI] |
| 10. | Lange MM, Marijnen CA, Maas CP, Putter H, Rutten HJ, Stiggelbout AM, Meershoek-Klein Kranenbarg E, van de Velde CJ. Risk factors for sexual dysfunction after rectal cancer treatment. Eur J Cancer. 2009;45:1578-1588. [PubMed] [DOI] |
| 11. | Lange MM, Maas CP, Marijnen CA, Wiggers T, Rutten HJ, Kranenbarg EK, van de Velde CJ. Urinary dysfunction after rectal cancer treatment is mainly caused by surgery. Br J Surg. 2008;95:1020-1028. [PubMed] [DOI] |
| 12. | Baxter NN, Garcia-Aguilar J. Organ preservation for rectal cancer. J Clin Oncol. 2007;25:1014-1020. [PubMed] [DOI] |
| 13. | Francois Y, Nemoz CJ, Baulieux J, Vignal J, Grandjean JP, Partensky C, Souquet JC, Adeleine P, Gerard JP. Influence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer: the Lyon R90-01 randomized trial. J Clin Oncol. 1999;17:2396. [PubMed] |
| 14. | Bosset JF, Collette L, Calais G, Mineur L, Maingon P, Radosevic-Jelic L, Daban A, Bardet E, Beny A, Ollier JC. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med. 2006;355:1114-1123. [PubMed] [DOI] |
| 15. | Glynne-Jones R, Sebag-Montefiore D. Role of neoadjuvant chemotherapy in rectal cancer: interpretation of the EXPERT study. J Clin Oncol. 2006;24:4664-4665; author reply 4664-4665. [PubMed] [DOI] |