修回日期: 2013-07-31
接受日期: 2013-08-29
在线出版日期: 2013-10-18
目的: 观察转化生长因子-β(transforming growth factor-beta 1, TGF-β1)与基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)在兔胆管电灼烧伤中的表达, 并探讨两者在胆管狭窄形成中的关系、作用及意义.
方法: 建立兔胆管电损伤模型, 分别于术后4、8 wk取材, 分别行TGF-β1与MMP-1免疫组织化学染色, 观察其阳性细胞数.
结果: 两者在正常胆管组织及假手术组中的表达无统计学意义. TGF-β1在电灼伤各组中持续高表达, 而MMP-1在电损伤4 wk中高表达、8wk中呈低表达. 两者在电灼伤狭窄胆管中的表达明显高于正常胆管组织, 假手术组(P<0.05). TGF-β1在4 wk(75.35±5.00)、8 wk(74.4±6.60)组中的表达无统计学差异, MMP-1在4 wk(42.4±5.16)、8 wk(17.2±3.88)中的表达差异有统计学意义(P<0.05). TGF-β1与MMP-1两者在狭窄胆管组织中的表达随炎症时间延长呈负相关(r = -0.218).
结论: TGF-β1持续高表达与MMP-1后期低表达是造成胆管狭窄的重要因素, 并且两者在胆管纤维化增厚、瘢痕形成过程中具有协同的作用.
核心提示: 本研究中发现在电损伤胆管的早期和晚期均可见转化生长因子-β(transforming growth factor-beta 1, TGF-β1)的持续高表达, 这与对照组和假手术组有明显的统计学差异, 但是手术组间无统计学意义, 这表明TGF-β1的持续分泌是狭窄形成的重要成因, 这与国内外相关报道一致. 此外, 本研究中发现基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)随炎症时间的延长分泌而减少, 是造成炎症后细胞外基质合成和降解失衡的重要原因. 持续高表达的TGF-β1诱导细胞分泌胶原蛋白、弹性纤维等, 造成细胞外基质大量沉积挛缩, 并抑制MMP-1的释放导致基质合成和降解的失衡, 最终在两者的共同作用下形成狭窄.
引文著录: 李锦锦, 李潼, 孟元普, 吴军卫, 柴新群. TGF-β1与MMP-1在兔胆管电灼伤中的表达及意义. 世界华人消化杂志 2013; 21(29): 3097-3101
Revised: July 31, 2013
Accepted: August 29, 2013
Published online: October 18, 2013
AIM: To investigate the significance of expression of transforming growth factor-beta 1 (TGF-β1) and matrix metalloproteinase 1 (MMP1) in bile duct injury caused by electrocautery in rabbits.
METHODS: A model of bile duct injury caused by electrocautery was established in rabbits. Expression and location of TGF-β1 and MMP1 in bile duct injury was detected by immunohistochemistry.
RESULTS: Expression of TGF-β1 and MMP1 showed no significant differences between the normal control group and sham operation group. Sustained high expression of TGF-β1 and low expression of MMP1 were observed in later stage in the operation group. With the prolongation of the time of inflammatory state, the expression of TGF-β1 showed a negative correlation with MMP1 in the operation group.
CONCLUSION: High expression of TGF-β1 and low expression of MMP1 are important factors leading to bile duct stricture, and they have a synergistic effect in leading to biliary fibrosis and cicatrization.
- Citation: Li JJ, Li T, Meng YP, Wu JW, Chai XQ. Significance of expression of TGF-β1 and MMP1 in bile duct injury caused by electrocautery in rabbits. Shijie Huaren Xiaohua Zazhi 2013; 21(29): 3097-3101
- URL: https://www.wjgnet.com/1009-3079/full/v21/i29/3097.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i29.3097
胆道良性狭窄是胆道外科非常棘手的问题, 常由腹腔镜胆囊切除术所致的医源性胆管损伤引起[1], 随着腔镜技术的广泛应用, 医源性胆管损伤的发生率由0.4%上升至0.5%[2,3], 国内大宗病例研究显示胆管电灼伤约占18.3%[4]. 胆管损伤后常以炎性疤痕挛缩和狭窄为突出表现, 尤以肝门部或肝门部以上胆管狭窄显著[5]. 但是胆道良性狭窄的发病机制仍是未知[6].
有关研究表明[7,8]纤维细胞的分化和激活是产生纤维性病变的重要事件, 纤维细胞分化为肌纤维细胞并持续大量存在是造成瘢痕挛缩和纤维病变的主要原因. 而转化生长因子-β1(transforming growth factor-beta 1, TGF-β1)是纤维细胞转化和激活的强有力的诱导者[7,9]. 分化成的肌成纤维细胞可分泌胶原, 造成大量细胞外基质沉积, 导致瘢痕增厚, 而基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)作为主要的胶原酶参与细胞外基质的降解和重建. 本研究旨在探讨两者在胆管损伤后所致狭窄中作用.
选用健康家兔25只(购自华中科技大学同济医学院动物实验中心)雌雄不限, 平均体质量2.1 kg±0.14 kg, 随机分为对照组、假手术组、实验组、假手术组和实验组根据术后处理时间分为2个亚组(术后4、8 wk组), 各组5只. 术前各组的体质量、进食量、精神状态无明显差异. 手术器械由武汉协和医院手术室提供.
1.2.1 各分组的处理: 同等条件下饲养, 术前晚禁饮食, 假手术组与实验组用3%的戊巴比妥钠(1 mL/kg)经耳缘静脉麻醉, 麻醉满意后备皮、消毒、铺巾, 参照文献[10]对实验组建立电灼伤模型, 假手术组仅作开关腹, 对照组不做任何处理; 术后3 d连续肌注单位青霉素80万单位.
1.2.2 取材: 术后4、8wk采用空气栓塞法处死后取材, 实验组剪取损伤部位胆管1 cm, 假手术组及对照组分别剪取相应部位胆管1 cm, 生理盐水漂洗胆管, 4%多聚甲醛固定, 常规制作石蜡包块, 沿胆总管横断面连续切片, 厚度5 μm, 行HE染色及免疫组织化学染色.
1.2.3 免疫组织化学: 采用SP法, 第一抗体: 抗兔TGF-β1抗体(武汉博士德公司), 抗兔MMP-1抗体(北京博奥森公司), 抗兔/鼠通用型免疫组织化学试剂盒REALTM EnVision+/HRP RABBIT/MOUSE(Dako Denmark A/S生产). 牛血清白蛋白(Roche, 北京索莱宝科技有限公司分装)染色步骤: 组织切片常规脱蜡止至水; 切片置于EDTA中行微波修复; 3%H2O2中室温下孵育5-10 min, 灭活内源性酶, 蒸馏水冲洗3次; PBS冲洗, 行电炉高温抗原修复; 滴加5%BSA封闭液, 37 ℃孵育30 min, 滴加一抗, 工作浓度1:50, 4 ℃过夜; PBS液冲洗5 min×3次, 滴加二抗, 4 ℃孵育50 min, PBS液冲洗5 min×3次; 滴加新鲜配制DAB显色液, 显微镜下控制染色, 显色完全后, 蒸馏水或自来水冲洗, 苏木素复染, 1%盐酸乙醇分化(1 s), 自来水冲洗, 氨水返蓝, 流水冲洗; 脱水、透明、封片、观察. 对照设计: 用已知的TGF-β1与MMP-1的阳性切片作为阳性对照; 空白对照中选用PBS代替一抗, 其余步骤同前; 置换实验中用正常鼠的血清代替一抗, 其余步骤同前.
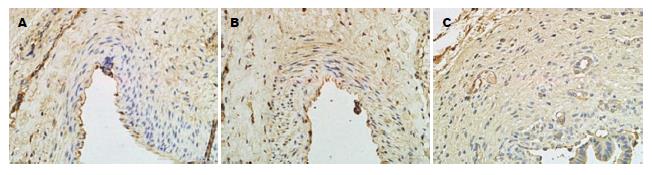
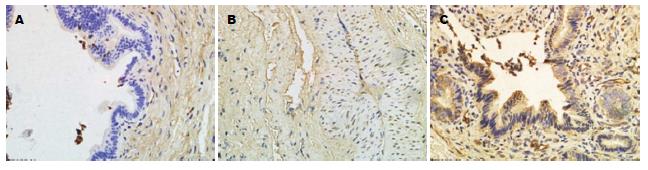
1.2.4 结果判定标准: 细胞质和/或核内见淡黄色颗粒明显高于背景色为阳性. 细胞着色强度分以下等级: "-"为阴性细胞; "+"为细胞核和/或细胞质染成淡棕黄色; "+++"为深棕黄色; "++"则介于两者之间. 每张切片高倍镜下(400×)随机选取5个视野, 计数每个视野中的阳性细胞数及百分比, 取其均数进行定量分析.
统计学处理 采用SPSS18.0统计软件进行分析, 差异性分析采用单因素方差分析(One-factor ANOVA), a = 0.05, 相关性分析采用Pearson积差相关系数, P<0.05为差异有统计学意义.
实验组有2只兔子分别于术后第3、5天因胆漏死亡. 其余全部成活, 共23只. 术后早期观察各组在饮食、精神状态、活动反应无明显差异. 实验组术后1 mo可见食欲下降、反应迟钝、毛色黯淡、小便色染等梗阻性黄疸表现. 假手术组胆管周围黏连, 胆管无扩张, 实验组可见腹腔明显黏连, 电损伤以上胆管可见明显扩张, 肝脏呈淤胆表现.
正常胆管组织中可见极少量的TGF-β1与MMP-1的表达(TGF-β1: 7.4±3.2, MMP-1: 7.4±3.15), 表达部位主要是管周组织. 假手术组中4、8 wk均见TGF-β1与MMP-1少量表达(4 wk: TGF-β1: 10.3±4.04, MMP-1: 9.1±4.72; 8 wk: TGF-β1: 13.0±2.94, MMP-1: 11.0±2.79), 主要表达在炎性细胞, 两者在假手术组与对照组中的表达均无明显统计学意义. 实验组中4、8 wk均可见TGF-β1与MMP-1的高表达(4 wk: TGF-β1: 75.35±5.00, MMP-1: 42.4±5.16; 4 wk: TGF-β1: 74.4±6.60, MMP-1: 17.2±3.88), 组内比较TGF-β1(75.35±5.00 vs 74.4±6.60)无明显统计学差异, MMP-1实验组内有明显统计学差异(42.4±5.16 vs 17.2±3.88, P<0.05). 两者的表达在实验组与对照组、假手术组中均有明显的统计学差异(P<0.05). 随炎性反应时间的延长, 两者在实验8 wk组中表达呈负相关(r = -0.218, 表1, 图1, 2).
| MMP-1 | 阳性细胞 | TGF-β1 | 阳性细胞 | |
| 正常组 | --+ | 7.4±3.15 | --+ | 7.4±3.2 |
| 假手术4 wk | --+ | 9.1±4.72 | --+ | 10.3±4.04 |
| 假手术8 wk | --+ | 11.0±2.79 | --+ | 13.0±2.94 |
| 手术4 wk | ++-+++ | 42.4±5.16 | +++ | 75.35±5.00 |
| 手术8 wk | +-++ | 17.2±3.88 | +++ | 74.4±6.60 |
胆管的电灼伤虽然占胆管损伤的18.3%[4], 但文献报道有确实的证据可表明胆管电灼伤不容忽视, 可引起急性胆管炎、急性胆源性胰腺炎、胆囊三角再出血、严重的瘢痕或挛缩[11-13]. 并且胆管电损伤具有不同于其他损伤的特点: (1)术中不易发现, 术中常规胆道造影似乎不能提高诊断率[13]; (2)损伤范围广、位置高, 研究表明[14]单极电烧工作产生的热量足以引起损伤处1 cm内的细胞膜的破坏; (3)发展缓慢, 可表现为电灼伤-坏死-穿孔-胆漏的过程[15]; (4)常合并胆管周围血管丛的损伤, 出现迟发型的狭窄和挛缩.
胆管损伤修复属于高度的纤维性修复, 修复细胞的大量增殖与凋亡抑制、细胞外基质中胶原合成与降解、部分细胞因子的大量产生及三者密切关系是构成其炎性疤痕的生物学基础[16]. TGF-β1是一种参与细胞增殖、细胞分化、免疫应答、纤维修复的多功能细胞因子[17,18], 是目前已知与纤维化、瘢痕发生发展最密切的细胞因子[19,20]. 损伤部位TGF-β1前体是由血小板释放, 经酶激活后, 诱导纤维细胞的转化并刺激产生胶原及细胞外基质, 趋化、诱导炎性细胞, 通过自分泌、旁分泌形成TGF-β的"正反馈"机制. 早期的TGF-β1的释放, 有利于损伤的修复, 但持续高表达的释放可能是造成瘢痕狭窄的重要原因. 本研究结果显示正常胆管不表达或弱阳性表达TGF-β1, 假手术组中的TGF-β1的可见弱阳性表达, 但与对照组无明显统计学差异, 可能与分离胆管破坏胆管周围血管丛有关, 并且亚组之间无统计学意义. 实验组中可见持续高表达, 主要表达在成纤维细胞、炎性细胞、血管内皮细胞, 与国内相关报道相符[21,22]. 此外, 我们在损伤处的胆管细胞内发现TGF-β1的高表达, 之前文献未见相关报道, 可能与胆管缺氧、胆盐刺激有关. 本研究中实验亚组术后均可见大量炎性细胞中持续强表达TGF-β1, 并且亚组之间无统计学意义, 证实炎性细胞是产生TGF-β1的主要细胞, 间接证实炎性反应时间长短与瘢痕形成有密切关系.
细胞外基质(extracellular matrix, ECM)的合成与降解之间的动态平衡受到破坏是导致ECM过度沉积形成瘢痕的重要原因. 文献报道TGF-β1在瘢痕形成过程中能够促进成纤维细胞大量合成Ⅰ型、Ⅲ型和Ⅷ型胶原蛋白、弹性纤维和纤连蛋白, 并对于漂浮和固定的胶原基质.都能使之发生挛缩[23,24]. 基质金属酶(matrix metalloproteinase, MMP)是一组依赖于Zn2+以细胞外基质作为底物的蛋白质水解酶类, 其中MMP-1是通过裂解胶原、改变胶原结构参与Ⅰ型、Ⅲ型胶原降解的胶原酶. 本实验中正常对照组无或少量MMP-1的表达, 假手术组有少量表达, 与正常组无统计学意义, 实验4 wk组中MMP-1强阳性表达, 8 wk组呈阳性表达, 两者之间有明显的统计学差异(P<0.05). 理论上讲, 随损伤时间的延长, 细胞外基质内过度沉积的胶原可诱导MMP-1的高表达, 以加速胞外基质改建. 但MMP-1的表达受激素、细胞因子等多种因素调控, 文献报道TGF-β1可以直接抑制MMP的表达, 并能促进组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase, TIMP)的释放[25]. 本研究中发现损伤胆管中TGF-β1与MMP-1的随时间表达呈负相关, 从而可证实高表达的TGF-β1抑制MMP-1的释放, 并随损伤时间的延长, 其抑制作用增强, 造成其降解作用减弱, 胶原合成和分解失衡, 细胞外基质大量沉积, 从而瘢痕形成.
本研究中损伤组胆管周围可见大量炎性细胞、纤维组织排列紊乱、明显增生, 缺氧和胆汁刺激可能是持续炎性反应的诱因. 持续的炎症反应诱导TGF-β1的高表达, 高表达的产物刺激诱导纤维细胞的分化, 使之分泌过量的胶原沉积于胞外, TGF-β1又通过抑制MMP-1的分泌, 破坏细胞外基质之间的动态平衡, 最终导致瘢痕狭窄. 鉴于胆管电灼伤的严重后果及自身特点, 因此在手术中应尽量避免损伤, 但对于损伤患者如何在炎症后期减少TGF-β1的过度分泌或增加MMP-1的分泌, 减轻狭窄瘢痕, 有待于进一步的研究.
良性胆管狭窄是胆道外科的棘手问题, 病情病程长, 易反复引起胆道感染及多种严重的并发症, 常因医源性胆道损伤引起, 由于腔镜技术的普及, 医源性胆道损伤的发生率在提高, 而胆管电损伤有其自身特点, 引起的后果更加严重, 因此本文旨在探讨电损伤中的狭窄形成机制.
薛东波, 教授, 哈尔滨医科大学附属第一医院
随腔镜技术的应用的普及, 由腹腔镜手术导致的医源性胆管损伤的发生率上升, 术后表现为炎性瘢痕挛缩和狭窄, 形成显著的良性狭窄, 但狭窄的发生机制却是未解之谜.
国内外报道一致认为TGF-β1与狭窄形成紧密相关, 国内学者相关研究同样表明TGF-β1在良性胆管狭窄中具有重要作用.
本研究密切联系临床, 并且从基质形成和降解两个不同角度分期、分别探讨狭窄形成的机制.
本文内容新颖、通俗易懂, 对良性胆管狭窄机制的研究有一定的学术价值, 对指导治疗有一定帮助.
编辑: 田滢 电编:鲁亚静
| 1. | Larghi A, Tringali A, Lecca PG, Giordano M, Costamagna G. Management of hilar biliary strictures. Am J Gastroenterol. 2008;103:458-473. [PubMed] |
| 2. | Waage A, Nilsson M. Iatrogenic bile duct injury: a population-based study of 152 776 cholecystectomies in the Swedish Inpatient Registry. Arch Surg. 2006;141:1207-1213. [PubMed] [DOI] |
| 3. | Pottakkat B, Vijayahari R, Prakash A, Singh RK, Behari A, Kumar A, Kapoor VK, Saxena R. Incidence, pattern and management of bile duct injuries during cholecystectomy: experience from a single center. Dig Surg. 2010;27:375-379. [PubMed] [DOI] |
| 5. | Xu J, Geng ZM, Ma QY. Microstructural and ultrastructural changes in the healing process of bile duct trauma. Hepatobiliary Pancreat Dis Int. 2003;2:295-299. [PubMed] |
| 6. | Geng ZM, Zheng JB, Zhang XX, Tao J, Wang L. Role of transforming growth factor-beta signaling pathway in pathogenesis of benign biliary stricture. World J Gastroenterol. 2008;14:4949-4954. [PubMed] [DOI] |
| 7. | Thannickal VJ, Lee DY, White ES, Cui Z, Larios JM, Chacon R, Horowitz JC, Day RM, Thomas PE. Myofibroblast differentiation by transforming growth factor-beta1 is dependent on cell adhesion and integrin signaling via focal adhesion kinase. J Biol Chem. 2003;278:12384-12389. [PubMed] [DOI] |
| 8. | Demetris AJ, Lunz JG, Specht S, Nozaki I. Biliary wound healing, ductular reactions, and IL-6/gp130 signaling in the development of liver disease. World J Gastroenterol. 2006;12:3512-3522. [PubMed] |
| 9. | Martin-Garrido A, Brown DI, Lyle AN, Dikalova A, Seidel-Rogol B, Lassègue B, San Martín A, Griendling KK. NADPH oxidase 4 mediates TGF-β-induced smooth muscle α-actin via p38MAPK and serum response factor. Free Radic Biol Med. 2011;50:354-362. [PubMed] [DOI] |
| 11. | Družijanić N, Pogorelić Z, Perko Z, Mrklić I, Tomić S. Comparison of lateral thermal damage of the human peritoneum using monopolar diathermy, Harmonic scalpel and LigaSure. Can J Surg. 2012;55:317-321. [PubMed] [DOI] |
| 12. | Humes DJ, Ahmed I, Lobo DN. The pedicle effect and direct coupling: delayed thermal injuries to the bile duct after laparoscopic cholecystectomy. Arch Surg. 2010;145:96-98. [PubMed] [DOI] |
| 13. | Giger U, Ouaissi M, Schmitz SF, Krähenbühl S, Krähenbühl L. Bile duct injury and use of cholangiography during laparoscopic cholecystectomy. British Journal of Surgery. 2011;98:391-396. [PubMed] [DOI] |
| 14. | Sutton PA, Awad S, Perkins AC, Lobo DN. Comparison of lateral thermal spread using monopolar and bipolar diathermy, the Harmonic Scalpel and the Ligasure. Br J Surg. 2010;97:428-433. [PubMed] [DOI] |
| 17. | Werner S, Krieg T, Smola H. Keratinocyte-fibroblast interactions in wound healing. J Invest Dermatol. 2007;127:998-1008. [PubMed] [DOI] |
| 18. | Blobe GC, Schiemann WP, Lodish HF. Role of transforming growth factor beta in human disease. N Engl J Med. 2000;342:1350-1358. [PubMed] [DOI] |
| 19. | Bissell DM, Roulot D, George J. Transforming growth factor beta and the liver. Hepatology. 2001;34:859-867. [PubMed] [DOI] |
| 20. | Nagashio Y, Ueno H, Imamura M, Asaumi H, Watanabe S, Yamaguchi T, Taguchi M, Tashiro M, Otsuki M. Inhibition of transforming growth factor beta decreases pancreatic fibrosis and protects the pancreas against chronic injury in mice. Lab Invest. 2004;84:1610-1618. [PubMed] [DOI] |
| 23. | Pandit A, Ashar R, Feldman D. The effect of TGF-beta delivered through a collagen scaffold on wound healing. J Invest Surg. 1999;12:89-100. [PubMed] [DOI] |
| 24. | 耿 智敏, 向 国安, 韩 庆, 刘 效恭, 苏 宝山, 刘 青光, 潘 承恩. 转化生长因子β1在胆管愈合过程中的表达及意义. 中国普外基础与临床杂志. 2000;7:362-363. |
| 25. | Philips N, Keller T, Gonzalez S. TGF beta-like regulation of matrix metalloproteinases by anti-transforming growth factor-beta, and anti-transforming growth factor-beta 1 antibodies in dermal fibroblasts: Implications for wound healing. Wound Repair Regen. 2004;12:53-59. [PubMed] [DOI] |