修回日期: 2013-08-28
接受日期: 2013-09-09
在线出版日期: 2013-10-08
目的: 探讨p53异构体与胃癌发生、发展中的相关性及其机制.
方法: 收集胃癌、萎缩性胃炎、正常胃黏膜组织各30例, 应用NT-PCR法及免疫组织化学方法检测3组中的p53异构体p53β、Δ133p53和PTEN、Bax、p21waf1/cip1基因的表达情况, 并进行统计学分析.
结果: p53β在胃癌、慢性萎缩性胃炎及正常胃黏膜组织中的表达率分别为26.7%、33.3%和70.0%, 胃癌组织p53β的表达明显低于正常胃组织(P<0.01); Δ133p53在胃癌、慢性萎缩性胃炎及正常胃黏膜组织中的表达率分别为70.0%、50.0%, 23.3%, 胃癌组织Δ133p53的表达明显高于正常胃组织(P<0.01); PTEN在胃癌、慢性萎缩性胃炎及正常胃黏膜组织中的表达率分别为53.3%、76.7%、86.7%; Bax在胃癌、慢性萎缩性胃炎及正常胃黏膜组织中的表达率分别为36.7%、73.3%、83.3%; p21waf1/cip1在胃癌、慢性萎缩性胃炎及正常胃黏膜组织中的表达率分别为46.7%、50.0%、86.7%, 胃癌组织中PTEN、Bax及p21waf1/cip1的表达均明显低于正常胃组织(P<0.05). p53β和PTEN、Bax、p21waf1/cip1在胃癌中表达均呈正相关关系, 而Δ133p53和PTEN、Bax、p21waf1/cip1在胃癌中表达均呈负相关关系(P<0.05).
结论: p53异构体p53β、Δ133p53在胃癌中的差异性表达, 可能通过调控Bax、p21waf1/cip1及PTEN等下游基因而抑制p53的活性, 对胃癌的发生发展产生了重要作用.
核心提示: p53异构体p53β、Δ133p53在胃癌中的差异性表达, 通过下调Bax、p21waf1/cip1及PTEN等下游基因的生物学活性, 从而抑制了p53的活性, 对胃癌的发生发展起了重要的作用.
引文著录: 张红梅, 张小茜, 仲华, 张娜, 李蕾, 季万胜. p53异构体与胃癌发生发展的相关性及其机制. 世界华人消化杂志 2013; 21(28): 2922-2928
Revised: August 28, 2013
Accepted: September 9, 2013
Published online: October 8, 2013
AIM: To investigate the relevance of p53 isoforms in the genesis and development of gastric cancer and to explore possible mechanisms involved.
METHODS: Ninety specimens of gastric cancer, atrophic gastritis and normal gastric mucosa were gathered. The expression of p53 splice variants (p53β, Δ133p53), PTEN, Bax, and p21waf1/cip1 in the above specimens was detected by nested reverse transcription-polymerase chain reaction (NT-PCR) and immunohistochemistry.
RESULTS: The positive rate of p53β expression was significantly lower in gastric cancer and atrophic gastritis than in normal gastric mucosa (26.7%, 33.3% vs 70.0%, both P < 0.01). The positive rate of Δ133p53 expression was 70.0% in gastric cancer, 50.0% in atrophic gastritis, and 23.3% in normal gastric mucosa, which was significantly higher in gastric cancer than in normal gastric mucosa (P < 0.01). The positive rate of PTEN expression was 53.3% in gastric cancer, 76.7% in atrophic gastritis, and 86.7% in normal gastric mucosa, and the corresponding percentages were 36.7%, 73.3% and 83.3% for Bax, and 46.7%, 50.0% and 86.7% for p21waf1/cip1. The positive rates of PTEN, Bax and p21waf1/cip1 expression were significantly lower in gastric cancer than in normal gastric mucosa (all P < 0.05). There were positive correlations between the expression of p53β and PTEN, p53β and Bax, p53β and p21waf1/cip1, and negative correlations between the expression of Δ133p53 and PTEN, Δ133p53 and Bax, Δ133p53 and p21waf1/cip1 in gastric cancer (all P < 0.05).
CONCLUSION: Differential expression of p53β and Δ133p53 in gastric cancer may suppress the activity of p53 by regulating Bax, p21waf1/cip1 and PTEN and thereby affect the genesis and development of gastric cancer.
- Citation: Zhang HM, Zhang XQ, Zhong H, Zhang N, Li L, Ji WS. Relevance of p53 isoforms in genesis and progression of gastric cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(28): 2922-2928
- URL: https://www.wjgnet.com/1009-3079/full/v21/i28/2922.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i28.2922
胃癌是我国最常见的消化系恶性肿瘤之一, 其发病率和死亡率均是世界平均水平的两倍多, 但其病因目前尚不清楚, 人们对胃癌的发病机制始终处于不断的研究探索之中. p53基因是迄今为止与人类肿瘤相关性最高的基因, 被认识为一种抑癌基因, 但最近的研究表明, 中国胃癌p53的突变率仅为30.6%[1], 提示部分胃癌的发生并没有伴随着p53的高突变率. 近几年来研究发现, 不同的p53剪接异构体作为一种转录因子可以调节p53的转录活性, 进而引发一系列的生物学反应, 对肿瘤的发生、发展发挥重要作用. 探讨p53异构体对野生型p53基因转录的影响以及对p53下游效应基因的影响, 都有可能发现胃癌发生的新机制. 本研究通过检测胃癌、萎缩性胃炎、正常胃组织中的p53异构体p53β、Δ133p53和同源丢失性磷酸酶张力蛋白PTEN、Bax(Bcl-2-associated X protein)、p21waf1/cip1基因的表达情况, 探讨p53异构体在胃癌发生、发展中的作用及他们之间的相互关系, 为研究胃癌的发生机制进一步提供理论依据.
选取2010-10-08/2012-08-21就诊于潍坊医学院附属医院的患者90例, 其中胃癌手术切除标本21例, 胃镜下胃癌活检组织标本9例, 胃镜下慢性萎缩性胃炎(chronic atrophic gastratritis, CAG)活检组织标本30例, 胃镜下正常黏膜组织活检标本30例. 男性56例、女性34例, 年龄在23-81岁之间, 平均年龄47.3岁, 中位年龄48岁. 所有标本均经病理学确诊, 入选患者均无长期糖皮质激素及非甾体抗炎药服用史, 标本采集前均未接受任何放化疗.
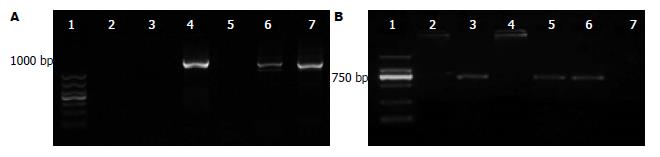
采用巢式逆转录多聚酶链反应法检测胃癌、慢性萎缩性胃炎及正常胃黏膜组织中p53β和Δ133p53的表达情况: 应用UNIQ-10柱式TRIzol总RNA提取试剂盒提取三组胃组织的总RNA. 按照MMLV第一链cDNA合成试剂盒说明书及相关文献操作, 以试剂盒内的Oligo-p(dT)18Primer为随机引物, 以M-MuLV RT酶为逆转录酶进行体外逆转录反应. 对胃组织中p53β、Δ133p53二种p53异构体PCR扩增, 引物序列如下: p53β外引物, 正向: 5'-GTC ACT GCC ATG GAG GAG CCG CA-3', 反向: 5-GAC GCA CAC CTA TTG CAA GCA AGG GTT C-3'; p53β内引物, 正向: 5'-ATG GAG GAG CCG CAGTCA GAT-3', 反向: 5'-TTT GAA AGC TGG TCT GGT CCT GA-3'; Δ133p53外引物, 正向: 5'-CTG AGG TGT AGA CGC CAA CTC TCT CTA G-3', 反向: 5'-AGT CAG TCT GAG TCA GGC CCT TCT GTC-3'; Δ133p53内引物, 正向: 5'-GCT AGT GGG TTG CAG GAG GTG CTT ACA C-3', 反向: 5'-CTC ACG CCC ACG GAT CTG A-3'. PCR扩增产物进行琼脂糖凝胶电泳后, 将凝胶放入BioSpectrum AC凝胶成像系统扫描并拍照, 并对电泳结果进行判定. 总RNA提取试剂盒、cDNA合成试剂盒、PCR扩增试剂盒、引物购自Sangon上海生工, BIO-RAD MyCyder PCR仪购自美国伯乐公司, BioSpectrum AC凝胶成像系统购自美国UVP公司.
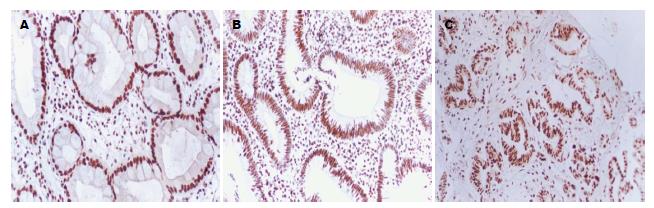
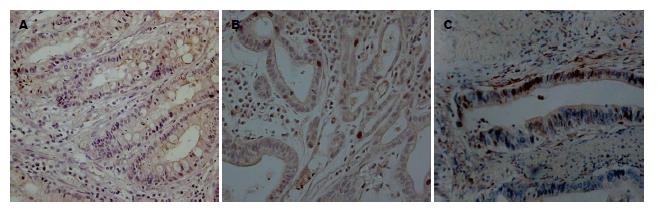
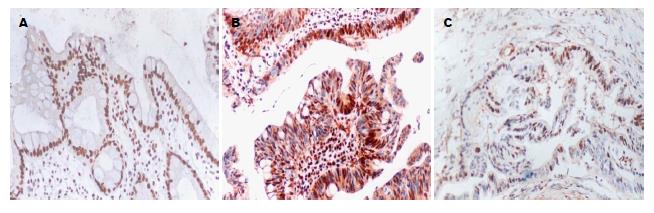
采用免疫组织化学PV-9000两步法检测胃癌、慢性萎缩性胃炎及正常胃黏膜组织中PTEN、Bax及p21waf1/cip1的表达情况: 标本经40 g/L甲醛固定, 石蜡包埋, 常规HE染色, 病理确诊, 免疫组织化学步骤按说明书进行. 每张切片随机选择5个视野, 共计数100个细胞, 分别计算3种抗体的阳性细胞百分率. 由两位以上病理医生对免疫组织化学染色进行评价, 分为两级, 阴性; 无染色或染色阳性细胞数占总细胞数≤10%, 阳性; 染色阳性细胞数占总细胞数>10%. 鼠抗人PTEN、Bax和p21waf1/cip1单克隆抗体均购自北京中杉金桥, 以PBS缓冲液代替一抗作阴性对照.
统计学处理 采用SPSS16.0统计软件进行处理, 计数资料采用χ2检验, 数据的相关性采用Spearman秩相关分析, P<0.05表示差异有统计学意义.
p53β在30例胃癌组织中有8例表达, 占26.7%, 在30例慢性萎缩性胃炎中有9例表达, 占33.3%, 在30例正常胃组织中有21例表达, 占70.0%, 胃癌组织p53β的表达明显低于正常胃组织, 差异有统计学意义(P<0.01). Δ133p53在30例胃癌组织中有21例表达, 占70.0%, 在30例慢性萎缩性胃炎中有15例表达, 占50.0%, 在30例正常胃组织中有7例表达, 占23.3%, 胃癌组织Δ133p53的表达明显高于正常胃组织, 差异有统计学意义(P<0.01)(表1, 图1).
| 分组 | + | - | p53β阳性率(%) | χ2 | P值 | + | - | △133p53阳性率(%) | χ2 | P值 |
| 胃癌 | 8 | 22 | 26.7 | 11.38 | 0.001 | 21 | 9 | 70.0 | 13.13 | 0.000 |
| 慢性萎缩性胃炎 | 9 | 21 | 33.3 | 15 | 15 | 50.0 | ||||
| 正常胃黏膜组织 | 21 | 9 | 70.0 | 7 | 23 | 23.3 |
PTEN在30例胃癌组织中有16例表达, 占53.3%, 在30例慢性萎缩性胃炎中有23例表达, 占76.7%, 在30例正常胃组织中有26例表达, 占86.7%, 胃癌组织PTEN的表达明显低于正常胃组织, 差异有统计学意义(P<0.01). Bax在30例胃癌组织中有11例表达, 占36.7%, 在30例慢性萎缩性胃炎中有22例表达, 占73.3%, 在30例正常胃组织中有25例表达, 占83.3%, 胃癌组织Bax的表达明显低于正常胃组织, 差异有统计学意义(P<0.05). p21waf1/cip1在30例胃癌组织中有14例表达, 占46.7%, 在30例慢性萎缩性胃炎中有15例表达, 占50.0%, 在30例正常胃组织中有26例表达, 占86.7%, 胃癌组织p21waf1/cip1的表达明显低于正常胃组织, 差异有统计学意义(P<0.05)(表2, 图2-4).
| 分组 | PTEN阳性率(%) | χ2 | P值 | Bax阳性率(%) | χ2 | P值 | p21waf1/cip1阳性率(%) | χ2 | P值 |
| 胃癌 | 53.3 | 7.937 | 0.005 | 36.7 | 15.808 | 0.000 | 46.7 | 10.800 | 0.001 |
| 慢性萎缩性胃炎 | 76.7 | 73.3 | 50.0 | ||||||
| 正常胃黏膜组织 | 86.7 | 83.3 | 86.7 |
Spearman秩相关分析显示, p53β和PTEN、Bax、p21waf1/cip1在胃癌中表达均呈正相关关系(r = 0.413, P = 0.023、r = 0.480, P = 0.007、r = 0.494, P = 0.006); Δ133p53和PTEN、Bax、p21waf1/cip1在胃癌中表达均呈负相关关系(r = -0.467, P = 0.009、r = -0.408, P = 0.025、r = -0.554, P = 0.001)(表3, 4).
| p53β | n | PTEN | r | P值 | Bax | r | P值 | p21waf1/cip1 | r | P值 | |||
| + | - | + | - | + | - | ||||||||
| + | 8 | 7 | 1 | 0.413 | 0.023 | 6 | 2 | 0.480 | 0.007 | 7 | 1 | 0.494 | 0.006 |
| - | 22 | 9 | 13 | 5 | 17 | 7 | 15 | ||||||
| Δ133p53 | n | PTEN | r | P值 | Bax | r | P值 | p21waf1/cip1 | r | P值 | |||
| + | - | + | - | + | - | ||||||||
| + | 21 | 8 | 13 | -0.467 | 0.009 | 5 | 16 | -0.408 | 0.025 | 6 | 15 | -0.554 | 0.001 |
| - | 9 | 8 | 1 | 6 | 3 | 8 | 1 | ||||||
p53基因是到目前为止在人类肿瘤的成因中占有重要作用的基因之一, p53在调节细胞的生长发育周期、DNA的损伤后修复、细胞的凋亡死亡等各个方面起着至关重要的作用[2-4]. p53剪接异构体是指p53 mRNA前体通过选择不同的剪接位点组合产生不同的mRNA剪接变异体, 进而表达多种具有不同生物学功能的蛋白质[5]. 目前已发现p53至少存在12种不同的剪接异构体[6,7]. p53剪接异构体能够在人类多种不同类型的肿瘤组织中表达, 他的表达可能和很多肿瘤的发生、发展密切相关[8-12]. 近年来有关p53剪接异构体和人类肿瘤关系的研究不断增多, 但是关于各个异构体的生物学功能、异构体之间的联系以及他们与野生型p53之间的作用机制目前尚不完全清楚. 孙华银等[13]应用p53缺失型1299细胞和Δ133p53 1299细胞为模型, 发现Δ133p53在内质网应激条件下, 促进了内质网应激诱导的细胞凋亡, 提示Δ133p53保留了p53促进细胞凋亡的功能. 多项研究发现, 肿瘤组织中p53β经常表达缺失, 而Δ133p53常过表达, 二者在肿瘤的发生发展中起了重要作用[14-16]. Hofstetter等[17]研究证明Δ133p53可以作为发生p53突变的进展期卵巢癌患者的一项独立预后因子. 近期研究还显示Δ133p53α能够刺激肿瘤的血管形成和进一步发展[12]. 研究发现, p53β在肾癌组织中过表达, 且p53β mRNA水平与肿瘤的分期密切相关[18]. 另外, p53β的表达水平还与卵巢癌的分化程度相关, 其表达预示着更差的无瘤生存[19]. 已经有报道证实, 在头颈部鳞癌中存在着频繁的p53β缺失[20]. Anensen等[21]的研究结果表明p53β是p53肿瘤抑制活性的调节因子, 能够增强p53的转录活性, 进一步转录激活某些凋亡基因, 以此来调节细胞命运的转归. 本研究发现, 在胃癌组织中Δ133p53 mRNA 水平较正常胃黏膜组织明显升高, 并在正常胃组织、萎缩性胃炎、胃癌3组中呈上升趋势, 而p53β mRNA水平的变化却完全相反, 这表明p53β和Δ133p53在胃癌的发生、发展中可能发挥了重要作用.
贾海江等[22]研究证实, PTEN蛋白的表达与胃癌浸润深度、有无淋巴结转移相关, 且阳性表达患者的术后5年生存率高于阴性者. 有研究发现, 在p53发生突变的肿瘤中, PTEN的表达与患者的生存期相关[23]. Lin等[24]研究发现p53突变对神经胶质瘤细胞增殖的调节作用是通过糖原合成酶激酶-3/PTEN信号通路来完成的. 古吉敏等[25]利用免疫组织化学法证实胃癌中p53的表达较胃炎组织明显升高, 而PTEN表达下降, 并提示突变型p53蛋白表达升高可能阻碍PTEN蛋白的表达. 欧阳艳红研究[26]发现子宫内膜癌和正常子宫内膜的PTEN蛋白表达缺失率和p53蛋白阳性表达率均有显著性差异. 但孙晓春[27]报道p53和PTEN在胃癌中的表达无明显相关性. Bax基因是近年来新发现的一种凋亡促进基因. 吴军等[28]利用免疫组织化学法检测100例胃癌和20例胃炎组织中的Bax表达, 发现胃癌组的Bax阳性表达率明显低于胃炎组. 朱亚杰等[29]研究证实, p21waf1/cip1在胃癌旁组织中的表达明显高于胃癌组织, 且随着肿瘤TNM分期的增高有表达降低的趋势. 黄荣等[30]通过检测胃癌组织中p53和p21waf1/cip1蛋白的表达情况, 发现p53蛋白高表达而p21waf1/cip1呈低表达, 且两者的表达呈负相关. Bourdon等[14]研究表明, p53β优先同Bax和p21waf1/cip1启动子结合, 而不是MDM2启动子, p53β能够通过Bax启动子干涉p53的转录活性. Marcel等[4]通过荧光素酶实验研究结果表明, 共转染Δ133p53和FLp53异构体之后, 他们通过作用于p21waf1/cip1和Bax启动子, 抑制了p53的转录表达. 以上研究表明了p53基因的生物学功能与PTEN、Bax、p21waf1/cip1有密切的相关性, 但以研究突变型p53为主. 本研究证实, 胃癌组织中PTEN、Bax及p21waf1/cip1基因的表达均明显低于正常胃组织, p53β和PTEN、Bax、p21waf1/cip1在胃癌中表达均呈正相关关系, 而Δ133p53和PTEN、Bax、p21waf1/cip1在胃癌中表达均呈负相关关系, 提示可能正是p53异构体的这种差异性表达, 通过下调Bax、p21waf1/cip1及PTEN等下游基因的生物学活性, 从而抑制了p53的活性, 并能参与调节细胞的某些生命过程, 对胃癌的发生发展起了重要的作用.
p53基因是迄今为止与人类肿瘤相关性最高的基因, 被认为一种抑癌基因, 但研究表明中国胃癌p53的突变率仅为30.6%提示部分胃癌的发生并没有伴随着p53的高突变率.
陈国忠, 主任医师, 广西中医学院第一附属医院消化内科
近几年来研究发现, 不同的p53剪接异构体作为一种转录因子可以调节p53的转录活性, 进而引发一系列的生物学反应, 对肿瘤的发生、发展发挥重要作用. 探讨p53异构体对野生型p53基因转录的影响以及对p53下游效应基因的影响, 都有可能发现胃癌发生的新机制.
多项研究发现, 肿瘤组织中p53β经常表达缺失, 而Δ133p53常过表达, 二者在肿瘤的发生发展中起了重要作用, Hofstetter等研究证明Δ133p53可以作为发生p53突变的进展期卵巢癌患者的一项独立预后因子. 近期研究还显示Δ133p53α能够刺激肿瘤的血管形成和进一步发展.
不同的p53剪接异构体作为一种转录因子可以调节p53的转录活性, 进而引发一系列的生物学反应, 对肿瘤的发生、发展发挥重要作用. 探讨p53异构体对野生型p53基因转录的影响以及对p53下游效应基因的影响, 都有可能发现胃癌发生的新机制.
本研究通过检测胃癌、萎缩性胃炎、正常胃组织中的p53异构体p53β、Δ133p53和同源丢失性磷酸酶张力蛋白PTEN、Bax、p21waf1/cip1基因的表达情况, 探讨p53异构体在胃癌发生、发展中的作用及他们之间的相互关系, 为研究胃癌的发生机制进一步提供理论依据.
本文有一定的科学意义和临床应用价值, 课题设计合理, 结论可信, 有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 2. | Ghosh A, Stewart D, Matlashewski G. Regulation of human p53 activity and cell localization by alternative splicing. Mol Cell Biol. 2004;24:7987-7997. [PubMed] |
| 3. | Hainaut P, Wiman KG. 30 years and a long way into p53 research. Lancet Oncol. 2009;10:913-919. [PubMed] [DOI] |
| 4. | Marcel V, Hainaut P. p53 isoforms - a conspiracy to kidnap p53 tumor suppressor activity? Cell Mol Life Sci. 2009;66:391-406. [PubMed] [DOI] |
| 5. | Marcel V, Dichtel-Danjoy ML, Sagne C, Hafsi H, Ma D, Ortiz-Cuaran S, Olivier M, Hall J, Mollereau B, Hainaut P. Biological functions of p53 isoforms through evolution: lessons from animal and cellular models. Cell Death Differ. 2011;18:1815-1824. [PubMed] [DOI] |
| 6. | Khoury MP, Bourdon JC. The isoforms of the p53 protein. Cold Spring Harb Perspect Biol. 2010;2:a000927. [PubMed] [DOI] |
| 7. | Marcel V, Perrier S, Aoubala M, Ageorges S, Groves MJ, Diot A, Fernandes K, Tauro S, Bourdon JC. Δ160p53 is a novel N-terminal p53 isoform encoded by Δ133p53 transcript. FEBS Lett. 2010;584:4463-4468. [PubMed] [DOI] |
| 8. | van den Berg L, Segun AD, Mersch S, Blasberg N, Grinstein E, Wai D, Anlauf M, Gabbert HE, Mahotka C, Heikaus S. Regulation of p53 isoform expression in renal cell carcinoma. Front Biosci (Elite Ed). 2010;2:1042-1053. [PubMed] |
| 9. | Wei J, Zaika E, Zaika A. p53 Family: Role of Protein Isoforms in Human Cancer. J Nucleic Acids. 2012;2012:687359. [PubMed] [DOI] |
| 10. | Bourdon JC. p53 and its isoforms in cancer. Br J Cancer. 2007;97:277-282. [DOI] |
| 11. | Chambers SK, Martinez JD. The significance of p53 isoform expression in serous ovarian cancer. Future Oncol. 2012;8:683-686. [PubMed] [DOI] |
| 12. | Bernard H, Garmy-Susini B, Ainaoui N, Van Den Berghe L, Peurichard A, Javerzat S, Bikfalvi A, Lane DP, Bourdon JC, Prats AC. The p53 isoform, Δ133p53α, stimulates angiogenesis and tumour progression. Oncogene. 2013;32:2150-2160. [PubMed] [DOI] |
| 13. | 孙 华银, 任 锋, 刘 凯, 江 瑛, 石 英, 李 莉, 刘 秀红, 娄 金丽, 段 钟平, 陈 德喜. Δ133p53异构体在内质网应激诱导自噬促进细胞凋亡的机制研究. 北京医学. 2011;33:953-955. |
| 14. | Bourdon JC, Fernandes K, Murray-Zmijewski F, Liu G, Diot A, Xirodimas DP, Saville MK, Lane DP. p53 isoforms can regulate p53 transcriptional activity. Genes Dev. 2005;19:2122-2137. [PubMed] |
| 15. | Avery-Kiejda KA, Zhang XD, Adams LJ, Scott RJ, Vojtesek B, Lane DP, Hersey P. Small molecular weight variants of p53 are expressed in human melanoma cells and are induced by the DNA-damaging agent cisplatin. Clin Cancer Res. 2008;14:1659-1668. [PubMed] [DOI] |
| 16. | Candeias MM, Powell DJ, Roubalova E, Apcher S, Bourougaa K, Vojtesek B, Bruzzoni-Giovanelli H, Fåhraeus R. Expression of p53 and p53/47 are controlled by alternative mechanisms of messenger RNA translation initiation. Oncogene. 2006;25:6936-6947. [PubMed] |
| 17. | Hofstetter G, Berger A, Schuster E, Wolf A, Hager G, Vergote I, Cadron I, Sehouli J, Braicu EI, Mahner S. Δ133p53 is an independent prognostic marker in p53 mutant advanced serous ovarian cancer. Br J Cancer. 2011;105:1593-1599. [PubMed] [DOI] |
| 18. | Song W, Huo SW, Lü JJ, Liu Z, Fang XL, Jin XB, Yuan MZ. Expression of p53 isoforms in renal cell carcinoma. Chin Med J (Engl). 2009;122:921-926. [PubMed] |
| 19. | Hofstetter G, Berger A, Fiegl H, Slade N, Zorić A, Holzer B, Schuster E, Mobus VJ, Reimer D, Daxenbichler G. Alternative splicing of p53 and p73: the novel p53 splice variant p53delta is an independent prognostic marker in ovarian cancer. Oncogene. 2010;29:1997-2004. [PubMed] [DOI] |
| 20. | Boldrup L, Bourdon JC, Coates PJ, Sjöström B, Nylander K. Expression of p53 isoforms in squamous cell carcinoma of the head and neck. Eur J Cancer. 2007;43:617-623. [PubMed] |
| 21. | Anensen N, Oyan AM, Bourdon JC, Kalland KH, Bruserud O, Gjertsen BT. A distinct p53 protein isoform signature reflects the onset of induction chemotherapy for acute myeloid leukemia. Clin Cancer Res. 2006;12:3985-3992. [PubMed] |
| 23. | Huang X, Zhang Y, Tang Y, Butler N, Kim J, Guessous F, Schiff D, Mandell J, Abounader R. A Novel PTEN/Mutant p53/c-Myc/Bcl-XL Axis Mediates Context-Dependent Oncogenic Effects of PTEN with Implications for Cancer Prognosis and Therapy. Neoplasia. 2013;15:952-965. [PubMed] |
| 24. | Lin C, Liang Y, Zhu H, Zhang J, Zhong X. R280T mutation of p53 gene promotes proliferation of human glioma cells through GSK-3β/PTEN pathway. Neurosci Lett. 2012;529:60-65. [PubMed] [DOI] |
| 30. | 黄 荣, 张 建兵. 小鼠双倍微体基因、P53及P21在胃癌组织中的表达及临床意义. 南通大学学报(医学版). 2010;30:177-179. |