修回日期: 2013-08-04
接受日期: 2013-08-13
在线出版日期: 2013-09-18
目的: 探讨Toll样受体9(Toll-like receptor 9, TLR9)在急性胰腺炎发病机制中的作用.
方法: 不同浓度脂多糖(lipopolysaccharide, LPS)(0、1、10、100 mg/L)刺激AR42J细胞后, RT-PCR法与Western blot法分别检测TLR9、核因子-κB(nuclear factor-κB, NF-κB)P65 mRNA和蛋白质表达的变化, 并分析TLR9、P65的相关性; ELISA法检测培养上清液白介素-1β(interleukin-1β, IL-1β)、白介素-6(interleukin-6, IL-6)含量.
结果: 与空白对照组相比, LPS刺激后TLR9、P65 mRNA与蛋白质表达升高, 呈浓度依赖性, 各组间有显著性差异(mRNA: F = 21.594, F = 24.449; 蛋白质: F = 23.193, F = 24.891, 均P<0.01), 相关性分析: r = 0.942, r = 0.900, 均P = 0.000, TLR9、P65呈正相关. 上清液IL-1β、IL-6含量随LPS浓度增加而上升, 组间差异有统计学意义(F = 45.459, F = 62.493, 均P<0.01).
结论: LPS刺激AR42J细胞诱导的炎症效应中, TLR9表达上调, 可能通过激活NF-κB, 从而促进炎症因子合成与分泌, 参与急性胰腺炎发病机制.
核心提示: 脂多糖(lipopolysaccharide, LPS)刺激损伤AR42J细胞使其释放自身DNA等损伤相关性分子模式, 被Toll样受体9(Toll-like receptor 9, TLR9)模式识别而激活TLR9, 进而通过经典的Toll样受体炎症通路, 活化并上调核因子-κB(nuclear factor-κB, NF-κB), NF-κB进入细胞核调控并介导炎症因子表达上调, 从而放大炎症反应.
引文著录: 张露艺, 唐国都, 唐曦平, 梁志海, 詹媛, 李维维. TLR9在脂多糖诱导的急性胰腺炎体外细胞模型中的作用. 世界华人消化杂志 2013; 21(26): 2685-2689
Revised: August 4, 2013
Accepted: August 13, 2013
Published online: September 18, 2013
AIM: To explore the role of Toll-like receptor 9 (TLR9) in the pathogenesis of acute pancreatitis.
METHODS: After AR42J cells were stimulated with lipopolysaccharide at different concentrations (0, 1, 10, or 100 mg/L), the mRNA and protein expression of TLR9 and nuclear factor κB (NF-κB) p65 was determined by RT-PCR and Western blot, respectively. The contents of interleukin-1β (IL-1β) and IL-6 proteins in culture supernatants were determined by ELISA.
RESULTS: Lipopolysaccharide up-regulated TLR9 and P65 mRNA and protein expression in a dose-dependent manner (mRNA: F = 21.594, 24.449; protein: F = 23.193, 24.891, all P < 0.01). There was a positive correlation between the mRNA and protein expression of TLR9 and that of P65 (mRNA: r = 0.942, protein: r = 0.900, both P = 0.000). Lipopolysaccharide also increased the contents of IL-1β and IL-6 protein in a dose-dependent manner (F = 45.459, 62.493, both P < 0.01).
CONCLUSION: TLR9 may play a role in the pathogenesis of acute pancreatitis by up-regulating the expression of NF-κB.
- Citation: Zhang LY, Tang GD, Tang XP, Liang ZH, Zhan Y, Li WW. Role of TLR9 in pathogenesis of lipopolysaccharide-induced acute pancreatitis in an in vitro model. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2685-2689
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2685.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2685
急性胰腺炎(acute pancreatitis, AP)为临床常见疾病之一, 但其发病机制尚未完全清楚. 多项研究表明脂多糖(lipopolysaccharide, LPS)参与了AP发病机制. Toll样受体(Toll-like receptor, TLR)家族是天然免疫的门户, 在炎症、自身免疫、肿瘤发生发展等方面发挥重要作用[1-3], 日益成为研究的热点. 近年来研究发现, TLR9与TLR2、TLR4一样, 是与AP发病机制有密切关系的Toll样受体家族成员之一[4], 但其具体的作用机制尚未明了, 国内亦未见相关研究报道. 核因子-κB(nuclear factor-κB, NF-κB)是广泛表达于体内细胞的转录因子, 研究表明, 其在Toll样受体通路中发挥了细胞信号转导作用[5]. 本实验以具有正常大鼠胰腺腺泡细胞功能的AR42J细胞株为研究对象, LPS刺激造成AP体外模型[6,7], 初步探讨TLR9在AP中的作用机制.
大鼠胰腺腺泡细胞株AR42J购自美国典型培养物保藏中心(american type culture collection, ATCC); LPS粉末购自Sigma公司; TRIzol购自Omega公司; 逆转录试剂盒、RT-PCR Taq酶购自Fermenta公司; DNA Marker购自天根生化科技有限公司; 总蛋白提取试剂盒、BCA试剂盒购自碧云天公司; 小鼠抗大鼠Toll样受体9单克隆抗体购自Imgenex公司; 小鼠抗大鼠NF-κB P65单克隆抗体购自Santa Cruz公司; 辣根过氧化物酶HRP标记的小鼠抗大鼠β-actin多克隆抗体购自Proteintech公司; 大鼠TLR9、P65 PCR引物由上海生工公司合成; 白介素(interleukin, IL)-1β、IL-6 ELISA试剂盒购自武汉博士德生物工程有限公司.
1.2.1 细胞培养及药物干预: 用含20%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的F12K培养基在50 mL/L CO2、湿度饱和的37 ℃培养箱中培养, 隔天更换培养基1次, 用含0.25%EDTA胰蛋白酶消化, 1:3传代. 取经传代2次的对数生长期细胞, 以1×106细胞/孔接种于6孔培养板中, 培养24 h后换液, 分别再加入含不同浓度LPS(0、1、10、100 mg/L)的培养基, 在培养箱中继续孵育24 h, 收集细胞和培养上清液备用, 每组设3个复孔.
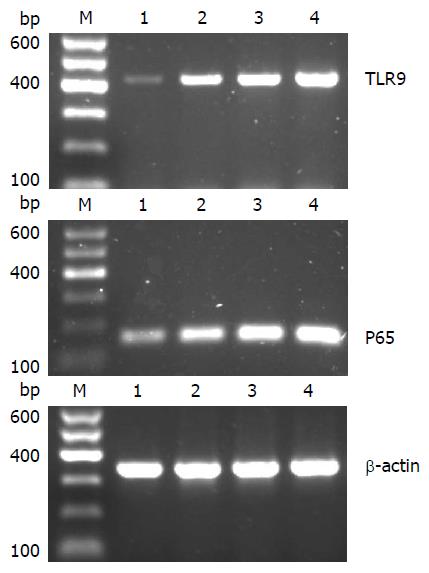
1.2.2 细胞总RNA提取及RT-PCR法检测TLR9、P65 mRNA表达的变化: 总RNA的提取参照Omega公司的TRIzol试剂说明书进行, 并采用分光光度计测RNA浓度及纯度. 取1 µg总RNA逆转录成cDNA备用, 流程参照逆转录试剂盒说明书. PCR反应条件: 95 ℃ 4 min, 95 ℃ 30 s, 60 ℃30 s, 72 ℃ 30 s, 35个循环, 72 ℃ 7 min. TLR9引物: 上游5'-GCTGTCAATGGCTCTCAGTTC-3', 下游5'-GGGAGGTAGTTGAGGTTCTGG-3', 产物长度425 bp; P65引物: 上游5'-ATCTGTTTCCCCTCATCTTTCC-3', 下游5'-TGCGTCTTAGTGGTATCTGTGC-3', 产物长度166 bp; 内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)引物: 上游5'-CATGGTCTACATGTTCCAGT-3', 下游5'-GGCTAAGCAGTTGGTGGTGC-3', 产物长度349 bp. 凝胶成像系统扫描计算条带灰度值.
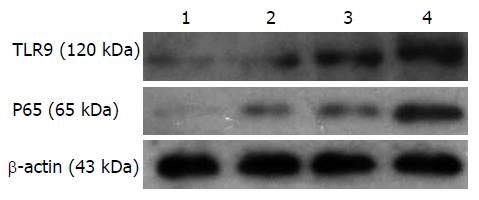
1.2.3 细胞总蛋白提取及Western blot法测TLR9、P65蛋白表达的变化: 试剂盒提取细胞总蛋白, BCA法测蛋白浓度. 各组取50 µg蛋白上样, 按流程电泳、转膜、牛奶封闭后一抗4 ℃孵育过夜, TLR9、P65、β-actin一抗工作浓度为(1:500、1:400、1:8000), 二抗(1:10000)室温孵育1 h, 化学发光胶片曝光显影. 图像分析仪行胶片扫描, 分析灰度值.
1.2.4 ELISA法检测细胞培养上清IL-1β、IL-6的含量: 收集干预24 h后各组细胞培养上清液, 离心去除杂质及细胞碎片, 按ELISA试剂盒说明书操作, 酶标仪450 nm波长测量A值. 以标准品浓度及其A值制作标准曲线, 据样品的A值计算相应指标的浓度.
统计学处理 应用SPSS16.0统计学软件, 多组比较行One-Way ANOVA方差分析并用SNK(student-newman-keuls, SNK)法进行两两比较, 数据以mean±SD表示, TLR9与P65相关性用Pearson相关性分析, P<0.05为差异有统计学意义.
RT-PCR结果如图1、表1所示, 与空白对照组相比, 加入LPS刺激后TLR9、P65 mRNA表达呈浓度依赖性增加, 两者表达量分别为: 0.06±0.05 vs 0.31±0.03, 0.55±0.15, 0.84±0.16, 差异具有统计学意义(F = 21.594, P<0.01); 0.38±0.03 vs 0.58±0.11, 0.79±0.15, 1.06±0.38, 差异具有统计学意义(F = 24.449, P<0.01); TLR9与P65 mRNA表达量的Pearson相关分析结果: r = 0.942, P<0.01, 提示两者呈正相关性.
Western blot结果如图2、表1所示, 与空白对照组相比, 加入LPS刺激后TLR9、P65蛋白质表达呈浓度依赖性增加, 两者表达量分别为: 0.20±0.16 vs 0.67±0.33, 1.24±0.31, 1.80±0.13, 差异具有统计学意义(F = 23.193, P<0.01); 0.07±0.05 vs 0.47±0.08, 0.85±0.22, 1.46±0.56, 差异有统计学意义(F = 24.891, P<0.01). TLR9与P65蛋白表达量的Pearson相关分析: r = 0.900, P<0.01, 提示呈正相关性.
如表2所示, 与空白对照组相比, 加入LPS刺激后上清液中IL-1β、IL-6含量随LPS浓度升高而增加, 两者浓度分别为: 6.84 pg/mL±2.01 pg/mL vs 22.21 pg/mL±2.85 pg/mL, 51.26 pg/mL±13.69 pg/mL, 75.95 pg/mL±7.04 pg/mL(F = 45.459, P<0.01); 24.59 pg/mL±15.74 pg/mL vs 74.07 pg/mL±10.77 pg/mL, 140.28 pg/mL±21.50 pg/mL, 178.85 pg/mL± 8.81 pg/mL, 差异具有统计学意义(F = 62.493, P<0.01).
Vaccaro等[6]报道, LPS刺激可直接造成胰腺腺泡细胞损伤, 使细胞形成胞质液泡、胞核改变及DNA断裂. 因此本实验以不同浓度LPS刺激AR42J细胞以构建急性胰腺炎体外细胞模型. Toll样受体家族属于Ⅰ型跨膜受体, 近年在急性胰腺炎中的作用日益引起关注, 其分为富含亮氨酸的胞外区、跨膜区和胞内高度保守的Toll/IL-1受体同源域(Toll/IL-1-receptor homologous region, TIR)结构, 胞外区模式识别病原相关分子模式(pathogen associated molecular patterns, PAMPs)和损伤相关性模式分子(damage associated molecular patterns, DAMPs), 激活固有免疫, 调节获得性免疫. PAMPs即病原微生物及其产物中某些共有的、非特异性的、高度保守的分子模式, 包括细菌LPS、脂磷壁酸、细菌DNA、病毒RNA等. DAMPs是指细胞损伤时从细胞内释放到细胞外的一类物质, 包括高迁移率族蛋白B1(HMGBl)、S100蛋白、热休克蛋白、DNA等[8]. TLR9作为Toll样受体家族成员之一, 由Hemmi等[9]于2000年首次在小鼠中发现, 识别PAMPs和DAMPs, 在炎症、自身免疫、肿瘤等方面的发挥重要作用. TLR9位于细胞内体膜上, 特异性配体为含有非甲基化的胞嘧啶鸟嘌呤二核苷酸(cytosine phosphate-guanosine, CPG)的DNA片段CPG-DNA, 经内吞作用后结合并激活TLR9, 继而产生炎症效应[5]. 近年来研究发现, TLR9可识别自身DNA[10]. 本实验中, 不同浓度LPS刺激具有正常胰腺腺泡细胞功能的AR42J细胞后, AR42J细胞损伤释放自身DNA, 被TLR9模式识别而激活TLR9, 使TLR9 mRNA与蛋白质表达都随浓度升高而增强, 提示TLR9在AP的发生发展中发挥重要作用, 与Hoque等[11]的研究得出了相同的结论.
NF-κB是核转录因子蛋白家族, 是TLR家族介导的炎症通路的下游分子, 最常见的NF-κB二聚体为P65与P50组成[12]. 抑制蛋白-κB(inhibitor protein-κB, IκB)是NF-κB的抑制蛋白, 可被活化的IκB激酶(IκB kinase, IκK)降解. 本实验选择检测P65来衡量NF-κB的激活合成状态. 静息状态下NF-κB在胞质中与IκB结合, 应激时IκK激活, 降解IκB, 使NF-κB活化进入细胞核, 调控DNA的转录, 使细胞转录生成大量炎症因子, 参与炎症反应[13]. 其中IL-1β是重要的炎症介质, 能引起中性粒细胞、嗜碱性粒细胞释放颗粒物质, 促进B、T淋巴细胞分裂, 其浓度可评价AP的炎症严重程度及腺泡细胞的损伤程度; 而IL-6急性期炎症的重要细胞因子, 临床上常用血清IL-6浓度评价AP的严重程度[14,15]. 本实验结果显示NF-κB mRNA、蛋白质随LPS浓度升高而表达增强, 趋势与TLR9相同, 而同时培养上清液中促炎症因子IL-1β及IL-6也浓度依赖性升高,提示AP炎症程度随LPS浓度升高而逐渐增高. 经Pearson相关性分析示, 在mRNA及蛋白质水平, TLR9与NF-κB均有正相关关系, r值分别为0.942、0.9, 由此推测, TLR9可能通过NF-κB炎症通路在AP炎症效应发挥作用. 其可能的机制为: LPS刺激造成AR42J细胞损伤后, 细胞释放自身DNA等损伤相关分子, TLR9模式识别DNA分子而被激活, 导致其表达上调[11]. TLR9被激活后通过经典的Toll样受体炎症通路, 活化并上调NF-κB, NF-κB进入细胞核调控并介导炎症因子表达上调, 从而放大炎症反应[16].
总之, 本研究提示, TLR9在LPS诱导的急性胰腺炎体外细胞模型中可能发挥了重要作用, 其作用机制可能与其下游的经典炎症通路NF-κB通路关系密切, 这可能为急性胰腺炎的发病机制及临床治疗等研究提供实验基础.
肝Toll样受体是进化中比较保守的一个受体家族, 目前发现13个成员. TLRs能特异地识别病原相关的分子模式和损伤相关性模式分子, 是连接天然免疫和获得性免疫的桥梁. 近年来, TLRs信号转导的研究在急性胰腺炎中的作用受到越来越多的关注.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
本研究最先检测脂多糖(lipopolysaccharide, LPS)刺激具有正常胰腺腺泡细胞功能的AR42J后, 细胞内TLR9 mRNA、蛋白质的表达变化, 同时检测TLR9下游分子核因子-κB(nuclear factor-κB, NF-κB)的表达变化, 并且应用ELISA技术检测培养上清液中白介素(interleukin, IL)-1β、IL-6的浓度, 以探讨TLR9在急性胰腺炎炎症效应中的作用机制.
多项研究显示, 急性胰腺炎时TLR2、TRL4表达水平增强, 通过NF-κB炎症通路参与急性胰腺炎的发病机制, 而Toll样受体家族中, 是否还有其他成员参与该炎症反应, 作用机制如何, 少有相关报道.
Toll样受体被认为是哺乳动物唯一将胞外抗原识别信息向细胞内传递并引发炎症反应的关键跨膜蛋白. 研究认为TLR4可与革兰阴性细菌内毒素LPS结合, 活化NF-κB信号通路, 导致炎症因子瀑链式释放而产生急性胰腺炎的生物学效应. TLR9在急性胰腺炎的发病机制中是否也具有类似的作用, 目前尚鲜有报道.
本研究显示TLR9在急性胰腺炎的发病机制中发挥重要作用, 在往后的临床新药研究中, 可研发TLR9的阻断剂, 治疗急性胰腺炎时应用, 阻断TLR9在炎症中的作用, 减少下游炎症介质的释放从而达到治疗急性胰腺炎的目的.
病原相关分子模式: 病原微生物及其产物中某些共有的、非特异性的、高度保守的分子模式, 包括细菌LPS、脂磷壁酸、细菌DNA、病毒RNA等; 损伤相关性模式分子: 组织或细胞受到损伤、缺氧、应激等因素刺激后释放到细胞间隙或血液循环中的一类物质, 如高迁移率族蛋白B1、S100蛋白、热休克蛋白、自身DNA等.
本文具有一定的新颖性. 从分子、细胞学层面进行分析, 结果提供了充足且有意义的信息 具有一定指导意义.
编辑: 田滢 电编: 闫晋利
| 1. | Richez C, Blanco P, Rifkin I, Moreau JF, Schaeverbeke T. Role for toll-like receptors in autoimmune disease: The example of systemic lupus erythematosus. Joint Bone Spine. 2011;78:124-130. [PubMed] [DOI] |
| 2. | Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat Immunol. 2010;11:373-384. [PubMed] [DOI] |
| 3. | Hirsch I, Caux C, Hasan U, Bendriss-Vermare N, Olive D. Impaired Toll-like receptor 7 and 9 signaling: from chronic viral infections to cancer. Trends Immunol. 2010;31:391-397. [PubMed] [DOI] |
| 4. | Vaz J, Akbarshahi H, Andersson R. Controversial role of toll-like receptors in acute pancreatitis. World J Gastroenterol. 2013;19:616-630. [PubMed] [DOI] |
| 5. | Takeda K, Akira S. Toll-like receptors in innate immunity. International Immunology. 2005;17:1-14. [DOI] |
| 6. | Vaccaro MI, Calvo EL, Suburo AM, Sordelli DO, Lanosa G, Iovanna JL. Lipopolysaccharide directly affects pancreatic acinar cells: implications on acute pancreatitis pathophysiology. Dig Dis Sci. 2000;45:915-926. [PubMed] |
| 7. | Jaworek J, Jachimczak B, Bonior J, Kot M, Tomaszewska R, Karczewska E, Stachura J, Pawlik W, Konturek SJ. Protective role of endogenous nitric oxide (NO) in lipopolysaccharide--induced pancreatic damage (a new experimental model of acute pancreatitis). J Physiol Pharmacol. 2000;51:85-102. [PubMed] |
| 8. | Nakamura T, Ito T, Igarashi H, Uchida M, Hijioka M, Oono T, Fujimori N, Niina Y, Suzuki K, Jensen RT. Cytosolic double-stranded DNA as a damage-associated molecular pattern induces the inflammatory response in rat pancreatic stellate cells: a plausible mechanism for tissue injury-associated pancreatitis. Int J Inflam. 2012;2012:504128. [PubMed] [DOI] |
| 9. | Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H, Matsumoto M, Hoshino K, Wagner H, Takeda K. A Toll-like receptor recognizes bacterial DNA. Nature. 2000;408:740-745. [PubMed] [DOI] |
| 10. | Holm CK, Paludan SR, Fitzgerald KA. DNA recognition in immunity and disease. Curr Opin Immunol. 2013;25:13-18. [PubMed] [DOI] |
| 11. | Hoque R, Sohail M, Malik A, Sarwar S, Luo Y, Shah A, Barrat F, Flavell R, Gorelick F, Husain S. TLR9 and the NLRP3 inflammasome link acinar cell death with inflammation in acute pancreatitis. Gastroenterology. 2011;141:358-369. [PubMed] [DOI] |
| 13. | Lawrence T. The nuclear factor NF-kappaB pathway in inflammation. Cold Spring Harb Perspect Biol. 2009;1:a001651. [PubMed] [DOI] |
| 14. | Kylänpää ML, Repo H, Puolakkainen PA. Inflammation and immunosuppression in severe acute pancreatitis. World J Gastroenterol. 2010;16:2867-2872. [PubMed] |