修回日期: 2013-07-21
接受日期: 2013-08-13
在线出版日期: 2013-09-18
目的: 研究氯膦酸二钠脂质体(liposomal clodronate, LC)对重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠肠黏膜蛋白激酶B(protein kinase B, Akt)和丝裂原活化蛋白激酶1/2[mitogen-activated protein kinase, MAPK(ERK1/2)]活性的影响, 探讨LC治疗SAP肠黏膜损伤的保护作用.
方法: 利用薄膜法制备LC. SD大鼠48只, 随机分为3组: 对照组(C组)、SAP+空白脂质体治疗组(P组)、SAP+Clodronate脂质体治疗组(T组). P组和T组采用胰腺被膜下均匀注射5%牛磺胆酸钠制作SAP模型后, 分别经尾静脉注射空白脂质体和Clodronate脂质体, C组仅注射等量生理盐水. 制模后2、6 h分别取肠系膜上静脉血液, 检测各组大鼠血清中淀粉酶(amylase, AMS)的含量, 同时检测各组大鼠血清中白介素-6(interleukin-6, IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的含量, 观察各组肠黏膜的病理学变化及病理评分, 采用免疫组织化学方法检测肠黏膜巨噬细胞Akt和MAPK(ERK1/2)的表达情况.
结果: P组大鼠在制模后2、6 h的血清AMS水平较C组明显升高(P<0.01). 与P组比较, T大鼠各时相的血清AMS水平均显著降低(P<0.01). P组较C组2、6 h血清IL-6和TNF-α明显升高(P<0.01). T组各时相较P组血清IL-6和TNF-α显著降低(P<0.01). T组大鼠的肠黏膜病理变化均较P组明显减轻, 病理学评分明显降低(P<0.01). T组肠黏膜Akt和MAPK(ERK1/2)的表达较P组明显减少.
结论: 巨噬细胞在SAP大鼠肠黏膜损伤中起重要作用, LC可选择性清除巨噬细胞, 减少肠黏膜Akt、MAPK(ERK1/2)的表达, 对肠黏膜损伤有一定的保护作用.
核心提示: 本研究表明氯膦酸二钠脂质体(liposomal clodronate)能导致巨噬细胞选择性凋亡, 减少重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠血清中的炎性介质的产生和释放, 减轻肠黏膜损伤, 阻止了SAP多器官损伤的进一步发展. 为SAP和SAP并发的肠黏膜损伤提供了新的有价值的治疗策略. 同时蛋白激酶B(protein kinase B)和MAPK(ERK1/2)可作为SAP的新的治疗靶点, 为SAP的治疗提供新的前景.
引文著录: 陈吉祥, 刘彬, 党胜春, 陈敏, 姜德立, 王坤, 王平江, 张建新. 氯膦酸二钠脂质体对重症急性胰腺炎大鼠肠黏膜Akt、MAPK(ERK1/2)活性的影响. 世界华人消化杂志 2013; 21(26): 2633-2640
Revised: July 21, 2013
Accepted: August 13, 2013
Published online: September 18, 2013
AIM: To study the effect of liposomal clodronate on the expression of protein kinase B (Akt) and mitogen-activated protein kinase [MAPK (ERK1/2)] in the intestinal mucosa of rats with severe acute pancreatitis (SAP), and to investigate the mechanism behind the therapeutic effect of liposomal clodronate on SAP-associated intestinal mucosal injury.
METHODS: Liposomal clodronate was prepared by means of thin film. Forty-eight SD rats were randomly divided into a model control group (C), a liposome control group (P), and a liposomal clodronate group (T). SAP was induced in rats of groups P and T by injection of sodium taurocholate under the pancreatic capsule, while group C received equal volume of normal saline. Serum levels of interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α) and AMS were measured 2 and 6 h after SAP induction. Pathological alterations in the intestinal mucosa were observed.
RESULTS: Serum levels of AMS, IL-6 and TNF-α were significantly elevated in group P compared to group C (all P < 0.01). Compared with group P, serum levels of AMS, IL-6 and TNF-α were significantly decreased in group T (all P < 0.01). Pathological alterations (scores) in the intestinal mucosa were significantly attenuated in group T compared to group P. The expression of Akt and MAPK (ERK1/2) was significantly decreased in group T compared to group P.
CONCLUSION: Macrophages play an important role in the pathogenesis of intestinal mucosal injury in SAP. Macrophages can be depleted via phagocytosis of liposome encapsulated clodronate. Liposomal clodronate alleviates intestinal mucosal injury in SAP rats possibly by decreasing the expression of Akt and MAPK (ERK1/2).
- Citation: Chen JX, Liu B, Dang SC, Chen M, Jiang DL, Wang K, Wang PJ, Zhang JX. Liposomal clodronate reduces Akt and mitogen-activated protein kinase expression in the intestinal mucosa of rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2013; 21(26): 2633-2640
- URL: https://www.wjgnet.com/1009-3079/full/v21/i26/2633.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i26.2633
重症急性胰腺炎(severe acute pancreatitis, SAP)是普外科常见的急腹症之一, 病死率高. 炎性介质的过度释放引起全身炎症反应, 从而导致远处器官发生功能障碍, 受到广泛关注[1]. SAP常诱发肠黏膜损伤, 其机制尚未完全阐明. 目前的研究表明, 肠黏膜损伤是一个复杂的病理生理过程, 牵涉到很多因素, 如微循环障碍、缺血再灌注损伤、炎症介质的过度释放等[2,3]. 肠黏膜损伤后细菌易位和内毒素释放, 可以引起肠源性内毒素血症及继发感染, 导致全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官系统功能障碍综合征(multiple organ dysfunction syndrome, MODS), 是SAP的严重程度和死亡率的重要影响因素.
近年来的研究已经表明, 巨噬细胞在SAP的病程发展中发挥重要的作用, 其通过识别受体检测致病物质, 继而引发和调节炎症反应[4]. 激活的巨噬细胞可以大量分泌炎症细胞因子[如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白介素-1(interleukin-1, IL-1)], 导致SIRS, 诱导脂质过氧化反应, 损害细胞膜的结构, 造成胰腺和其他器官的损伤, 并最终导致MODS[5,6]. 目前大多认为肠黏膜屏障损伤后细菌/内毒素易位, 过度激活巨噬细胞释放一系列促炎介质和细胞因子(如TNF-α、IL-1β、IL-6、IL-12), 诱导细胞因子在全身循环出现第二个高峰. 这些过度释放的炎性介质和细胞因子会加重全身炎症反应, 并增加死亡率. 调节巨噬细胞功能, 已成为SAP治疗的主要方向.
氯膦酸二钠(clodronate)是一种人工合成的双磷酸酯, van Rooijen等[7]研究发现, 静脉注射含有氯膦酸二钠的脂质体可以选择性地清除体内巨噬细胞. 运用其这一特性, 可用于一些炎症疾病的治疗. 在本研究中, 将氯膦酸二钠脂质体(liposomal clodronate, LC)注入SAP大鼠体内, 观察其对肠黏膜损伤及蛋白激酶B(protein kinase B, Akt)、MAPK(ERK1/2)活性的影响, 讨论其对SAP大鼠肠黏膜损伤的保护效应.
SD大鼠(体质量350-400 g)由江苏大学动物中心提供; 氯膦酸二钠购自上海伟进生物科技有限公司; 牛磺胆酸钠购自美国Sigma公司; IL-6、TNF-α ELISA试剂盒购自美国Invitrogen公司; p-Akt、p-p44/42 MAPK(ERK1/2)试剂盒购自美国Cell Signaling公司.
1.2.1 LC的制备: 参照文献[8]制备脂质体的方法加以改进. 获得的4 mL LC悬液大约含有20 mg的氯膦酸二钠. 同法制备空白脂质体. 应用紫外分光光度法测定脂质体中氯膦酸二钠的浓度及包封率, 测定包封率约为6%.
1.2.2 动物分组及处理: 大鼠48只, 随机分为3组: 对照组(C组), SAP+空白脂质体组(P组), SAP+LC组(T组). 各组又分为术后2、6 h组, 每组8只. 大鼠术前12 h禁食, 自由饮水. 按体质量肌肉注射氯胺酮(2 mg/kg)进行麻醉. P组及T组麻醉后参照文献制作SAP模型[9]; C组予以开腹后胰腺包膜下均匀注射等量生理盐水. P组于造模后立即大鼠尾静脉注射空白脂质体(4 mL/kg); T组于造模后尾静脉注射LC(4 mL/kg); C组予以尾静脉注射生理盐水(4 mL/kg); 注射过程缓慢, 脂质体注射时予以常温下静置3 h, 注射前摇晃均匀. 2、6 h后处死动物.
1.2.3 标本测定: (1)血清淀粉酶(amylase, AMS)含量: 3组分别于制模后2、6 h肠系膜上静脉取血4 mL, 3000 r/min离心10 min, 取上层血清-20 ℃保存, 自动生化分析仪测定血清AMS含量; (2)血清IL-6和TNF-α含量测定: 取上述血清, 严格按照ELISA试剂盒说明测定2、6 h血清IL-6和TNF-α含量; (3)肠黏膜组织形态学观察: 2、6 h距末端回肠5 cm取回肠组织标本2 cm左右, 4%甲醛溶液固定, 修剪、脱脂、石蜡包埋和切片, 苏木精-伊红(HE)染色, 光镜下观察肠黏膜病理改变, 评分标准见文献[10]; (4)免疫组织化学检测肠黏膜Akt、MAPK(ERK1/2)的表达: 采用链霉素抗生物素蛋白过氧化酶(SP)免疫组织化学方法染色, 兔抗人P-Akt单克隆抗体和兔抗人P-p44/42 MAPK(ERK1/2)单克隆抗体购于Cell Signaling公司, 工作浓度为1:200. 操作过程按照试剂盒说明书进行.
统计学处理 采用SPSS16.0统计软件进行数据分析, 所有数据均用mean±SD表示, 采用ANOVA程序进行单因素方差分析, 方差不齐采用Kruskal-Wallis检验, 以P<0.05为差异具有统计学意义.
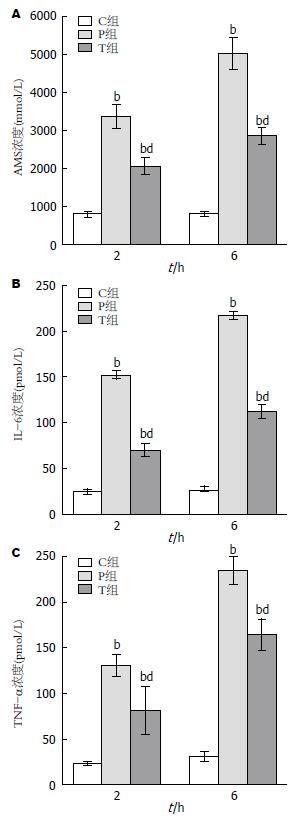
和C组比较, P组和T组血清AMS含量在2、6 h明显升高. T组各时相血清AMS含量较P组显著降低(P<0.01)(图1A).
SAP大鼠模型诱导成功后, P组2、6 h血清IL-6和TNF-α浓度较C组明显升高(P<0.01), 和P组比较, T组各时相血清IL-6和TNF-α浓度显著下降(P<0.01)(图1B, C).
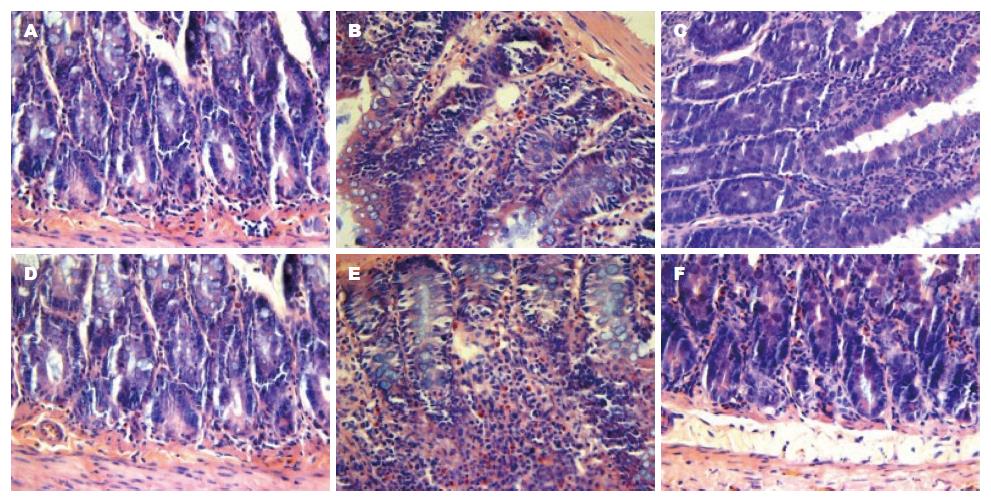
2.3.1 肠黏膜组织病理学检查: C组肠黏膜完整, 无炎性细胞浸润及出血现象. P组2 h肠黏膜轻度水肿伴炎性细胞浸润, 部分绒毛坏死脱落; 6 h组出现黏膜层及黏膜下层明显充血水肿, 大量炎性细胞浸润, 固有层绒毛脱落, 片状坏死. T组各时相肠黏膜损伤较P组明显减轻(图2).
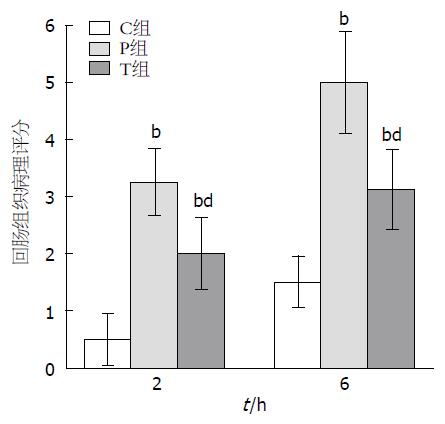
2.3.2 各组肠黏膜病理评分: 在P和T组与C组相比存在显著性差异(P<0.01). T组较P组明显好转(P<0.01)(图3).
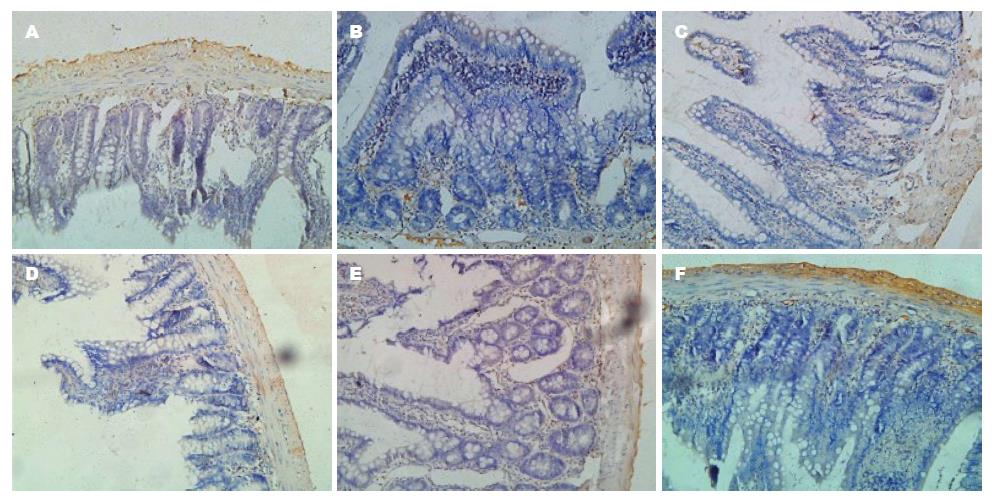
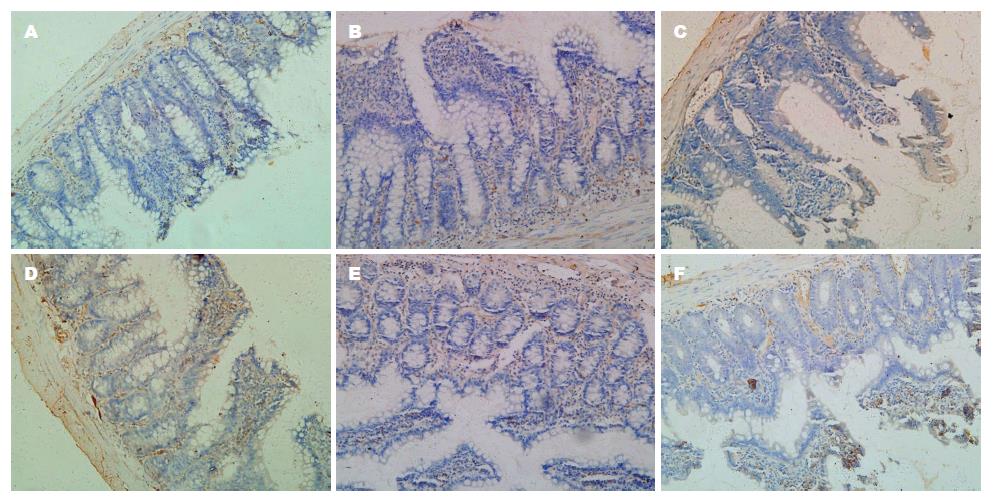
Akt的表达定位于细胞质, 呈棕黄色颗粒状, 与C组比较, P组和T组的Akt表达明显增多, T组较P组的表达明显减少. MAPK(ERK1/2)的表达主要定位于细胞质, 呈淡黄色颗粒状, P组和T组的MAPK(ERK1/2)表达较C组明显增多, 与P组比较, T组的表达明显减少(图4, 5).
SAP容易诱发SIRS和MODS, 其死亡率为15%-30%, 仍是临床上难以攻克的疾病之一[11]. 氧自由基和多种炎症介质的大量释放是SAP从胰腺局部的炎症向全身性炎症发展的主要因素[12]. SAP患者及动物模型血浆中, 存在大量炎症介质和细胞因子, 包括TNF-α、IL-1和IL-6等, 通过产生级联瀑布效应, 造成全身多个脏器的损伤[13]. 多项研究表明, SAP常并发肠黏膜损伤, 并且发生在1/3患者的病程早期, 在此阶段巨噬细胞被激活, 释放大量的炎性介质和细胞因子, 肠黏膜屏障功能被破坏, 通透性增加, 管腔细菌移位, 引起炎症反应, 最终导致MODS[14,15].
巨噬细胞的浸润和活化不但是SAP发生的始动因素, 而且是导致MODS的一个重要的病理生理过程[16,17]. 巨噬细胞来源的促炎细胞因子(IL-1、IL-6和TNF-α等)发挥了至关重要的作用, 他们促进炎症的扩散, 增强中性粒细胞弹性蛋白酶的活性, 产生自由基, 破坏内皮细胞, 引起内皮肿胀和循环淤滞. 炎性细胞因子和抗炎细胞因子的自稳失衡是SAP病程进展的关键因素[18-20]. 然而, 正常的肠黏膜储存着大量的巨噬细胞, 在SAP病程中, 其被大量激活, 通过以上机制诱发肠黏膜损伤. 通过抑制巨噬细胞的活化, 可在一定程度上减轻胰腺及其他组织、脏器的病理损害并改善预后.
氯膦酸二钠临床上常被用于治疗骨质疏松等疾病. 其主要机制是形成有毒的ATP类似物, 诱导破骨细胞凋亡, 从而减少破骨细胞对骨质的吸收[21]. 当注入体内的LC被巨噬细胞吞噬后, 导致巨噬细胞选择性凋亡[22]. 在体循环中, 游离的氯膦酸二钠有一个很短的半衰期, 不能渗透细胞, 也不会对巨噬细胞以外的细胞产生影响[23].
Akt, 又称蛋白激酶B是一种丝氨酸/苏氨酸激酶, 在巨噬细胞的增殖、分化中起重要作用. 细胞因子介导的Akt活化, 通常是通过磷酸肌醇3-激酶(phosphatidylinositide 3-kinase, PI-3K)途径实现的. PI-3K/Akt通路通过抑制凋亡蛋白的活性和炎性介质激活发挥抗细胞凋亡作用[24]. Akt的Ser473位点被磷酸肌醇依赖激酶1磷酸化, 激活PI-3K/Akt通路的核心蛋白Akt, 进而促进巨噬细胞增殖、分化[25,26]. MAPKs又称丝裂素活化的蛋白激酶, 是一类丝氨酸/苏氨酸蛋白激酶, 由ERK1/2、p38和c-Jun-N-终端激酶组成, 是连接细胞内和细胞外调节蛋白信号通路的重要组成部分, 负责将细胞外的刺激信号传递给细胞核[27]. 细胞外刺激信号通过对苏氨酸和酪氨酸双位点磷酸化而激活MAPKs[28]. MAPKs的家族成员ERK1/2和p38 MAPK活化后, 参与巨噬细胞的增殖, 促进炎性介质及细胞因子的产生, MAPK(ERK1/2)和Akt的活化是巨噬细胞中信号转导的一个标志, 检测活化的MAPK(ERK1/2)和Akt水平可反应炎症的程度[29-31]. Akt和MAPK(ERK1/2)在一些炎症反应中的机制也得到许多学者的关注. 有研究表明, 脂多糖诱导的腹腔巨噬细胞活化后, 通过其共同的抑制剂可阻断PI-3K/Akt和MAPK-ERK1/2信号通路, 能够下调Akt和MAPK(ERK1/2)的表达, 减少IL-1β和IL-6等细胞因子的产生, 减轻炎症反应及组织病理损害, 改善疾病预后[32]. 因此, 为了进一步确认LC减轻肠黏膜损伤的机制, 我们运用LC干预巨噬细胞前后, 采用免疫组织化学的方法, 观察SAP大鼠肠黏膜巨噬细胞Akt和MAPK(ERK1/2)的表达情况. 与C组相比, P组Akt和MAPK(ERK1/2)的表达增多, 提示Akt和MAPK(ERK1/2)在SAP大鼠发病过程中发挥着重要作用, 可能通过激活PI-3K/Akt和MAPK-ERK1/2信号通路, 上调Akt和MAPK(ERK1/2)的表达, 促进巨噬细胞增殖, 产生TNF-α、IL-6、IL-12等炎性细胞因子, 加重了SAP的发展. T组较P组Akt和MAPK(ERK1/2)的表达明显减少, 表明LC可能参与抑制PI-3K/Akt和MAPK-ERK1/2信号通路, 进而抑制Akt和MAPK(ERK1/2)的活化, 下调其表达, 减轻炎症反应.
本实验检测了SAP大鼠肠黏膜组织中Akt和MAPK(ERK1/2)的活性及AMS、IL-6、IL-12和TNF-α的水平变化, 反映了给予LC治疗前后, 肠黏膜损伤后Akt和MAPK(ERK1/2)的活性及AMS、IL-6、IL-12和TNF-α水平的变化. 结果显示, 给予LC治疗后, 血清IL-6、IL-12和TNF-α水平的明显下降. AMS含量明显降低. 胰腺及肠黏膜的病理损害显著减轻, 病理评分明显降低. 本研究表明LC能导致巨噬细胞选择性凋亡, 减少SAP大鼠血清中的炎性介质及细胞因子的产生和释放, 减轻肠黏膜炎症反应, 阻止了SAP多器官损伤的进一步发展, 从而改善SAP的预后. 为SAP和SAP并发的肠黏膜损伤提供了新的有价值的治疗策略. 同时Akt和MAPK(ERK1/2)可作为SAP的新的治疗靶点, 为SAP的治疗提供新的前景.
重症急性胰腺炎(severe acute pancreatitis, SAP)是普外科常见的急腹症之一, 发病机制复杂, 病死率高. 炎性介质的过度释放引起全身炎症反应, 从而导致远处器官发生功能障碍, 受到广泛关注. 有研究表明约1/3 SAP患者早期并发肠黏膜损伤, 目前尚缺乏有效的治疗手段, 巨噬细胞在其中发挥着重要作用, 其分泌的多种炎性介质及细胞因子促进了炎症反应的发生. 本文利用氯膦酸二钠脂质体(liposomal clodronate, LC), 抑制巨噬细胞功能, 减轻肠黏膜损伤, 为临床治疗SAP等提供理论依据.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
目前国内外治疗SAP大都以抗炎、抑制胰酶分泌为主. 本研究利用脂质体包裹氯膦酸二钠进入肠黏膜巨噬细胞内发挥作用, 诱导巨噬细胞凋亡, 阻断了Akt、MAPK的信号传导通路, 减少炎性介质的释放, 减轻胰腺炎症状, 在国内外的研究均不多见. 伴随着越来越多的脂质体药物面世, 该领域的研究受到广泛关注.
van Rooijen等报道, 经大鼠尾静脉注射LC, 巨噬细胞通过吞噬作用摄取脂质体, 其膦脂酶破坏脂质体的膦脂双分子层, 药物在细胞内释放从而诱导了巨噬细胞的凋亡, 减轻了炎症反应综合征.
本研究通过脂质体包裹特异性巨噬细胞清除剂氯膦酸二钠来抑制巨噬细胞功能, 阻断了Akt、MAPK的信号传导通路, 从巨噬细胞增殖、凋亡及巨噬细胞分泌自由基、炎性介质等方面入手研究, 为临床治疗SAP及多器官功能损伤等提供新的理论依据.
国外目前已有多种脂质体药物面世(如紫杉醇脂质体等), 其应用价值已经得到了业内人士的好评. 本研究从一个新的方面着手治疗SAP及并发肠黏膜损伤.
本文选题新颖, 研究方法科学, 内容详实, 结论客观, 写作规范, 可读性好. 为SAP及其肠黏膜损伤的治疗提供了实验依据和新的思路.
编辑: 田滢 电编: 闫晋利
| 1. | Singh VK, Wu BU, Bollen TL, Repas K, Maurer R, Mortele KJ, Banks PA. Early systemic inflammatory response syndrome is associated with severe acute pancreatitis. Clin Gastroenterol Hepatol. 2009;7:1247-1251. [PubMed] [DOI] |
| 2. | Rahman SH, Ammori BJ, Holmfield J, Larvin M, McMahon MJ. Intestinal hypoperfusion contributes to gut barrier failure in severe acute pancreatitis. J Gastrointest Surg. 2003;7:26-35; discussion 35-36. [PubMed] [DOI] |
| 3. | Xiping Z, Hua T, Hanqing C, Li C, Binyan Y, Jing M. Effects of Baicalin on inflammatory mediators and pancreatic acinar cell apoptosis in rats with sever acute pancreatitis. J Res Med Sci. 2009;14:19-27. [PubMed] |
| 4. | Akbarshahi H, Menzel M, Posaric Bauden M, Rosendahl A, Andersson R. Enrichment of murine CD68+ CCR2+ and CD68+ CD206+ lung macrophages in acute pancreatitis-associated acute lung injury. PLoS One. 2012;7:e42654. [PubMed] [DOI] |
| 5. | Gutierrez PT, Folch-Puy E, Bulbena O, Closa D. Oxidised lipids present in ascitic fluid interfere with the regulation of the macrophages during acute pancreatitis, promoting an exacerbation of the inflammatory response. Gut. 2008;57:642-648. [PubMed] [DOI] |
| 6. | Mikami Y, Takeda K, Shibuya K, Qiu-Feng H, Shimamura H, Yamauchi J, Egawa S, Sunamura M, Yagi H, Endo Y. Do peritoneal macrophages play an essential role in the progression of acute pancreatitis in rats? Pancreas. 2003;27:253-260. [PubMed] [DOI] |
| 7. | van Rooijen N, Sanders A, van den Berg TK. Apoptosis of macrophages induced by liposome-mediated intracellular delivery of clodronate and propamidine. J Immunol Methods. 1996;193:93-99. [PubMed] [DOI] |
| 8. | van Rooijen N, van Kesteren-Hendrikx E. "In vivo" depletion of macrophages by liposome-mediated "suicide". Methods Enzymol. 2003;373:3-16. [PubMed] [DOI] |
| 9. | Zhang JX, Dang SC, Qu JG, Wang XQ. Preventive effect of tetramethylpyrazine on intestinal mucosal injury in rats with acute necrotizing pancreatitis. World J Gastroenterol. 2006;12:6386-6390. [PubMed] |
| 10. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 11. | Merza M, Wetterholm E, Zhang S, Regner S, Thorlacius H. Inhibition of geranylgeranyltransferase attenuates neutrophil accumulation and tissue injury in severe acute pancreatitis. J Leukoc Biol. 2013;94:493-502. [PubMed] [DOI] |
| 12. | Lima PR, de Melo TS, Carvalho KM, de Oliveira ÍB, Arruda BR, de Castro Brito GA, Rao VS, Santos FA. 1,8-cineole (eucalyptol) ameliorates cerulein-induced acute pancreatitis via modulation of cytokines, oxidative stress and NF-κB activity in mice. Life Sci. 2013;92:1195-1201. [PubMed] [DOI] |
| 13. | Kimura Y, Hirota M, Okabe A, Inoue K, Kuwata K, Ohmuraya M, Ogawa M. Dynamic aspects of granulocyte activation in rat severe acute pancreatitis. Pancreas. 2003;27:127-132. [PubMed] [DOI] |
| 14. | Rychter JW, van Minnen LP, Verheem A, Timmerman HM, Rijkers GT, Schipper ME, Gooszen HG, Akkermans LM, Kroese AB. Pretreatment but not treatment with probiotics abolishes mouse intestinal barrier dysfunction in acute pancreatitis. Surgery. 2009;145:157-167. [PubMed] [DOI] |
| 15. | Wang G, Wen J, Xu L, Zhou S, Gong M, Wen P, Xiao X. Effect of enteral nutrition and ecoimmunonutrition on bacterial translocation and cytokine production in patients with severe acute pancreatitis. J Surg Res. 2013;183:592-597. [PubMed] [DOI] |
| 16. | Khomiak IV. [Ultrastructural peculiarities of mononuclear macrophages of the demarcation zone in an acute necrotic pancreatitis and elaborating of methods for the disease course prognosis and treatment]. Klin Khir. 2012;27-31. [PubMed] |
| 17. | Saeki K, Kanai T, Nakano M, Nakamura Y, Miyata N, Sujino T, Yamagishi Y, Ebinuma H, Takaishi H, Ono Y. CCL2-induced migration and SOCS3-mediated activation of macrophages are involved in cerulein-induced pancreatitis in mice. Gastroenterology. 2012;142:1010-1020. e9. [PubMed] [DOI] |
| 18. | Ukhanova IIu, Karaulov AV, Konoplia AI, Loktionov AL, Suniaĭkina OA. [Functional activity of peritoneal macrophages in acute destructive pancreatitis: evaluation, implication]. Klin Lab Diagn. 2011;42-44. [PubMed] |
| 19. | Shrivastava P, Bhatia M. Essential role of monocytes and macrophages in the progression of acute pancreatitis. World J Gastroenterol. 2010;16:3995-4002. [PubMed] [DOI] |
| 20. | Sailai Y, Yu X, Baiheti P, Tang H, Li Y, Xu M. Influence of nuclear factor kappaB activation on inflammatory mediators of alveolar macrophages in rats with acute necrotizing pancreatitis. J Investig Med. 2010;58:38-42. [PubMed] [DOI] |
| 21. | Russell RG, Rogers MJ. Bisphosphonates: from the laboratory to the clinic and back again. Bone. 1999;25:97-106. [PubMed] [DOI] |
| 22. | Rogers MJ, Gordon S, Benford HL, Coxon FP, Luckman SP, Monkkonen J, Frith JC. Cellular and molecular mechanisms of action of bisphosphonates. Cancer. 2000;88:2961-2978. [PubMed] [DOI] |
| 23. | Van Rooijen N, Sanders A. Liposome mediated depletion of macrophages: mechanism of action, preparation of liposomes and applications. J Immunol Methods. 1994;174:83-93. [PubMed] [DOI] |
| 24. | Song ZF, Chen DY, DU B, Ji XP. Poly (ADP-ribose) polymerase inhibitor reduces heart ischaemia/reperfusion injury via inflammation and Akt signalling in rats. Chin Med J (Engl). 2013;126:1913-1917. [PubMed] |
| 25. | Minhajuddin M, Bijli KM, Fazal F, Sassano A, Nakayama KI, Hay N, Platanias LC, Rahman A. Protein kinase C-delta and phosphatidylinositol 3-kinase/Akt activate mammalian target of rapamycin to modulate NF-kappaB activation and intercellular adhesion molecule-1 (ICAM-1) expression in endothelial cells. J Biol Chem. 2009;284:4052-4061. [PubMed] [DOI] |
| 26. | Marchbank T, Mahmood A, Playford RJ. Pancreatic secretory trypsin inhibitor causes autocrine-mediated migration and invasion in bladder cancer and phosphorylates the EGF receptor, Akt2 and Akt3, and ERK1 and ERK2. Am J Physiol Renal Physiol. 2013;305:F382-F389. [PubMed] [DOI] |
| 27. | Feng Z, Fei J, Wenjian X, Jiachen J, Beina J, Zhonghua C, Xiangyi Y, Shaoying W. Rhubarb attenuates the severity of acute necrotizing pancreatitis by inhibiting MAPKs in rats. Immunotherapy. 2012;4:1817-1821. [PubMed] [DOI] |
| 28. | Wei S, Huang Q, Li J, Liu Z, You H, Chen Y, Gong J. Taurine attenuates liver injury by downregulating phosphorylated p38 MAPK of Kupffer cells in rats with severe acute pancreatitis. Inflammation. 2012;35:690-701. [PubMed] [DOI] |
| 29. | Park HY, Han MH, Park C, Jin CY, Kim GY, Choi IW, Kim ND, Nam TJ, Kwon TK, Choi YH. Anti-inflammatory effects of fucoidan through inhibition of NF-κB, MAPK and Akt activation in lipopolysaccharide-induced BV2 microglia cells. Food Chem Toxicol. 2011;49:1745-1752. [PubMed] [DOI] |
| 30. | Zhu R, Huang YH, Tao Y, Wang SC, Sun Ch, Piao HL, Wang XQ, Du MR, Li DJ. Hyaluronan up-regulates growth and invasion of trophoblasts in an autocrine manner via PI3K/AKT and MAPK/ERK1/2 pathways in early human pregnancy. Placenta. 2013;34:784-791. [PubMed] [DOI] |
| 31. | Jang SE, Hyam SR, Han MJ, Kim SY, Lee BG, Kim DH. Lactobacillus brevis G-101 ameliorates colitis in mice by inhibiting NF-κB, MAPK and AKT pathways and by polarizing M1 macrophages to M2-like macrophages. J Appl Microbiol. 2013;115:888-896. [PubMed] [DOI] |
| 32. | Park SY, Park GY, Ko WS, Kim Y. Dichroa febrifuga Lour. inhibits the production of IL-1beta and IL-6 through blocking NF-kappaB, MAPK and Akt activation in macrophages. J Ethnopharmacol. 2009;125:246-251. [PubMed] [DOI] |