修回日期: 2013-07-22
接受日期: 2013-07-31
在线出版日期: 2013-08-28
目的: 探讨促肾上腺皮质激素释放因子(corticotrophin-releasing factor, CRF)对肠上皮细胞紧密连接相关蛋白的调节作用.
方法: 以CRF(20 ng/mL)刺激HT-29细胞24 h后再以脂多糖(lipopolysaccharides, LPS)(100 ng/mL)刺激24 h, 收集细胞, ELISA法检测细胞提取物中胞质附着蛋白(zonula occludins protein, ZO)-1、ZO-2、Occludin、cldn1、cldn2、cldn3和cldn4的表达. 再次将HT-29细胞以CRF 0、1、10、20 ng/mL的浓度刺激24 h和核因子κB(nuclear factor κB, NF-κB)抑制剂马来酸二乙酯(diethylmaleate, DEM)1 mmol/L预孵1 h后加CRF 20 ng/mL刺激24 h, 然后更换各组细胞液后继续再以LPS 100 ng/mL的浓度孵育24 h, 收集各组HT-29细胞, 提取蛋白, 免疫印迹法检测cldn2表达水平.
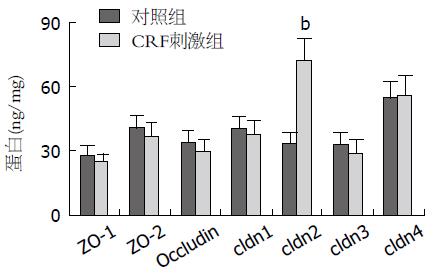
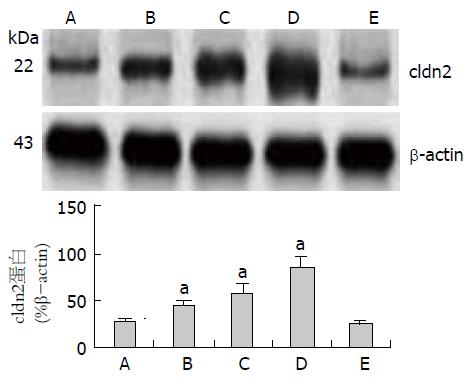
结果: ELISA检测结果显示以CRF刺激结肠上皮细胞24 h后再以LPS刺激后ZO-1、ZO-2、Occludin、cldn1和cldn3表达水平较单纯LPS刺激有轻度的下降, 但是cldn2的表达则较前明显升高(P<0.01). 免疫印迹法检测结果显示以LPS孵育前以CRF(1 ng/mL)刺激即可引起cldn2表达增高, 随后加大CRF刺激浓度, 分别以10和20 ng/mL刺激, 则cldn2的表达随着刺激浓度加大而逐渐增高(P<0.05), 呈现剂量依赖效应, 而以CRF(20 ng/mL)刺激同时加入NF-κB抑制剂DEM后再以LPS孵育HT-29细胞后, CRF则不能诱导cldn2表达增高(P>0.05).
结论: CRF对肠上皮细胞中的cldn2表达刺激呈剂量依赖效应, 并且CRF对肠上皮细胞的这种诱导作用可能与NF-κB 激活有关.
核心提示: 本实验从体外细胞实验证实了应激因子肾上腺皮质激素释放因子(corticotrophin-releasing factor, CRF)可以刺激肠上皮细胞中紧密连接相关蛋白cldn2表达并且发现CRF对肠上皮细胞的这种诱导作用与核因子κB(nuclear factor κB)激活有关, 为体内进一步研究应激因素对肠道炎症的作用奠定了基础.
引文著录: 杨丽, 郑鹏远, 刘志强. 促肾上腺皮质激素释放因子对肠上皮细胞紧密连接相关蛋白的调节. 世界华人消化杂志 2013; 21(24): 2424-2428
Revised: July 22, 2013
Accepted: July 31, 2013
Published online: August 28, 2013
AIM: To investigate the effect of corticotropin-releasing factor on the expression of tight junction proteins in intestinal epithelial cells.
METHODS: HT-29 cells pretreated with corticotrophin-releasing factor (CRF) at a concentration of 20 ng/mL for 24 h were stimulated with LPS at a concentration of 100 ng/mL for 24 h, and cellular extracts were harvested to measure the expression of ZO-1, ZO-2, Occludin, cldn1, cldn2, cldn3 and cldn4 by enzyme-linked immunosorbent assay (ELISA). Subsequently, groups of HT-29 cells were stimulated with CRF at a concentration of 0, 1, 10 or 20 ng/mL for 24 h, or pretreated with nuclear factor κB (NF-κB) inhibitor diethylmaleate (DEM, 1 mmol/L) and then incubated with CRF at a concentration of 20 ng/mL for 24 h. Each group was then stimulated with LPS at a concentration of 100 ng/mL for 24 h, and the expression of cldn2 protein was detected by Western blot.
RESULTS: The expression of ZO-1, ZO-2, Occludin, cldn1, cldn3 and cldn4 was changed slightly (all P > 0.05) while the expression of cldn2 was markedly increased (P < 0.05) in HT-29 cells after exposure to both LPS and CRF. CRF significantly increased the expression of cldn2 in HT-29 cells in a dose-dependent manner, while NF-κB inhibitor DEM could block this effect.
CONCLUSION: CRF significantly increases the expression of cldn2 in HT-29 cells in a dose-dependent manner, and NF-κB activation is involved in CRF-induced cldn2 expression. CRF has no effect on the expression of ZO-1, ZO-2, Occludin, cldn1, cldn3 and cldn4 in HT-29 cells.
- Citation: Yang L, Zheng PY, Liu ZQ. Effect of corticotropin-releasing factor on expression of tight junction proteins in intestinal epithelial cells. Shijie Huaren Xiaohua Zazhi 2013; 21(24): 2424-2428
- URL: https://www.wjgnet.com/1009-3079/full/v21/i24/2424.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i24.2424
胃肠道上皮是机体抵御各种病原体、毒素和来自肠腔内变应原的机械屏障. 肠黏膜上皮屏障完整性一旦破坏, 可导致多种肠道疾病如溃疡性结肠炎、克罗恩病、慢性腹泻性疾病及其他肠道炎症性疾病[1,2]. 而肠上皮细胞间的紧密连接(tight junctions, TJs)相关蛋白是构成机械屏障的决定因素. TJs位于上皮顶端两相邻细胞间, 主要由跨膜蛋白claudins、occludin和胞质附着蛋白(zonula occludins proteins, ZOs)组成[3,4]. 已经发现精神紧张等应激因素不仅可以导致功能性肠病如肠易激综合征, 还可诱发或加剧器质性疾病如炎症性肠病的发生[5,6], 而促肾上腺皮质激素释放因子(corticotrophin-releasing factor, CRF)作为主要的应激因子, 其在肠道炎症发生中的作用如何, 是否与肠上皮屏障的破坏有关? 本研究以肠上皮细胞为研究对象, 观察CRF对肠上皮细胞紧密连接相关蛋白的作用, 探讨其对肠黏膜屏障破坏的可能机制.
HT-29细胞株购自购中国科学院细胞库; 促肾上腺皮质释放因子CRF购自Sigma公司; occludin, cldn1、cldn2、cldn3、cldn4、ZO-1和ZO-2 ELISA试剂盒购自上海邦奕生物公司; cldn2抗体和DEM购自Sigma公司.
1.2.1 细胞培养: HT-29细胞复苏后, 接种培养于含10%胎牛血清、100 U/mL青霉素以及100 U/mL链霉素的RPMI 1640培养基中, 置于5%CO2孵箱中培养, 温度调至37 ℃, 每天观察细胞生长情况, 更换细胞培养液, 4-5 d后以0.25%的胰酶消化传代, 取对数生长期的细胞, 以5×105/mL的密度接种于50 mL培养瓶备用.
1.2.2 细胞刺激: 以CRF(20 ng/mL)的浓度刺激24 h后, 更换细胞液后继续再以脂多糖(lipopolysaccharides, LPS)(100 ng/mL)的浓度孵育24 h, 对照组单纯以LPS(100 ng/mL)孵育刺激24 h, 收集细胞提取液, -20 ℃冰箱冻存, 以备ELISA检测. HT-29细胞以含10%胎牛血清的RPMI 1640培养接种于培养板内, 以CRF 0、1、10、20 ng/mL的浓度刺激24 h和核因子κB(nuclear factor κB, NF-κB)抑制剂DEM 1 mmol/L预孵1 h后加CRF 20 ng/mL刺激24 h, 然后更换各组细胞液后继续再以LPS 100 ng/mL的浓度孵育24 h, 收集各组HT-29细胞, PBS洗涤2次, 冻存于-70 ℃冰箱, 用于提取蛋白.
1.2.3 ELISA检测: 参照说明书检测细胞培养液中occludin、cldn1、cldn2、cldn3、cldn4、ZO-1和ZO-2因子的表达.
1.2.4 免疫印迹法检测cldn2的表达: 将刺激后的各组HT29细胞, 分别加入细胞蛋白裂解液提取蛋白, Bradford方法测定蛋白浓度, 配置8%十二烷基硫酸钠聚丙烯酰胺凝胶, 将总蛋白加样, 横压电泳, 横流转膜, 加入5%的脱脂奶粉封闭过夜, 加一抗兔抗人cldn2多克隆抗体, 孵育2 h, PBS洗涤2次, 加辣根过氧化物酶标记的羊抗兔IgG, 孵育2 h, 加ECL显色, 暗室曝光. 将所有免疫印迹结果进行图像分析, 用UVIBand成像系统进行扫描分析, 结果以目的条带面积灰度值表示.
统计学处理 实验数据采用SPSS13.0软件进行分析, 计量资料以mean±SD表示, 计量资料多组间比较采用单因素方差分析, 以P<0.05认为差异有统计学意义.
ELISA检测结果显示以CRF刺激结肠上皮细胞24 h后再以LPS刺激后ZO-1、ZO-2、Occludin、cldn1和cldn3表达水平与单纯LPS刺激无明显变化(P>0.05), 但是cldn2的表达则较前明显升高(P<0.01, 图1).
以LPS孵育前以CRF(1 ng/mL)刺激即可引起cldn2表达增高, 随后加大CRF刺激浓度, 分别以10和20 ng/mL刺激, 则cldn2的表达随着刺激浓度加大而逐渐增高(P<0.05), 呈现剂量依赖效应, 而以CRF(20 ng/mL)刺激同时加入NF-κB抑制剂DEM后再以LPS孵育HT-29细胞然后CRF则不能诱导cldn2表达增高(P>0.05, 图2).
CRF是一种41氨基酸肽, 是下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal, HPA)6产生的主要应激因子[7-9], 目前研究发现, 不仅脑组织中存在CRF, 周围组织也有CRF和其相关肽的表达, 并且发现周围组织中的一些免疫细胞、神经细胞释放的CRF有促炎作用[10,11], 如类风湿关节炎[12]、溃疡性结肠炎[13]、桥本甲状腺炎[14]和银屑病[15]中炎症组织中的CRF表达都是增高的. 周围型CRF信号传导系统在多种疾病中的致炎作用已越来越引起人们的注意. 近年越来越多的报道显示环境因素中应激因素不仅可导致功能性肠病如肠易激综合征还可导致器质性肠病如炎症性肠病的发生, 而CRF是主要的应激因子, 已经发现肠道黏膜组织中广泛存在有CRF及其受体, 并且肠道组织中CRF信号系统活化也与炎症产生有关[16], 但具体机制尚不甚清, 揭示CRF在肠道炎症中的作用机制有可能进一步阐释应激因素在肠道炎症发生中的作用.
许多肠道炎症性疾病如溃疡性结肠炎、克罗恩病、慢性腹泻性疾病等都与肠黏膜屏障的破坏有关[17,18]. 那么应激导致肠道炎症的发生是否也与肠黏膜屏障的破坏有关, 具体机制又是如何目前鲜有报道. 肠上皮是构成肠黏膜的第一道防御屏障, 肠上皮毗邻细胞之间形成紧密连接的屏障需要TJs相关蛋白的作用, TJs位于上皮顶端两相邻细胞间, 主要由跨膜蛋白claudins、occludin和ZOs组成. 肠道上皮细胞中的TJ蛋白改变可导致毗邻细胞之间浆膜空隙或者细胞旁路空隙不能被紧密连接封闭, 肠上皮细胞的机械屏障作用则破坏, 通透性增高, 导致腔内微生物产物, 大分子抗原以及其他毒性物质可以有机会进入肠道深部组织引起进一步的病理反应[19-21]. 由于原代培养肠上皮细胞非常困难, 体外研究肠上皮细胞多采用生物学活性与其非常相似的结肠腺癌细胞株, 本研究中我们采用了与正常肠上皮细胞具有相似细胞免疫学特性的人结肠腺癌细胞系HT-29细胞为研究对象. 我们的实验发现CRF刺激HT-29细胞株24 h后再以LPS刺激可以引起ZO-1、ZO-2、Occludin、cldn1和cldn3的轻度降低, 但是cldn2则明显升高, 并且随着CRF刺激浓度加大, cldn2表达量亦逐渐增高, 呈现剂量依赖效应, 已有研究证实活动性溃疡性结肠炎或克罗恩病患者肠黏膜炎症组织中cldn2表达也是增高的, 体外实验已经陆续发现克罗恩病患者肠黏膜固有层淋巴细胞释放的肿瘤坏死因子(tumor necrosis factor α, TNF-α)可通过诱导cldn2升高而导致肠黏膜炎症的发生[22], 溃疡性结肠炎患者中促炎因子IL-13也是通过诱导cldn2升高而诱发肠黏膜炎症反应[23], 这些都证实cldn2升高导致了肠上皮细胞间的紧密连接破坏, 进而引起肠黏膜通透性增高, 屏障功能削弱[21]. 而本实验从体外研究发现应激因子CRF可以显著升高cldn2, 提示应激造成肠上皮屏障的破坏可能与cldn2的诱导升高.
本研究还显示单独以LPS刺激并不能诱导肠上皮细胞中cldn2的表达增高, 这与体内肠黏膜屏障对腔内内毒素呈免疫耐受的结果一致, 而以CRF刺激后再以LPS刺激则能诱导cldn2表达增高, 并且CRF与LPS协同刺激cldn2表达增高呈现CRF剂量依赖效应, 这就提示CRF有增强LPS对肠上皮屏障的破坏作用, 但是CRF是通过何种通路诱导cldn2表达? Ma等[23]研究发现TNF-α诱导肠上皮紧密相关蛋白表达异常通透性增高与NF-κB的激活有关, 我们推测CRF对cldn2的诱导表达是否也与NF-κB活化有关, 为了验证这种假设我们以CRF 20 ng/mL刺激的同时加入NF-κB抑制剂DEM, 然后再以LPS刺激, 结果显示cldn2表达无明显增高, 这就提示CRF对cldn2的诱导表达与CRF促进结肠上皮对LPS反应增高都与NF-κB活化有关.
近年来, 越来越多的临床报道环境因素在肠道疾病发生中的作用, 但是具体机制尚不清楚, 而我们的研究从体外实验证实了应激因子CRF可以刺激肠上皮细胞中紧密连接相关蛋白cldn2表达增高, 且呈剂量依赖效应, 并且发现CRF对肠上皮细胞的这种诱导作用与NF-κB激活有关, 为体内进一步研究应激因素对肠道炎症的作用奠定了基础.
很多肠道疾病特别是炎症性肠病都与肠黏膜屏障损伤有关, 而肠上皮毗邻细胞之间形成紧密连接的屏障需要紧密连接相关蛋白的作用, 已经证实应激因素与多种肠病的发生有关, 但是否与肠黏膜屏障的破坏有关尚不清楚.
刘占举, 教授, 同济大学附属上海市第十人民医院
促肾上腺皮质激素释放因子是下丘脑-垂体-肾上腺轴产生的主要应激因子, 近年发现不仅中枢组织中存在肾上腺皮质激素释放因子(corticotrophin-releasing factor, CRF), 周围组织中也存在着CRF, 并证实与周围组织中的炎症发生有关.
肠黏膜屏障的破坏是炎症性肠病发生的关键, 肠上皮之间的紧密连接相关蛋白的异常表达可导致肠黏膜屏障功能受损, 而应激因素导致肠病的发生是否与紧密连接相关蛋白的异常表达之间的关系尚未报道.
炎症性肠病的发病机制尚不甚清, 既往的研究多集中在免疫、遗传因素, 近年发现应激亦可诱导或加剧炎症性肠病的发生, 但是具体机制尚不清楚.
本文为探讨应激因素对肠道炎症反应提供了新的理论依据, 具有一定指导意义.
编辑: 黄新珍 电编: 闫晋利
| 1. | Clayburgh DR, Shen L, Turner JR. A porous defense: the leaky epithelial barrier in intestinal disease. Lab Invest. 2004;84:282-291. [PubMed] [DOI] |
| 2. | Shih DQ, Targan SR. Immunopathogenesis of inflammatory bowel disease. World J Gastroenterol. 2008;14:390-400. [PubMed] [DOI] |
| 3. | González-Mariscal L, Betanzos A, Nava P, Jaramillo BE. Tight junction proteins. Prog Biophys Mol Biol. 2003;81:1-44. [PubMed] [DOI] |
| 4. | Rao RK, Basuroy S, Rao VU, Karnaky Jr KJ, Gupta A. Tyrosine phosphorylation and dissociation of occludin-ZO-1 and E-cadherin-beta-catenin complexes from the cytoskeleton by oxidative stress. Biochem J. 2002;368:471-481. [PubMed] [DOI] |
| 5. | Maunder RG, Levenstein S. The role of stress in the development and clinical course of inflammatory bowel disease: epidemiological evidence. Curr Mol Med. 2008;8:247-252. [PubMed] [DOI] |
| 6. | Santos J, Alonso C, Vicario M, Ramos L, Lobo B, Malagelada JR. Neuropharmacology of stress-induced mucosal inflammation: implications for inflammatory bowel disease and irritable bowel syndrome. Curr Mol Med. 2008;8:258-273. [PubMed] [DOI] |
| 7. | Perrin MH, Vale WW. Corticotropin releasing factor receptors and their ligand family. Ann N Y Acad Sci. 1999;885:312-328. [PubMed] [DOI] |
| 8. | Lightman SL. The neuroendocrinology of stress: a never ending story. J Neuroendocrinol. 2008;20:880-884. [PubMed] [DOI] |
| 9. | Hsu SY, Hsueh AJ. Human stresscopin and stresscopin-related peptide are selective ligands for the type 2 corticotropin-releasing hormone receptor. Nat Med. 2001;7:605-611. [PubMed] [DOI] |
| 10. | Chang CL, Hsu SY. Ancient evolution of stress-regulating peptides in vertebrates. Peptides. 2004;25:1681-1688. [PubMed] [DOI] |
| 11. | Black PH. Stress and the inflammatory response: a review of neurogenic inflammation. Brain Behav Immun. 2002;16:622-653. [PubMed] [DOI] |
| 12. | McEvoy AN, Bresnihan B, FitzGerald O, Murphy EP. Corticotropin-releasing hormone signaling in synovial tissue from patients with early inflammatory arthritis is mediated by the type 1 alpha corticotropin-releasing hormone receptor. Arthritis Rheum. 2001;44:1761-1767. [PubMed] [DOI] |
| 13. | Saruta M, Takahashi K, Suzuki T, Torii A, Kawakami M, Sasano H. Urocortin 1 in colonic mucosa in patients with ulcerative colitis. J Clin Endocrinol Metab. 2004;89:5352-5361. [PubMed] [DOI] |
| 14. | Scopa CD, Mastorakos G, Friedman TC, Melachrinou M, Merino MJ, Chrousos GP. Presence of immunoreactive corticotropin releasing hormone in thyroid lesions. Am J Pathol. 1994;145:1159-1167. [PubMed] |
| 15. | Cemil BC, Canpolat F, Yilmazer D, Eskioğlu F, Alper M. The association of PASI scores with CRH-R1 expression in patients with psoriasis. Arch Dermatol Res. 2012;304:127-132. [PubMed] [DOI] |
| 16. | Paschos KA, Kolios G, Chatzaki E. The corticotropin-releasing factor system in inflammatory bowel disease: prospects for new therapeutic approaches. Drug Discov Today. 2009;14:713-720. [PubMed] [DOI] |
| 17. | Mawdsley JE, Rampton DS. Psychological stress in IBD: new insights into pathogenic and therapeutic implications. Gut. 2005;54:1481-1491. [PubMed] [DOI] |
| 18. | Salim SY, Söderholm JD. Importance of disrupted intestinal barrier in inflammatory bowel diseases. Inflamm Bowel Dis. 2011;17:362-381. [PubMed] [DOI] |
| 19. | Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1901-1909. [PubMed] |
| 20. | Shen L, Su L, Turner JR. Mechanisms and functional implications of intestinal barrier defects. Dig Dis. 2009;27:443-449. [PubMed] [DOI] |
| 21. | Amasheh M, Grotjohann I, Amasheh S, Fromm A, Söderholm JD, Zeitz M, Fromm M, Schulzke JD. Regulation of mucosal structure and barrier function in rat colon exposed to tumor necrosis factor alpha and interferon gamma in vitro: a novel model for studying the pathomechanisms of inflammatory bowel disease cytokines. Scand J Gastroenterol. 2009;44:1226-1235. [PubMed] [DOI] |
| 22. | MacDonald TT, Hutchings P, Choy MY, Murch S, Cooke A. Tumour necrosis factor-alpha and interferon-gamma production measured at the single cell level in normal and inflamed human intestine. Clin Exp Immunol. 1990;81:301-305. [PubMed] |
| 23. | Ma TY, Iwamoto GK, Hoa NT, Akotia V, Pedram A, Boivin MA, Said HM. TNF-alpha-induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2004;286:G367-G376. [PubMed] |