修回日期: 2013-07-05
接受日期: 2013-07-15
在线出版日期: 2013-08-18
目的: 探讨慢性活动性EB病毒性肝炎(chronic active Epstein-Barr virus hepatitis, CAEBVH)的临床病理特征、诊断、鉴别诊断、治疗方法和预后.
方法: 报道2例CAEBVH, 总结其临床表现、病理特征、诊断及鉴别诊断、治疗及预后, 并结合文献进行分析讨论.
结果: 两例患者为青少年男性, 例1主要表现为发热、黄疸、肝脾肿大、肝功能异常, 例2首先以血生化检查肝功能异常为特征, 后期出现双下肢水肿、尿黄、乏力、脾大, 伴中枢神经系统症状. 活检肝组织于光镜下观察: 两例均出现不同程度的肝细胞大泡性脂肪变性和纤维组织增生, 肝小叶内可见点灶状坏死, 肝窦内成串淋巴细胞浸润, 界板炎和汇管区炎症. 电镜观察: 慢性肝炎, 肝细胞脂肪变性及纤维增生, 未见髓鞘样小体、特征性溶酶体、乙肝表面抗原等特征性病变结构. EBER原位杂交均检出细胞核阳性的淋巴细胞. 例1病程为2年零4 mo, 例2病程为13年零5 mo, 最终均死亡.
结论: 慢性活动性EB病毒感染肝炎的临床表现不具有特异性, 易于误诊或漏诊. 病理学特点为大泡性脂肪变, 肝窦内成串淋巴细胞浸润, 肝小叶点灶状坏死, 界板炎和汇管区炎症, 以及EBER原位杂交均检出细胞核阳性的淋巴细胞. 该病预后差, 早期诊断是治疗的关键.
核心提示: 对于无法用其他原因解释的反复发热、肝功能异常等症状, 伴或不伴神经系统损害症状时都应考虑到慢性活动性EB病毒性肝炎(chronic active Epstein-Barr virus hepatitis)的可能, 以实现早期诊断, 为临床治疗提供合适的时机.
引文著录: 李鑫静, 曲利娟, 郑雄伟, 陈丽红, 董菁, 李东良, 潘晨, 吕旭江, 郑智勇. 慢性活动性EB病毒性肝炎的临床病理特征. 世界华人消化杂志 2013; 21(23): 2325-2330
Revised: July 5, 2013
Accepted: July 15, 2013
Published online: August 18, 2013
AIM: To investigate the clinicopathologic features of chronic active Epstein-Barr virus hepatitis (CAEBVH) as well as its diagnosis, differential diagnosis, treatment and prognosis.
METHODS: We presented the clinical manifestations, histopathological characteristics, diagnosis, treatment and prognosis of two cases of CAEBVH. A literature review was also performed to summarize the characteristics of this clinical entity.
RESULTS: Of two young male patients, one presented with intermittent fever, jaundice, hepatosplenomegaly and abnormal liver function, the other had abnormal liver biochemical tests and symptoms including edema of lower limbs, yellowish urine, fatigue, splenomegaly, and central nervous system symptoms. Histopathologic examination of liver biopsies revealed varying degrees of macrovesicular steatosis and fibrosis, scattered lobular necrosis, beaded sinusoidal lymphocytic infiltration, portal inflammation and interface activity. Electron microscopic investigation showed chronic hepatitis along with steatosis of liver cells and fibrosis. No mylinoid body, special lysosome, glycogen storage or hepatitis B surface antigens were found. In situ hybridization (ISH) for EBV early RNA (EBER) showed EBER-positive nuclei of lymphocytes. Both patients ended in death. The course was 2 years and 4 mo for case 1 and 13 years and 5 mo for case 2.
CONCLUSION: CAEBVH has no specific clinical features, which makes it easy to reach a misdiagnosis. Pathologic features include macrovesicular steatosis, fibrosis, beaded sinusoidal lymphocytes infiltration, scattered lobular necrosis, interface activity and portal inflammation. EBER-positive nuclei of lymphocytes can be detected by ISH. This disease has a poor prognosis and early diagnosis is pivotal for appropriate clinical management.
- Citation: Li XJ, Qu LJ, Zheng XW, Chen LH, Dong J, Li DL, Pan C, Lv XJ, Zheng ZY. Clinicopathologic features of chronic active Epstein-Barr virus hepatitis. Shijie Huaren Xiaohua Zazhi 2013; 21(23): 2325-2330
- URL: https://www.wjgnet.com/1009-3079/full/v21/i23/2325.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i23.2325
慢性活动性EB病毒性肝炎(chronic active Epstein-Barr virus hepatitis, CAEBVH)少见, 伴有明显中枢神经系统症状者更鲜有报道[1], 因此临床上容易误诊或漏诊. 现报道我科诊断的两例CAEBVH, 其中1例后期伴有明显的中枢神经系统症状, 结合文献进行分析讨论, 以提高对该疾病的认识.
选取南京军区福州总医院病理科2011-2012年诊治的2例慢性活动性EB病毒性肝炎.
2例肝穿组织石蜡切片行HE、网纤-Masson染色, EliVision法免疫组织化学HBsAg、HBcAg染色, 罗丹宁铜染色, 普鲁士蓝铁染色, EBER原位杂交检测; 透射电镜检查. 免疫组织化学染色所用HBsAg、HBcAg和EliVision试剂盒均购自福州迈新公司, EBER原位杂交试剂盒购自福州泰普生物科学有限公司.
病例1, 男, 24岁, 以"反复眼黄、尿黄2年, 加剧并疲乏、腹胀2 wk."为主诉入院. 两年前无明显诱因出现眼黄、尿黄、皮肤黄就诊当地医院, 血培养检出液化沙雷菌, 考虑败血症, 予抗感染治疗, 症状缓解后出院. 此后反复出现上述症状并伴有发热, 其中一次最高体温达40 ℃, 持续20 d, 多次住院予抗感染及保肝等治疗, 病情好转后出院, 但定期复查肝功能仍有波动. 期间3次肝穿, 病理诊断为: 中度慢性肝炎伴肝细胞大泡性脂肪变(第1次穿刺G3、S0、F3, 第2次G3、S1、F3, 第3次G3、S1、F4); 免疫组织化学HBsAg、HBcAg染色均阴性, 病因结合临床. 本次入院查体: 全身皮肤无黄染, 巩膜轻度黄染; 肝右肋下4 cm、剑突下4 cm可触及, 质地偏实; 实验室检查: 淋巴细胞59.34%, 粒细胞33.64%, 粒细胞计数1.36/L, 尿胆红素强阳性, 尿胆原16 μmol/L, 总胆红素(total bilirubin, TBIL)98 μmol/L, 结合胆红素(conjugative bilirubin, DBIL)71.3 μmol/L, 白蛋白(albumin, ALB)34.4 g/L, 丙氨酸转氨酶(alanine aminotransferase, ALT)416 U/L, 谷草转氨酶(aspartate amino-transferase, AST)436 U/L, 谷酰转肽酶(glutamyltransferase, GGT)466 U/L, 碱性磷酸酶(alkaline phosphatase, ALP)1284 U/L, 铜蓝蛋白428 mg/L, 内毒素鲎定量测定、肺炎支原体抗体、肝病自身抗体、ds-DNA、ANA谱、甲型肝炎抗体、丙型肝炎抗体、戊型肝炎抗体及乙型肝炎两对半均阴性, 巨细胞病毒IgG阳性、IgM阴性, EB病毒抗体IgA 3.30 S/CO(参考值S/CO<1), 血铜24.89 μmol/L; 彩超显示肝脾肿大, 脂肪肝, 少量腹水. 行第4次肝穿, 送光镜病理检查.
病例2, 男, 23岁, 以"反复肝功异常13年余, 乏力、纳差、腹胀、肢肿、尿黄及发作性意识不清伴行走困难3 mo余"为主诉, 坐轮椅送入院. 13年前体检发现肝功异常, HBsAg阳性, B超提示肝肿脾大; 第1次肝穿病理诊断"轻度慢性肝炎(G1, S0), 结合血清学检查结果符合乙型肝炎", 临床诊断"肝硬化活动期"; 之后多次复查肝功能指标反复轻度异常, 期间服用保肝、抗纤维化等药物治疗. 5年前复查肝功ALT 45 U/L, AST 78 U/L, 铜蓝蛋白0.65/L, CMV IgM、IgG均阴性, 血清HCV-RNA、HBsAg和HBcAg均阴性; 行第2次肝穿刺术, 病理诊断"病因不明中度慢性肝炎(G3, S2-3), HBsAg和HBcAg均阴性"; 继续服用保肝、抗纤维化等药物治疗, 期间肝功能ALT 43-96 U/L, AST 39-93 U/L. 3 mo前出现乏力不适, 食欲减退, 伴眼黄、尿黄, 并无明显诱因出现发作性意识不清伴行走困难; 就诊上海某大医院, 拟诊"异常代谢性脑脊髓疾病: 遗传代谢性脑病(尼曼匹克C型可能)", 行头颅MRI、串联质谱检测、尼曼匹克病及戈谢氏病酶学检查但无阳性发现, 予"美能、多烯磷脂酰胆碱及保肝治疗", 症状无明显改善. 本次入院查体: 神志清楚, 对答尚可, 智力下降, 言语不清, 定向力、计算力、记忆力均减退, 皮肤巩膜中度黄染, 见肝掌, 右肋下未触及肝脏, 左肋缘下5.0 cm触及脾脏, 腹部移动性浊音阳性, 双下肢中度凹陷性水肿, 双上肢肌力4级, 双下肢2级, 全身肌张力升高, 四肢腱反射亢进, 踝震挛阳性, 四肢感觉无异常, 巴彬斯基征阳性; 实验室检查: ALB 14 g/L、GLB 20 g/L, ALT 182 U/L, AST 266 U/L, GGT 93 U/L, AKP 362 U/L, CHE 1178 U/L, 血尿素氮2.5 mmol/L, Cr 34 μmol/L, PT 16.5 s, APTT 45.2 s, 肝纤维化PIIIP 171.3 ng/mL, 肝炎病毒相关抗体均阴性, 乙肝病毒DNA<420 IU/mL, HIV-Ag/Ab阴性. 上腹部CT示肝硬化, 脾脏增大, 胃底静脉曲张, 肝脏脂肪浸润. 行第3次肝穿, 送光镜及电镜检查.
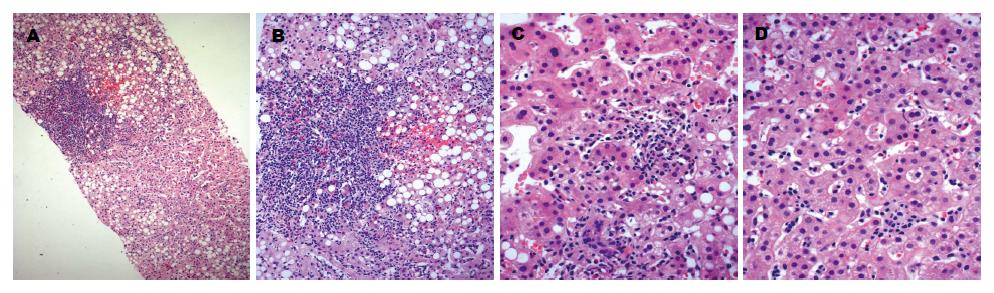
两例肝穿组织形态学大体一致,肝小叶结构存在, 肝细胞水肿, 显著大泡性脂肪变性, 中度肝细胞内淤胆, 中度点灶状坏死; 肝小叶及汇管区较多淋巴单核细胞、少量中性粒细胞、浆细胞及嗜酸粒细胞浸润, 肝窦内Kupffer细胞增多并见"串样"排列的淋巴细胞; 汇管区轻度纤维组织增生(图1). 例2还可见轻度界板炎和轻度桥接坏死; 门-门型纤维间隔形成.
HBsAg、HBcAg染色均阴性.
铜、铁染色均阴性.
例1肝小叶结构存在, 肝细胞显著大泡性脂滴, 明显水肿、空泡变性, 肝细胞较多核空泡变性, 肝细胞糖原增多, 线粒体形态大小正常; 窦间隙少量炎症细胞浸润, 局灶纤维组织增多; 未见汇管区. 例2肝细胞水肿变性, 线粒体增多, 糖原稍多, 中量大小泡性脂滴, 明显淤胆, 点灶性坏死; 窦间隙Kupffer细胞增多, 肝细胞间纤维组织明显增多; 汇管区扩大, 纤维组织增生, 少许炎症细胞浸润.
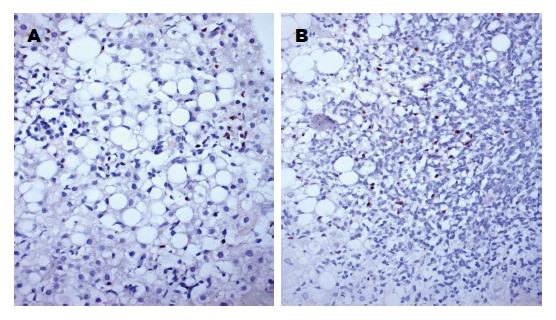
肝组织中浸润淋巴细胞核EBER阳性(占5%-10%), 阳性细胞分布散在或聚集(图2). 再取两例患者此前的所有肝穿标本行原位杂交EBER检测, 均可见到少量淋巴细胞核阳性.
病例1(第4次肝穿)慢性活动性EB病毒性肝炎(G3、S1、F4). 请临床查血清EB病毒DNA含量, 为462000 IU/mL(正常值<1000 IU/mL). 临床给予保肝、提高免疫力、抗EB病毒等治疗, 病情平稳后出院. 此后4 mo内患者又多次发病, 先后就诊于多家医院. 后期因出现反复消化系出血, 病情危重, 患者及家属放弃治疗. 病例2(第3次肝穿)慢性活动性EB病毒性肝炎(G3, S2, F2). 请临床查血清EB病毒DNA含量, 为57700 IU/mL. 临床给予保肝、抗病毒及对症等治疗, 但治疗效果不佳, 中枢神经系统损害进行性加重, 2 mo后因循环衰竭病逝.
EB病毒感染通常引起急性感染, 发病年龄常在5岁以前, 无明显症状或表现为传染性单核细胞增多症(infectious mononucleosis disease, IM), 病程具有自限性; 少部分病人可发展为慢性活动性EB病毒感染(chronic active EB virus infection, CAEBV), 以持续或反复的IM样症状为主要特征, 并可累及全身多系统、器官[1,2]. CAEBV临床表现多样, 突出表现主要有反复发热、淋巴结病变、肝功能异常、肝脾肿大、间质性肺炎等, 其他少见症状有中枢神经系统病变、心肌炎、肠穿孔等; 实验室检查出现EBV-DNA水平升高和EBV相关抗体滴度异常升高[2-4]. CAEBV引起的肝炎临床表现常无特异性, 易误诊、漏诊. 本组两例均为青壮年, 病例1表现为反复发热、黄疸、肝功能异常、肝脾肿大, 而无其他特异表现, 每次住院抗感染、保肝等治疗症状可暂时缓解, 但病情反复, 最终因肝衰竭、消化道大出血死亡. 病例2病程长达13年, 晚期时除了乏力、纳差、腹胀、肢肿、尿黄等肝硬化相关症状、体征外, 同时伴无明显诱因的发作性意识不清, 伴有行走困难等中枢神经系统损害表现, 可能由于EB病毒脑炎所致. 该患者出现中枢神经系统损害症状后, 病情进展迅速, 发病到死亡仅5 mo左右. 中枢神经系统受累是CAEBV较为少见的合并症之一, 常给诊断增加困难, 同时可能提示疾病预后不佳.
2007年Suh等[5]对8例EB病毒性肝炎的肝活检组织形态进行了详细描述, 每例都有汇管区炎症, 炎症细胞以淋巴细胞主, 特征性肝窦内淋巴细胞浸润; 其他还可有肝细胞脂肪变性、气球样变、肝小叶内小肉芽肿和胆管等改变. EBER原位杂交可见阳性细胞或PCR检测EBV-DNA阳性. 本组两例也出现类似病理特征: 汇管区以淋巴细胞为主要浸润细胞, 肝窦内串珠样淋巴细胞浸润, 肝细胞点灶状坏死, 肝轻度界板炎; 另外在疾病不同阶段还出现不同程度的肝细胞大泡性脂肪变性和纤维组织增生; 肝组织内EBER原位杂交检出阳性细胞. 透射电镜检查均表现为慢性肝炎, 脂肪变性, 而无髓鞘样小体、特征性溶酶体、乙型肝炎表面抗原等特征性病变结构.
通过对比两例患者的多次肝活检组织学发现, 肝小叶及汇管区炎症在保肝、抗感染等治疗后有所减轻, 而肝细胞脂肪变及纤维组织增生随病程逐步进展, 提示肝损害呈慢性不可逆发展. 两例患者前后数次肝活检组织行EBER原位杂交都检测出阳性细胞, 即在病变早期肝组织内就可检测EB病毒感染阳性细胞, 且肝损害逐步进展, 这可能提示患者长期处于慢性活动性EB病毒感染状态, 使肝脏病变慢性进行性发展, 到后期肝脏严重硬化. CAEBVH虽然形态学无特异表现, 但肝窦内出现"串珠样"排列的单个核细胞可提示需对疾病进一步行病毒学检查[5].
目前CAEBV的诊断多采用2005年Okano等[6]提出的诊断标准(必须同时满足以下3个标准): (1)持续或反复IM样临床表现: 主要为长期或反复发热、淋巴结肿大、肝脾肿大; 一些患者也出现血液系统、消化系统、神经系统、肺部、心血管系统、眼、耳和皮肤等并发症; (2)特定EBV抗体谱(anti-EBV antibody patterns): VCA-IgG抗体和EA-IgG抗体滴度显著升高; 和或受累组织(包括血浆和外周血细胞)EBV 拷贝数升高; (3)临床表现不能用其他慢性疾病解释. 对于诊断EB病毒性肝炎, 而Kimura等[7]对30例CAEBV患者的分析中, 有部分患者EB病毒相关抗体滴度并不高, 认为抗体滴度改变并非诊断必需并指出外周血EBV DNA>102.5 copies/µg可作为CAEBV的诊断依据. Drebber等[8]则提出, 血生化检查肝功能异常、EB病毒血清学检查阳性、典型的组织学形态及EBV-DNA或EBER检查阳性是诊断必不可少的4个指标.
本组2例临床表现多样, 临床上曾长期未能对病因做出正确诊断, 最后根据肝窦内串珠样淋巴细胞排列方式的提示, 通过原位杂交方法检测出EBER阳性淋巴细胞, 最终确诊为CAEBVH; 此后再查血清EBV-DNA含量均显著升高. 诊断CAEBVH需排除其他疾病所致肝炎, 比如自身免疫性肝炎, 是以肝细胞损害为主的慢性进行性肝炎[9], 其临床表现和病毒学检查都可能与CAEBVH相似, Chiba等[10]即报道过CAEBV引起的肝炎被误诊为自身免疫性肝炎. 而本组通过自身免疫抗体及其他病毒相关抗体检测等检验指标、免疫组织化学染色和透射电镜检查排除了自身免疫性肝炎、Wilson病、糖原累积症及甲乙丙戊型肝炎等疾病. 此外例2患者晚期伴有明显中枢神经系统症状, 需要与一些先天性代谢性疾病如尼曼-匹克病、戈谢氏病等鉴别, 这些疾病常有肝损害、肝脾肿大等表现, 并可出现不同程度的神经系统症状; 鉴别要点为尼曼-匹克病和戈谢氏病患者的外周单核吞噬细胞、骨髓及肝组织中可见特征性因脂类蓄积于吞噬细胞内而形成的尼曼-匹克细胞或戈谢氏细胞, 肝活检EBER原位杂交无阳性细胞. 本组病例提示对于无法用其他原因解释的反复发热、肝功能异常等症状, 伴或不伴神经系统损害症状时都应考虑到CAEBV的可能.
CAEBV预后差, 病死率较高, 而目前针对慢性活动性EB病毒感染相关疾病的规范治疗方案尚待建立, 抗病毒药物、免疫制剂、等治疗无明显效果或只有短暂缓解作用[3,11]. 本报道例1患者在诊断结果明确后临床给予保肝、提高免疫力、抗EB病毒等治疗, 但病情反复, 后期因反复消化道出血, 病情危重, 患者及家属放弃治疗. 病例2患者在诊断明确后经抗EB病毒、抗肝纤维化、提高免疫力等治疗, 病情无明显改善, 明确诊断到死亡的时间仅2 mo. 关于其他治疗措施, 有输注自体EBV特异性细胞毒细胞(EBV-CTL)治疗成功的报道[12,13]. 而近年更多的研究热点在于通过同种异基因外周血干细胞移植、骨髓移植或脐带血干细胞移植达到免疫重建, 消除EBV感染细胞[3,14-16]. 通过以上方法重建机体对EB病毒的有效免疫或成为今后治疗的主要选择, 但这些方法治疗CAEBVH的效果受到治疗时机、移植后并发症等因素的影响. 早期诊断是免疫重建治疗取得合适时机的关键. 实现早期诊断、早期治疗则有赖于更全面的认识该疾病, 提高对该疾病的敏感性.
例1的病理诊断承蒙上海东方肝胆医院病理科丛文铭教授的指导, 例2的病理诊断承蒙北京中日友好医院病理科王泰龄教授的指导, 特此志谢
慢性活动性EB病毒性肝炎(chronic active Epstein-Barr virus hepatitis, CAEBVH)并不多见, 伴有中枢神经系统症状者更为罕见, 该病临床表现和病理特征均缺乏特异性, 容易引起临床医生和病理医生的误诊.
张明辉, 副主任医师, 河北医科大学第一医院肝病中心(传染病)
应用同种异基因外周血干细胞移植、骨髓移植或脐带血干细胞移植进行免疫重建以消除EB病毒(Epstein-Barr virus)感染细胞有望成为今后治疗CAEBV主要方法.
2007年Suh等对EB病毒性肝炎的肝组织病理特征进行了详细描述.
本文主要对2例CAEBVH的临床诊疗经过、病理形态学特征及病毒学检查结果进行总结分析, 并复习相关文献, 探讨CAEBVH的临床病理特征及病毒学检查特点.
CAEBVH的临床表现和组织形态学表现无特异性, 容易误诊、漏诊. 在原因不明的肝炎的诊断中应想到此病的可能, 组织病理特征结合病毒学检查有助于鉴别诊断.
本文准确反映了研究工作的科学问题和特定内容, 简明而有特色. 文章条理分明, 有系统的理论分析和有价值的科学结论. 尤其对检验手段相对匮乏的基层医院医生帮助较大.
编辑: 田滢 电编: 鲁亚静
| 1. | 彭 向欣, 王 泰龄. EB病毒性肝炎. 肝脏疾病临床病理学. 北京: 化学工业出版社 2010; 118-126. |
| 2. | Kimura H, Morishima T, Kanegane H, Ohga S, Hoshino Y, Maeda A, Imai S, Okano M, Morio T, Yokota S. Prognostic factors for chronic active Epstein-Barr virus infection. J Infect Dis. 2003;187:527-533. [PubMed] [DOI] |
| 3. | Cohen JI, Jaffe ES, Dale JK, Pittaluga S, Heslop HE, Rooney CM, Gottschalk S, Bollard CM, Rao VK, Marques A. Characterization and treatment of chronic active Epstein-Barr virus disease: a 28-year experience in the United States. Blood. 2011;117:5835-5849. [PubMed] [DOI] |
| 4. | Kimura H, Hoshino Y, Hara S, Sugaya N, Kawada J, Shibata Y, Kojima S, Nagasaka T, Kuzushima K, Morishima T. Differences between T cell-type and natural killer cell-type chronic active Epstein-Barr virus infection. J Infect Dis. 2005;191:531-539. [PubMed] |
| 5. | Suh N, Liapis H, Misdraji J, Brunt EM, Wang HL. Epstein-Barr virus hepatitis: diagnostic value of in situ hybridization, polymerase chain reaction, and immunohistochemistry on liver biopsy from immunocompetent patients. Am J Surg Pathol. 2007;31:1403-1409. [PubMed] [DOI] |
| 6. | Okano M, Kawa K, Kimura H, Yachie A, Wakiguchi H, Maeda A, Imai S, Ohga S, Kanegane H, Tsuchiya S. Proposed guidelines for diagnosing chronic active Epstein-Barr virus infection. Am J Hematol. 2005;80:64-69. [PubMed] [DOI] |
| 7. | Kimura H, Hoshino Y, Kanegane H, Tsuge I, Okamura T, Kawa K, Morishima T. Clinical and virologic characteristics of chronic active Epstein-Barr virus infection. Blood. 2001;98:280-286. [PubMed] |
| 8. | Drebber U, Kasper HU, Krupacz J, Haferkamp K, Kern MA, Steffen HM, Quasdorff M, Zur Hausen A, Odenthal M, Dienes HP. The role of Epstein-Barr virus in acute and chronic hepatitis. J Hepatol. 2006;44:879-885. [PubMed] [DOI] |
| 10. | Chiba T, Goto S, Yokosuka O, Imazeki F, Tanaka M, Fukai K, Takahashi Y, Tsujimura H, Saisho H. Fatal chronic active Epstein-Barr virus infection mimicking autoimmune hepatitis. Eur J Gastroenterol Hepatol. 2004;16:225-228. [PubMed] [DOI] |
| 11. | Okano M. Therapeutic approaches for severe Epstein-Barr virus infection. Pediatr Hematol Oncol. 1997;14:109-119. [PubMed] [DOI] |
| 12. | Savoldo B, Huls MH, Liu Z, Okamura T, Volk HD, Reinke P, Sabat R, Babel N, Jones JF, Webster-Cyriaque J. Autologous Epstein-Barr virus (EBV)-specific cytotoxic T cells for the treatment of persistent active EBV infection. Blood. 2002;100:4059-4066. [PubMed] [DOI] |
| 13. | Hagihara M, Tsuchiya T, Hyodo O, Ueda Y, Tazume K, Masui A, Kanemura A, Yoshiba F, Takashimizu S, Matzusaki S. Clinical effects of infusing anti-Epstein-Barr virus (EBV)-specific cytotoxic T-lymphocytes into patients with severe chronic active EBV infection. Int J Hematol. 2003;78:62-68. [PubMed] [DOI] |
| 14. | Taketani T, Kikuchi A, Inatomi J, Hanada R, Kawaguchi H, Ida K, Oh-Ishi T, Arai T, Kishimoto H, Yamamoto K. Chronic active Epstein-Barr virus infection (CAEBV) successfully treated with allogeneic peripheral blood stem cell transplantation. Bone Marrow Transplant. 2002;29:531-533. [PubMed] [DOI] |
| 15. | Ishimura M, Ohga S, Nomura A, Toubo T, Morihana E, Saito Y, Nishio H, Ide M, Takada H, Hara T. Successful umbilical cord blood transplantation for severe chronic active Epstein-Barr virus infection after the double failure of hematopoietic stem cell transplantation. Am J Hematol. 2005;80:207-212. [PubMed] [DOI] |
| 16. | Sato E, Ohga S, Kuroda H, Yoshiba F, Nishimura M, Nagasawa M, Inoue M, Kawa K. Allogeneic hematopoietic stem cell transplantation for Epstein-Barr virus-associated T/natural killer-cell lymphoproliferative disease in Japan. Am J Hematol. 2008;83:721-727. [PubMed] [DOI] |