修回日期: 2013-07-08
接受日期: 2013-07-15
在线出版日期: 2013-08-08
目的: 探讨原发性肝细胞癌(hepatocellular carcinoma, HCC)组织中表皮生长因子受体(epidermal growth factor receptor, EGFR)、细胞间隙连接蛋白(connexin43, Cx43)和E-cadherin蛋白的表达及其与临床病理特征的关系.
方法: 采用免疫组织化学PV 6000法检测74例原发性HCC, 25例肝硬化组织和20例正常肝组织中EGFR、Cx43和E-cadherin的表达情况.
结果: EGFR、Cx43和E-cadherin HCC组织中阳性率分别为66.22%、27.03%和40.54%, 肝硬化组织阳性率分别为44.00%、68.00%和52.00%, 正常肝组织阳性率分别为10.00%、95.00%和80.00%. EGFR在HCC组织中阳性率明显高于肝硬化和正常肝组织阳性率, 差异有显著性(P<0.05, P<0.01); Cx43在HCC组织中阳性率明显低于肝硬化和正常肝组织阳性率, 差异有显著性(P<0.01, P<0.01); E-cadherin在HCC组织中阳性率明显低于正常肝组织阳性率, 差异有显著性(P<0.01). EGFR、Cx43和E-cadherin表达与肿瘤的大小、分化程度、TNM分期、肝内血管癌栓、浸润性生长方式及累及肝被膜具有相关性(均P<0.05), 与患者年龄、性别、是否伴有肝硬化、门静脉癌栓及术前血清甲胎蛋白水平无相关性(均P>0.05). HCC组织中Cx43和E-cadherin表达降低, EGFR表达增加, EGFR表达和Cx43(rs' = -0.3123, P = 0.0068)及E-cadherin(rs' = -0.2962, P = 0.0104)间呈负相关性.
结论: 联合检测HCC组织中EGFR、Cx43和E-cadherin的表达, 有助于综合探讨HCC的发生机制. EGFR、Cx43和E-cadherin可以作为新的预测HCC浸润、转移、判断预后和指导临床靶向治疗的重要因子. 我们的研究为肝癌的基因治疗提供理论依据.
核心提示: 本文联合检测表皮生长因子受体(epidermal growth factor receptor, EGFR)、Cx43和E-cadherin在正常肝组织、肝硬化组织和原发性肝细胞癌(hepatocellular carcinoma, HCC)中表达, EGFR在HCC中呈高表达, 与HCC的分化程度、临床分期、侵袭浸润、转移和判断预后有关; Cx43和E-cadherin在HCC中呈低表达, 与HCC的恶性生物学行为和预后有关. 同时检测3种蛋白的表达, 发现他们在HCC发生发展中具有反向调节作用, 三者协同参与HCC的发生和发展. 3种蛋白相应的基因位点, 有望成为HCC新的基因治疗药物的靶点, 为HCC临床基因治疗提供可靠的理论依据.
引文著录: 蒋艳霞, 于文娟, 林东亮, 李宏, 李玉军. 原发性肝细胞癌中EGFR、Connexin43和E-cadherin的表达及意义. 世界华人消化杂志 2013; 21(22): 2185-2191
Revised: July 8, 2013
Accepted: July 15, 2013
Published online: August 8, 2013
AIM: To investigate the expression of EGFR, Connexin43 (Cx43) and E-cadherin in primary hepatocellular carcinoma (HCC) and to analyze their relationship with clinicopathological characteristics of HCC.
METHODS: Immunohistochemistry was used to detect the expression of EGFR, Cx43 and E-cadherin in 74 HCC tissue specimens, 25 liver cirrhosis tissue specimens and 20 normal liver tissue specimens.
RESULTS: The positive rates of EGFR, Cx43 and E-cadherin protein expression were 66.22%, 27.03% and 40.54% in HCC, 44.00%, 68.00% and 52.00% in liver cirrhosis, and 10.00%, 95.00% and 80.00% in normal liver tissues. Expression of EGFR was significantly higher in HCC than in liver cirrhosis (P < 0.05) and normal liver tissue (both P < 0.01). Expression of Cx43 was significantly lower in HCC than in liver cirrhosis (P < 0.05) and normal liver tissue (P < 0.01). Expression of E-cadherin differed significantly between HCC and normal liver tissue (P < 0.01). Expression of EGFR, Cx43 and E-cadherin was associated with tumor size, differentiation grade, TNM stage, presence of intravascular cancer embolus, capsule involvement and infiltrative growth pattern (all P < 0.05), but not with age, gender, cirrhosis background, cancer embolus in the portal vein or serum level of alpha-fetal protein (all P > 0.05). In HCC, expression of EGFR was up-regulated, while that of Cx43 and E-cadherin was down-regulated. Expression of EGFR was negatively correlated with expression of Cx43 (r = -0.3123, P = 0.0068) and E-cadherin (r = -0.2962, P = 0.0104).
CONCLUSION: Combined detection of EGFR, Cx43 and E-cadherin expression can help reveal the carcinogenic mechanisms of HCC. EGFR, Cx43 and E-cadherin might be used as novel and useful markers for predicting the invasion, metastasis and prognosis of HCC and guiding the clinical therapy of this malignancy.
- Citation: Jiang YX, Yu WJ, Lin DL, Li H, Li YJ. Significance of expression of EGFR, Connexin43 and E-cadherin in primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(22): 2185-2191
- URL: https://www.wjgnet.com/1009-3079/full/v21/i22/2185.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i22.2185
肿瘤的发生发展和演进是涉及多因素、多步骤和多基因调控的复杂病理过程, 原发性肝细胞癌(hepatocellular carcinoma, HCC)是临床常见的恶性肿瘤, 其死亡率占恶性肿瘤的第2位[1], 其发生和演进亦受多因素影响和多基因调控, 为进一步探讨其发生、浸润和转移机制, 寻求更好的合理有效的治疗方法选做本实验. 本研究采用免疫组织化学技术, 观察表皮生长因子受体(epidermal growth factor receptor, EGFR)、细胞间隙连接蛋白(connexin43, Cx43)和E-cadherin蛋白在HCC组织中的表达及其与HCC的发生机制、作用靶点、临床病理特征、浸润和转移的关系, 为临床采用新思路诊断治疗HCC提供一定的理论支持.
收集青岛大学医学院附属医院手术切除存档蜡块标本, 经病理科确诊的原发性HCC 74例, 术前均未行放化疗. 其中男56例, 女18例; 年龄35-79岁, 中位54.4岁; 每例均有详细的临床资料及手术记录. 按国际抗癌联盟(Union for International Cancer Control, UICC)制定的HCC TNM分期标准:Ⅰ期25例、Ⅱ期19例、Ⅲ期22例、Ⅳ期8例; 病理学分级按WHO分级法划分为4型[2], 即高分化、中分化、低分化和未分化. 其中高分化(Ⅰ级)14例、中分化(Ⅱ级)34例、低分化(Ⅲ级)26例; 瘤结节直径2.5-12.0 cm, 肿瘤直径≤5 cm 46例, 肿瘤直径>5 cm 28例; 伴有肝硬化背景63例, 无肝硬化背景11例. 经临床检查及手术记录发现有门静脉癌栓8例, 无癌栓66例. 经病理镜下观察并免疫组织化学证实有血管内癌栓33例, 无血管内癌栓41例; 浸润性生长方式53例, 膨胀性生长方式21例; 累及肝被膜56例, 未累及肝被膜18例. 术前检测血液中甲胎蛋白(alpha-fetal protein, AFP)含量, ≤400 μg/L 53例, >400 μg/L 21例. 取25例肝硬化组织; 另取20例正常肝组织(肝内良性病变手术患者周边的正常肝组织)作为对照.
1.2.1 免疫组织化学: 所有标本均经40 g/L中性甲酫固定, 石蜡包埋, 3 μm厚切片. 采用免疫组织化学PV 6000法染色, 具体步骤严格按说明书操作. EGFR和E-cadherin抗体均为鼠抗人单克隆抗体(即用型); Cx43抗体为兔抗人多克隆抗体(即用型), 购自北京中杉公司; PV 6000通用型试剂盒购自Zymed公司, 并设阴性及阳性对照.
1.2.2 结果判断: 采用双盲法, 由两位有经验的高年资病理医师共同进行. EGFR、Cx43和E-cadherin阳性表达均表现为棕黄色颗粒状. EGFR和E-cadherin主要定位于细胞膜, 少量定位于细胞质, Cx43定位于细胞质. 根据阳性细胞染色范围(面积: ≤4%为0分, 5%-24%为1分, 25%-49%为2分, 50%-74%为3分, ≥75%为4分)和染色强度(根据染色强弱分为0分、1分、2分、3分)乘积进行计分并进行结果判断: 0-3分为阴性(-), 4-8分为阳性(+), 9-12分为强阳性(++).
统计学处理 采用JMTJFX简明统计分析13.0, 应用χ2检验和Spearman等级相关性分析, 若χ2检验条件不符合则采用确切概率法. 以P<0.05和P<0.01为差异有显著性, 具有统计学意义.
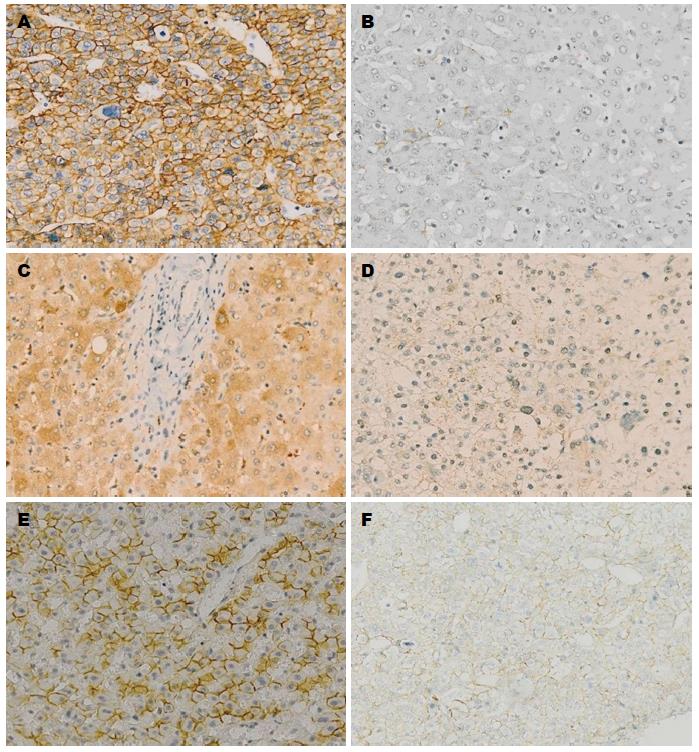
EGFR、Cx43和E-cadherin在HCC及正常肝组织中的表达(图1): EGFR在HCC组织中呈强阳性表达(图1A), 正常肝组织中呈弱阳性表达(图1B); Cx43在正常肝组织中呈强阳性表达(图1C), HCC组织中呈弱阳性表达(图1D). E-cadherin在正常肝组织中呈强阳性表达(图1E), HCC组织中呈弱阳性表达(图1F).
EGFR、Cx43和E-cadherin在HCC、肝硬化及正常肝组织中阳性表达不同(表1). EGFR在HCC组织中阳性率明显高于肝硬化和正常肝组织中阳性率, 差异有显著性(P<0.05, P<0.01); Cx43在HCC中阳性率明显低于肝硬化和正常肝组织中阳性率, 差异有显著性(P<0.01, P<0.01); E-cadherin在HCC中阳性率明显低于肝硬化和正常肝组织中阳性率, 与正常肝组织间差异有显著性(P<0.01).
EGFR阳性率随着肿瘤分化程度降低表达升高(42.86%、64.71%、80.77%), 低分化HCC阳性率明显高于高分化, 差异有显著性(P<0.05). Cx43在HCC中随着肿瘤分化程度降低阳性率降低(57.14%、23.53%、15.38%), 高分化HCC Cx43阳性率明显高于低分化, 差异有显著性(P<0.05); E-cadherin在HCC中随着肿瘤分化程度降低阳性率降低(64.29%、47.06%、19.23%), 高分化与低分化间差异有显著性(P<0.05), 中分化与低分化间差异有显著性(P<0.05). EGFR、Cx43和E-cadherin表达与肿瘤大小, TNM分期, 血管内癌栓, 浸润性生长方式和是否累及肝被膜间有相关性(P<0.05或P<0.01); 与患者年龄、性别、有无伴肝硬化背景、门静脉癌栓、术前血清AFP水平均无相关性(均P>0.05, 表2).
| 临床病理特征 | n | EGFR | Cx43 | E-cadherin | ||||||
| 74 | - | +-++ | P值 | - | +-++ | P值 | - | +-++ | P值 | |
| 性别 | >0.05 | >0.05 | ||||||||
| 男 | 56 | 19 | 37 | 38 | 18 | >0.05 | 34 | 22 | ||
| 女 | 18 | 6 | 12 | 16 | 2 | 10 | 8 | |||
| 年龄(岁) | >0.05 | >0.05 | ||||||||
| ≤50 | 26 | 12 | 14 | 20 | 6 | >0.05 | 17 | 9 | ||
| >50 | 48 | 13 | 35 | 34 | 14 | 27 | 21 | |||
| 分化程度 | ||||||||||
| 高分化 | 14 | 8 | 6 | <0.05a | 6 | 8 | <0.05a | 5 | 9 | <0.05a |
| 中分化 | 34 | 12 | 22 | >0.05c | 26 | 8 | >0.05c | 18 | 16 | >0.05c |
| 低分化 | 26 | 5 | 21 | >0.05e | 22 | 4 | >0.05e | 21 | 5 | <0.05e |
| TNM分期 | <0.05 | <0.05 | ||||||||
| I-II | 44 | 19 | 25 | 28 | 16 | <0.05 | 23 | 21 | ||
| III-IV | 30 | 6 | 24 | 26 | 4 | 24 | 6 | |||
| 肝硬化 | >0.05 | >0.05 | ||||||||
| 有 | 63 | 20 | 43 | 48 | 15 | >0.05 | 37 | 26 | ||
| 无 | 11 | 5 | 6 | 6 | 5 | 6 | 5 | |||
| 瘤体直径(cm) | <0.05 | <0.01 | ||||||||
| ≤5 | 46 | 20 | 26 | 29 | 17 | <0.05 | 21 | 25 | ||
| >5 | 28 | 5 | 23 | 25 | 3 | 23 | 5 | |||
| 血管内癌栓 | <0.05 | <0.05 | ||||||||
| 有 | 33 | 5 | 28 | 28 | 5 | <0.05 | 24 | 9 | ||
| 无 | 41 | 20 | 21 | 26 | 15 | 20 | 21 | |||
| 门静脉癌栓 | >0.05 | >0.05 | ||||||||
| 有 | 8 | 3 | 5 | 5 | 3 | >0.05 | 4 | 4 | ||
| 无 | 66 | 22 | 44 | 49 | 17 | 40 | 26 | |||
| 术前AFP(μg/L) | >0.05 | >0.05 | ||||||||
| ≤400 | 53 | 20 | 33 | 36 | 17 | >0.05 | 33 | 20 | ||
| >400 | 21 | 5 | 16 | 18 | 3 | 11 | 10 | |||
| 生长方式 | <0.05 | <0.01 | ||||||||
| 浸润性 | 53 | 14 | 39 | 44 | 9 | <0.01 | 38 | 15 | ||
| 膨胀性 | 21 | 11 | 10 | 10 | 11 | 6 | 15 | |||
| 累及肝被膜 | <0.01 | <0.01 | ||||||||
| 累及 | 56 | 13 | 43 | 47 | 9 | <0.01 | 40 | 16 | ||
| 未累及 | 18 | 12 | 6 | 7 | 11 | 4 | 14 | |||
本组研究结果显示, 在HCC中EGFR表达增加, Cx43和E-cadherin表达减少, 经Spearman等级相关性分析, EGFR和Cx43、E-cadherin表达间呈负相关性(rs' = -0.3123, P = 0.0068; rs' = -0.2962, P = 0.0104, 表3).
| Cx43 | E-cadherin | ||||||||
| - | + | ++ | rs' | - | + | ++ | rs' | ||
| EGFR | - | 14 | 4 | 7 | -0.3123 | 12 | 3 | 10 | -0.2962 |
| + | 18 | 4 | 2 | 12 | 8 | 3 | |||
| ++ | 22 | 2 | 1 | 20 | 4 | 2 | |||
EGFR是生长因子受体家族的重要成员之一, 广泛表达于人体血管组织和多种正常细胞表面, 如上皮细胞、肝细胞、成纤维细胞、神经胶质细胞等[3]. 在多种上皮来源的恶性肿瘤, 如乳腺癌、胃癌、前列腺癌、非小细胞肺癌等细胞表面都有异常表达[4], 而且与肿瘤的组织学类型和侵袭力有关.
EGFR与HCC的关系目前尚未明确, 其作用机制可能为: (1)肝癌细胞可以通过自分泌EGF, 直接作用于细胞膜上的EGFR, 加速肿瘤细胞无抑制性生长; (2)EGFR的氨基酸排列和组成与某些癌基因的产物具有高度同源性, 使EGFR不依赖于EGF也能被激活, 受体的持续性激活可导致细胞不断性生长, 可能导致细胞恶性转化; (3)HCC组织中EGFR过表达, 加速肿瘤细胞生长. EGFR可能主要通过Ras/Raf/MEK/ERK/MAPK信号通路传递信号参与调节肝癌细胞的增殖与分化[5], 使肿瘤细胞过度增殖和表型恶性转化, 促进HCC的发生和发展.
本实验结果显示, EGFR在HCC组织中阳性率明显高于肝硬化组织与正常肝组织, 并且随着肿瘤分化程度降低, 恶性程度增高, 阳性率增加. EGFR高表达与HCC TNM分期、瘤体大小、伴有血管内癌栓、浸润性生长方式和累及肝被膜间有关. 该结果提示: EGFR高表达可能参与HCC的恶性转化, 与HCC的恶性程度、侵袭和转移有密切关系, 可作为判断HCC预后不良的一项重要指标.
目前研究发现: EGFR在多种实体瘤中均可呈高表达, 已经作为肿瘤治疗的一个新的靶点[6]. 在HCC中, 针对阻断EGFR的靶向治疗药物(抗EGFR单克隆抗体和小分子EGFR酪氨酸激酶抑制剂)已经应用于HCC临床试验Ⅱ期和Ⅲ期, 并取得一定的疗效[7]. 联合应用gemcitabine加oxaliplatin和erlotinib药物对控制晚期HCC患者疾病的进展有一定疗效, 并能适当延长患者无进展生存期[8].
Cx是存在于细胞间负责物质及信息交换的通道蛋白, 其正常表达对细胞增殖、分化、凋亡及机体的生长发育至关重要. 这种由间隙连接(gap junction, GJ)介导的细胞间物质、能量及信息的交换活动称为间隙连接细胞间通讯(gap junction intercellular communication, GJIC). Cx属于多基因家族, Cx43是间隙连接家族中分布最广的分子, 对组织细胞具有生长调控的作用, 连接蛋白基因水平升高可促进间隙连接的组装, 增加细胞间信号的交流, 使细胞之间的生长相互控制[9]. 近年来研究表明, Cx43表达异常(减少或缺失)与多种肿瘤的发生、发展及转移密切相关[10], 而表达异常主要是表达水平的下调, 而非基因的丢失或突变[11].
本研究结果显示, Cx43蛋白在正常肝组织、肝硬化和HCC中阳性率逐渐降低, HCC中阳性率明显低于肝硬化和正常肝组织, 与二者间比较有统计学意义; Cx43阳性表达随着HCC的分化程度降低, 恶性程度增高, 阳性率降低, 且与肿瘤大小、TNM分期及伴有血管内癌栓、浸润性生长方式和累及肝被膜有关. 本研究结果与以往报道有一致性[12], Cx43表达与HCC的浸润性生长方式和是否累及肝被膜间的关系尚未见报道. HCC中Cx43表达降低, 提示癌细胞GJIC异常, 机体对细胞的监视和调控能力减弱, 使细胞之间的生长相互控制减弱, 促进细胞过度克隆生长, 同时细胞凋亡功能减弱, 可导致肿瘤的发生和发展; GJIC功能降低, 影响细胞间的黏附, 黏附机制减弱, 使细胞彼此分离, 是导致肿瘤细胞浸润和转移的重要机制之一. Lin等[9]研究结果支持这一观点. 针对HCC组织中Cx43表达减少, 提示Cx43可能成为抗肿瘤药物的潜在靶点, 提高癌组织中Cx43表达, 恢复GJIC功能, 抑制癌细胞的增殖, 降低癌细胞侵袭和转移, 有望为HCC的基因靶向治疗找到一条新的途径.
E-cadherin是一种钙离子依赖性细胞间黏附分子, 是调节细胞与细胞之间, 细胞与基质之间黏附反应的重要媒介, 对维持细胞的形态和极性及组织结构的完整性有重要作用[13]. E-cadherin在结肠癌、泌尿系统肿瘤、口腔上皮癌等多种肿瘤中呈低表达或表达缺失, 与多种肿瘤的发生发展和浸润转移及预后有关[14,15]. E-cadherin表达下降或缺失, 一方面, 可使肿瘤细胞间黏附力下降, 细胞间接触抑制功能下降, 促使细胞增殖增加, 同时还能抑制细胞凋亡; 另一方面, 肿瘤细胞容易离散而呈浸润性生长, 促进肿瘤扩散和转移, 而且可以诱导上皮细胞向间质细胞转化, 增强肿瘤细胞的侵袭力和抗凋亡能力[16].
本研究中, E-cadherin蛋白在HCC中阳性率明显低于肝硬化和正常肝组织, 随着HCC分化程度降低, 恶性程度升高, 表达减少; 且与肿瘤大小、TNM分期, 伴有血管内癌栓、累及肝被膜和浸润性生长方式有关, 且随着肿瘤临床病程进展, 侵袭性加强, E-cadherin表达下降. 该结果同Armeanu-Ebinger等[17]研究基本一致. HCC中E-cadherin表达下降, 肿瘤细胞间黏附力下降, 细胞接触抑制功能减弱, 促进细胞增殖, 导致HCC发生, 同时肿瘤细胞获得高侵袭性, 促进肝癌细胞扩散和转移. E-cadherin异常表达与HCC的恶性生物学行为密切相关, 表达减弱可促进癌细胞的浸润和转移, 提示E-cadherin是反映HCC恶性生物学行为和预后的重要标志物.
本研究显示, HCC组织中, EGFR表达增加, Cx43和E-cadherin表达减少, EGFR与Cx43、E-cadherin在HCC发生发展中具有反向调节作用, 三者协同作用共同参与HCC的发生和演进过程.
EGFR和Cx43在HCC中具有反向调节作用, 王凤翔等[18]研究EGF对人视网膜色素上皮细胞胞间通讯功能和Cx43表达关系的影响发现, 经EGF处理后的人视网膜色素上皮细胞Cx43表达明显降低, 并且与EGF的浓度呈正相关性. 该结果提示, EGF可以降低细胞间隙连接通讯功能, 减少Cx43蛋白的表达, 降低细胞间接触抑制, 刺激细胞的生长; 而EGF发挥其功能必须通过与其受体(EGFR)结合才能完成, 则EGFR的表达可以影响EGF的功能. 本实验结果表明, HCC组织中EGFR高表达, Cx43低表达, 高表达的EGFR可以通过EGF作用, 使Cx43蛋白在HCC组织中表达下调, 降低肝癌细胞间缝隙连接功能, 降低细胞间接触性抑制, 刺激细胞过度增殖分化, 降低细胞的凋亡, 促进HCC的发生和发展.
EGFR和E-cadherin在HCC组织中表达具有负相关性, 其具体作用机制尚不清楚. Jones等[19]对乳腺癌中EGFR和E-cadherin表达关系的研究发现, E-cadherin表达下降与EGFR表达呈明显相关性, 在细胞水平上, EGFR和E-cadherin共存于细胞间的粘着小带处, 并与β-catenin相连, 当EGFR结合配体, 受体自身酪氨酸磷酸化, 使得E-cadherin从肌动蛋白丝上解离下来, 使细胞的黏附功能破坏, 促进肿瘤细胞的生长与转移.
肝硬化是一个长期持续慢性肝损伤后的复杂病理过程, 导致肝硬化的原因很多, 在我国最重要的原因是病毒性肝炎, 尤其是乙型肝炎和丙型肝炎. 但肝硬化的发生发展是一个多因素、多步骤的复杂过程, 受多方面因素的影响, 本实验结果显示, 肝硬化增生结节内EGFR阳性率明显高于正常肝组织, 二者间有显著性差异(P<0.01), 提示EGFR可能参与了肝硬化的发病过程; 且伴有肝硬化背景组(68.25%)HCC组织中EGFR阳性率高于无肝硬化背景组(54.55%), 提示EGFR可能参与了肝硬化向HCC转化的过程, 并与肝硬化最终发展成为HCC的过程有一定的相关性. 而Cx43、E-cadherin在肝硬化组织中阳性率低于正常肝组织, 同时发现伴有肝硬化背景组HCC组织中Cx43、E-cadherin阳性率低于无肝硬化背景组, 提示Cx43、E-cadherin缺失可能参与了肝硬化的发病过程, 且在肝硬化向HCC转化过程中发挥一定的作用, 其之间详细的作用机制尚未见报道, 有待于进一步探讨.
原发性肝细胞癌(hepatocellular carcinoma, HCC)是临床常见的恶性肿瘤之一, 发病率有逐年上升趋势, 且死亡率高. HCC发生和演进受多因素影响和多基因控制, 本文联合检测EGFR、Connexn43(Cx43)和E-cadherin与HCC的关系, 进一步探讨其发生发展, 浸润转移机制及预测预后, 为临床早期发现HCC和寻求更好的合理有效的基因靶向治疗方法提供理论依据.
单云峰, 副主任医师, 温州医学院第一附属医院肝胆外科
本文联合检测EGFR、Cx43和E-cadherin在正常肝组织、肝硬化组织和HCC中表达情况, 进一步综合探讨HCC发生机制; HCC 3种蛋白存在异常表达, 相应的3个基因可能成为抗肿瘤药物的潜在靶点, 有望为HCC的基因治疗找到新的途径. 3种蛋白在HCC发生发展中具有反向调节作用, 具体作用机制有待进一步明确.
Laskin等研究EGFR在多种肿瘤中呈高表达, 可作为肿瘤治疗的一个新的靶点. Berasain等研究HCC中针对阻断EGFR的靶向治疗药物已经应用于临床试验Ⅱ和Ⅲ期, 并取得较好的疗效.
本文联合检测EGFR、Cx43和E-cadherin在正常肝组织、肝硬化组织和HCC中表达情况, 进一步探讨HCC发生和演进过程, 寻求基因靶向治疗的新位点. 3种蛋白在HCC发生发展中具有反向调节作用及其与肝硬化发病机制的相关性, 目前尚未见报道.
检测HCC中3种蛋白的表达, 可以预测HCC的恶性生物学行为和判断预后. 阻断EGFR基因的靶向治疗药物已经应用于临床试验, 并取得较好的效果; 针对Cx43和E-cadherin基因治疗有望成为新的靶向治疗位点.
本文选题新颖, 研究方法科学, 结果可靠, 对临床肝癌的防治有重要的指导意义.
编辑: 黄新珍 电编:闫晋利
| 2. | Bosman F H, Carneiro F, Hruban R H. WHO classification of tumors of the digestive system. 4th ed, Lyon: IARC 2010; 196-261. |
| 3. | Sako Y, Minoghchi S, Yanagida T. Single-molecule imaging of EGFR signalling on the surface of living cells. Nat Cell Biol. 2000;2:168-172. [PubMed] [DOI] |
| 5. | Okano J, Nagahara T, Matsumoto K, Murawaki Y. Caffeine inhibits the proliferation of liver cancer cells and activates the MEK/ERK/EGFR signalling pathway. Basic Clin Pharmacol Toxicol. 2008;102:543-551. [PubMed] [DOI] |
| 6. | Laskin JJ, Sandler AB. Epidermal growth factor receptor: a promising target in solid tumours. Cancer Treat Rev. 2004;30:1-17. [PubMed] [DOI] |
| 7. | Berasain C, Perugorria MJ, Latasa MU, Castillo J, Goñi S, Santamaría M, Prieto J, Avila MA. The epidermal growth factor receptor: a link between inflammation and liver cancer. Exp Biol Med (Maywood). 2009;234:713-725. [PubMed] [DOI] |
| 8. | Asnacios A, Fartoux L, Romano O, Tesmoingt C, Louafi S S, Mansoubakht T, Artru P, Poynard T, Rosmorduc O, Hebbar M. Gemcitabine plus oxaliplatin (GEMOX) combined with cetuximab in patients with progressive advanced stage hepatocellular carcinoma: results of a multicenter phase 2 study. Cancer. 2008;112:2733-2739. [PubMed] [DOI] |
| 9. | Lin FL, Chang CI, Chuang KP, Wang CY, Liu HJ. Advanced glycation end products down-regulate gap junctions in human hepatoma SKHep 1 cells via the activation of Src-dependent ERK1/2 and JNK/SAPK/AP1 signaling pathways. J Agric Food Chem. 2010;58:8636-8642. [PubMed] [DOI] |
| 10. | Chen JT, Cheng YW, Chou MC, Sen-Lin T, Lai WW, Ho WL, Lee H. The correlation between aberrant connexin 43 mRNA expression induced by promoter methylation and nodal micrometastasis in non-small cell lung cancer. Clin Cancer Res. 2003;9:4200-4204. [PubMed] |
| 11. | Krutovskikh VA, Troyanovsky SM, Piccoli C, Tsuda H, Asamoto M, Yamasaki H. Differential effect of subcellular localization of communication impairing gap junction protein connexin43 on tumor cell growth in vivo. Oncogene. 2000;19:505-513. [PubMed] [DOI] |
| 13. | Birchmeier W, Behrens J. Cadherin expression in carcinomas: role in the formation of cell junctions and the prevention of invasiveness. Biochim Biophys Acta. 1994;1198:11-26. [PubMed] [DOI] |
| 14. | Pyo SW, Hashimoto M, Kim YS, Kim CH, Lee SH, Johnson KR, Wheelock MJ, Park JU. Expression of E-cadherin, P-cadherin and N-cadherin in oral squamous cell carcinoma: correlation with the clinicopathologic features and patient outcome. J Craniomaxillofac Surg. 2007;35:1-9. [PubMed] [DOI] |
| 15. | Lascombe I, Clairotte A, Fauconnet S, Bernardini S, Wallerand H, Kantelip B, Bittard H. N-cadherin as a novel prognostic marker of progression in superficial urothelial tumors. Clin Cancer Res. 2006;12:2780-2787. [PubMed] [DOI] |
| 16. | Onder TT, Gupta PB, Mani SA, Yang J, Lander ES, Weinberg RA. Loss of E-cadherin promotes metastasis via multiple downstream transcriptional pathways. Cancer Res. 2008;68:3645-3654. [PubMed] [DOI] |
| 17. | Armeanu-Ebinger S, Wenz J, Seitz G, Leuschner I, Handgretinger R, Mau-Holzmann UA, Bonin M, Sipos B, Fuchs J, Warmann SW. Characterisation of the cell line HC-AFW1 derived from a pediatric hepatocellular carcinoma. PLoS One. 2012;7:e38223. [PubMed] [DOI] |
| 19. | Jones JL, Royall JE, Walker RA. E-cadherin relates to EGFR expression and lymph node metastasis in primary breast carcinoma. Br J Cancer. 1996;74:1237-1241. [PubMed] [DOI] |