修回日期: 2013-04-22
接受日期: 2013-05-12
在线出版日期: 2013-06-18
目的: 通过动态观察基质金属蛋白酶(matrix metalloproteinases, MMPs)和其抑制物1型金属蛋白酶组织抑制剂(type-1 tissue inhibitor of metalloproteinases, TIMP-1)大鼠酒精性肝纤维化(alcohol liver fibrosis, ALF)形成中的变化, 探讨在ALF形成中MMPs纤溶途径的作用.
方法: ♂SD大鼠随机分为空白组、四氯化碳(CCl4)组和造模组. 造模组采用56度二锅头酒、玉米油、吡唑混合物灌胃联合腹腔注射CCl4橄榄油溶液(CCl4:橄榄油 = 1:3)的方法造模型. 分别于第4、8、10、12周处死大鼠, 观察大鼠肝功能变化, 肝组织病理学改变. 采用蛋白印迹法、荧光定量PCR法检测MMP2、MMP9和TIMP-1蛋白和mRNA表达的动态变化.
结果: 与同期空白组大鼠相比, CCl4组大鼠体质量、肝质量、肝体比及肝功能均无明显变化(P>0.05), 而模型组大鼠体质量明显降低; 肝质量、肝体比明显增加, 转氨酶显著升高, 肝纤维化程度明显加重, 空白组和CCl4组大鼠肝组织MMP-2、MMP-9、TIMP-1蛋白及mRNA表达之间无显著性差异, 而模型组大鼠肝组织MMP-2、MMP-9、TIMP-1蛋白及mRNA表达显著高于空白组(P<0.01)随着肝纤维化的形成, MMP-2、MMP-9和TIMP-1的表达均逐渐增强, TIMP-1的表达明显强于相应的MMP-2或MMP-9.
结论: TIMP-1过多增长, MMP-2及MMP-9的生成相对不足, 促进了ALF的形成. 抑制TIMP-1的过度表达, 或者增加MMP-2及MMP-9的表达可能是治疗ALF的重要途径之一.
核心提示: 在酒精性肝纤维化(alcohol liver fibrosis, ALF)形成过程中, 1型金属蛋白酶组织抑制剂(type-1 tissue inhibitor of metalloproteinases, TIMP-1)过多增长, 基质金属蛋白酶(matrix metalloproteinases, MMPs)-2及MMP-9相对不足, MMPs与TIMPs之间的平衡被破坏, 肝细胞微环境稳态失衡, 导致细胞外基质(extracellular matrix)过多沉积的是ALF形成的重要机制, 抑制TIMP-1的过度表达, 或者增加MMP-2及MMP-9的表达可能是治疗ALF的重要途径之一.
引文著录: 陈珺明, 田淑霞, 邢练军, 郑培永, 季光. 基质金属蛋白酶纤溶系统在大鼠酒精性肝纤维化形成中的作用. 世界华人消化杂志 2013; 21(17): 1595-1601
Revised: April 22, 2013
Accepted: May 12, 2013
Published online: June 18, 2013
AIM: To study the role of matrix metalloproteinases and tissue inhibitor of metalloproteinases type-1 in alcoholic liver fibrosis (ALF) in rats by dynamically monitoring their expression in ALF.
METHODS: SD rats were randomly divided into three groups: a control group, a CCl4 group and an experimental group. The experiment group was intragastrically given a mixture (560 mL/L alcohol, 10 mL/kg; corn oil 2 mL/kg; pyrazole 25 mg/kg) once a day and an intraperitoneal injection of 0.3 mL/kg 25% CCl4 solution (in olive oil) twice a week. The CCl4 group received an intraperitoneal injection of CCl4 solution and was intragastrically given equal volume of normal saline (12 mL/kg per day). The control group was given equal volume of normal saline both intraperitoneally and intragastrically. The rats were anaesthetized and killed 4, 8, 10 and 12 wk after modeling. Serum levels of ALT and AST were measured. Pathological changes in liver tissues were observed. The expression of MMP2, MMP9 and TIMP-1 was detected by Western blot and real-time PCR.
RESULTS: Compared to the control group, the CCl4 group showed no significant changes in body weight, liver weight, liver/body weight ratio and serum transaminase levels, but the experimental group had significantly decreased body weight and significantly increased liver weight, liver/body weight ratio and serum transaminases. In the experimental group, with the increase in the severity of liver fibrosis, MMP2, MMP9 and TIMP-1 levels were gradually elevated, and expression of TIMP-1 increased more obviously than that of MMP2 and MMP9.
CONCLUSION: MMP2, MMP9 and TIMP-1 may play an important role in the pathogenesis of ALF in rats.
- Citation: Chen JM, Tian SX, Xing LJ, Zheng PY, Ji G. Role of matrix metalloproteinases and tissue inhibitor of metalloproteinases type-1 in the development of alcoholic liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(17): 1595-1601
- URL: https://www.wjgnet.com/1009-3079/full/v21/i17/1595.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i17.1595
肝纤维化是继发于肝脏炎症或损伤后组织修复过程中的代偿反应, 以肝内细胞外基质(extracellular matrix, ECM)过度沉积, 结缔组织增生为病理特征, 是各种慢性肝病最后发展为肝硬化的必经阶段, 因此积极控制肝纤维化进展具有重要的临床意义. 基质金属蛋白酶(matrix metalloproteinases, MMPs)主要功能是降解ECM成分. 而1型金属蛋白酶组织抑制剂(type-1 tissue inhibitor of metalloproteinases, TIMP-1)是组织中MMPs的主要内源性抑制因子. MMPs与TIMPs在肝脏中维持一种动态平衡的状态是肝脏保持正常功能的基础之一. 正常情况下, 当有过量的ECM产生时, 会被MMPs降解, 同时TIMP-1又适当抑制着MMPs的活性, 不至于损伤正常肝脏组织. 一旦有各种致病因子打破这种动态平衡, 则可导致MMPs活性受到影响, 造成ECM堆积, 最终发生肝纤维化. 但这一机制在酒精性肝纤维化(alcohol liver fibrosis, ALF)中的作用尚无报道. 本研究通过体内实验, 观察MMPs纤溶途径在ALF的动态变化. 探讨MMPs纤溶途径在ALF形成中的作用.
SPF级♂SD大鼠(上海中医药大学龙华医院实验动物中心)150只, 体质量260 g±20 g, 许可证号: SCXK(沪)2007-0005, 分笼饲养, 室温15 ℃-25 ℃, 自由饮水, 普通饲料喂养. HE及Masson染液(上海虹桥乐翔医用试剂有限公司); TRIzol、逆转录(reverse transcription, RT)试剂盒(美国Invitrogen公司); DNA Marker(上海申能博彩生物科技有限公司); SYBR Green Supermix(日本东洋公司); 兔抗大鼠MMP2单克隆抗体试剂盒、兔抗大鼠MMP-9单克隆抗体试剂盒、羊抗大鼠TIMP-1单克隆抗体试剂盒(Santa Cruz Biotechnology INC); UV-2102C分光光度计(Uniqem公司); 凝胶成像系统(上海四星生物技术有限公司); 实时荧光聚合酶链式反应ABI7300型检测仪(美国ABI公司); 引物由上海英骏生物科技有限公司合成, 序列见表1.
| 基因名称 | 引物序列 |
| MMP-2 | Forward: 5'-ACTCCCACTTTGATGACGAC-3' |
| Reverse: 5'-GAAGAGGAAAGGGAACTTGC-3' | |
| MMP-9 | Forward: 5'-GCACAGTGAGTGTGGCTGG-3' |
| Reverse: 5'-GGTGGATATGAGGGTGATGG-3' | |
| TIMP-1 | Forward: 5'-CCTCAGAAGTCAACCAGACC-3' |
| Reverse: 5'-CTCCGACCTGTGGAAGTATC-3' |
1.2.1 动物分组及处理: 大鼠随机分为空白组10只, CCl4组10只, 其余130只为造模组. 造模参考文献方法[1], 10 mL/(kg·d)56度二锅头酒、2 mL/(kg·d)玉米油、25 mg/(kg·d)吡唑混合物灌胃, 1次/d; 第2周起按0.3 mL/(kg·d)剂量予腹腔注射微量CCl4橄榄油溶液(CCl4:橄榄油 = 1:3), 2次/wk. CCl4组予与模型组等量的CCl4橄榄油溶液腹腔注射, 并以等体积生理盐水灌胃. 空白组予与造模组等体积生理盐水腹腔注射和灌胃. 第4、8、10、12周以盐酸氯胺酮腹腔注射麻醉, 腹主动脉采血后处死动物, 常规留取血清. 摘取肝脏称质量后, 于肝右叶切取肝组织2块, 4%甲醛溶液固定, 用于观察肝脏病理学变化.
1.2.2 指标检测: (1)ALF大鼠造模过程中肝功能变化: 赖氏法检测大鼠血清丙氨酸氨基转移酶和门冬氨酸氨基转移酶活性, 均采用7170S型自动检测仪检测; (2)病理学检测: HE染色, 观察肝组织病理损害情况. Masson染色后行肝纤维化程度评分, 评分标准参照文献[2], 汇管区纤维组织无增生为"-"; 增生后面积占肝小叶1/3以下为"+"; 占肝小叶1/3-2/3为"++"; 占肝小叶2/3以上为"+++". 每个"+"记1分, 每个标本记总分. 积分越高, 表明肝脏纤维化程度及病理损害越重; (3)Western blot法: 100 mg肝组织置于1 mL RIPA裂解液4 ℃匀浆, 12000 g离心取上清测定总蛋白含量. 取30 μg总蛋白进行8%-10% SDS-PAGE凝胶电泳. 经硝酸纤维素膜转移后, 丽春红染色观察转膜效率. 50 g/L脱脂牛奶中封闭, 分别加入特异性兔抗大鼠MMP-2、MMP-9或TIMP-1单克隆抗体(1:1000稀释)、鼠抗鼠GAPDH单克隆抗体及辣根过氧化物酶标记的抗兔、抗鼠多克隆抗体(1:5000稀释)进行免疫反应, 用凝胶图像处理系统分析目标; (4)Real-Time PCR法: 肝组织100 mg, 匀浆后用TRIzol抽提总RNA并测定含量及纯度. 用RT试剂盒进行实时PCR反应. 反应体系为25 μL: cDNA和上下游引物各0.5 μL, SYBS green supermix 12.5 μL, 去离子水11 μL. 循环条件: 95 ℃预变性3 min, 95 ℃变性30 s, 62 ℃退火45 s, 72 ℃延伸45 s, 60次循环, 55 ℃ 10 min. 实时数据采用仪器自带软件ABI Prism 7300 SDS Software分析, 计算出MMP-2、MMP-9和TIMP-1 mRNA的相对表达量.
统计学处理 应用SPSS18.0软件进行分析, 各组计量资料以mean±SD表示, 用单因素方差分析, 两两比较用LSD-t法, 等级资料采用Kruskall-Wallis法检验. 检验水准a = 0.05.
与空白组大鼠相比, CCl4组大鼠体质量无明显变化(P>0.05), 而模型组体质量明显降低(P<0.05); 肝质量、肝体比明显增加(P<0.05)(表2).
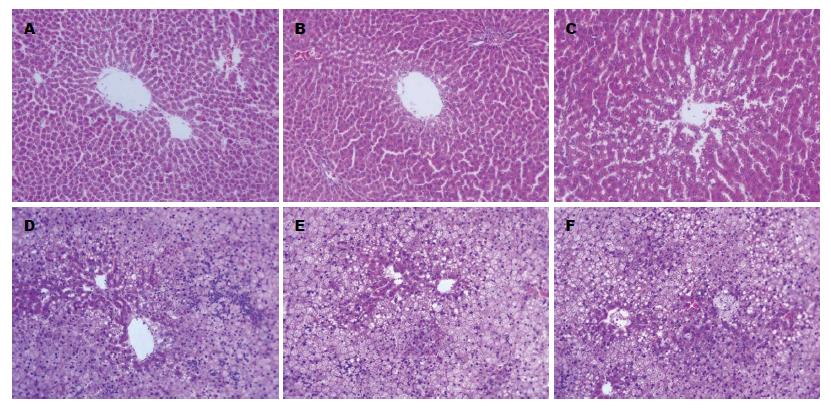
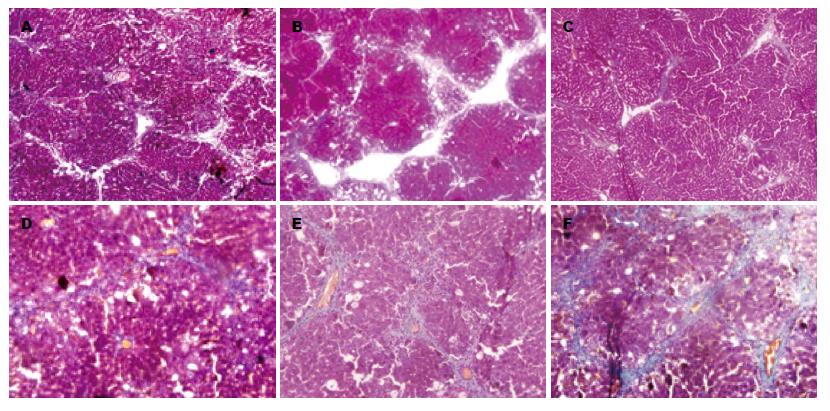
HE染色显示, 空白组和CCl4组大鼠肝小叶结构完整, 肝细胞放射状排列, 无变性、坏死和炎细胞浸润. Masson染色显示肝小叶中央静脉外少量绿染胶原纤维分布, 汇管区管壁偶尔有少许细小的绿染胶原纤维包围. 与空白组比较, 模型组大鼠肝小叶形成弥漫性以大泡为主的混合性脂肪变, 肝细胞坏死增多, 小叶各带可见不同程度的点状坏死及Mallory小体形成, 可见较多量多核细胞、淋巴细胞及单核细胞浸润. 肝小叶中央静脉外及汇管区周围有大量绿染胶原纤维包绕, 部分包绕肝小叶, 但无假小叶形成, 窦周亦有明显的纤维组织增生. 对大鼠肝纤维化进行评分(Masson染色, 表3, 图1, 图2).
| 分组 | 肝纤维化程度 | ||||
| - | + | ++ | +++ | ||
| CCl4组 | 7 | 3 | 0 | 0 | |
| 模型组 | 0 | 3 | 5 | 4 | χ2 = 24.9113, P<0.01 |
与同期空白组相比, CCl4组肝功能无明显差异(P>0.05), ALF组大鼠转氨酶第10、12周显著升高(P<0.05, P<0.01)(表4).
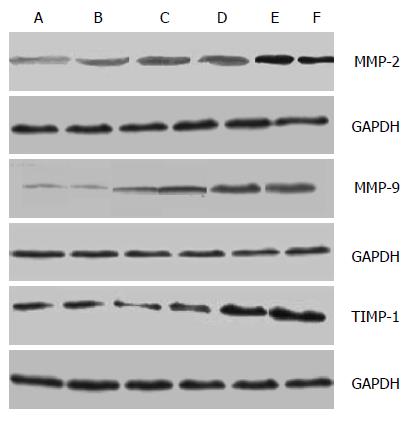
空白组和CCl4组大鼠肝组织MMP-2、MMP-9、TIMP-1蛋白表达之间无显著性差异(P>0.05). 模型组大鼠肝组织MMP-2、MMP-9、TIMP-1蛋白表达显著高于空白组(P<0.01), 三者均同步升高, 三者升高幅度之间无明显差异(图3).
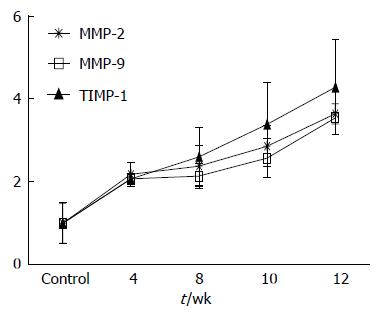
空白组和CCl4组大鼠肝组织MMP-2、MMP-9、TIMP-1蛋白表达之间无显著性差异(P>0.0.5). 模型组大鼠肝组织MMP-2、MMP-9、TIMP-1蛋白表达显著高于空白组(P<0.01), TIMP-1升幅高于MMP-2及MMP-9(图4).
酒精性肝病(alcoholic liver disease, ALD)是慢性肝病的常见形式之一. ALD具体的致病机制不详, 大部分学者认为可能主要与细胞死亡、组织损伤有关[3-5]. 过量饮酒是世界公认的致病、致残、致死原因之一[6,7]. ALD包括轻症ALD、酒精性脂肪肝、酒精性肝炎、ALF和酒精性肝硬化5种类型[8]. ALF是肝脏对慢性损伤的一种修复反应, 其进一步发展可引起肝小叶改建、假小叶和结节形成, 进入酒精性肝硬化[9]. 肝纤维化为一动态病理过程, 属可逆性病变[10,11]. 因此, 明确肝纤维化的发病机制, 阻断、抑制或逆转肝纤维化是成为临床治疗ALD的一个十分重要的靶点[12-14]. 本实验在参考以前各种造模方法和大量前期实验的基础上, 采用复合因素制作ALF大鼠模型, 本研究结果提示: 采用微量CCl4对照, 与空白组无论是肝质量、体质量、肝功能、肝纤维化评分以及在MMP-2、MMP-9和TIMP-1均无明显差异, 充分说明虽然CCl4可诱导大鼠肝纤维化形成, 但在本实验中仅起协同作用[15,16]. 模型组大鼠肝纤维化程度明显升高. 模型组ALT和AST升高明显, 说明乙醇对肝细胞造成损伤, 符合ALF的临床表现. 由上可见, 复合因素制备ALF模型具有造模周期缩短、乙醇给予量可控、肝脏病理改变稳定、该模型不失为一种简便、快捷的ALF模型. 肝纤维化的病理特征是ECM的堆积, 破坏肝的组织结构和损坏肝功能[17]. 肝纤维化发生这一过程的最终结果既是ECM合成过多, 更大程度上尤其后期是由于降解的减少引起的[18,19]. MMPs和TIMPs二者参与了肝纤维化形成和降解恢复的全过程[20,21]. MMPs家族主要功能是降解ECM成分, 肝纤维化时, 在ECM降解中起关键作用的MMPs为MMP-2、MMP-9、MMP-1、MMP-3[22-25]. 较多的研究认为MMP-2在纤维化阶段升高, 而在肝硬化和肝纤维化恢复期逐渐降低. 朱跃科等[26]研究发现, MMP-2从基因水平、蛋白水平及酶活性在肝纤维化的形成过程中均增高. MMP-2的表达与酶活性在肝纤维化逆转过程中逐渐降低, 说明MMP-2与肝纤维化的发生发展密切相关. Leroy等[27]发现MMP-9在慢性丙型肝炎患者血清中MMP-9的水平与纤维化分期呈明显负相关, 即随着疾病的进展其水平逐渐降低. 激活的MMPs主要被特异的TIMPs所抑制, 他是组织中MMP的主要内源性抑制因子. 目前已发现的TIMP肝内主要存在TIMP-1和TIMP-2[28], MMPs与TIMPs在肝脏中维持一种平衡统一的状态, 当有过量的ECM产生时, 会被MMPs降解, 同时TIMPs又适当抑制着MMPs的活性, 不至于损伤正常肝脏组织. 一旦有各种致病因子打破这种统一, 从而导致肝纤维化的发生、发展. 在肝纤维化发展过程中, TIMP-1的表达增强, 增加了胶原纤维的积累并促进肝纤维化的发展, 是肝纤维化形成的重要因素[29]. Yoshiji等[30,31]、通过TIMP-1转基因小鼠模型研究证实, 在CCl4肝损伤时, TIMP-1转基因小鼠过度表达TIMP-1, 肝纤维化发展比野生型小鼠更快, 范围更广, 但在无损伤原因时, TIMP-1转基因小鼠过度表达TIMR-1但无肝纤维化, 表明肝纤维化发展是ECM对肝损伤的反应性合成增加与TIMP-1介导的ECM降解减少的共同结果. 相反, 用MMP-9的突变蛋白作为TIMP-1的清除剂, 也可因为增加基质的吸收而使纤维化减轻[32]. 在本研究中发现, 随着肝纤维化的进展, MMP-2、MMP-9及TIMP-1均同时升高, TIMP-1的升高幅度超过MMP-2及MMP-9, 提示在ALF的形成中, MMPs与TIMPs之间的平衡被打破, 导致ECM的过多沉积并促进了ALF的发生与发展.
总之, 在ALF形成过程中, TIMP-1过多增长, MMP-2及MMP-9相对不足, MMPs与TIMPs之间的平衡被破坏, 肝细胞微环境稳态失衡, 导致ECM过多沉积的是ALF形成的重要机制, 抑制TIMP-1的过度表达, 或者增加MMP-2及MMP-9的表达可能是治疗ALF的重要途径之一.
酒精性肝纤维化(alcohol liver fibrosis, ALF)在肝硬化的病因构成比从1999年的10.8%上升到2003年的24.0%. 如何有效地预防和治疗酒精性肝病, 是国民经济和社会发展中亟待解决的问题. 现代研究表明肝纤维化是可以逆转的.
鲁玉辉, 副教授, 福建中医药大学中医学院; 倪润洲, 教授, 南通大学附属医院消化内科
基质金属蛋白酶(matrix metalloproteinases, MMPs)可以调解细胞外基质(extracellular matrix, ECM)的含量, 而在ALF中此类研究尚未见报道.
季光等对酒精性肝病进行了多年研究, 并用中药进行干预, 收到了不错的效果.
部分肺、肾纤维化研究报告中, MMPs在纤维化形成后逐渐下降, 而其抑制因子迅速升高. 而在本研究中发现在肝纤维化形成后MMPs及其抑制因子均继续升高, 只是抑制因子升高更快.
抑制TIMP-1的过度表达或者增加MMP-2及MMP-9的表达, 调解MMPs与TIMPs之间的平衡, 可能是治疗ALF的重要途径之一.
本文题目简明, 研究目的明确, 科学问题与结论一致, 掌握了国内外相关研究进展, 并有一定的创新性. 对于揭示肝纤维化形成的分子机制及寻求药物的多途径、多靶点干预有一定意义.
编辑: 田滢 电编:鲁亚静
| 3. | O'Shea RS, Dasarathy S, McCullough AJ. Alcoholic liver disease. Hepatology. 2010;51:307-328. [PubMed] |
| 4. | Stickel F, Seitz HK. Alcoholic steatohepatitis. Best Pract Res Clin Gastroenterol. 2010;24:683-693. [PubMed] [DOI] |
| 5. | Miller AM, Horiguchi N, Jeong WI, Radaeva S, Gao B. Molecular mechanisms of alcoholic liver disease: innate immunity and cytokines. Alcohol Clin Exp Res. 2011;35:787-793. [PubMed] [DOI] |
| 6. | Li TK. Quantifying the risk for alcohol-use and alcohol-attributable health disorders: present findings and future research needs. J Gastroenterol Hepatol. 2008;23 Suppl 1:S2-S8. [PubMed] [DOI] |
| 7. | Setshedi M, Wands JR, Monte SM. Acetaldehyde adducts in alcoholic liver disease. Oxid Med Cell Longev. 2010;3:178-185. [PubMed] [DOI] |
| 8. | Arteel GE. New role of plasminogen activator inhibitor-1 in alcohol-induced liver injury. J Gastroenterol Hepatol. 2008;23 Suppl 1:S54-S59. [PubMed] [DOI] |
| 9. | Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S79-S84. [PubMed] |
| 10. | Friedman SL. Reversibility of hepatic fibrosis and cirrhosis--is it all hype? Nat Clin Pract Gastroenterol Hepatol. 2007;4:236-237. [PubMed] [DOI] |
| 11. | Gunzerath L, Hewitt BG, Li TK, Warren KR. Alcohol research: past, present, and future. Ann N Y Acad Sci. 2011;1216:1-23. [PubMed] [DOI] |
| 12. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] [DOI] |
| 13. | Frazier TH, Stocker AM, Kershner NA, Marsano LS, McClain CJ. Treatment of alcoholic liver disease. Therap Adv Gastroenterol. 2011;4:63-81. [PubMed] [DOI] |
| 14. | Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. Best Pract Res Clin Gastroenterol. 2011;25:195-206. [PubMed] [DOI] |
| 15. | Lieber CS, Weiss DG, Morgan TR, Paronetto F. Aspartate aminotransferase to platelet ratio index in patients with alcoholic liver fibrosis. Am J Gastroenterol. 2006;101:1500-1508. [PubMed] |
| 16. | Mueller S, Millonig G, Sarovska L, Friedrich S, Reimann FM, Pritsch M, Eisele S, Stickel F, Longerich T, Schirmacher P. Increased liver stiffness in alcoholic liver disease: differentiating fibrosis from steatohepatitis. World J Gastroenterol. 2010;16:966-972. [PubMed] |
| 17. | Stickel F, Urbaschek R, Schuppan D, Poeschl G, Oesterling C, Conradt C, McCuskey RS, Simanowski UA, Seitz HK. Serum collagen type VI and XIV and hyaluronic acid as early indicators for altered connective tissue turnover in alcoholic liver disease. Dig Dis Sci. 2001;46:2025-2032. [PubMed] |
| 18. | Chambers JC, Zhang W, Sehmi J, Li X, Wass MN, Van der Harst P, Holm H, Sanna S, Kavousi M, Baumeister SE. Genome-wide association study identifies loci influencing concentrations of liver enzymes in plasma. Nat Genet. 2011;43:1131-1138. [PubMed] |
| 19. | Mir RA, Chauhan SS. Down regulation of a matrix degrading cysteine protease cathepsin L, by acetaldehyde: role of C/EBPα. PLoS One. 2011;6:e20768. [DOI] |
| 20. | Okazaki I, Watanabe T, Hozawa S, Arai M, Maruyama K. Molecular mechanism of the reversibility of hepatic fibrosis: with special reference to the role of matrix metalloproteinases. J Gastroenterol Hepatol. 2000;15 Suppl:D26-D32. [PubMed] |
| 21. | Zhang LJ, Chen YX, Chen ZX, Huang YH, Yu JP, Wang XZ. Effect of interleukin-10 and platelet-derived growth factor on expressions of matrix metalloproteinases-2 and tissue inhibitor of metalloproteinases-1 in rat fibrotic liver and cultured hepatic stellate cells. World J Gastroenterol. 2004;10:2574-2579. [PubMed] |
| 22. | Hemmann S, Graf J, Roderfeld M, Roeb E. Expression of MMPs and TIMPs in liver fibrosis - a systematic review with special emphasis on anti-fibrotic strategies. J Hepatol. 2007;46:955-975. [PubMed] |
| 23. | Zhou X, Hovell CJ, Pawley S, Hutchings MI, Arthur MJ, Iredale JP, Benyon RC. Expression of matrix metalloproteinase-2 and -14 persists during early resolution of experimental liver fibrosis and might contribute to fibrolysis. Liver Int. 2004;24:492-501. [PubMed] [DOI] |
| 24. | Galli A, Svegliati-Baroni G, Ceni E, Milani S, Ridolfi F, Salzano R, Tarocchi M, Grappone C, Pellegrini G, Benedetti A. Oxidative stress stimulates proliferation and invasiveness of hepatic stellate cells via a MMP2-mediated mechanism. Hepatology. 2005;41:1074-1084. [PubMed] [DOI] |
| 25. | Han YP, Yan C, Zhou L, Qin L, Tsukamoto H. A matrix metalloproteinase-9 activation cascade by hepatic stellate cells in trans-differentiation in the three-dimensional extracellular matrix. J Biol Chem. 2007;282:12928-12939. [PubMed] [DOI] |
| 27. | Leroy V, Monier F, Bottari S, Trocme C, Sturm N, Hilleret MN, Morel F, Zarski JP. Circulating matrix metalloproteinases 1, 2, 9 and their inhibitors TIMP-1 and TIMP-2 as serum markers of liver fibrosis in patients with chronic hepatitis C: comparison with PIIINP and hyaluronic acid. Am J Gastroenterol. 2004;99:271-279. [PubMed] |
| 28. | Adya R, Tan BK, Punn A, Chen J, Randeva HS: Visfatin induces human endothelial VEGF and MMP-2/9 production via MAPK and PI3K/Akt signalling pathways: novel insights into visfatin-induced angiogenesis. Cardiovasc Res. 2008;78:356-365. |
| 29. | Zheng WD, Zhang LJ, Shi MN, Chen ZX, Chen YX, Huang YH, Wang XZ. Expression of matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-1 in hepatic stellate cells during rat hepatic fibrosis and its intervention by IL-10. World J Gastroenterol. 2005;11:1753-1758. [PubMed] |
| 30. | Yoshiji H, Kuriyama S, Miyamoto Y, Thorgeirsson UP, Gomez DE, Kawata M, Yoshii J, Ikenaka Y, Noguchi R, Tsujinoue H. Tissue inhibitor of metalloproteinases-1 promotes liver fibrosis development in a transgenic mouse model. Hepatology. 2000;32:1248-1254. [PubMed] [DOI] |
| 31. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Nakatani T, Tsujinoue H, Yanase K, Namisaki T, Imazu H. Tissue inhibitor of metalloproteinases-1 attenuates spontaneous liver fibrosis resolution in the transgenic mouse. Hepatology. 2002;36:850-860. [PubMed] [DOI] |