修回日期: 2013-03-07
接受日期: 2013-03-29
在线出版日期: 2013-05-08
目的: 探讨三氧化二砷(arsenic trioxide, As2O3)粉针剂联合重组腺病毒介导的IκBαM抑制肝癌细胞增殖及对大鼠肝癌的治疗效果.
方法: MTT法检测不同浓度As2O3联合Ad-IκBαM对肝癌细胞增殖的抑制作用. 探讨体内As2O3联合Ad-IκBαM对二乙基亚硝胺诱发的大鼠肝癌的抑制作用, 并应用TUNEL法检测各处理组肝癌的凋亡指数.
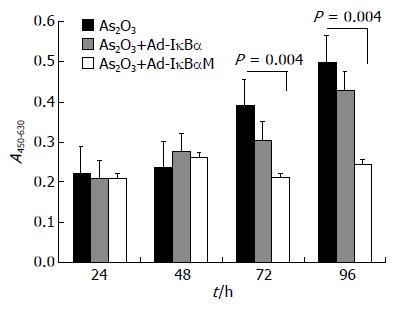
结果: As2O3处理肝癌细胞SMMC-7721的细胞毒作用存在剂量依赖性以及时间依赖性, 16 µmol/L的As2O3抑制率最高, 48、72、96 h分别为17.7%±5.3%、40.7%±2.5%、62.8%±5.4%. 16 µmol/L As2O3联合转染Ad-IκBαM处理组在72 h和96 h, 对肝癌细胞抑制率分别为68.3%±2.1%和81.9%±3.0%, 显著高于16 µmol/L As2O3联合Ad-IκBα组(P值分别为0.004). 二乙基亚硝胺于第16周诱发大鼠肝癌, 成瘤率约达80%. 各处理组成瘤大鼠(包括无菌生理盐水组、As2O3组、As2O3+Ad-IκBα组以及As2O3+Ad-IκBαM组)的生存期无明显差别. As2O3联合Ad-IκBαM处理组肝癌的凋亡率较其他处理组均显著增高.
结论: 腺病毒介导的IκBαM与As2O3具有协同作用, 转染Ad-IκBαM可以明显增强As2O3的抑制肝癌细胞增殖作用以及体内抑瘤作用.
核心提示: 腺病毒介导的IκBαM与三氧化二砷(arsenic trioxide, As2O3)具有协同作用, 转染重组腺病毒-IκBαM可以明显增强As2O3的抑制肝癌细胞增殖作用以及体内抑瘤作用.
引文著录: 杨雅雯, 刘丹, 刘婷, 胡丽红, 杜雅菊, 刘冰熔. 三氧化二砷粉针剂联合重组腺病毒介导的IκBαM治疗肝癌. 世界华人消化杂志 2013; 21(13): 1159-1163
Revised: March 7, 2013
Accepted: March 29, 2013
Published online: May 8, 2013
AIM: To analyze the inhibitory effect of arsenic trioxide (As2O3) combined with adenovirus carrying IκBαM (Ad-IκBαM) on proliferation of liver cancer cells in vitro and in vivo.
METHODS: The effect of As2O3 combined with Ad-IκBαM on liver cancer cell growth was assessed by MTT assay. Wistar rats were treated with diethylnitrosamine (DENA) for about 16 wk to induce liver cancer. The index of apoptosis was assessed by TUNEL assay.
RESULTS: As2O3 induced cellular toxicity in a dose- and time-dependent fashion in SMMC-7721 cells. MTT assay showed that the proliferation of SMMC-7721 cells was most significantly suppressed by As2O3 at a dose of 16 µmol/L, and the reduced rate of cell proliferation was 17.7% ± 5.3%, 40.7% ± 2.5% and 62.8% ± 5.4% at 48, 72 and 96 h, respectively. The reduced rate of cell proliferation at 72 and 96 h in cells treated with 16 µmol/L As2O3 and Ad-IκBαM was 68.3% ± 2.1% and 81.9% ± 3.0%, significantly higher than those in other groups (all P < 0.01). DENA treatment successfully induced tumors in rats at week 16. There was no significant difference in life span of liver cancer-bearing rats among each group. TUNEL assay demonstrated that treatment with As2O3 and Ad-IκBαM greatly enhanced apoptotic cell death.
CONCLUSION: Ad-IκBαM has a synergistic effect with As2O3 in inhibiting liver cancer cell proliferation in vitro and in vivo.
- Citation: Yang YW, Liu D, Liu T, Hu LH, Du YJ, Liu BR. Inhibitory effect of As2O3 combined with adenovirus carrying IκBαM on proliferation of liver cancer cells in vitro and in vivo. Shijie Huaren Xiaohua Zazhi 2013; 21(13): 1159-1163
- URL: https://www.wjgnet.com/1009-3079/full/v21/i13/1159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i13.1159
细胞核因子-κB(nuclear factor-κB, NF-κB)是一种广泛存在于细胞中的具有多向调节作用的蛋白质因子, 是恶性肿瘤抗凋亡的重要机制之一[1,2]. 三氧化二砷(arsenic trioxide, As2O3)在肿瘤治疗中的研究, 已经从血液系统肿瘤扩展到实体瘤, 研究表明As2O3可选择性抑制多种人类肿瘤细胞生长, 诱导肿瘤细胞凋亡与分化[3-8]. 在前期工作中, 我们用已经克隆成功的中国人IκBα基因定点诱变构建成NF-κB超抑制物IκBαM, 并在此基础上应用最新的腺病毒构建系统构建成重组腺病毒-IκBαM(adenovirus carrying-IκBαM, Ad-IκBαM)以及对照组腺病毒Ad-IκBα[9]. 本研究中我们应用粉针剂As2O3联合Ad-IκBαM进行肝癌的治疗研究, 为今后的肝癌基因治疗打下坚实的基础.
人肝癌细胞系SMMC-7721、人胚肾细胞系293T均购自中科院上海细胞所细胞库; 试验动物是6周龄Wistar大鼠, 共25只, 均为♂, 体质量为110 g±10 g, 购自哈医大二院动物中心洁净动物房. 分析纯的As2O3粉针剂购自北京五七六零一化工厂; 二乙基亚硝胺(diethylnitrosamine, DENA)为Sigma公司产品, 用纯净水配制成95 mg/L溶液, 每日新鲜配制并避光保存; TUNEL细胞凋亡原位检测试剂盒购自Roche公司; NF-κB P65小鼠单克隆抗体(一抗)及鼠SP免疫组织化学染色试剂盒均购自北京中山金桥生物技术有限公司.
1.2.1 重组腺病毒的构建: 含Ser32和36位丝氨酸定点诱变为丙氨酸的中国人IκBα基因编码区cDNA序列并表达绿色荧光蛋白(green fluorescent protein, GFP)的Ad-IκBαM、含未突变的中国人IκBα基因并表达GFP的重组腺病毒Ad-IκBα, 均系刘冰熔博士构建[9].
1.2.2 试验动物及动物模型制备: 试验动物随机分笼饲养, 每笼5只, 每日正常饲料喂饲, 将每日新鲜配制的DENA水溶液(浓度为95 mg/L)按每只大鼠20 mL/d药液饮饲(饮饲容器用避光容器). 所有动物均在相同条件下饲养.
1.2.3 肝癌细胞的体外增殖试验: 采用四甲基偶氮唑盐(MTT)方法检测, 取对数生长期人肝癌细胞系SMMC-7721分别转染实验组腺病毒Ad-IκBαM(2.0×108 pfu)和对照组腺病毒Ad-IκBα(2.0×108 pfu). 转染后24 h将各组细胞接种于96孔板中, 每组设6个复孔, 1000-2000个细胞/孔, 待细胞贴壁后分别加入不同浓度三氧化二砷使之终浓度为0、2、4、8和16 µmol/L. 分别取4个时间点进行检测, 分别为24、48、72和96 h. 检测前首先更换培养液100 µL/孔在培养箱继续培养, MTT溶液10 mL/孔, 反应1 h后, 选择450 nm和630 nm双波长测定各孔的吸光度值.
1.2.4 成瘤大鼠的处理: 实验分As2O3联合Ad-IκBαM组(注入药物为As2O3 2.2 mg/kg、碘化油0.5 mL/kg、Ad-IκBαM 2.0×108 pfu); As2O3联合Ad-IκBα组(As2O3 2.2 mg/kg、碘化油0.5 mL/kg、Ad-IκBα 2.0×108 pfu); As2O3组(As2O3 2.2 mg/kg、碘化油0.5 mL/kg); 生理盐水对照组(等体积生理盐水). 术前大鼠禁食12 h, 采用10 mg/mL戊巴比妥钠(按大鼠体质量30 mg/kg)腹腔注射麻醉. 应用29 G胰岛素针经肝固有动脉注射各组药物. 将各组大鼠分笼饲养2 wk后麻醉处死取出肝脏, 10%中性甲醛固定, 脱水、石蜡包埋处理.
1.2.5 免疫组织化学法检测NF-κB/P65的表达: 3%H2O2灭活、抗原修复、血清封闭、滴加1:100稀释的一抗, 4 ℃过夜; PBS洗涤3次, 每次5 min; 滴加二抗, 室温静置1 h, PBS洗涤3次; DAB显色5-10 min, 自来水浸洗终止反应, 苏木素复染2 min后盐酸乙醇分化、氨水返蓝, 封片, 读片.
1.2.6 TUNEL法检测凋亡: 3%H2O2灭活阻断内源性辣根过氧化物酶, PBS洗2次, 每次5 min, 2×SSC中80 ℃浸泡20 min, PBS洗2次, 每次5 min; 蛋白酶K消化0-20 min; PBS洗2次, 每次5 min, TdT缓冲液孵育10 min, TdT反应液37 ℃孵育1 h; 2×SSC溶液浸泡10 min, 终止反应; PBS洗2次, 每次5 min; 链卵白素标记的辣根过氧化物酶孵育30 min, PBS洗2次, 每次5 min; DAB显色5-10 min, 苏木素复染3-5 min, 封片. 凋亡指数的计算: 随机计数高倍视野下细胞每100个细胞中的阳性细胞数.
统计学处理 数据结果均采用mean±SD表示, 组间差异显著性分析采用配对t检验, 应用SPSS10.0统计软件进行数据分析.
As2O3对肝癌细胞SMMC-7721增殖的抑制作用具有时间依赖性和浓度依赖性, 16 µmol/L的As2O3对肝癌细胞的抑制率最高, 48、72、96 h分别为17.7%±5.3%、40.7%±2.5%、62.8%±5.4%. 如图1所示, 在72 h和96 h时间点, 16 µmol/L As2O3联合转染Ad-IκBαM处理组吸光光度值显著低于16 µmol/L As2O3联合转染Ad-IκBα组, 前者抑制率分别为68.3%±2.1%和81.9%±3.0%, 二者比较具有显著统计学差异(P值均为0.004).
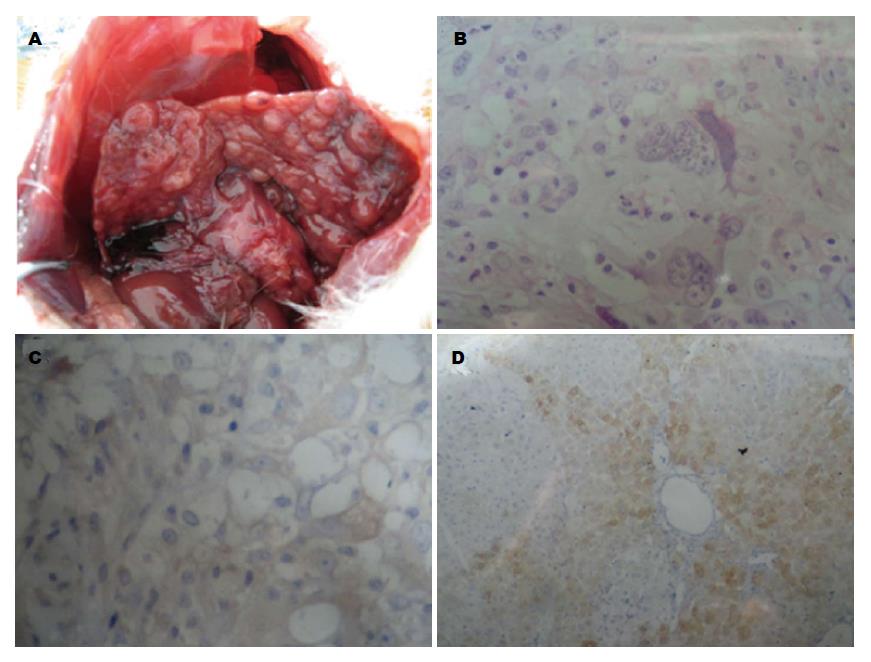
喂饮DENA 16 wk后大鼠开始出现精神萎靡, 活动减少, 进食饮水减少以及体质量下降, 大鼠肝脏表面粗糙并形成肿瘤(图2A), 成瘤率约为80%. 应用免疫组织化学方法检测各处理组肝癌中NF-κB/P65表达情况(图2C, D). 各处理组大鼠的生存期无显著差别.
肝细胞癌(hepatocellular carcinoma, HCC)是严重威胁人类生命的恶性肿瘤之一, 我国每年约有11万人死于肝癌, 占全球肝癌死亡人数的45%. 尽管手术切除和肝移植是HCC首选治疗方式, 但多数患者诊断时已不具备手术适应症, 且术后肿瘤复发率高以及肝移植的高额医疗成本限制了其普遍应用. 近年来肝癌的治疗模式逐渐向多元化发展, 除占有重要地位的化疗外, 基因治疗也成为具有广泛应用前景的治疗手段之一[10].
As2O3是中国传统医药"砒霜"的活性成分, 能够诱导多种实体瘤细胞和白血病细胞的凋亡[11-14]. 与以往对As2O3的研究一致, 我们的研究结果表明, 体外培养基中As2O3的浓度在2 μmol/L以上就可抑制肝癌细胞SMMC-7721的生长, 并且随着剂量的增加其抑制作用显著增强, 此外As2O3对细胞增殖的抑制作用具有明显的时间依赖性.
许多抗癌药物以诱导细胞凋亡作为治疗肿瘤的机制之一, 但是肿瘤细胞往往对抗癌药物诱导的细胞凋亡产生耐药性, 从而削弱治疗的效果[15,16]. 大量研究表明, 肿瘤细胞核转录因子NF-κB的活化是其耐药性产生机制之一. NF-κB通常以二聚体形式与其抑制蛋白IκB形成复合物, 以非活性形式存在于细胞质中, 在受到各种理化因素的作用后IκB将被磷酸化、降解, 因而NF-κB将会被解离、活化进入细胞核内发挥调节基因转录表达的作用, 参与免疫调节、细胞转化、肿瘤的发生发展和转移以及细胞凋亡. 因此, NF-κB一旦被激活可以诱导凋亡抑制基因表达, 对抗化疗药物引起的细胞凋亡, 造成肿瘤细胞的化疗抵抗[17-19]. 因此, 抑制NF-κB通路的活化将在肿瘤治疗中发挥重要作用[20-22].
在前期工作中我们应用新型腺病毒载体构建系统AdEasy system构建含突变的IκBα基因的重组腺病毒Ad-IκBαM, 他是NF-κB的超抑制物, 是调控NF-κB活性的有力武器. 本研究发现Ad-IκBαM与As2O3具有协同作用, 转染Ad-IκBαM可以明显增强As2O3的抑制肝癌细胞增殖作用以及体内抑瘤作用. 16 µmol/L As2O3联合转染Ad-IκBαM处理组在72 h和96 h的抑制率分别为68.3%±2.1%和81.9%±3.0%, 显著高于16 µmol/L As2O3联合转染Ad-IκBα组. 经肝固有动脉注入As2O3和Ad-IκBαM后肿瘤组织中的凋亡细胞显著增多. 由此可见, As2O3和Ad-IκBαM联合无论在抑制肝癌细胞的增殖还是促进肿瘤细胞的凋亡方面均具有明显的协同作用. 本研究中As2O3联合Ad-IκBαM处理组荷瘤大鼠的生存期与其他处理组相比没有显著延长, 其原因可能是各组试验动物较少以及观察时间较短. 总之, Ad-IκBαM重组腺病毒在肝癌治疗中的应用值得进一步研究.
三氧化二砷(arsenic trioxide, As2O3)是中国传统医药"砒霜"的活性成分, 能够诱导多种实体瘤细胞和白血病细胞的凋亡. 本文将As2O3粉针剂与腺病毒介导的核因子(nuclear factor-κB, NF-κB)超抑制物IκBαM联合应用于肝癌治疗, 观察其对肝癌增殖及凋亡的影响.
施晓雷, 副主任医师, 南京大学医学院附属鼓楼医院
肝癌是严重威胁人类生命的恶性肿瘤之一, 近年来肝癌的治疗模式逐渐向多元化发展, 除占有重要地位的化疗, 基因治疗也成为具有广泛应用前景的治疗手段之一.
研究表明, NF-κB一旦被激活可以诱导凋亡抑制基因表达, 对抗化疗药物引起的细胞凋亡, 造成肿瘤细胞的化疗抵抗. 因此, 抑制NF-κB通路的活化将在肿瘤治疗中发挥重要作用.
As2O3和Ad-IκBαM联合无论在抑制肝癌细胞的增殖还是促进肿瘤细胞的凋亡方面均具有明显的协同作用。
本文具有较高的临床应用价值. 课题设计严谨, 观察指标能说明Ad-IκBαM联合As2O3粉针剂对肝癌细胞增殖和凋亡的作用.
编辑: 田滢 电编: 鲁亚静
| 1. | Yan X, Shen H, Jiang H, Hu D, Wang J, Wu X. External Qi of Yan Xin Qigong Inhibits Activation of Akt, Erk1/2 and NF-ĸB and Induces Cell Cycle Arrest and Apoptosis in Colorectal Cancer Cells. Cell Physiol Biochem. 2013;31:113-122. [PubMed] [DOI] |
| 2. | Samy RP, Rajendran P, Li F, Anandi NM, Stiles BG, Ignacimuthu S, Sethi G, Chow VT. Identification of a novel Calotropis procera protein that can suppress tumor growth in breast cancer through the suppression of NF-κB pathway. PLoS One. 2012;7:e48514. [PubMed] [DOI] |
| 3. | Maeda H, Hori S, Nishitoh H, Ichijo H, Ogawa O, Kakehi Y, Kakizuka A. Tumor growth inhibition by arsenic trioxide (As2O3) in the orthotopic metastasis model of androgen-independent prostate cancer. Cancer Res. 2001;61:5432-5440. [PubMed] |
| 4. | Nakagawa Y, Akao Y, Morikawa H, Hirata I, Katsu K, Naoe T, Ohishi N, Yagi K. Arsenic trioxide-induced apoptosis through oxidative stress in cells of colon cancer cell lines. Life Sci. 2002;70:2253-2269. [PubMed] [DOI] |
| 5. | Jutooru I, Chadalapaka G, Sreevalsan S, Lei P, Barhoumi R, Burghardt R, Safe S. Arsenic trioxide downregulates specificity protein (Sp) transcription factors and inhibits bladder cancer cell and tumor growth. Exp Cell Res. 2010;316:2174-2188. [PubMed] [DOI] |
| 6. | Kodigepalli KM, Dutta PS, Bauckman KA, Nanjundan M. SnoN/SkiL expression is modulated via arsenic trioxide-induced activation of the PI3K/AKT pathway in ovarian cancer cells. FEBS Lett. 2013;587:5-16. [PubMed] [DOI] |
| 7. | Jang M, Kim Y, Won H, Lim S, K R J, Dashdorj A, Min YH, Kim SY, Shokat KM, Ha J. Carbonyl reductase 1 offers a novel therapeutic target to enhance leukemia treatment by arsenic trioxide. Cancer Res. 2012;72:4214-4224. [PubMed] [DOI] |
| 8. | Long YM, Ye S, Rong J, Xie WR. Nuclear factor kappa B: a marker of chemotherapy for human stage IV gastric carcinoma. World J Gastroenterol. 2008;14:4739-4744. [PubMed] [DOI] |
| 11. | Zhang X, Su Y, Zhang M, Sun Z. Opposite effects of arsenic trioxide on the Nrf2 pathway in oral squamous cell carcinoma in vitro and in vivo. Cancer Lett. 2012;318:93-98. [PubMed] [DOI] |
| 12. | Chun YJ, Park IC, Park MJ, Woo SH, Hong SI, Chung HY, Kim TH, Lee YS, Rhee CH, Lee SJ. Enhancement of radiation response in human cervical cancer cells in vitro and in vivo by arsenic trioxide (As2O3). FEBS Lett. 2002;519:195-200. [PubMed] [DOI] |
| 13. | Pu YS, Hour TC, Chen J, Huang CY, Guan JY, Lu SH. Arsenic trioxide as a novel anticancer agent against human transitional carcinoma--characterizing its apoptotic pathway. Anticancer Drugs. 2002;13:293-300. [PubMed] [DOI] |
| 14. | Jiang XH, Wong BC, Yuen ST, Jiang SH, Cho CH, Lai KC, Lin MC, Kung HF, Lam SK. Arsenic trioxide induces apoptosis in human gastric cancer cells through up-regulation of p53 and activation of caspase-3. Int J Cancer. 2001;91:173-179. [PubMed] |
| 15. | He H, Chen J, Xie WP, Cao S, Hu HY, Yang LQ, Gong B. Ketamine used as an acesodyne in human breast cancer therapy causes an undesirable side effect, upregulating anti-apoptosis protein Bcl-2 expression. Genet Mol Res. 2013; Jan 4. [Epub ahead of print]. [PubMed] |
| 16. | Kim HJ, Kim JC, Min JS, Kim MJ, Kim JA, Kor MH, Yoo HS, Ahn JK. Aqueous extract of Tribulus terrestris Linn induces cell growth arrest and apoptosis by down-regulating NF-κB signaling in liver cancer cells. J Ethnopharmacol. 2011;136:197-203. [PubMed] [DOI] |
| 17. | Hien TT, Kim HG, Han EH, Kang KW, Jeong HG. Molecular mechanism of suppression of MDR1 by puerarin from Pueraria lobata via NF-kappaB pathway and cAMP-responsive element transcriptional activity-dependent up-regulation of AMP-activated protein kinase in breast cancer MCF-7/adr cells. Mol Nutr Food Res. 2010;54:918-928. [PubMed] [DOI] |
| 18. | Kim HG, Hien TT, Han EH, Hwang YP, Choi JH, Kang KW, Kwon KI, Kim BH, Kim SK, Song GY. Metformin inhibits P-glycoprotein expression via the NF-κB pathway and CRE transcriptional activity through AMPK activation. Br J Pharmacol. 2011;162:1096-1108. [PubMed] [DOI] |
| 20. | Shibata-Kobayashi S, Yamashita H, Okuma K, Shiraishi K, Igaki H, Ohtomo K, Nakagawa K. Correlation among 16 biological factors [p53, p21(waf1), MIB-1 (Ki-67), p16(INK4A), cyclin D1, E-cadherin, Bcl-2, TNF-α, NF-κB, TGF-β, MMP-7, COX-2, EGFR, HER2/neu, ER, and HIF-1α] and clinical outcomes following curative chemoradiation therapy in 10 patients with esophageal squamous cell carcinoma. Oncol Lett. 2013;5:903-910. [PubMed] |
| 21. | Ke SZ, Ni XY, Zhang YH, Wang YN, Wu B, Gao FG. Camptothecin and cisplatin upregulate ABCG2 and MRP2 expression by activating the ATM/NF-κB pathway in lung cancer cells. Int J Oncol. 2013;42:1289-1296. [PubMed] [DOI] |
| 22. | Peinado C, Kang X, Hardamon C, Arora S, Mah S, Zhang H, Ngolab J, Bui JD. The NF-κB pathway down-regulates expression of the NKG2D ligand H60a in vitro: implications for use of NF-κB inhibitors in cancer therapy. Immunology. 2013; Jan 28. [Epub ahead of print]. [PubMed] [DOI] |