修回日期: 2013-01-10
接受日期: 2013-03-14
在线出版日期: 2013-04-08
目的: 探讨研究小肠黏液样脂肪肉瘤的临床病理特征.
方法: 结合文献对1例小肠黏液样脂肪肉瘤进行形态学观察并分析其鉴别诊断及预后.
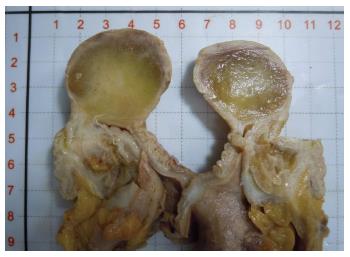
结果: 女, 60岁, 以急性肠梗阻收住. CT扫描见回肠末端黏膜下实性低密度肿块. 大体检查: 肌壁间灰黄色圆形肿物大小约5.0 cm, 突向黏膜导致急性肠套叠, 肿物边界清楚但部分肠黏膜显著糜烂. 形态学显示肿瘤由大量的黏液样间质和成熟性脂肪细胞样细胞组成, 其间可见丰富的分支状薄壁血管及纤细的纤维间隔支撑. 黏液样间质呈粉色或云雾状, 宛如"肺水肿"样, 少许多泡性脂肪母细胞散布其中. 免疫组织化学检查: 肿瘤细胞S-100呈阳性表达而CD34及CD117均为阴性. 局部手术切除后随访10 mo, 未见肿瘤复发或转移.
结论: 小肠黏液样脂肪肉瘤为罕见的恶性肿瘤, 分化程度高, 如处置得当, 预后良好. 充分认识其组织病理学特点有助于确诊.
核心提示: 黏液样脂肪肉瘤(myxoid liposarcomas, MLS)好发于年青人四肢深部软组织. 迄今为止, 文献仅报道4例小肠MLS. 本文研究了1例, 患者为老年女性. 其组织学显著特点在于肿瘤细胞呈圆形或卵圆形, 与小的印戒细胞样脂肪母细胞混合, 间质富于黏液, 可见特征性的分支状毛细血管. 需要与脂肪瘤, 黏液型胃肠间质瘤相鉴别.
引文著录: 方三高, 马强, 马瑜, 李艳青, 曾英, 肖华亮. 小肠黏液样脂肪肉瘤的临床病理特点. 世界华人消化杂志 2013; 21(10): 931-935
Revised: January 10, 2013
Accepted: March 14, 2013
Published online: April 8, 2013
AIM: To investigate the clinicopathologic characteristics of primary myxoid liposarcoma (MLS) of the small intestine.
METHODS: One case of MLS of the small intestine was reported, and its morphological features, differential diagnosis and prognosis were analyzed by reviewing the relevant literature.
RESULTS: A 60-year-old female was admitted for acute bowel obstruction. A CT scan revealed a solitary, hypodense submucosal mass in the terminal ileum. Grossly, the tumor was round in shape, pale-yellow in color, and 5 cm large, with a well-defined margin but partly with severe mucosal erosion. The mass was located in the intramural portion, protruded into the mucosa and caused acute ileal intussusception. Histologically, the tumor was composed predominantly of myxoid stroma and of small amounts of mature lipocyte-like cells that were supported by rich thin arborizing vasculature and delicate fibrous septa. Some multi vacuolated lipoblasts were scattered in pink or cloudy myxoid matrix that showed a "pulmonary edema-like" pattern. Immunohistochemically, the neoplastic cells were positive for S-100, but negative for CD117 and CD34. The mass was resected, and no recurrence or metastasis was found 14 mo after local excision.
CONCLUSION: Primary MLS of the small intestine is a rare, well-differentiated neoplasm that has a good prognosis if managed properly. Full recognition of its histopathologic features is helpful to the diagnosis of this rare condition.
- Citation: Fang SG, Ma Q, Ma Y, Li YQ, Zeng Y, Xiao HL. Clinicopathologic features of myxoid liposarcoma of the small intestine. Shijie Huaren Xiaohua Zazhi 2013; 21(10): 931-935
- URL: https://www.wjgnet.com/1009-3079/full/v21/i10/931.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i10.931
小肠原发性黏液样脂肪肉瘤十分罕见, 自1957年Atik等[1]首次描述以来, 经查英文文献报道4例[2-5], 国内仅见个案报道. 由于发病率极低, 认识不足, 形态特点不明显, 临床及病理易误诊为良性病变如脂肪瘤等. 本研究观察了1例小肠原发性黏液样脂肪肉瘤, 分析其临床表现、形态学改变及免疫组织化学表达, 结合文献重点探讨其病理诊断及鉴别诊断.
女, 60岁. 腹痛、腹胀5 d, B超发现回肠末端肠管内卵圆形肿块, 门诊以"回肠末端肿瘤合并肠梗阻"收住. 于2011-10-07行全麻下剖腹探查. 术中见回肠末端距回盲瓣30.0 cm处黏膜下实性类圆形包块, 完全阻塞肠腔, 引起部分回肠顺行单式套叠约10.0 cm, 肿块表面回肠黏膜形成溃疡, 浆膜充血水肿. 腹腔探查无腹水, 肝脾及盆腔未见异常, 淋巴结无肿大. 遂切除套叠部肿块及上下各约10.0 cm的小肠. 病理检查: 回肠有一无蒂肿物突入肠腔, 大小约5.0 cm×4.0 cm×4.0 cm, 表面黏膜粗糙、糜烂. 肿物位于肌壁间, 切面淡黄灰白相间, 质软, 边界清楚. 病理报告: 送检回肠肠壁软组织肿瘤, 伴明显黏液样背景, 可见脂肪母细胞样细胞, 结合免疫组织化学, 形态符合黏液样脂肪肉瘤, 伴回肠溃疡形成(病理号码: 1121355).
标本经40 g/L甲酫固定, 常规脱水, 石蜡包埋, 4 μm厚切片, HE染色, 光镜观察. 免疫组织化学采用EnVision法. 所选一抗S-100(多克隆)、S-100(单克隆)、vimentin、CK、CD34、CD117、Dog-1、SMA、desmin、calponin、h-caldesmon、Ki-67和二抗分别购自福州迈新公司和北京中杉金桥公司. 操作步骤按照试剂盒说明书进行. 用PBS代替一抗作空白对照. 阳性细胞数占总细胞数的比例>10%时即判为阳性. Ki-67胞膜或胞核阳性, 其余抗体胞膜或胞质阳性.
2.1.1 巨检: 肠管一段, 长13.0 cm, 直径3.0-4.0 cm, 部分肠管外翻, 距一侧切缘3.0 cm处可见一卵圆形肿物, 大小5.0 cm×4.5 cm×3.0 cm, 主要位于肌壁间向黏膜面膨胀性生长, 突向肠腔几乎完全阻塞肠管, 但并不像一般肠癌那样固定、质硬, 而是可推移. 与肿块毗邻的部分小肠黏膜重度糜烂, 覆盖脓苔. 切面淡黄色或灰白色, 质软, 有黏滑感(图1).
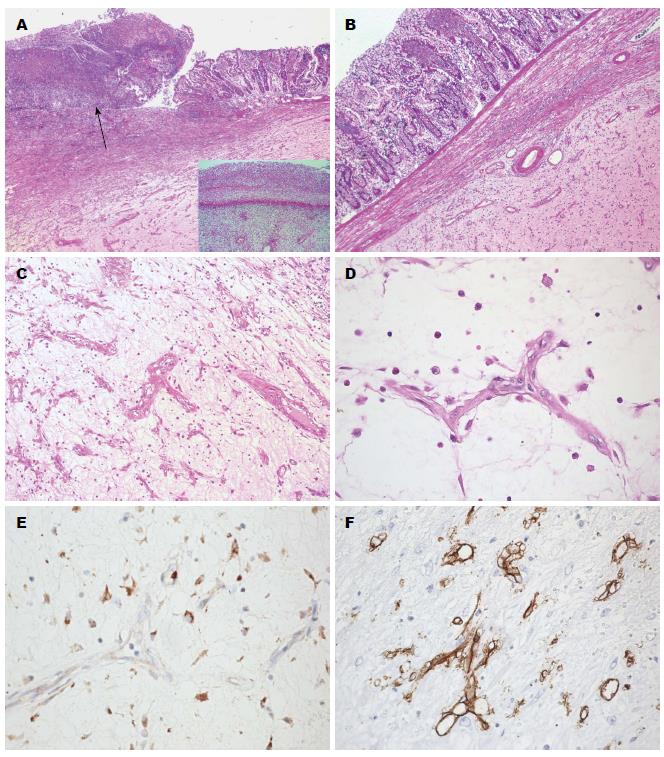
2.1.2 镜检: 镜下特点: (1)肿瘤位于黏膜下, 部分表面坏死(图2A); (2)脂肪源性肿瘤特有的分叶状结构不明显, 主要由弥漫性黏液样间质、散在诊断性脂肪母细胞及较成熟的肿瘤性脂肪细胞构成, 脂肪母细胞呈卵圆形或星形, 核端可见月牙形空泡, 呈印戒细胞状(图2B); (3)丰富的分支状毛细血管及纤细的纤维间隔互联成网, 较大的血管仅由一层内皮细胞构成, 形成"鸡爪样"或"鹿角状"(图2C), 具有形态学诊断价值; (4)肿瘤富含黏液样基质, 云雾状或淡粉色, 弥漫成片形成黏液池, 类似"肺水肿样"改变(图2D).
2.1.3 免疫组织化学: S-100(多克隆)(图2E)、S-100(单克隆)、vimentin及CD68阳性, CD34(瘤细胞阴性而血管阳性)(图2F)、CK、SMA、desmin、calponin、h-caldesmon、CD117、Dog-1均阴性. Ki-67约5%(+).
脂肪肉瘤(liposarcoma, LS)于1857年由病理学先驱Virchow氏首先报道[6]. 2013年WHO软组织和骨肿瘤分类中, 分为去分化脂肪肉瘤、黏液样脂肪肉瘤、多形性脂肪肉瘤及脂肪肉瘤(非其他特殊型)4种类型. 其中黏液样脂肪肉瘤(myxoid liposarcomas, MLS)为最多见的类型, 约占脂肪肉瘤的15%-20%[7].
目前认为脂肪肉瘤并非起源于脂肪细胞, 而是起源于原始间叶肿瘤性脂肪干细胞. 根据细胞形态, 大致可分为脂源性或非脂源性两种成份, 两者在不同的病例或同一肿瘤的不同区域及不同切面所占比例各不相同, 但数量不等的脂肪母细胞始终为脂源性成分所特有, 并且成为脂肪肉瘤组织学诊断的重要依据. 这种脂肪母细胞呈单核或多核, 富含脂质空泡, 大小不一, 小者胞核可被空泡推至一侧呈印戒状, 大者核位于中央, 被多数小空泡挤成锯齿状或花蕾样, 犹如肥胖的皮脂腺细胞. 而非脂源性成分如纤维, 血管、神经等可因外伤、缺血和继发感染而引起出血、梗死、纤维化、钙化、囊性变和炎症反应等, 使其形态多变, 给组织学诊断带来困难.
发生于小肠的脂肪肉瘤很少见. 文献报道多见于年龄相对较轻的中年人[8], 一般呈膨胀性推进式生长, 恶性程度较低. 如果部位隐匿, 发现时往往已长至巨大, 引起肠梗阻或肠扭转, 若侵及肠壁可导致黏膜溃疡、消化道出血及继发性贫血. 有时肿瘤坏死、溃破可引起急性腹膜炎. 后期患者往往出现明显消瘦和恶液质. 本例瘤体较大, 肿瘤位于小肠黏膜下向肠腔内生长, 发生肠套叠引起肠梗阻才来就诊. 如果肿块位于非重要部位如肠系膜或腹腔, 仅引起压迫症状, 更难以早期发现. 术前临床诊断为脂肪瘤, 大体取材见肿块覆盖的回肠黏膜形成溃疡, 部分切面呈灰白色而非黄色, 引起警觉并补充取材. 镜下最可靠的诊断依据是脂肪母细胞, 呈星形及小梭形, 有程度不同的异型性, 散在于具有黏液背景的丛状毛细血管网络中.
黏液样脂肪肉瘤常位于下肢深部, 肿块一般较大, 肉眼变化肿瘤有包膜或假包膜, 界限清楚, 切面湿润似胶冻样或半透明状, 质地柔韧. MLS由形态一致的圆形或卵圆形原始间叶细胞、数量不等的小印戒样脂肪母细胞、突出的分支状血管及黏液样基质组成. 以前称为圆形细胞脂肪肉瘤(round cell liposarcoma, RCL)也包括在这一类中. 90%以上的MLS中存在一种非随机的特异性染色体相互平衡易位, 导致FUS/DDIT3基因融合[9], 形成t(12;16)(q13;p11), 即12号染色体长臂的1区3带至末端与16号染色体短臂的1区1带至末端片段相互易位.
MLS的病理学诊断并不难: (1)肿瘤组织内出现大片均匀黏液样基质, 部分区域呈微囊性淋巴管瘤样或扩张的肺泡状, 囊腔内可见云雾样或粉染颗粒, 具有典型"肺水肿"样形态表现, 以瘤体中央区域为著, 可能系组织变性或细胞器发育不良, 分界膜系统包括胞膜破裂脂质融合所致; (2)大量分支状毛细血管, 壁较薄, 缺乏平滑肌支撑, 有时仅由一层内皮细胞构成, 张力低, 口径小, 形成网络; (3)较成熟的脂肪细胞中散在不同成熟阶段的脂肪母细胞, 多数为核端小空泡型及小印戒细胞型, 核浓染, 有压凹或形状不规则, 轻度异型, 核分裂象罕见.
因无特异性标记, 只能通过排除法并结合特殊染色如油红O和苏丹Ⅳ等协助诊断. S-100常用来确定脂肪母细胞, 但特异性较差. 本例S-100及vimentin阳性表达, 诊断明确.
发生于小肠的MLS需要与以下病变相鉴别: (1)脂肪瘤: 多位于小肠黏膜下, 可多发, 呈息肉状生长, 肿瘤被覆小肠黏膜, 一般包膜完整, 切面黄色, 质软, 有油腻感. 镜下见小而不规则的脂肪小叶由粗细不等的纤维分隔, 肿瘤性脂肪细胞分化良好, 如果不是占据空间及完整包膜, 几乎与正常脂肪细胞无异. 核位于细胞边缘, 无异型及核分裂像. 有时基质呈黏液样, 血管丰富, 但不形成明显的丛状血管网. 最新研究表明[10], MDM2检测有助于MLS与其他脂肪源性肿瘤相鉴别; (2)小肠转移性脂肪肉瘤[11]或肠外脂肪肉瘤累及小肠[12]: 详细了解病史及影像学有助于鉴别. 转移者可多发, 累计小肠者, 肿瘤组织往往浸润浆膜并与之紧密黏连, 从外及内, 而小肠黏膜层一般无异常; (3)黏膜下脂肪黏液样变(mucoid degeneration): 病变无明显包膜, 由成熟性脂肪组织伴黏液样变性为特征, 缺乏脂肪母细胞; (4)脂肪瘤样脂肪肉瘤黏液变性可找到多泡状的脂肪母细胞; (5)小肠脂肪增生症(intestinal lipomatosis): 肠壁间质尤其是浆膜脂肪组织弥漫性增生, 无明确包膜[13], 细胞分化成熟, 无脂肪母细胞; (6)血管脂肪瘤: 多发生于20岁左右男青年的前臂, 局部有疼痛和压痛, 可多发, 瘤体直径多在2 cm以内, 由成熟的脂肪细胞和簇状毛细血管构成, 血管腔内多发性微血栓为本瘤的特征之一; (7)血管黏液瘤, 该瘤好发于会阴及盆腔, 血管无分支, 血管壁常有厚的平滑肌, 无脂肪母细胞; (8)黏液样胃肠道间质瘤(gastrointestinal stromal tumours, GIST): 虽可见广泛的黏液样改变, 但肿瘤密集区主要由细长梭形细胞构成, 边界清楚, 胞质红染, 核常位于中心, 呈棒状, 缺少脂肪母细胞及丛状毛细血管网. 免疫组织化学CD34、CD117及Dog-1[14]呈阳性; (9)低度恶性纤维黏液样肉瘤: 肿瘤由纤维母细胞样细胞密集区及黏液样变性疏松区组成, 梭形细胞胞质淡染, 核细长, 异型性不明显, 常呈旋涡状排列. 肌源性标记物阳性而S-100阴性; (10)神经纤维瘤黏液变性. 腹膜后多见. 瘤细胞呈纤细的梭形, 胞质少, 核细长呈波浪状, 染色质深, 呈束状、平行状排列, 偶见栅栏状排列, 细胞疏密分布不均, 有灶性黏液样间质. 虽S-100呈阳性, 但同时Syn、CD56等神经内分泌标记物也阳性表达. 本例部位和形态学典型, 免疫组织化学结果显示瘤细胞表达S-100及vimentin, 不表达CD117、desmin、calponin及h-caldesmon, 结果支持MLS.
黏液样脂肪肉瘤一般预后良好, 少数病例可局部复发, 文献报道MLS的5年生存率75%, 复发率约12%[15], 仅个别出现转移[2,10,15]. 其发病部位、深度、大小及安全手术切缘情况等因素与肿瘤预后相关, 其中最重要的因素是肿瘤发生部位, 如发生于肢体和躯干浅表部位, 广泛切除一般可治愈, 而发生于深部组织(如腹膜后、腹腔和纵隔)则有复发的倾向. 在外检中如遇到反复复发的"脂肪瘤"要小心, 以避免被其假良性形态所迷惑, 如果伴有黏液变要想到MLS. 肿瘤体积大、核分裂指数高被认为是预后不良的病理学独立指标. 手术为主辅以放化疗, 可提高疗效. 手术应至少切除肿瘤及其边缘2-3 cm以上的正常组织. 因MLS较少发生淋巴道转移, 一般不必行淋巴结清扫. 本例术后未行放化疗, 随访至今已历14 mo, 患者健在. 然而到目前为止, 由于文献报道较少, MLS的临床特点、生物学特性以及其与组织形态之间的关系等尚待进一步研究.
黏液样脂肪肉瘤主要见于腹膜后和四肢皮下, 发生于小肠的极为罕见, 目前国外仅报道21例, 国内尚未见报道. 临床医生和病理医生对小肠黏液样脂肪肉瘤的临床病理特征认识不足, 容易误诊.
郭炜, 教授, 河北医科大学第四医院河北省肿瘤研究所病理研究室
罕见疾病是个点, 而鉴别诊断是个面. 本文对1例小肠黏液样脂肪肉瘤的临床资料、病理形态学特征及免疫表型进行总结, 并审阅相关文献, 分析其形态学特征, 重点探讨其病理诊断及鉴别诊断.
病理标本的大体所见非常重要, 对特殊病例诊断者最好亲自取材, 仔细观察. 对脂肪源性肿瘤应借助于特殊染色、免疫组织化学标记、分子病理学检查甚至电镜后方可做出恰当的诊断.
本文内容实用, 图片精美, 鉴别诊断详细, 有一定的指导意义.
编辑: 田滢 电编:闫晋利
| 2. | Mohandas D, Chandra RS, Srinivasan V, Bhaskar AG. Liposarcoma of the ileum with secondaries in the liver. Am J Gastroenterol. 1972;58:172-176. [PubMed] |
| 3. | Wood DL, Morgenstern L. Liposarcoma of the ileocecal valve: a case report. Mt Sinai J Med. 1989;56:62-64. [PubMed] |
| 4. | Bianchi E, De Monti M, Miani S, Stringhi E, Scorza R. [Malignant neoplasia of the small intestine. Apropos of 7 cases. Clinical discussion and review of the literature]. Minerva Chir. 1998;53:289-298. [PubMed] |
| 5. | De Monti M, Mangoni I, Gobatti D, Ghilardi G, Scorza R. [Primary jejunal liposarcoma]. Minerva Gastroenterol Dietol. 2000;46:119-122. [PubMed] |
| 7. | Christopher DM Fletcher, Julis A Bridge, Pancras CW Hogendoorn, Fredrik Mertens. WHO Classification of Tumours of Soft and Bone. WHO. 2013;39-41. |
| 8. | Bosman FT, Carneiro F, Hruban RH, Theise ND (EDS). World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Digestive System. IARC Press: Lyon 2010; 115-116. |
| 9. | Antonescu CR, Elahi A, Humphrey M, Lui MY, Healey JH, Brennan MF, Woodruff JM, Jhanwar SC, Ladanyi M. Specificity of TLS-CHOP rearrangement for classic myxoid/round cell liposarcoma: absence in predominantly myxoid well-differentiated liposarcomas. J Mol Diagn. 2000;2:132-138. [PubMed] |
| 10. | Thway K, Flora R, Shah C, Olmos D, Fisher C. Diagnostic utility of p16, CDK4, and MDM2 as an immunohistochemical panel in distinguishing well-differentiated and dedifferentiated liposarcomas from other adipocytic tumors. Am J Surg Pathol. 2012;36:462-469. [PubMed] [DOI] |
| 11. | Shibata Y, Sato K, Kodama M, Nanjyo H. Metastatic liposarcoma in the jejunum causing intussusception: report of a case. Surg Today. 2008;38:1129-1132. [PubMed] [DOI] |
| 12. | Wolfhagen FH, Mensing JW, Veen HF, Dees A. Late recurrence of liposarcoma simulating adenoma of the duodenum. Neth J Med. 1999;54:231-234. [PubMed] |