修回日期: 2011-12-20
接受日期: 2012-02-27
在线出版日期: 2012-03-28
目的: 探讨进展期食管胃交界腺癌临床病理特征、Siewert分型、Lauren分型与预后的关系, 观察新版AJCC分期指南在食管胃交界腺癌中的适用性.
方法: 回顾性分析319例具有完整随访资料的进展期食管胃交界腺癌的临床病理特征, 采用Kaplan-Meier方法进行生存分析.
结果: 319例进展期食管胃交界腺癌的1年、3年、5年总生存率分别为62%、44%和35%. 局限型患者生存率高于浸润型; 肿瘤最大径<5 cm患者生存率比5 cm以上患者高; 肿瘤分化程度、浸润深度(T分期)和淋巴结转移与低生存率相关(P<0.01); 按照AJCC第7版中N分期标准分组, 组间未见生存差异, 而将淋巴结转移数目以10为界, 发现10个以上淋巴结转移的病例生存率显著低于10个以内者(P<0.05); Lauren 弥漫型病例生存率显著低于肠型和混合型, 而肠型和混合型之间无明显差异; Siewert三型病例之间生存率无明显差异(P>0.05).
结论: 食管胃交界腺癌肿瘤最大径、浸润深度、分化程度、Lauren分型等临床病理特征与预后相关, 其中AJCC第7版分期指南中所参照的食管癌N分期标准并不能揭示预后意义, 提示食管胃交界腺癌有其独特的临床病理学特征, 有必要研究并建立食管胃交界腺癌适用的分期标准, 而不仅仅是参照食管癌或胃癌现有标准.
引文著录: 杨琳, 朱玥璐, 王斌, 袁燕玲, 郭蕾, 张海峰, 薛新华, 吕宁. 进展期食管胃交界腺癌临床病理分析319例. 世界华人消化杂志 2012; 20(9): 784-789
Revised: December 20, 2011
Accepted: February 27, 2012
Published online: March 28, 2012
AIM: To explore the clinicopathological features and prognostic factors in patients with advanced oesophagogastric adenocarcinoma (OGA), and to assess the applicability of the AJCC TNM staging guideline (7th edition) in OGA.
METHODS: The clinical data for 319 cases of surgically removed advanced OGA were retrospectively reviewed, and survival analysis was made by the Kaplan-Meier method.
RESULTS: The 1-, 3-, and 5-year survival rates were 62%, 44% and 35%, respectively. Patients with localized OGA had a higher survival rate than those with infiltrative disease. Diameter of tumor, grade, infiltration depth and lymph node metastasis were significantly correlated with lower survival rate (all P < 0.01). Patients with the Lauren infiltration subtype had a lower survival rate than those with intestinal and mixed subtypes. The survival rate had no difference among patients with stages N1-N3 disease (N staging according to AJCC guideline), but was significantly lower in patients with more than 10 metastatic lymph nodes than in those with less than 10 metastatic lymph nodes.
CONCLUSION: Tumor diameter, infiltration depth, grade and Lauren classification are associated with prognosis in patients with esophagogastric adenocarcinoma. N staging according to AJCC guideline (7th Ed) can not reveal prognostic significance, which suggests that OGA should have unique staging guidelines instead of referring to gastric or esophageal adenocarcinomas.
- Citation: Yang L, Zhu YL, Wang B, Yuan YL, Guo L, Zhang HF, Xue XH, Lv N. Clinicopathological and prognostic analysis of 319 cases of advanced esophageal gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 784-789
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/784.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.784
2000年《WHO classification of Tumors of the Digestive System》明确将发生于远端食管鳞状上皮和贲门腺上皮移行区的癌命名为食管胃交界腺癌(adenocarcinoma of the oesophagogastric junction, OGA), 并提出应区别于下段食管癌和近端胃癌; 不主张沿用有误导含义的词"贲门癌"[1], 2010年新版《WHO classification of Tumors of the Digestive System》重申了上述定义, 并提出其TNM分期标准依据肿瘤主体位置分别沿用食管腺癌和胃腺癌的标准[2]. 此前, 国内对发生于食管胃交界区域的腺癌统称为"贲门癌", 并定义为食管胃交界线下2 cm范围之内, 并且由于解剖部位不清而曾分别归类于食管癌和胃癌进行统计[3]. 然而, 外科手术范围基本共识的是Siewert等依据解剖学提出的3型: Ⅰ型为远端食管腺癌, 主要来源于Barrett食管; Ⅲ型为贲门下癌, 而Ⅱ型肿瘤中心位于食管胃交界(oesophagogastric junction, OGJ)近侧1 cm远侧2 cm之间[4]. SiewertⅠ型手术方式与食管癌相似, 而Ⅱ、Ⅲ型治疗上应采取与胃癌相似的标准[5]. 目前, 虽然大多数学者承认OGA是一独特的临床类型, 但有不少学者对现行TNM分期对OGA的适用性提出质疑. 由于OG交界位于体内胸腔和腹腔交叉处, 淋巴引流有2个不同方向, 近心方向向纵隔引流, 而远心方向向腹腔淋巴结引流. SiewertⅠ型OGA除向腹腔转移外, 更易于向纵隔淋巴结转移, 而SiewertⅢ型更倾向于向腹腔淋巴结转移. 按现行TNM分期系统, SiewertⅠ型可按食管癌进行分期, SiewertⅢ型可按胃癌进行分期, 但SiewertⅡ型OGA的肿瘤真正处在OGJ位置上, 如何进行N分期还是一个有待进一步探讨的问题[6]. 2010年国际抗癌联盟(UICC)和美国癌症联合会(AJCC)联合制定的第7版《癌症分期手册》将OGA作为一种相对独立的疾病并将其归类与分期等同于食管腺癌分期标准, 这与原有食管癌分期的不同在于, 将转移淋巴结的数目考虑其中; 而与胃癌分期的不同是, 将膈上淋巴结考虑为区域而非远处转移. 然而, 新版分期系统将OGA作为一个相对独立的疾病来认识的同时而其分期标准仍分别参照食管和胃, 所引用的数据来源于4 000余例食管癌研究数据, 缺乏来自食管胃交界腺癌本身的研究数据来检验这个标准的科学性和实用性[7]. 因此, AJCC第7版分期指南将食管胃交界腺癌等同于食管腺癌的分期标准究竟能否反映出食管胃交界腺癌独特的临床病理学特征有待深入探讨. 另外, Lauren分型对胃癌的发生发展尤其是环境因素与癌的关系具有重要的揭示意义, 但对于食管胃交界腺癌是否也有同样的流行病学和预后方面的意义尚待研究[1,2]. 因此有必要按照WHO定义、AJCC/UICC分期指南、Siewert分型以及Lauren分型等回顾性分析食管胃交界腺癌的临床病理学特征, 探索其可能的发生发展及相关预后因素, 为进一步研究其生物学行为、制定合理的防治方案等奠定必要的科学基础.
调阅中国医学科学院肿瘤医院病理科2002-07-01/2004-12-31存档数据库(病理号230532-262922号段)中涵盖进展期食管胃交界腺癌共436例, 其中具有完整病理资料和随诊结果的319例纳入本研究中.
复阅病理存档资料及所有病理切片, 记录大体和镜下所见. 包括肿瘤大小、大体分型、肿瘤中心距离食管胃交界线的距离(Siewert分型的依据); 并由2名高级医师独立复阅全部病理切片, 核实病理诊断, 包括肿瘤组织学类型、分化程度、浸润深度、边界是否清楚、淋巴结转移数等. 如诊断不一致, 则由上述2名医师共同讨论达成一致诊断意见. 将所有入选进展期食管胃交界腺癌根据肿瘤大体边界是否清楚分为局限型和浸润型; 根据瘤体中心距离食管胃交界线的距离分为SiewertⅠ型(瘤体中心位于食管胃交界线上方2 cm之外)、Ⅱ型(瘤体中心位于食管胃交界线上1 cm至线下2 cm之间)、Ⅲ型(瘤体中心位于食管胃交界线下2 cm以外); Lauren分型依据于肿瘤镜下腺管状结构的比例, 简言之, Lauren肠型包括高、中分化腺癌为主要成分; Lauren弥漫型指的是镜下细胞黏附力差, 无或少有腺管结构形成, 以印戒细胞癌和部分低分化腺癌为主要成分; Lauren混合型指肠型和弥漫型形态比例相当. 按照AJCC/UICC TNM分期指南第7版将所有进展期食管胃交界腺癌分为T2(浸润肌层)、T3(浸润浆膜及浆膜下脂肪)、T4(浸透管壁全层并侵犯邻近组织和器官); N0(无淋巴结转移), N1(1-2个淋巴结转移), N2(3-6个淋巴结转移), N3(7个或7个以上淋巴结转移)4组[8].
统计学处理 通过门诊随诊记录及电话随访的方式, 随诊时间2-81 mo; 记录随访结果(生存、死亡、截止), 用例数和百分比来描述临床资料. 采用Kaplan-Meier方法进行生存分析, Log-rank检验统计量, P<0.05有统计学意义.
319例食管胃交界腺的临床病理特征见表1. 319例进展期食管胃交界腺癌中, 男性270例, 女性49例(男女比例5.5:1); 年龄31-105岁, 平均年龄69岁, 中位年龄65岁. 按照10岁年龄分段, 其中40岁以下2例(0.6%), 40-49岁5例(1.6%), 50-59岁44例(13.8%), 60-69岁109例(34.1%), 70-79岁115例(35.9%), 80-89岁41例(12.8%), 90岁以上3例(0.9%). 可见, 本组病例中60-80岁为高发年龄段, 占总病例数的70%.
| 分组 | 病理特征 | n | % |
| 大体分型 | |||
| 局限型 | 173 | 54.2 | |
| 浸润型 | 146 | 45.8 | |
| Siewert分型 | |||
| I型 | 7 | 2.2 | |
| II型 | 215 | 67.4 | |
| III型 | 97 | 30.4 | |
| Lauren分型 | |||
| 肠型 | 134 | 42.1 | |
| 混合型 | 48 | 15.0 | |
| 弥漫型 | 137 | 42.9 | |
| 肿瘤最大径 | |||
| ≤5 cm | 123 | 38.6 | |
| >5 cm | 196 | 61.4 | |
| 浸润深度(T分期) | |||
| 肌层(T2) | 18 | 5.6 | |
| 浆膜(T3) | 288 | 90.3 | |
| 浆膜外(T4) | 13 | 4.1 | |
| 分化程度 | |||
| 高分化 | 13 | 3.7 | |
| 中分化 | 138 | 38.9 | |
| 低分化 | 204 | 57.5 | |
| 受累淋巴结数目 | |||
| 0 | 59 | 18.5 | |
| 1-10 | 199 | 62.4 | |
| >10 | 61 | 19.1 |
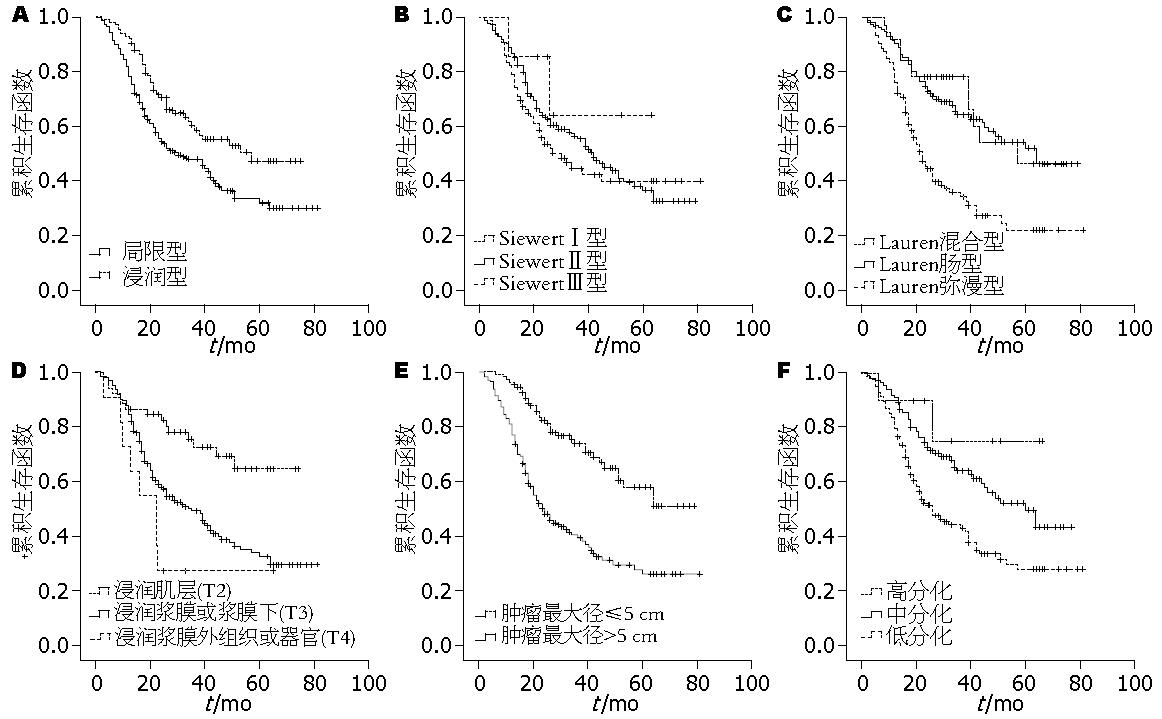
将436例进展期食管胃交界腺癌中具有完整随诊记录的319例进行生存分析. 结果显示其1年、3年、5年总生存率分别为62%、44%和35%. 按照大体分型、Siewert分型、Lauren分型、浸润深度以及肿瘤分化程度分组, 分别进行Kaplan-Meier分析比较生存曲线. 作者发现局限型患者生存率高于浸润型; 肿瘤最大径<5 cm患者生存率比5 cm以上患者高; 肿瘤分化程度、浸润深度(T分期)和淋巴结转移与低生存率相关(P<0.01). SiewertⅢ型病例之间生存率无明显差异, Lauren 弥漫型病例生存率显著低于肠型和混合型, 而肠型和混合型之间无明显差异(P>0.05), 生存函数如图1A-F所示.
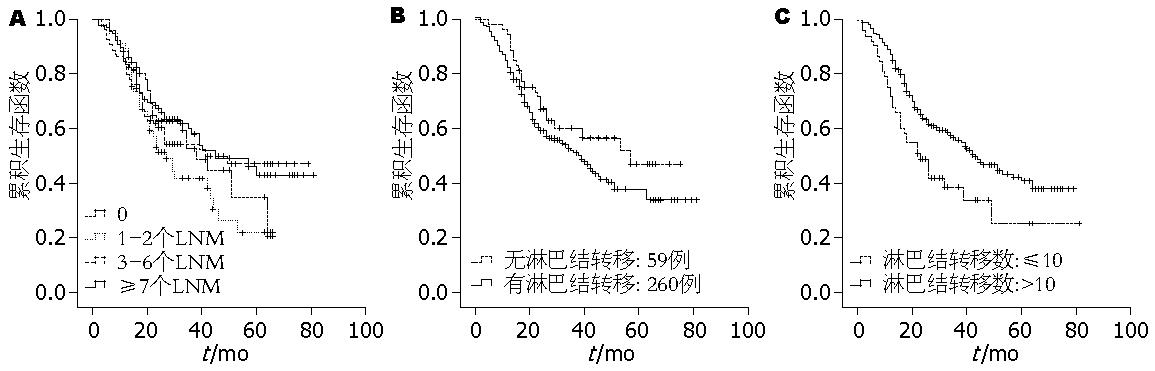
所有病例中, 无淋巴结转移组(59例)和淋巴结转移组(260例)生存率有差异趋势, 但差异不显著(P = 0.316)(图2A). 按照AJCC-TNM分期指南第7版"食管胃交界腺癌淋巴结分期标准"分为N0 (无淋巴结转移), N1(1-2个淋巴结转移), N2(3-6个淋巴结转移), N3(7个或7个以上淋巴结转移)4组, 各组之间生存率未见明显差异(图2B). 作者将淋巴结转移个数以10为界, 分为2组, 发现10个以上淋巴结转移的病例生存率显著低于10个以内者(P<0.05, 图2C).
2000年《WHO消化系统肿瘤病理学和遗传学》提出"食管胃交界(oesophagogastric, OG)"概念, OG交界是食管并入胃的解剖学区域. 横跨食管和胃交界处的腺癌称为食管胃交界腺癌. 然而, 由于存在不同的分类系统, 所以对OGA的病群研究就显得很不一致, 10年后的新版《WHO消化系统肿瘤病理学和遗传学》仍然缺乏OGA的可靠流行病学资料[2]. 2009年AJCC/UICC肿瘤TNM分期指南中主要基于一项多中心的食管癌研究数据而提出OGA的分期标准等同于食管腺癌. 然而, 由于缺乏食管胃交界腺癌本身的临床病理数据分析, 上述这类源于食管癌研究所得依据显然不够充分. 基于此, 本研究回顾性分析食管胃交界腺癌的临床病理学特征并进行预后分析, 以探索其可能的发生发展及相关预后因素, 为进一步研究其生物学行为、制定合理的防治方案等奠定必要的科学基础.
流行病学研究发现东西方国家食管胃交界腺癌的发病率及Siewert型别比例有差异. 德国、美国、意大利等西方国家食管胃交界腺癌呈逐年递增趋势并且Siewert分类3型比例相当; 而日本、韩国、中国台湾等近20年食管胃交界腺癌发病率增加不明显且SiewertⅠ型比例显著低于西方国家[9]; 2006年, 我国学者白纪纲等首次按照Siewert分型报道了203例中国人食管胃交界腺癌, 发现其SiewertⅠ型比例及癌旁肠上皮化生发病率与西方国家及日韩显著不同[10]. 我们的研究发现SiewertⅠ型显著低于德国等西方国家比例, 这与来自日本人群的研究[9]以及白纪纲等[10]一致; 提示食管胃交界腺癌的发病可能具有种群或地域特征, 值得深入研究, 以更好地指导其防治问题.
Lauren分类对评估胃癌的自然病史非常有用, 尤其是关于他与环境因素、癌前病变的关系. 根据肿瘤镜下腺管成分的多少, 被分为2种主要类型: 肠型和弥漫型, 那些肠型和弥漫型比例大致相当的称为混合型. Lauren肠型胃癌的发生发展及预后与弥漫型胃癌不同[1,2]. 那么, 他对于食管胃交界腺癌的预后有无影响? 我们的数据表明, Lauren弥漫型病例预后明显低于肠型和/或混合型, 这与胃癌的研究一致[1,2], 仅有少数文献涉及食管胃交界腺癌的Lauren分型与预后的关系, 我们的结果与文献一致[11]. 这提示Lauren分型一定程度上能揭示食管胃交界腺癌的预后, 那么他与食管胃交界腺癌中的发病即肠上皮化生和/或不典型增生等是否也有揭示作用呢? 需要进一步深入研究, 这将有助于建立食管胃交界腺癌的早期防治措施.
AJCC第7版[8]提出食管胃交界腺癌的分期标准同食管腺癌, 并将肿瘤的镜下分级整合到TNM分期中. T1肿瘤侵及黏膜下层; T2肿瘤侵及固有肌层; T3肿瘤侵及纤维膜; T4肿瘤侵及邻近器官. N代表区域淋巴结转移情况, 采用四分法: Nx无法确定淋巴结转移情况, N0无淋巴结转移, N1 1-2个淋巴结转移, N2 3-6个淋巴结转移, N3 ≥7个淋巴结转移. 肿瘤组织的镜下分级包括: Grade X无法评估级别; Grade 1(高分化)-95%以上均为腺管成分; Grade 2(中分化)腺管成分占50%-95%; Grade 3(低分化)腺管成分<50%. 按照上述分期标准分析我们的数据发现, 进展期食管胃交界腺癌的浸润深度(T分期)、分化程度与预后相关, 而根据上述淋巴结分期标准分组, 组间并无生存率的差别. 为此, 我们在本组数据中探索了淋巴结转移情况对预后的影响, 将所有319例进展期食管胃交界腺癌按照有无淋巴结转移分为2组(分别为59例和260例), 进行生存率的比较, 发现2组间具有差别趋势(P = 0.149). 进而, 将有淋巴结转移组按照淋巴结转移数目是否>10分为2组, 发现2组生存率具有显著差异.
将淋巴结转移数目用于评价食管癌和胃癌的N状态已经得到广泛认可. Hagen及Lerut等的研究表明, 食管癌中淋巴结转移个数的增加与生存率的下降密切相关[12,13]. 但采用多少枚转移淋巴结作为N分期的分界值以及采用多少级划分法仍存在较大争议. Zhang等[14]对1 146例食管鳞癌患者的病例资料进行回顾性分析, 将患者按淋巴将转移数为0, 1, 2, 3, ≥4分为5组, 结果后3组间生存率无显著差异, 而当分为0, 1, ≥2分3组后, 他们之间的生存率有显著差异(P<0.001).
由于食管胃交界特殊的解剖部位, 历来食管胃交界腺癌的命名和分期标准均难与食管癌和胃癌分开. AJCC第7版食管胃交界腺癌的分期标准同食管腺癌, 这个标准的建立是依据一项多中心4 627个食管癌病例分析总结而成. 这里有2方面需要仔细斟酌: 其一, 上述4 627例来自不同的医学中心, 采用的手术方法并不尽一致, 而不同的手术径路清扫淋巴结范围及数量可能不同, 对预后分析就会产生影响. 罗孔嘉等[15]对482例胸中段食管鳞癌进行预后分析, 采用左胸入路者350例, 右胸入路者132例, 结果发现右胸组平均清扫淋巴结数目显著多于左胸组(16.3枚 vs 11.8枚, P<0.001), 3年无病生存期右胸组与左胸组相比有显著提高(25.09 mo vs 22.92 mo, P = 0.039); 其二, AJCC第7版食管胃交界腺癌的TNM分期标准并没有依据于其本身的数据分析, 而是借用了食管腺癌的TNM分期标准, 尤其是N分期采用上述四分法, 可能更多是为了与第7版胃癌分期保持一致. 但我们的研究表明, 这种仅为了与食管腺癌和胃癌保持一致而采取的四分法进行N分期, 并不能准确反映食管胃交界腺癌的预后.
2010年第7版AJCC肿瘤TNM分期指南虽有很大进步, 但仍未将食管胃交界腺癌真正独立开来. 因此, 有必要从食管胃交界腺癌的现有定义, 进行深入的临床病理特征与预后的分析来揭示其独特的发生发展规律. 本研究取自单一中心样本数据分析表明, 食管胃交界腺癌相关临床病理特征(包括Lauren型别、分化程度、浸润深度、淋巴结转移数目等)与其预后有一定相关性, 部分特征尤其是N分期与食管癌和胃癌有所不同. 我们认为, 食管胃交界腺癌特殊的解剖部位需要特殊的对待和分析, 应该选取更大样本, 最好是来自同一研究中心、相同术式的病例进行预后相关的回顾性分析, 才能更准确地揭示这一特殊部位腺癌独特的临床病理学特征, 以更科学地指导其防治研究.
食管胃交界腺癌的流行病学特征、临床病理特征、生物遗传学特征以及预后相关因素等多方面的认知有待深入.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
2006年, 我国学者白纪纲等首次按照Siewert分型报道了203例中国人食管胃交界腺癌, 发现其SiewertⅠ型比例及癌旁肠上皮化生发病率与西方国家及日韩显著不同.
本研究严格按照WHO的OGA定义, 进行临床病理特征相关预后分析. 发现AJCC第7版分期指南中所参照的食管腺癌N分期标准并不能揭示预后, 提示食管胃交界腺癌有其独特的临床病理学特征, 有必要研究并建立食管胃交界腺癌适用的分期标准, 而不仅仅是参照食管癌或胃癌现有标准.
本研究取自单一中心样本数据分析表明, 食管胃交界腺癌相关临床病理特征(包括Lauren型别, 分化程度, 浸润深度, 淋巴结转移数目等)与其预后有一定相关性, 部分特征尤其是N分期与食管癌和胃癌有所不同. AJCC第7版食管胃交界腺癌的TNM分期标准中N分期标准并不能准确反映食管胃交界腺癌的预后. 有待更大样本研究证实并建立新的TNM分期标准.
食管胃交界腺癌: 横跨食管胃交界线(EGJ)的腺癌. 完全位于EGJ上方的腺癌界定为食管腺癌; 完全位于EGJ下方的腺癌界定为"胃近端癌"或"胃体癌".
食管胃结合部癌到底是食管癌还是贲门癌已争论多年, 直至近年才有比较明确的研究方向, 本文是一篇该研究的佐证, 文章的科学性、创新性和可读性能较好地反映国际胃肠病学临床和基础研究的先进水平.
编辑: 曹丽鸥 电编: 闫晋利
| 1. | Stanley RH, Lauri AA. World Health Organization Classification of Tumours. Pathology & Genetics Tumours of the Digestive System. 3th edition. Lyon: IARC Press 2000; 32-36. |
| 2. | Fred TB, Fatima C, Ralph HH, Neil DT. World Health Organization Classification of Tumours.WHO classification of Tumours of the Digestive System. 4th edition. Lyon: IARC Press 2010; 40-44. |
| 3. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 4. | Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg. 1998;85:1457-1459. [PubMed] [DOI] |
| 6. | Pedrazzani C, de Manzoni G, Marrelli D, Roviello F. It is time for a proper staging system for adenocarcinoma of the gastroesophageal junction. J Clin Oncol. 2007;25:907-908; author reply 907-908;. [PubMed] [DOI] |
| 7. | Hasegawa S, Yoshikawa T. Adenocarcinoma of the esophagogastric junction: incidence, characteristics, and treatment strategies. Gastric Cancer. 2010;13:63-73. [PubMed] [DOI] |
| 8. | Stephen BE, David RB, Carolyn CC, April GF, Frederick , LG , Andrew T. AJCC Cancer Staging Manual. 7th Edition. New York: Springer 2010; 103-111. |
| 9. | Hasegawa S, Yoshikawa T, Cho H, Tsuburaya A, Kobayashi O. Is adenocarcinoma of the esophagogastric junction different between Japan and western countries? The incidence and clinicopathological features at a Japanese high-volume cancer center. World J Surg. 2009;33:95-103. [PubMed] [DOI] |
| 10. | 白 纪刚, 党 诚学. 食管胃连接部腺癌新的分型标准在中国的应用. 中南大学学报(医学版). 2007;32:138-143. |
| 11. | Polkowski W, van Sandick JW, Offerhaus GJ, ten Kate FJ, Mulder J, Obertop H, van Lanschot JJ. Prognostic value of Laurén classification and c-erbB-2 oncogene overexpression in adenocarcinoma of the esophagus and gastroesophageal junction. Ann Surg Oncol. 1999;6:290-297. [PubMed] [DOI] |
| 12. | Hagen JA, DeMeester SR, Peters JH, Chandrasoma P, DeMeester TR. Curative resection for esophageal adenocarcinoma: analysis of 100 en bloc esophagectomies. Ann Surg. 2001;234:520-530; discussion 530-531. [PubMed] [DOI] |
| 13. | Lerut T, Nafteux P, Moons J, Coosemans W, Decker G, De Leyn P, Van Raemdonck D, Ectors N. Three-field lymphadenectomy for carcinoma of the esophagus and gastroesophageal junction in 174 R0 resections: impact on staging, disease-free survival, and outcome: a plea for adaptation of TNM classification in upper-half esophageal carcinoma. Ann Surg. 2004;240:962-72; discussion 972-4. [PubMed] [DOI] |
| 14. | Zhang HL, Chen LQ, Liu RL, Shi YT, He M, Meng XL, Bai SX, Ping YM. The number of lymph node metastases influences survival and International Union Against Cancer tumor-node-metastasis classification for esophageal squamous cell carcinoma. Dis Esophagus. 2010;23:53-58. [PubMed] [DOI] |