修回日期: 2012-01-21
接受日期: 2012-02-27
在线出版日期: 2012-03-28
目的: 观察人剪切修复基因人类着色性干皮病D组基因(xeroderma pigmentosum group D, XPD)转染至人肝癌细胞株SMMC-7721细胞后XPD、DNp73和GADD45β基因的表达变化以及对肝癌细胞生长的影响.
方法: 实验分4组: 重组质粒SMMC-7721-pEGFP-N2-XPD(XPD组)、空载质粒SMMC-7721-pEGFP-N2组(N2组), 脂质体组和SMMC-7721细胞空白对照组. 应用Lipofectamine2000脂质体瞬时转染, 逆转录聚合酶链反应(RT-PCR)和蛋白印迹(Western blot)法检测转XPD基因后, 人肝癌细胞株SMMC-7721细胞中DNp73以及GADD45β的mRNA和蛋白质的表达量变化, 并用四甲基偶氮唑盐(MTT)法检测细胞增殖的活力, 流式细胞仪检测细胞凋亡的变化.
结果: 荧光显微镜下, XPD组和N2组细胞中观察到绿色荧光蛋白表达, 说明转染成功; RT-PCR检测显示: XPD组中DNp73 mRNA相对表达量较其他3组显著下调, XPD和GADD45β mRNA相对表达量较其他3组明显上调(均P<0.01); Western blot检测显示: XPD、DNp73以及GADD45β蛋白相对表达量在各组间的差异与其mRNA各组间差异一致; MTT检测示: SMMC-7721细胞空白对照组、脂质体组、N2组、XPD组的吸光度(A)值分别为0.633±0.012, 0.623±0.009, 0.628±0.016, 0.384±0.011, XPD组低于其他3组, 差异均有统计学意义(均P<0.01), 表明转染XPD后SMMC-7721细胞的增殖能力减弱. 流式细胞仪检测SMMC-
7721肝癌细胞凋亡: 转染XPD的SMMC-7721细胞凋亡显著, 凋亡率达56.53%, 而其他3组均未见明显凋亡.
结论: XPD基因在肝癌的发生发展中起抑制作用, 癌基因DNp73的表达随XPD表达增加而降低, 抑癌基因GADD45β则随XPD表达增加而增加, 提示两者可能在XPD抑制肝癌细胞的生长机制中起重要作用.
引文著录: 王芬芬, 张吉翔. XPD对SMMC-7721肝癌细胞中DNp73和GADD45β的调控及意义. 世界华人消化杂志 2012; 20(9): 764-770
Revised: January 21, 2012
Accepted: February 27, 2012
Published online: March 28, 2012
AIM: To evaluate the impact of transfection with the XPD gene on the expression of DNp73 and GADD45β and cell proliferation and apoptosis in human hepatoma cell line SMMC-7721.
METHODS: After SMMC-7721 cells were transfected with SMMC-7721-pEGFP-N2-XPD, the mRNA and protein expression of DNp73 and GADD45β was detected by RT-PCR and Western blot, respectively; cell proliferation was assessed by MTT assay; and the changes in cell apoptosis were evaluated by flow cytometry.
RESULTS: Compared to control cells, the expression of DNp73 mRNA decreased significantly and that of XPD and GADD45β mRNAs was enhanced obviously in cells transfected with XPD (all P < 0.01). Similar results were obtained for the expression of XPD, DNp73 and GADD45β proteins. The proliferation of SMMC-7721 cells was markedly inhibited and the apoptosis of SMMC-7721 cells was increased after transfection with XPD (both P < 0.01).
CONCLUSION: The wild-type XPD plays an important inhibitory role in the carcinogenesis of HCC. Overexpression of XPD decreases the expression of DNp73 and increases the expression of GADD45β, which suggests that both DNp73 and GADD45β may play a key role in the inhibitory effect of XPD on the carcinogenesis of HCC.
- Citation: Wang FF, Zhang JX. Overexpression of XPD decreases DNp73 expression and increases GADD45β expression in SMMC-7721 hepatoma cells. Shijie Huaren Xiaohua Zazhi 2012; 20(9): 764-770
- URL: https://www.wjgnet.com/1009-3079/full/v20/i9/764.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i9.764
原发性肝癌是伴有癌基因活化和抑癌基因失活的细胞无性繁殖, 其发生机制与DNA修复能力障碍有着密不可分的联系. 核苷酸切除修复(nucleotide excision repair, NER)机制是细胞修复损伤DNA的重要途径, 主要修复紫外线诱导和化学物质引起的大片段DNA损伤. 哺乳动物基本转录因子ⅡH(TFⅡH)复合物的第2大亚基XPD, 在TFⅡH介导的核苷酸剪切修复(NER)和转录调控过程中发挥重要作用, 参与了细胞增殖和凋亡过程的调控[1]; 本实验室以往研究结果显示着色性干皮病D组基因(xeroderma pigmentosum group D, XPD)基因通过上调抑癌基因(如p53, p21)和下调癌基因(如c-Myc, CDC25A)的表达, 从而抑制肝癌细胞的生长[2]. p73在肿瘤发生发展机制中的角色扑朔迷离, 相关研究表明: DNp73是p73亚型之一, 在肿瘤组织(如: 肝癌、结肠癌、肺癌、食管癌)中表达异常增高, 在正常组织中不表达. Zaika等[3]将DNp73基因导入正常小鼠体内, 构建高表达DNp73小鼠模型, 证明DNp73通过2条途径促进正常肝细胞向癌细胞分化, 第一: 抑制p53和TAp73的促细胞凋亡作用; 第二: 促进抑癌蛋白Rb蛋白磷酸化, Rb蛋白被磷酸化而与E-2F(转录激活蛋白)解离, 结合状态的E-2F变成游离状态, 细胞立即进入增殖活跃阶段, 导致肿瘤发生. 其中, DNp73抑制p53及其下游基因的表达为主要途径, 这一发现让笔者联想到DNp73与p53在影响正常组织或细胞向恶性转化过程中的竞争关系, 而XPD促进p53的表达在本实验室以往研究中已经得到证实, 故猜测XPD利用DNp73与p53之间的竞争关系影响DNp73的表达.
GADD45β作为P53、BRCA1调控的下游基因, 是一个损伤修复因子, 参与监测细胞周期和诱导凋亡. 杨娟等[4]研究发现在肝癌组织中GADD45β阳性表达较正常肝脏组织及肝硬化组织显著降低, 证实GADD45β作为抑癌基因在肝癌的发生发展中起到相当重要的作用, 故进一步研究肝癌细胞中GADD45β表达下调的分子机制有望为肝癌提供一种潜在的靶向分子治疗途径; 本文推测同为抑癌基因的XPD可能通过影响p53的分子水平, 从而与GADD45β的表达存在某种联系. 因此, 本研究用pEGFP-N2-XPD重组质粒瞬时转染人肝癌细胞SMMC-7721, 检测转染前后细胞内DNp73和GADD45β的表达情况, 探讨他们三者之间的相互作用以及对SMMC-7721细胞生长的影响. 该研究是本实验室对XPD抑制SMMC-7721肝癌细胞生长研究的延伸, 可望为诊断和治疗肝癌提供一条新的靶向途径.
人肝癌细胞株SMMC-7721细胞购自中国典型培养物保藏中心(China Center for Type Culture Collection, CCTCC), 重组质粒SMMC-7721-pEGFP-N2-XPD(XPD质粒)及空载质粒pEGFP-N2(N2质粒)由本实验室构建[2], 改良型PRMI-1640培养基(澳大利亚Hy-clone公司), 胎牛血清(美国GIBCO公司), Lipofectamine 2000TM、TRIzol(美国Invitrogen公司), 逆转录试剂盒(加拿大Fermentas公司), 2×Taq PCR Master Mix、MarkrⅠ(北京全式金生物技术有限公司), 总蛋白提取试剂盒(北京普利莱基因技术有限公司), XPD兔抗人单克隆抗体(美国Abcam公司), DNp73鼠抗人单克隆抗体、GADD45β兔抗人单克隆抗体(美国Santa Cruz公司), 鼠抗β-actin、山羊抗小鼠IgG、山羊抗兔IgG(北京中杉金桥生物技术有限公司), 四甲基偶氮唑盐(MTT, 上海普飞生物技术有限公司), Annexin V-FITC细胞凋亡检测试剂盒(联科生物技术有限公司). PCR引物(上海捷瑞公司): 从NCBI中获得人XPD、DNp73和GADD45βmRNA序列, 应用Primer Primier5.0软件设计引物.
1.2.1 细胞培养及转染: SMMC-7721肝癌细胞在含100 mL/L胎牛血清的改良型PRMI-1640培养基中, 于37 ℃、950 mL/L空气湿度和50 mL/L CO2孵箱中培养, 0.25%胰蛋白酶消化, 2-4 d传代1次. 根据实验需要及处理情况不同将细胞分为4组: (1)SMMC-7721细胞空白对照组; (2)脂质体组; (3)空载质粒SMMC-7721-pEGFP-N2组(N2组); (4)重组质粒SMMC-7721-pEGFP-N2-XPD(XPD组). 以2×105/孔的密度铺于6孔板内, 待细胞达60%-80%融合时用Lipofectamine2000进行瞬时转染, 转染后4-6 h, 换有血清的PRMI-1640培养基继续培养至48 h, 收集细胞进行RT-PCR或Western blot检测.
1.2.2 RT-PCR: (1)抽提总RNA: TRIzol法分别提取各组细胞总RNA, 合成cDNA; (2)内参基因β-actin上游引物: GGGCACGAAGGCTCATCATT,下游引物: AGCGAGCATCCCCCAAAGTT; 扩增片段长度285 bp. 目的基因XPD上游引物: TCTGCCTCTGCCCTATGAT, 下游引物: CGATTCCCTCGGACACTTT; 扩增片段长度363 bp. 目的基因DNp73上游引物: CGAAAATGCCAACAAACGG, 下游引物: GGAGCAGACTGTCCTTCGTTG; 扩增片段长度676 bp. 目的基因GADD45β上游引物: ACAGTGGGGGTGTACGAGTC, 下游引物: GACCAGGAGACAATGCAGGT; 扩增片段长度258 bp; (3)cDNA合成及PCR扩增: 按RT-PCR试剂盒要求步骤进行反转录聚合酶链反应. 先合成cDNA, 再进行PCR, 同一标本扩增β-actin作为内对照. 取10 μL扩增产物经1.5 g/L琼脂糖凝胶电泳(含5 mg/L溴化乙锭), 紫外灯下观察结果, 用Band Leader3.0图像分析软件读取目的电泳条带, 以各组β-actin条带的扫描值标化其相应组的XPD、DNp73及GADD45β的密度扫描值, 获得其mRNA相对表达量.
1.2.3 Western blot检测: 收集4组细胞总蛋白, 采用Bradford法测定蛋白浓度, 制备8%SDS-PAGE, 以每孔40 μg加样、电泳、转膜、封闭, 一抗4 ℃孵育过夜、二抗孵育2 h, ECL显色、定影、拍照, 以β-actin作为内对照. 用Quantity One图像分析软件进行灰度分析.
1.2.4 MTT法检测细胞增殖力: 转染前24 h胰酶消化收集各组细胞, 以5×103/孔密度接种于96孔板, 每组6孔, 并设置一对照孔, 于37 ℃、50 mL/L CO2培养箱培养, 转染5-6 h后换液, 分别加入新鲜含50 mL/L血清培养基100 μL/孔、MTT 10 μL/孔(5 g/L溶于PBS磷酸盐缓冲液, 过滤器过滤), 培养箱中继续培养4 h, 小心吸弃培养基, 加入DMSO 100 μL, 避光振荡10 min, 酶标仪测定492 nm波长下各孔吸光度(A)值, 记录结果并计算各组平均值, 以反映各组活细胞数量.
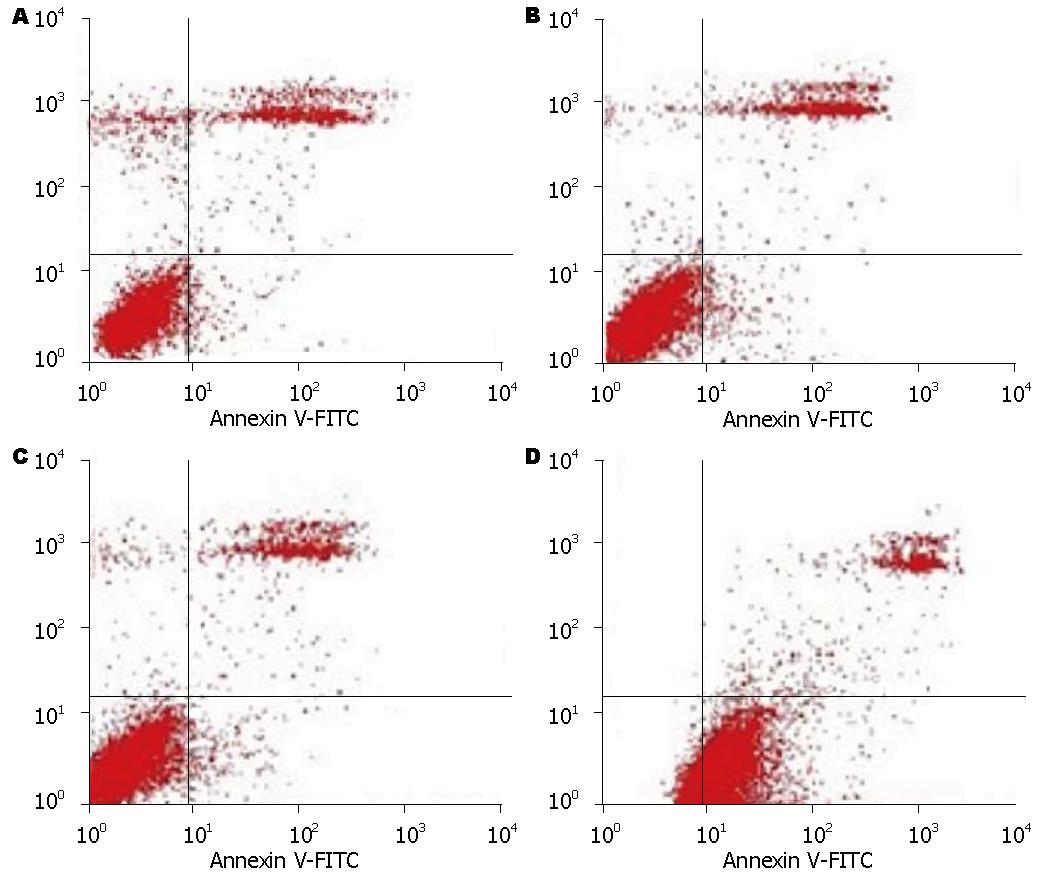
1.2.5 流式细胞仪检测细胞凋亡率: 分别取空白对照组、脂质体组、N2组、XPD组细胞, 经0.25%胰酶消化后采用Annexin V-FITC细胞凋亡检测试剂盒进行流式细胞仪检测, 具体操作严格按照试剂盒说明书进行, 实验重复3次. 结果判断: 左下象限代表正常细胞, 右下象限代表早期凋亡细胞, 右上象限代表晚期凋亡细胞和坏死细胞, 左上象限代表细胞收集过程中出现的损伤细胞.
统计学处理 采用SPSS13.0统计软件进行分析, 符合正态分布的计量资料用mean±SD表示, 组间比较用单因素方差分析, 进一步两两比较采用SNK-q检验, 以P<0.05为差异有统计学意义, P<0.01为差异显著.
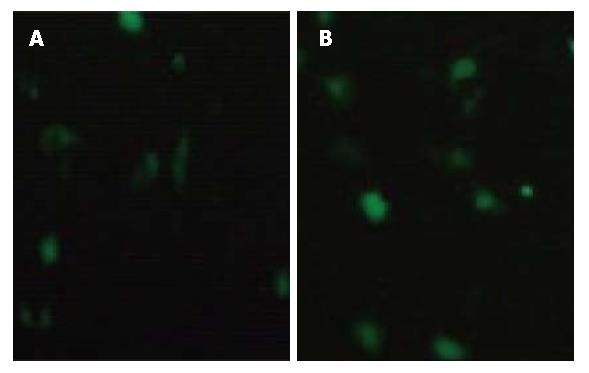
利用脂质体将pEGFP-N2和pEGFP-N2-XPD重组质粒转染入SMMC-7721细胞48 h后, 荧光显微镜下可见N2组和XPD组细胞中均有绿色荧光蛋白的表达, 无转染空白对照组和脂质体组细胞则未见表达(图1).
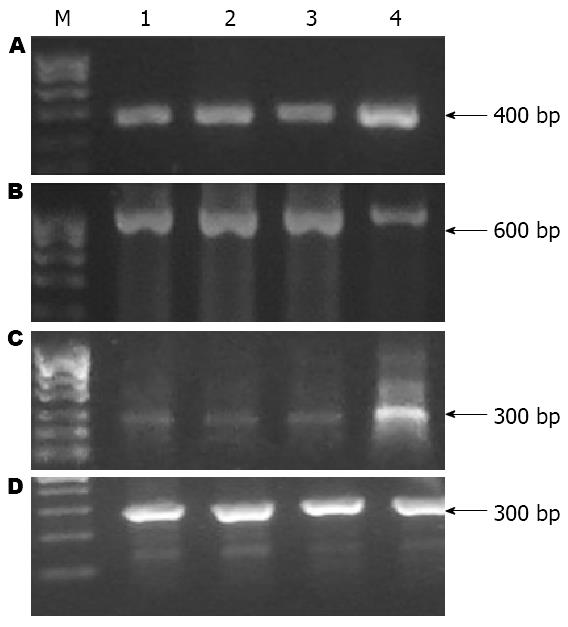
XPD组中XPD mRNA、GADD45β mRNA表达量均高于其他3组, 而DNp73 mRNA表达量低于其他3组, 差异均有统计学意义(均P<0.01), 而XPD、DNp73、GADD45β mRNAs表达量在对照组、脂质体组、N2组之间差异均无统计学意义(表1, 图2).
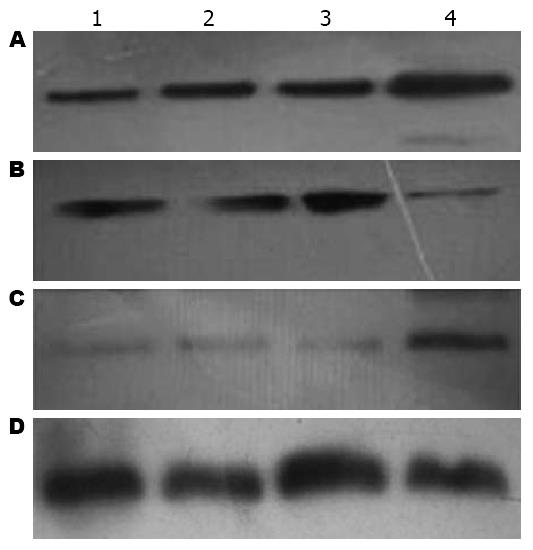
XPD组中XPD、GADD45β蛋白表达量高于其他3组, 而DNp73低于其他3组, 差异均有统计学意义(均P<0.01), 而XPD、DNp73、GADD45β蛋白表达量在对照组、脂质体组、N2组之间差异均无统计学意义(表2, 图3).
4组的A值分别为0.633±0.012, 0.623±0.009, 0.628±0.016, 0.384±0.011, XPD组与其他3组比较, 差异均有统计学意义(均P<0.05), 对照组、脂质体组、N2组之间差异均无统计学意义, 即XPD组细胞增殖活力低于其他3组, 说明XPD基因降低了SMMC-7721细胞代谢, 抑制了SMMC-7721细胞的增殖.
转染XPD的SMMC-7721肝癌细胞凋亡显著, 凋亡率达56.53%, 而其他3组均未见明显凋亡, 差异均有统计学意义(均P<0.01, 图4).
原发性肝癌是常见的恶性肿瘤之一, 病死率位居第3, 他的发生发展是一个经历多步骤、多阶段、多基因参与的复杂的生物学演变过程[5]. 近年来研究表明, 肝癌的发生是由多种基因共同参与的结果, 其发生机制与DNA修复能力障碍有着密不可分的联系. DNA修复是保持人类基因组完整性的核心, DNA修复能力的减低常易发生癌变. 为维持基因组稳定性和完整性, 机体可通过多种途径(如核酸切除修复、同源重组修复、非同源重组修复、错配修复和碱基切除修复等)促使各种损伤得到有效修复. 其中核酸切除修复是最多样和最常见的DNA修复机制, 而基本转录因子ⅡH(TFⅡH)则在核苷酸切除修复功能中发挥着重要作用[6]. XPD作为TFⅡH复合物的第2大亚基, 在核苷酸切除修复过程中负责从5'→3'方向打开受损位置的DNA双链. XPD基因发生突变时, 核苷酸剪切修复受到影响, 发生肿瘤的概率增加; 有研究证实, XPD基因可以抑制肝癌细胞中某些癌基因(如c-Myc, CDC25A), 以及促进抑癌基因(如p53, p21)的表达[7,8], 从而推测其在抑制肝癌的发生发展过程中发挥重要作用.
p73基因作为第一个p53类似物, 于1997年在COS细胞中被偶然发现. 与p53有所不同, p73表达产物可因羧基或氨基端的选择性剪接而产生不同的亚型, 分为TAp73和DNp73(dominant negative p73)[9]. DNp73又分为: 由启动子p1产生N末端截短的异构体(DEx2p73, DEx2/3p73和DN'p73), 由启动子p2产生的异构体 (P2p73)[10]. DNp73因其N末端转录活化区缺失导致转录活化功能完全丧失, 对p53和全长型p73依赖的转录活性有抑制作用. 同时, 他还有抗细胞凋亡和促细胞增殖的作用, 扮演着癌基因的角色; 研究发现DNp73是肿瘤组织中p73基因表达的主要形式, 在大部分肿瘤细胞中的表达均明显高于癌旁细胞, 其中包括人肝癌细胞[11]. 大多数表达TAp73的肝癌细胞中出现TAp73表达的缺失或错义突变, p53失去了作用, p73基因编码仅为DNp73蛋白; 研究表明, 异常表达的P73蛋白(包括突变的TAp73和高表达的DNp73蛋白)很可能是正常P53蛋白的一个模拟突变体, 在肝癌细胞内可模拟P53蛋白分子而封闭其作用底物, 使P53蛋白失活, 从而促使细胞的恶性转化. 目前对XPD基因与DNp73基因间的关系研究报道尚少. 本研究结果显示, 将XPD转染入SMMC-7721肝癌细胞后, DNp73在mRNA和蛋白水平的表达量均有明显下降; 其机制之一可能是XPD基因促进P53的表达, P53与DNp73在结构上高度同源, 因此高表达P53竞争性结合DNp73特异性的靶点, 最终抑制DNp73的表达, 成为XPD抑制肝癌细胞生长的机制之一; 由此可推测正常肝脏细胞中P53与DNp73之间的相对表达量是肝脏细胞恶变的一个决定因素; 除此之外, XPD基因通过促进P53的表达而选择性下调Bcl-3蛋白水平, 抑制cyclin D1启动子活性, 降低cyclin D1蛋白和mRNA的表达水平, 导致细胞在G1期阻滞, 抑制SMMC-7721肝癌细胞增殖.
GADD45β是生长抑制及DNA损伤诱导蛋白质基因家族的成员, 是P53、BRCA1调控的下游基因, 他在细胞周期控制、DNA损伤修复及信号转导过程中发挥重要作用[12,13]. 研究发现GADD45β在肝癌组织中是一个明显低表达基因, 呈特异性缺失, 提示其在肝癌的发生发展中可能发挥抑癌基因的作用[4]. 他编码的核蛋白能与其他蛋白如PCNA、P21、核组蛋白、MTK1/MEKK4激酶以及Cdk1等相互作用[14,15], 并参与多种信号通路的调节, 在NF-κB[16]、p38/JNK[17]等的通路中发挥作用, 通过信号通路间的交叉对话(cross talk)行使生物学功能, 参与DNA的损伤修复, 实现对肿瘤细胞的负性生长调节; 此外, GADD45β可在不同水平抑制细胞的增殖, 其中包括G1/S和G2/M细胞周期检测点. 所以, GADD45β低表达意味着损伤修复功能的缺陷和细胞周期检测点的异常, 以及随之而来的对细胞生长不利的异常转录调节, 最终将导致肝细胞增殖恶变. 本研究显示转染XPD后, GADD45β的表达量增加, 肝癌细胞生长受到明显抑制, 从而证实了GADD45β基因发挥的抑制肝癌细胞增殖的作用.
GADD45β是p53的下游激活产物, 其功能需要完整的p53基因的辅助和/或调控. XPD可以通过激活p53间接上调GADD45β的表达. DNp73虽与p53高度同源, 但却无法像p53一样激活p53靶基因GADD45β的转录, 不仅如此, DNp73还通过竞争性结合p53和TAp73特异性的靶点从而抑制p53和TAp73依赖的转录激活, 对GADD45β的表达具有负性调控作用. 本实验将XPD基因转染入SMMC-7721肝癌细胞, 使DNp73的表达减少, 减弱了DNp73对GADD45β的负性调控作用, 进一步使GADD45β的表达增加.
总之, XPD可与抑癌基因GADD45β协同作用抑制肝癌细胞的生长, 同时, 还可减少癌基因DNp73的表达, 从而降低SMMC-7721肝癌细胞的增殖能力, 值得注意的是, 抑癌基因p53的激活是XPD调控GADD45β和DNp73表达过程中的关键. 本实验对XPD基因抑制肝癌细胞生长的分子机制进行了初步的探讨, 为肝癌的基因治疗提供了分子水平的实验依据. 随着研究的不断深入, XPD在TFⅡH复合物中起关键调节作用的角色得到不少研究者的认同, 但其具体调节作用机制还有待于进一步研究探索.
哺乳动物基本转录因子ⅡH(TFⅡH)复合物的第2大亚基XPD, 在TFⅡH介导的核苷酸剪切修复(NER)和转录调控过程中发挥重要作用. 对XPD基因抑制肝癌细胞生长的分子机制的研究将为诊断和治疗肝癌提一条新的靶向途径.
党双锁, 教授, 西安交通大学医学院第二附属医院感染科
原发性肝癌除手术、局部治疗及放、化疗等治疗手段, 基因治疗和肿瘤疫苗技术近年来也在研究之中. 目前尚无绝对有效且统一的治疗标准, 所以, 进一步提高肝癌的基因诊断和发现肝癌基因治疗的靶向途径是目前亟待研究的热点.
Zaika等发现DNp73通过抑制p53和TAp73的促细胞凋亡作用, 从而促进正常肝脏细胞向癌细胞分化; 杨娟等研究发现在肝癌组织中GADD45β阳性表达较正常肝脏组织及肝硬化组织显著降低.
XPD基因在肝癌的发生发展中起到相当重要的作用, 对抑制肝癌细胞生长的整个分子调控网络进行更深入而全面的研究, 将为肝癌的诊断和基因治疗提供分子水平的实验依据以及靶向途径.
核苷酸切除修复: DNA修复的一种, 他主要修复那些影响区域性的染色体结构的DNA损害, 包括紫外线诱导和化学物质引起的大片段DNA损伤等.
本研究立题有临床实用价值, 实验方法可行, 结果可靠, 实验结果对于揭示人剪切修复基因XPD在肝癌发生中作用机制有意义.
编辑: 张珊珊 电编: 闫晋利
| 3. | Zaika AI, Slade N, Erster SH, Sansome C, Joseph TW, Pearl M, Chalas E, Moll UM. DeltaNp73, a dominant-negative inhibitor of wild-type p53 and TAp73, is up-regulated in human tumors. J Exp Med. 2002;196:765-780. [PubMed] [DOI] |
| 5. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 6. | Giglia-Mari G, Coin F, Ranish JA, Hoogstraten D, Theil A, Wijgers N, Jaspers NG, Raams A, Argentini M, van der Spek PJ. A new, tenth subunit of TFIIH is responsible for the DNA repair syndrome trichothiodystrophy group A. Nat Genet. 2004;36:714-719. [PubMed] [DOI] |
| 7. | Wang HY, Xiong GF, Zhang JX, Xu H, Guo WH, Xu JJ, Xiong XY. The role of XPD in cell apoptosis and viability and its relationship with p53 and cdk2 in hepatoma cells. Med Oncol. 2012;29:161-167. [PubMed] [DOI] |
| 8. | Chang-Claude J, Ambrosone CB, Lilla C, Kropp S, Helmbold I, von Fournier D, Haase W, Sautter-Bihl ML, Wenz F, Schmezer P. Genetic polymorphisms in DNA repair and damage response genes and late normal tissue complications of radiotherapy for breast cancer. Br J Cancer. 2009;100:1680-1686. [PubMed] [DOI] |
| 9. | Stiewe T. The p53 family in differentiation and tumorigenesis. Nat Rev Cancer. 2007;7:165-168. [PubMed] [DOI] |
| 10. | Testoni B, Schinzari V, Guerrieri F, Gerbal-Chaloin S, Blandino G, Levrero M. p53-paralog DNp73 oncogene is repressed by IFNα/STAT2 through the recruitment of the Ezh2 polycomb group transcriptional repressor. Oncogene. 2011;30:2670-2678. [PubMed] [DOI] |
| 11. | Rufini A, Agostini M, Grespi F, Tomasini R, Sayan BS, Niklison-Chirou MV, Conforti F, Velletri T, Mastino A, Mak TW. p73 in Cancer. Genes Cancer. 2011;2:491-502. [PubMed] [DOI] |
| 12. | Bringold F, Serrano M. Tumor suppressors and oncogenes in cellular senescence. Exp Gerontol. 2000;35:317-329. [PubMed] [DOI] |
| 13. | Maeda T, Hanna AN, Sim AB, Chua PP, Chong MT, Tron VA. GADD45 regulates G2/M arrest, DNA repair, and cell death in keratinocytes following ultraviolet exposure. J Invest Dermatol. 2002;119:22-26. [PubMed] [DOI] |
| 14. | Takekawa M, Saito H. A family of stress-inducible GADD45-like proteins mediate activation of the stress-responsive MTK1/MEKK4 MAPKKK. Cell. 1998;95:521-530. [PubMed] [DOI] |
| 15. | Smith ML, Ford JM, Hollander MC, Bortnick RA, Amundson SA, Seo YR, Deng CX, Hanawalt PC, Fornace AJ. p53-mediated DNA repair responses to UV radiation: studies of mouse cells lacking p53, p21, and/or gadd45 genes. Mol Cell Biol. 2000;20:3705-3714. [PubMed] [DOI] |
| 16. | Qiu W, Zhou B, Chu PG, Luh F, Yen Y. The induction of growth arrest DNA damage-inducible gene 45 beta in human hepatoma cell lines by S-adenosylmethionine. Am J Pathol. 2007;171:287-296. [PubMed] [DOI] |
| 17. | Papa S, Zazzeroni F, Fu YX, Bubici C, Alvarez K, Dean K, Christiansen PA, Anders RA, Franzoso G. Gadd45beta promotes hepatocyte survival during liver regeneration in mice by modulating JNK signaling. J Clin Invest. 2008;118:1911-1923. [PubMed] [DOI] |